非致死剂量的四溴双酚A胁迫下蚯蚓的生长和抗氧化防御反应
史雅静,徐晓宇,王宇,韩雪松,李田春,王玉荣,史雅娟
1. 辽宁科技学院生物医药与化学工程学院 辽宁省生物医药与化学工程重点实验室, 本溪 117004 2. 中国科学院生态环境研究中心 城市与区域生态国家重点实验室,北京 100085
四溴双酚A(tetrabromobisphenol A, TBBPA)是常用的溴化阻燃剂之一,被广泛用于聚苯乙烯泡沫、电子产品和ABS树脂等领域中[1]。由于TBBPA可通过制造业以及各种纺织和材料的处理或循环利用释放到环境中,并且具有迁移性、蓄积性和持久性等特点[2]。TBBPA在空气、土壤、水体底泥等多种环境介质、海鸟和鱼体内、甚至人体血液和母乳生物样品中存在[3-9]。TBBPA不仅在环境中能长期残留,而且可以通过食物链和其他途径在人体内富集,长期接触会妨碍大脑和骨骼的发育,并且可能致癌[10-12],因此引起日益广泛的关注。
利用蚯蚓作为研究污染物对土壤生物影响的指示生物,可以间接反映环境中污染物的污染强度。经济合作与发展组织(OECD)等机构已将蚯蚓(赤子爱胜蚓)作为标准试验动物。蚯蚓体内多种酶系能够被污染物诱导或激活,可在生化水平上对污染暴露做出敏感响应[13-15]。近几年,国内外关于TBBPA对水生生物毒性的研究报道颇多[16-21],但以土壤生态系统中的生物进行的毒理研究尚少,其中以蚯蚓作为模式生物进行毒理研究的,多数是采用滤纸接触法和人工土壤法并且以急性暴露(48 h 或14 d)为主[22],而污染物对蚯蚓的亚急性(28 d)、慢性毒性(56 d以上),因具有较好的生态相关性,且测试终点比急性的终点要敏感,而受到关注[23-24]。采用自然土壤法模拟蚯蚓生活的真实环境, 可比较真实地反映污染物在自然环境中对生物的实际影响,更好地对污染地区进行环境安全评价。
本实验采用自然土壤暴露法,通过非致死剂量的TBBPA对蚯蚓的急性、亚急性暴露试验,以蚯蚓的生长抑制率、体内蛋白质含量和抗氧化酶活性(SOD、GST)的反应变化,来揭示TBBPA的生态生理毒性,为TBBPA土壤生态风险评估提供科学依据。
1 材料与方法(Materials and methods)
1.1 供试生物、化学品和土壤
赤子爱胜蚓(Eiseniafetida)购自沈阳尊龙生物技术有限公司。选用2~3月龄,体重0.35~0.45 g,生殖带明显且无损伤的成熟个体。实验前用去离子水进行清洗。
四溴双酚A(TBBPA)(CAS No.79-94-7), 纯度为98%,购自梯希爱(上海)化成工业发展有限公司(中国)。
供试清洁自然土壤采自山东省潍坊市荒地,实验前,对土壤进行风干,过10目筛。经测定该土壤样品pH值为8.68,有机质含量1.08%,全N为0.03%,TBBPA未检出,重金属含量低于国家土壤环境质量一级标准。
1.2 暴露方法
蚯蚓暴露于添加不同浓度TBBPA的清洁自然土壤中,将一定量的TBBPA溶于少量丙酮并均匀拌入土壤中,TBBPA浓度梯度根据预实验所确定的非致死剂量设定,各处理TBBPA含量依次为:0、50、100、400 mg·kg-1(以干重计,下同),用去离子水调节土壤湿度为25%,置于通风厨中使丙酮完全挥发干净。
暴露方法参照人工土壤标准暴露法(OECD Guideline No.207)[25]并加以适当修改。暴露试验前,赤子爱胜蚓在供试清洁土壤中驯养24 h,用去离子水清洗干净后置于放有潮湿滤纸的培养皿中(黑暗环境、(20 ± 1) ℃、24 h),去除消化系统内容物。随机挑选10条蚯蚓放入装有750 g湿土的1 000 mL烧杯中,放置于人工气候箱。控制条件为:温度(20±1) ℃,相对湿度80%~85%,24 h连续光照,光照强度400~800 lux。试验包括急性期(0~14 d)和亚急性期(15~28 d)2个阶段,分别在4、7、14、21、28 d进行称重。在14 d、28 d时从每个重复中随机挑选蚯蚓2条,进行蛋白含量和酶活性测定。设空白(CK,仅加水)和溶剂空白(CKs,丙酮含量为0.02%)对照组。每个处理4个重复。
1.3 生长抑制率测定
将暴露于不同剂量TBBPA中,第4、7、14、21和28 天的蚯蚓平均体重与其在试验开始时的平均体重相比较,采用公式In=(W0-Wt)×100%/W0计算生长抑制率[26],其中,In是不同处理的蚯蚓的生长抑制率,W0是试验开始时蚯蚓的平均体重(mg),Wt是第t天蚯蚓的平均体重(mg)。
1.4 蛋白质含量和酶活性测定
1.4.1 粗酶液制备
将经过染毒处理的蚯蚓,洗净,称重,低温匀浆,在4 ℃下以4 000 r·min-1离心30 min,取上清液按1:4(V:V)稀释后,用于蛋白质含量、GST酶活性、SOD酶活性测定。
1.4.2 蛋白质含量与酶活性测定方法
蛋白质含量采用考马斯亮蓝方法测定[27],使用牛血清蛋白作为参考标准蛋白,以595 nm下的吸光度值计算蛋白含量,单位为mg。GST酶活性测定参考文献[28-29]中的方法,以340 nm下吸光度值计算酶活性,单位为nmol·min-1·mg-1pro(以protein计);超氧化物歧化酶(SOD)活性测定,采用氮蓝四唑法[30],以560 nm下的吸光度值计算酶活性,单位为U·mg-1pro,以50%抑制率的酶量为一个酶活力单位。
1.5 数据处理
在满足正态分布或对数正态分布(Shapiro-Wilk test)和方差齐次(Levene’s test)的前提下,采用单因素方差分析(ANOVA),多重比较采用LSD,与对照比较时P<0.05为显著性差异。所有统计均采用SPSS18.0软件完成。
2 结果(Results)
2.1 TBBPA对蚯蚓生长的抑制
赤子爱胜蚓暴露于TBBPA后的4 d、7 d、10 d、14 d、21 d、28 d的生长抑制率如图1所示。统计分析显示对照空白(CK)和溶剂空白(CKs)之间并没有显著差异,说明经过挥发后的残余丙酮对赤子爱胜蚓并没有产生影响。随着暴露时间的延长,空白对照(CK)的生长抑制率表现上升的趋势,可能是由于土壤中营养物质的消耗而造成营养不足,以致体重下降。
TBBPA暴露急性期(0~14 d),随着TBBPA浓度增大,蚯蚓生长抑制率增大并在400 mg·kg-1处理组达到最大(21.48%)。TBBPA暴露的亚急性期(14~28 d)也有相同的规律。相同的TBBPA暴露浓度,随着TBBPA暴露时间增长,蚯蚓生长抑制率逐渐增大且均在28 d时达到最大,28 d的400 mg·kg-1处理组的生长抑制率最大(33.02%)。经检验,5次生长抑制率数据满足进行方差分析的前提条件,所以采用方差分析法来分析不同浓度处理之间差异的显著性,结果表明在0~14 d 的急性试验期间TBBPA对蚯蚓的生长抑制情况均存在显著的剂量效应关系,而在亚急性暴露期(14~28 d)各处理的生长抑制率不具有显著性差异。(4 d:F=4.708,P= 0.014;7 d:F=3.954,P= 0.026;14 d:F=10.037,P= 0.001;21 d:F=2.469,P=0.112;28 d:F=21.743,P=0.217)。多重比较(LSD test)进一步表明了在各暴露时期高浓度(400 mg·kg-1)处理组与空白和其他浓度组相比都显著抑制蚯蚓的生长(P<0.05)。
2.2 TBBPA对蚯蚓体内蛋白含量影响
TBBPA对蚯蚓体内蛋白含量影响如图2所示,TBBPA暴露急性期(14 d),蚯蚓体内的蛋白含量在对照组水平上下波动, ANOVA 分析表明蚯蚓体内蛋白含量在各处理间不存在显著性差异(P=0.712)。进入TBBPA暴露的亚急性期(28 d),蚯蚓体内的蛋白质含量,在50 mg·kg-1染毒组减少,然后随着TBBPA浓度的增加而增加,并且到400 mg·kg-1染毒组时达到最大值,方差分析表明处理组之间存在显著性差异(P=0.039)。
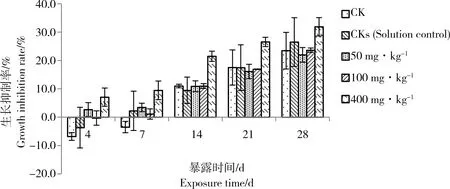
图1 不同浓度的四溴双酚A(TBBPA)对蚯蚓的生长抑制率Fig. 1 Growth inhibition rates of earthworms exposed to tetrabromobisphenol A (TBBPA) at different concentrations

图2 不同浓度的TBBPA对蚯蚓体内蛋白质含量影响Fig. 2 Effects of TBBPA at different concentrations on protein contents of earthworms

图3 不同浓度的TBBPA对蚯蚓体内SOD酶活力的影响Fig. 3 Effects of TBBPA at different concentrations on SOD activities of earthworms
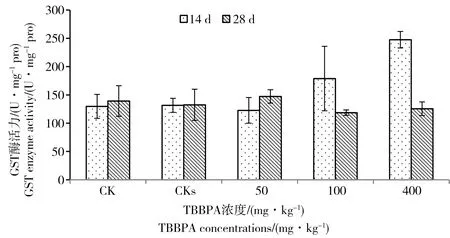
图4 不同浓度的TBBPA对蚯蚓体内GST酶活力的影响Fig. 4 Effects of TBBPA at different concentrations on GST activities of earthworms
2.3 TBBPA对蚯蚓体内SOD酶活性的影响
TBBPA对赤子爱胜蚓SOD酶活性的影响如图3所示。TBBPA暴露急性期(14 d),数据分析显示对照(CK)和溶剂空白(CKs)之间SOD酶活性并没有显著差异,所有TBBPA染毒组SOD酶活力均显著高于空白对照组,其中在50 mg·kg-1处理组显著高于中、高浓度(100 mg·kg-1、400 mg·kg-1)处理组,随着浓度增加,SOD酶活略有下降,但都高于对照组。
随着暴露时间的延长,空白对照(CK)和溶剂空白(CKs)的SOD酶活性有所升高。TBBPA暴露亚急性期(28 d),各染毒组蚯蚓体内SOD 酶活性与对照组之间仍具有显著性差异(ANOVA,P=0.029)。低、中浓度(50 mg·kg-1、100 mg·kg-1)处理组与空白对照没有显著性差异,但高浓度400 mg·kg-1处理组SOD酶活性显著升高(LSD检验,P<0.05)。
2.4 TBBPA对GST酶活性的影响
TBBPA对赤子爱胜蚓GST酶活性的影响如图4所示。TBBPA暴露急性期(14 d),统计分析显示对照空白(CK)和溶剂空白(CKs)与低浓度染毒组(50 mg·kg-1)之间GST酶活性并没有显著差异,100 mg·kg-1染毒组开始有上升趋势,直到400 mg·kg-1组GST酶活性才出现显著诱导效应(ANOVA,P=0.039)。TBBPA暴露亚急性期(28 d),各处理组GST酶活性与对照无显著差异(ANOVA,P=0.428)。
3 讨论(Discussion)
传统的蚯蚓生态毒理学研究多采用标准的滤纸接触法或人工土壤法。滤纸接触法暴露时间短(24~48 h),可对受试物毒性进行初筛,初步了解蚯蚓的潜在毒性,但仅反映了化学品经皮肤暴露一种途径对蚯蚓的影响,很难评估其对蚯蚓的真实影响。人工土壤法可较好地模拟蚯蚓生活的真实环境,能够体现皮肤、消化道2种暴露途径的影响,但由于实验导则中没有就人工土中有机质含量进行明确规定,不同批次土实验中有机质含量常有一定差异[31],从而降低了各批次人工土壤法实验之间的可比性;而且自然土壤有很多未知因素,污染物也是长期存在的[32],自然土壤性质和结构与人工土壤仍有一定差异,对污染物的毒性均有较大影响,采用人工土壤暴露的结果表征污染物的生态风险可能会有较大的误差。TBBPA作为类似于“POPs”的潜在环境内分泌干扰物,目前还缺乏自然土壤生态环境的急性、亚急性毒性数据,因此本文采用自然土壤法进行TBBPA毒性暴露实验所获得的数据可以作为一种补充和参考,以更好地对污染地区进行环境安全评价。
本文研究了非致死剂量的TBBPA经急性和亚急性暴露对赤子爱胜蚓生长、蛋白质含量和抗氧化酶活性的影响。采用非致死剂量在亚急性试验条件下进行暴露,更能反映出蚯蚓在接近真实环境中毒性反应[26]。非致死浓度梯度是根据急性试验得到半致死浓度而确定的,确保蚯蚓在整个试验过程中无死亡或死亡率低于10%,本试验的死亡率低于10%符合OECD标准。
生物量变化是联系化学胁迫、化学效应与能量动态变化的[33]。CK和CKs组蚯蚓在实验前期(0~7 d)的生长抑制率均为负值,在14 d的生长抑制率也低于10%,表示蚯蚓在此条件下可以正常生长;CK和CKs组在亚急性期的生长抑制率增加,体重下降可能因为亚急性试验过程中只依靠自然土壤中营养物质,其不足以满足蚯蚓生长的需要,因此,在亚急性期时,可以适当增加有机质以补充营养物质的不足。
在试验范围内,急性期间,TBBPA没有使蚯蚓死亡,却显著抑制蚯蚓生长,随着TBBPA暴露浓度增大,暴露时间延长,生长抑制率逐渐增大;进入亚急性期时,受到TBBPA胁迫的蚯蚓体重进一步下降,生长抑制率持续增大,与空白对照之间不具有显著性差异,此时蚯蚓体重的下降可能更多的是受土壤营养物质缺乏的影响。实际上蚯蚓受TBBPA胁迫而体重下降是一个综合过程,蚯蚓持续受到TBBPA胁迫时,会减少食物的摄取,TBBPA的吸收随之减少,同时摄入体内的有限能量更多地应用于解毒过程的代谢消耗,而对影响蚯蚓存活的非必要功能如生长、繁殖功能则受到抑制,导致体重下降[26]。
在TBBPA暴露急性期(14 d),蚯蚓蛋白质含量与空白对照无显著性差异。这可能是由于TBBPA在微生物的作用下部分降解,蚯蚓表现出一定的适应性,而此时影响蛋白质含量的主要是肠组织,其吸收得比较少,所以蛋白质含量仅在空白组水平上下波动,基本上没有变化。然而进入TBBPA暴露亚急性期时(28 d),蚯蚓蛋白含量在低浓度组显著减少,后逐渐增加,在TBBPA 400 mg·kg-1时达到最大值。这种变化规律可能是由于蚯蚓暴露在TBBPA中,低浓度TBBPA的长时间刺激,使蚯蚓做出反应相对较少,体内蛋白质含量有所减少,但当随着TBBPA浓度的增加到一定程度,并长时间刺激以后,且土壤中的TBBPA降解产物的毒性比较大[9, 34],在大分子TBBPA和其小分子降解产物对蚯蚓的共同作用下,并且相当一部分产物被肠组织吸收,吸收量比较大,使得肠组织会做出相应的反应,刺激体内的蛋白质和酶分泌增加,以缓解外来刺激作用。蚯蚓面对外来刺激做出相应的反应,体壁组织和肠组织分泌的蛋白质和一些酶会增加,从而起到自我保护的作用[32]。
已有的TBBPA对蚯蚓毒性效应的研究显示,TBBPA对蚯蚓抗氧化酶活性具有诱导效应[35]。SOD催化超氧阴离子自由基变成过氧化氢和氧气。在本研究中TBBPA暴露急性期(14 d),各染毒组与对照空白组相比均有显著差异,并且SOD酶活性在染毒组50 mg·kg-1达到最大值(P<0.01)。一般认为,当蚯蚓受到轻度环境胁迫时,体内SOD酶活性往往有所提高,而当受到重度逆境胁迫时,SOD酶活性通常下降[33, 36]。这与利用人工土壤研究TBBPA对蚯蚓SOD基因表达,证明低浓度TBBPA对SOD基因表达水平有诱导效应的结果[33]相一致。进入TBBPA暴露亚急性期时,蚯蚓体内的SOD酶活性随着TBBPA的增加,总体上表现为上升的趋势。在TBBPA胁迫损害下,破坏蚯蚓体内的代谢平衡,引起代谢产物的积累,并产生过量的能产生氧化损伤的活性氧等有害物质。因此蚯蚓通过启动防御系统如诱导SOD酶活性来抵御和清除这些物质,以保持机体内部动态稳定平衡。
GST催化谷胱甘肽和外源亲电子基团结合并将产物移出体外。与对照组相比,400 mg·kg-1染毒组中GST活性基因表达量出现明显诱导的现象[33]。我们可以推断蚯蚓暴露在含有400 mg·kg-1TBBPA的土壤中,被诱导产生大量谷胱甘肽转移酶来应对氧化胁迫。进入TBBPA暴露亚急性期时,染毒组与空白对照GST酶活性无显著性差异,表明TBBPA毒性超过了蚯蚓的耐受范围,对蚯蚓的机体造成了一定损伤。
本实验中,TBBPA对蚯蚓的生长抑制情况,在急性试验中均存在显著的剂量效应关系,而在亚急性暴露期, 400 mg·kg-1时被显著抑制蚯蚓的生长(P<0.05);TBBPA对蚯蚓体内蛋白含量影响,在急性试验中各处理间差异不显著(P=0.712),进入亚急性期蛋白质含量在400 mg·kg-1时被显著诱导(P=0.039,P<0.05);TBBPA对蚯蚓SOD酶活性的影响,在急性试验中50 mg·kg-1时被显著诱导(P<0.01),在亚急性试验中400 mg·kg-1时SOD酶活性显著升高(P<0.05);TBBPA对蚯蚓GST酶活性,在急性试验中400 mg·kg-1时呈现显著诱导效应(P<0.05),在亚急性期各处理间差异不显著(P=0.428)。蚯蚓生长抑制率、蛋白质含量、体内各生化酶系对TBBPA暴露的时间效应和剂量效应的敏感性存在不同程度差异,因而在土壤污染生态毒性诊断时,应依据污染暴露指示的有效性和敏感性选择多时间段检测和多指标联合诊断。
土壤性质对污染物在土壤中的毒性程度具有重要影响。土壤有机质含量与疏水性有机物在土壤中的生物有效性密切相关,因而土壤有机质是对有机污染物在土壤中毒性影响的最重要因素,也是将人工土毒性实验结果外推到自然土中的重要依据[37-39],但含水量、土壤pH值和微生物活性等对污染物在土壤中的毒性也具有一定影响[39-42]。污染物在自然和人工土中具有不同的行为和生物可利用性[38, 43-45],因而对土壤生物表现出不同的毒性,例如苯敌草在有机质含量高的人工土中吸附性强,对线蚓在人工土中的存活率和繁殖率都比在自然土中高[41];而重金属Zn在人工土中比在自然土壤的毒性强10倍,是由于人工土中的生物可利用性强[46];DDT在有机质含量相当的自然土和人工土对蚯蚓存活的毒性差异接近2倍[47],因而采用土壤有机质含量作为在自然土和人工土中外推的唯一标准常常引起较大偏差。
目前尚缺乏TBBPA在人工土和不同自然土壤中对蚯蚓的毒性的全面对比研究。本研究中TBBPA在自然土中经14 d暴露后对蚯蚓的生长抑制作用与有关人工土中TBBPA对蚯蚓生长抑制程度[33]相当,上述2个研究其他暴露条件相似,所用实验介质的差异在于本研究所用的自然土壤有机质含量(1.08%)仅为人工土中的1/3,而偏碱性(pH值为8.68)土壤与中性的人工土差异较大。二者土壤性质差异较大但毒性却相当,说明土壤有机质含量和土壤酸碱性对TBBPA在土壤中的毒性具有一定影响,土壤有机质含量作为TBBPA在自然土和人工土中外推的唯一标准将会引起偏差。
[1] 魏建良. 四溴双酚A(TBBPA)的研发生产现状与质量提升[J]. 盐业与化工, 2014, 43(4): 4-7
Wei J L. Research and development production status and quality improvement of tetrabromobisphenol A (TBBPA) [J]. Journal of Salt and Chemical Industry, 2014, 43(4): 4-7 (in Chinese)
[2] Iasur-Kruh L, Ronen Z, Arbeli Z, et al. Characterization of an enrichment culture debrominating tetrabromobisphenol A and optimization of its activity under anaerobic conditions [J]. Journal of Applied Microbiology, 2010, 109(2): 707-715
[3] Celada L J, Whalen M M. The effect of TBBPA on MAP3Ks in human natural killer cells [J]. The FASEB Journal, 2013, 27(1): 1042-1045
[4] Fujii Y, Nishimura E, Kato Y, et al. Dietary exposure to phenolic and methoxylated organohalogen contaminants in relation to their concentrations in breast milk and serum in Japan [J]. Environment International, 2014, 63: 19-25
[5] Harrad S, Abdallah A E, Rose N L, et al. Current-use brominated flame retardants in water, sediment, and fish from English lakes [J]. Environmental Science and Technology, 2009, 43(24): 9077-9083
[6] Johnson-Restrepo B, Adams D H, Kannan K. Tetrabromobisphenol A(TBBPA) and hexabromocyclododecanes (HBCDs) in tissues of humans, dolphins, and sharks from the United States [J]. Chemosphere, 2008, 70(11): 1935-1944
[7] Lu Z, Letcher R J, Chu S, et al. Spatial distributions of polychlorinated biphenyls, polybrominated diphenyl ethers, tetrabromobisphenol A and bisphenol A in Lake Erie sediment [J]. Journal of Great Lakes Research, 2015, 41(3): 808-817
[8] Ni H-G, Zeng H. HBCD and TBBPA in particulate phase of indoor air in Shenzhen, China [J]. Science of the Total Environment, 2013, 458: 15-19
[9] 钱艳园, 刘莉莉, 于晓娟, 等. 四溴双酚 A 好氧降解菌的筛选及其降解特性研究[J]. 环境科学, 2012, 33(11): 3962-3966
Qian Y Y, Liu L L, Yu X J, et al. Isolation of aerobic degrading strains for TBBPA and the properties of biodegradation [J]. Environmental Science, 2012, 33(11): 3962-3966 (in Chinese)
[10] Colnot T, Kacew S, Dekant W. Mammalian toxicology and human exposures to the flame retardant 2,2′,6,6′-tetrabromo-4,4′-isopropylidenediphenol (TBBPA): Implications for risk assessment [J]. Archives of Toxicology, 2014, 88(3): 553-573
[11] He M-J, Luo X-J, Yu L-H, et al. Diasteroisomer and enantiomer-specific profiles of hexabromocyclododecane and tetrabromobisphenol A in an aquatic environment in a highly industrialized area, South China: Vertical profile, phase partition, and bioaccumulation [J]. Environmental Pollution, 2013, 179: 105-110
[12] 陈海, 孙云娜, 魏东洋. 溴代阻燃剂的环境危害[J]. 广东化工, 2011, 38(8): 91-92
Chen H, Sun Y N, Wei D Y. Bromination flame retardants environmental damage [J]. Guangdong Chemical Industry, 2011, 38(8): 91-92 (in Chinese)
[13] 胡玲, 林玉锁. 呋喃丹对赤子爱胜蚓体内蛋白含量, SOD 和 TChE 活性的影响[J]. 安徽农业科学, 2006, 34(13): 3165-3167
Hu L, Lin Y S. Effect of carbofuran on protein content and the SOD and TChE activity of theEiseniafoetidaearthworm [J]. Journal of Agricultural Science, 2006, 34(13): 3165-3167 (in Chinese)
[14] 刘凯, 杨亚军, 田俊策, 等. 种植 Bt 水稻后的土壤对赤子爱胜蚓生长发育及酶活性的影响[J]. 生物安全学报, 2015, 24(3): 225-231
Liu K, Yang Y J, Tian J C, et al. Effect of soil planted with Bt rice on the development and enzyme activities ofEiseniafoetida[J]. Journal of Biosafety, 2015, 24(3): 225-231 (in Chinese)
[15] 王飞菲, 郑梦梦, 刘树海, 等. 两种除草剂对蚯蚓的急性毒性及氧化胁迫效应[J]. 生态毒理学报, 2014, 9(6): 1210-1218
Wang F F, Zheng M M, Liu S H, et al. Acute toxicity and oxidative stress of two herbicides on earthwormEiseniafetide[J]. Asian Journal of Ecotoxicology, 2014, 9(6): 1210-1218
[16] Gerecke A C, Giger W, Hartmann P C, et al.Anaerobic degradation of brominated flame retardants in sewage sludge [J]. Chemosphere, 2006, 64(2): 311-317
[17] Hu F, Pan L, Xiu M, et al. Bioaccumulation and detoxification responses in the scallopChlamysfarreriexposed to tetrabromobisphenol A (TBBPA) [J]. Environmental Toxicology and Pharmacology, 2015, 39(3): 997-1007
[18] Ji C, Li F, Wang Q, et al. An integrated proteomic and metabolomic study on the gender-specific responses of musselsMytilusgalloprovincialisto tetrabromobisphenol A (TBBPA) [J]. Chemosphere, 2016, 144: 527-539
[19] 陈玛丽, 瞿璟琰, 刘青坡, 等. 四溴双酚-A和五溴酚对红鲫肝脏组织和超微结构的影响[J]. 安全与环境学报, 2008, 8(4): 8-11
Chen M L, Qu J Y, Liu Q P, et al. Effects of tetrabromobisphenol A and pentabromophenol on the liver histological and ultra-microstructure ofCarassiusauratus[J]. Journal of Safety and Environment, 2008, 8(4): 8-11 (in Chinese)
[20] 苏燕, 范涤敏, 罗义, 等. 四溴双酚 A 对鲫鱼血清抗氧化系统的影响[J]. 南京大学学报: 自然科学版, 2007, 43(2): 164-170
Su Y, Fan D M, Luo Y, et al. Antioxidant response in serum ofCarassiusauratusunder tetrabromobisphenol A exposure [J]. Journal of Nanjing University: Science Edition, 2007, 43(2): 164-170 (in Chinese)
[21] 张丽, 蒋凤华, 曹为, 等. 四溴双酚A (TBBPA) 对中肋骨条藻的毒性效应研究[J]. 生态毒理学报, 2014, 9(6): 1219-1225
Zhang L, Jiang F H, Cao W, et al. Toxic effects of tetrabromobisphenol A (TBBPA) onSkeletonemacostatum[J]. Asian Journal of Ecotoxicology, 2014, 9(6): 1219-1225 (in Chinese)
[22] Chen C, Xue S, Zhou Q, et al. Multilevel ecotoxicity assessment of polycyclic musk in the earthwormEiseniafetidausing traditional and molecular endpoints [J]. Ecotoxicology, 2011, 20(8): 1949-1958
[23] 范学铭, 史小航, 王哲娟, 等. 玉迪安对蚯蚓 3 种抗氧化酶活性的影响[J]. 中国农学通报, 2010, 26(13): 319-323
Fan X M, Shi X H, Wang Z J, et al. Effect of dean onEisenisfoetidathree antioxidant enzymes activities [J]. Chinese Agricultural Science Bulletin, 2010, 26(13): 319-323 (in Chinese)
[24] 郑丽萍, 王国庆, 林玉锁, 等. 贵州省典型矿区土壤重金属污染对蚯蚓的毒性效应评估[J]. 生态毒理学报, 2015, 10(2): 258-265
Zheng L P, Wang G Q, Lin Y S, et al. Evaluation of toxicity effects of heavy metal contaminated soils on earthworm (Eiseniafoetida) in a mining area of Guizhou Province [J]. Asian Journal of Ecotoxicology, 2015, 10(2): 258-265 (in Chinese)
[25] Organization for Economic Co-operation and Development. Test 207: Earthworm, Acute Toxicity Tests [R]. Paris: OECD, 1984
[26] 郑晓奇, 史雅娟, 吕永龙, 等. 全氟辛烷磺酸对赤子爱胜蚓的抗氧化酶, 代谢酶和 DNA 损伤的影响[J]. 环境科学学报, 2013, 33(11): 3153-3159
Zheng X Q, Shi Y J, Lü Y L, et al. Effects of perfluorooctane sulfonate on antioxidant and metabolic enzymes and DNA damage of earthworms (Eiseniafetida) [J]. Acta Scientiae Circumstantiae, 2013, 33(11): 3153-3159 (in Chinese)
[27] Bradford M M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding [J]. Analytical Biochemistry, 1976, 72(1-2): 248-254
[28] Habig W H, Pabst M J, Jakoby W B. Glutathione S-transferases the first enzymatic step in mercapturic acid formation [J]. Journal of Biological Chemistry, 1974, 249(22): 7130-7139
[29] Saint-Denis M, Labrot F, Narbonne J, et al. Glutathione, glutathione-related enzymes, and catalase activities in the earthwormEiseniafetidaandrei[J]. Archives of Environmental Contamination and Toxicology, 1998, 35(4): 602-614
[30] 张薇, 宋玉芳, 孙铁珩, 等. 土壤低剂量荧蒽胁迫下蚯蚓的抗氧化防御反应[J]. 土壤学报, 2007, 44(6): 1049-1057
Zhang W, Song Y F, Sun T H, et al. Antioxiding defensive responses of earthworms (Eiseniafetida) exposed to lowdosage of fluoranthenein soil [J]. Acta Pedologica Sinica, 2007, 44(6): 1049-1057 (in Chinese)
[31] Bielská L, Hovorková I, Komprdová K, et al. Variability of standard artificial soils: Physico-chemical properties and phenanthrene desorption measured by means of supercritical fluid extraction [J]. Environmental Pollution, 2012, 163(4): 1-7
[32] 张敏, 邢永雷, 李成涛, 等. PBS基共聚物对蚯蚓体内蛋白质含量的影响研究[J]. 环境科学与技术, 2012, 35(10): 42-45
Zhang M, Xing Y L, Li C T, et al. Effect of PBS-based copolymer on protein content of earthworm [J]. Environmental Science and Technology,2012,35(10):42-45 (in Chinese)
[33] 徐湘博, 史雅娟, 吕永龙, 等. 四溴双酚A对赤子爱胜蚓的生长和基因表达的影响[J]. 生态毒理学报, 2014, 9(6): 1053-1059
Xu X B, Shi Y J, Lv Y L, et al. Effects of tetrabromobisphenol A(TBBPA) on growth and gene expression of earthworms (Eiseniafetida) [J]. Asian Journal of Ecotoxicology, 2014, 9(6): 1053-1059 (in Chinese)
[34] 晋艺聪, 刘丽华, 罗贤丽, 等. 四溴双酚-A 的降解性和毒性研究进展[J]. 中央民族大学学报: 自然科学版, 2010, 19(2): 5-10
Jin Y C, Liu L H, Luo X L, et al. Progress in study of degradability and ecotoxicology of tetrabromobisphenol A [J]. Journal of MUC: Natural Sciences Edition, 2010, 19(2): 5-10 (in Chinese)
[35] 白桂芬, 曾小波. 敌百虫对蚯蚓体内3种抗氧化酶活性的影响[J]. 吉林农业科学, 2013, 38(1): 22-26
Bai G F, Zeng X B. Effect of trichlorfon on the activities of three antioxidant enzymes of earthworm [J]. Journal of Jilin Agricultural Sciences, 2013, 38(1): 22-26 (in Chinese)
[36] 邰托娅, 林玉锁, 贺静. 土壤中 Cu 和 Pb 单一及复合污染对蚯蚓体内蛋白含量和 SOD 活性的影响[J]. 农业环境科学学报, 2008, 27(5): 1985-1990
Tai T Y, Lin Y S, He J. Effect of Cu, Pb single and combined pollution on total protein content and SOD activity of theEiseniafoetidaearthworm in soils [J]. Journal of Agro-Environment Science, 2008, 27(5): 1985-1990 (in Chinese)
[37] Gestel C A M V, Diepen A M F V. The influence of soil moisture content on the bioavailability and toxicity of cadmium forFolsomiacandidaWillem (Collembola: Isotomidae) [J]. Ecotoxicology and Environmental Safety, 1997, 36(2): 123-132
[38] Amorim M J D B, Sousa J P, Nogueira A J A, et al. Bioaccumulation and elimination of 14C -lindane byEnchytraeusalbidusin artificial (OECD) and a natural soil [J]. Chemosphere, 2002, 49(3): 323-329
[39] Hofman J, Rhodes A, Semple K T. Fate and behaviour of phenanthrene in the natural and artificial soils [J]. Environmental Pollution, 2008, 152(2): 468-475
[40] Belfroid A C, Sijm D T H M, Gestel C A M V. Bioavailability and toxicokinetics of hydrophobic aromatic compounds in benthic and terrestrial invertebrates [J]. Environmental Reviews, 1996, 4(4): 276-299
[41] Amorim M J, Römbke J, Scheffczyk A, et al. Effect of different soil types on the enchytraeidsEnchytraeusalbidusandEnchytraeusluxuriosususing the herbicide phenmedipham [J]. Chemosphere, 2005, 61(8): 1102-1114
[42] Sun K, Gao B, Zhang Z, et al. Sorption of atrazine and phenanthrene by organic matter fractions in soil and sediment [J]. Environmental Pollution, 2010, 158(12): 3520-3526
[44] Bielská L K, Hofman J. Supercritical fluid extraction of persistent organic pollutants from natural and artificial soils and comparison with bioaccumulation in earthworms [J]. Environmental Pollution, 2013, 176(5): 48-54
[45] Amorim M J, Römbke J, Schallnass H J, et al. Effect of soil properties and aging on the toxicity of copper forEnchytraeusalbidus,Enchytraeusluxuriosus, andFolsomiacandida[J]. Environmental Toxicology & Chemistry, 2005, 24(8): 1875-1885
[46] Spurgeon D J, Hopkin S P. Extrapolation of the laboratory-based OECD earthworm toxicity test to metal-contaminated field sites [J]. Ecotoxicology, 1995, 4(3): 190-205
[47] Shi Y, Zhang Q, Huang D, et al. Survival, growth, detoxifying and antioxidative responses of earthworms (Eiseniafetida) exposed to soils with industrial DDT contamination [J]. Pesticide Biochemistry and Physiology, 2016, 128: 22-29

