长链非编码 RNA EVADR 促进人结直肠癌细胞系增殖及迁移
韩 丹,童亚楠,贾银平,唐梦灵,曹刘素,张竹君,潘 渠
(1.成都医学院 病原生物学教研室, 四川 成都 610500;2.陆军军医大学(第三军医大学) 医学检验系临床微生物及免疫学教研室, 重庆 400038)
结直肠癌(colorectal cancer,CRC)是全球第三大癌位居癌相关死亡原因的第二。肿瘤的复发且发生转移是导致治疗失败和死亡的主要原因[1- 2]。大量研究证实长链非编码 RNA(long non-coding RNA,lncRNA)在肿瘤的发生发展、侵袭和转移的过程里发挥了十分重要的作用。其中长度为379 bp,位于人 6 号染色体的lncRNA EVADR 是与结直肠癌有密切相关性的 lncRNA。值得注意的是 EVADR 的高表达提示预后不良,其表达水平与结直肠癌患者生存时间呈负相关[3]。而 lncRNA EVADR 在结直肠癌发生发展中的作用及调控机制目前尚不清楚。因此,本研究构建过表达 EVADR 的结直肠癌细胞通过利用慢病毒技术,观察其对结直肠癌细胞增殖和迁移能力的影响,并通过实验研究其对上皮间质转化(epithelial to mesenchymal transition,EMT)及参与调节分子表达的影响,深入探讨结直肠癌细胞增殖及转移中 EVADR 的潜在作用机制,为结直肠癌的早期诊断和治疗提供科学理论和实验依据。
1 材料与方法
1.1 材料
1.1.1 主要试剂:慢病毒表达载体的构建和包装(上海汉恒生物科技有限公司);嘌呤霉素;DMEM培养基、胎牛血清和胰蛋白酶(Gibco公司);Primer Script RT Reagent Kit (TaKaRa公司);SYBR-GREEN Real-time PCR MIX (Toyobo公司);Trizol(Invitrogen公司); ECL Western blot substrate (Pierce公司);PVDF 膜(GE公司);兔抗 E-cadherin (24E10) 和兔抗 β-actin(Cell Signaling公司);HRP 标记的山羊抗兔抗体(北京中杉金桥生物技术公司);Transwell小室(BD 公司);CCK- 8试剂盒(东仁化学科技有限公司)。
1.1.2 细胞:人结直肠癌细胞系 HCT116 和 LOVO(中国科学院上海细胞库)。
1.2 方法
1.2.1 HCT116和LOVO 细胞的培养与慢病毒感染:人结直肠癌 HCT116和LOVO细胞培养环境为含10%胎牛血清的DMEM培养基,37 ℃、5% CO2培养。取增生至对数期的 HCT116和LOVO细胞,分别按 1×105个/孔接种于24孔板,待细胞汇合率为50%左右,加入MOI=15病毒液同时加入终浓度为6 mg/L的Polybrene,感染24 h后更换新鲜完全培养液,继续37 ℃培养,感染48 h后加入1 mg/L的 Puromycin 筛选7 d,获得稳定转染的细胞系。实验组设置:HCT116-EVADR和LOVO-EVADR (转染lncRNA EVADR的靶向组),HCT116-NC和LOVO-NC (转染GFP的阴性对照组)。
1.2.2 CCK- 8法检测细胞增殖:将 HCT116、LOVO两组(NC组和EVADR组)稳定转染后对数增殖期细胞按 3×105个/孔接种 96 孔板,每组设置5个复孔,同时设置空白对照为不含细胞的培养基,培养环境为:37 ℃、5% CO2、95%湿度,24 h后分别在培养孔加入 10 μL CCK- 8 检测试剂,37 ℃孵育2 h,酶标仪上测定吸光度于A450处,以吸光度值为纵坐标,时间为横坐标,绘制细胞增殖曲线。
1.2.3 Transwell小室法检测各组细胞迁移能力:将稳定转染的 HCT116、LOVO两组(NC组和EVADR组)细胞以 1×105个/孔加入孔径为 8 μm的Transwell小室,用来进行细胞迁移能力的检测。其上层小室培养液加入不含血清的 DMEM 培养基,下层小室加入含10%胎牛血清的培养基。常规培养18 h后,将上下室培养基吸尽,棉签干净擦拭上室细胞。10% 甲醛固定细胞后用结晶紫染色,倒置显微镜250倍下分别计数5个视野的穿膜细胞均数。
1.2.4 实时定量PCR检测lncRNA EVADR和间质化标志物 Snail、Slug、ZEB1和ZEB2的表达:稳定转染后检测两组细胞(NC组和EVADR组) lncRNA EVADR表达水平。Trizol 收集2组细胞,提取总RNA,反转录合成cDNA。每个样品设3个复孔,所有反应均重复3次。用SYB Green染料法检测lncRNA表达水平,总反应体系10 μL(SYBR Green 5 μL,上下游引物各 0.5 μL,cDNA 模板2 μL,DEPC-H2O 2 μL)。反应条件为:95 ℃预变性30 s,95 ℃变性5 s,58 ℃退火30 s,72 ℃延伸30 s,30个循环。实时定量 PCR引物用 Primer Premier 5.0设计,于上海生工生物工程有限公司合成。反应引物见表 1。lncRNA EVADR的表达水平以 2-△△Ct计算,以 β-actin作为内参。

表1 EVEDR、Snail、 Slug、 ZEB1、 ZEB2 real time-PCR引物
1.2.5 Western blot 检测蛋白的表达:收集稳定转染的 HCT116和LOVO两组(NC组和EVADR组)细胞于冰上用冷PBS液清洗细胞3次,加入蛋白酶抑制剂,离心后弃除沉淀,BCA 法测定蛋白质含量。加入上样缓冲液后,98 ℃蛋白变性 5 min;8% SDS-PAGE 胶电泳,用湿转膜法转至PVDF膜上,封闭液室温环境下封闭2 h,一抗4 ℃孵育过夜(稀释倍数:E-cadherin 1∶10 000,β-actin 1∶1 000),二抗室温 1.5 h (稀释倍数:1∶4 000)。在化学与荧光成像仪下加ECL发光液曝光,结果处理用Image Lab 软件分析。
1.3 统计学分析

2 结果
2.1 慢病毒感染 HCT116和LOVO细胞
慢病毒感染 HCT116和LOVO细胞3 d后,荧光显微镜下观察,干扰效率大于90%(图1)。感染 HCT116和LOVO的最佳 MOI 值为15。
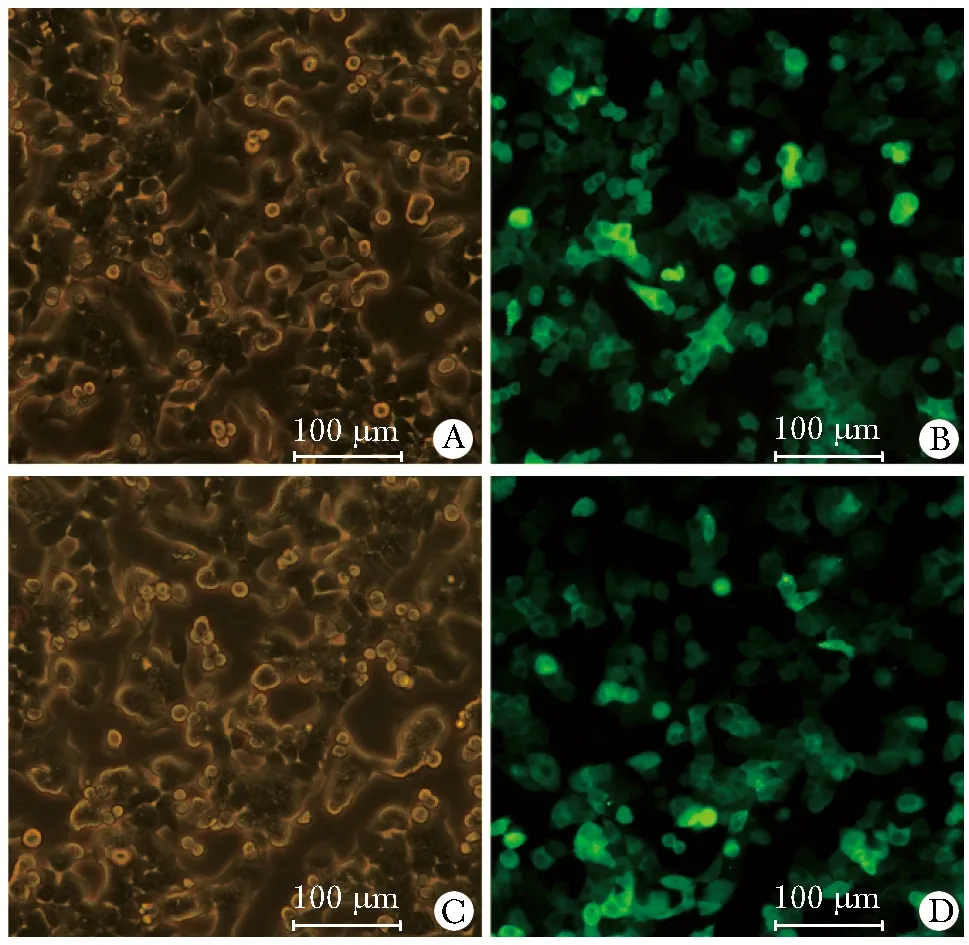
HCT116 cells infected with EVEDR-GFP lentivirus in fluorescence images (A) and microscopy images (B); LOVO cells infected with EVEDR-GFP lentivirus in fluorescence images (C) and microscopy images (D)图1 慢病毒感染HCT116,LOVO细胞的荧光强度Fig 1 Fluorescence intensity of HCT116 and LOVO cells after lentivirus infection (×40)
2.2 慢病毒感染细胞后对 lncRNA EVADR 表达的影响
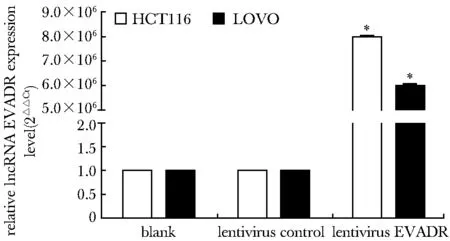
blank.no lentivirus infection; lentivirus control.NC-lentivirus infection; lentivirus EVEDR.EVEDR-lentivirus infection; *P<0.05 compared with blank and lentivirus control group图2 qPCR验证HCT116细胞和LOVO细胞中EVEDR的过表达效果Fig 2 Effect of overexpression of lncRNA EVEDR after lentivirus infection by qPCR (±s, n=3)
与 HCT116-NC和LOVO-NC相比,HCT116-EVADR和LOVO-EVADR中lncRNA EVADR表达水平均显著升高(P<0.05)(图2)。
2.3 lncRNA EVADR对HCT116和LOVO细胞增殖能力的影响
与 HCT116-NC和LOVO-NC细胞组对比,HCT116-EVADR和LOVO-EVADR细胞组增殖能力明显增强(P<0.001)(图3)。
2.4 lncRNA EVADR对 HCT116和LOVO细胞迁移能力的影响
HCT116和LOVO细胞过表达lncRNA EVADR后,与HCT116-NC和LOVO-NC细胞组对比,HCT116-EVADR和LOVO-EVADR细胞组穿过Transwell微孔滤膜的细胞数量显著升高(P<0.05)(图4)。
2.5 过表达 lncRNA EVADR可以促进结直肠癌细胞的EMT发生
与 HCT116-NC和LOVO-NC细胞组对比,HCT116-EVADR和LOVO-EVADR细胞组中上皮化标志物E-cadherin表达明显减少(图5),而间质化标志物Snail、Slug、ZEB1 和 ZEB2表达增多(图6)。
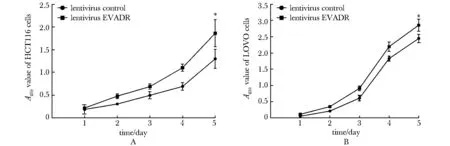
The effect on proliferation of HCT116 cells(A) and LOVO cells(B);*P<0.001 compared with lentivirus control图3 过表达lncRNA EVEDR对HCT116细胞和LOVO细胞增值的影响Fig 3 Effect of lncRNA EVEDR overexpression on proliferation of HCT116 cells and LOVO cells (±s, n=6)
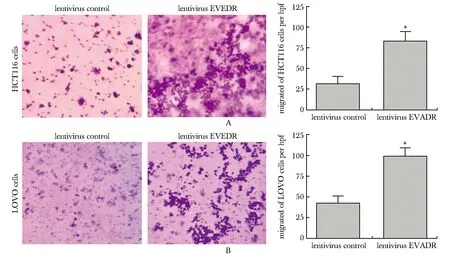
The transwell cell assay of HCT116 cells(A) and LOVO cells(B);*P<0.001 compared with lentivirus control图4 Transwell 小室检测过表达lncRNA EVEDR后HCT116细胞和LOVO细胞迁移能力
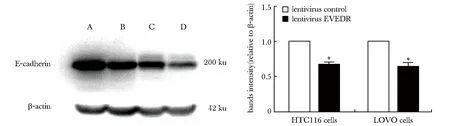
the expression level of E-cadherin in EVEDR-Lentivirus infection group of HCT116 cells(B) and LOVO cells(D) were lower than NC-Lentivirus infection group of HCT116 cells(A) and LOVO cells(C);*P<0.05 compared with lentivirus control

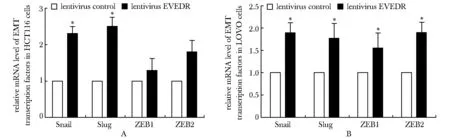
The relative mRNA level of BMT transcription factors in HCT116 cells(A) and LOVO cells(B); *P<0.05 compared with lentivirus control
3 讨论
中国每年新增结直肠癌患者高达33万例,死亡人数就有16万例。其中20%的患者确诊时因为已出现转移而失去了手术的最佳时机,约有50%的患者术后第2年就因为肿瘤的复发和转移而死亡[4]。因此,阐明结直肠癌发生发展机制对其早期诊断和综合防治具有重要的临床意义。
近年来越来越多的研究发现 lncRNA在结直肠癌中起着重要的调控作用,其有望成为新的肿瘤标志物和治疗靶点。lncRNA是一类长度大于200 nt的非蛋白编码RNA,占到非编码 RNA的80%以上[5- 6]。在前期研究中,本研究收集25例结直肠癌患者临床标本,采用高通量基因芯片检测分析肿瘤组织及对应癌旁组织中lncRNA表达情况,发现 EVADR差异最为显著。已有报道表明EVADR与结直肠癌密切相关,EVADR高表达提示预后不良,其表达水平与癌患者生存时间呈负相关[3]。本研究通过在结直肠癌细胞中稳定过表达 EVADR,结果发现与 HCT116-NC和LOVO-NC细胞组对比,HCT116-EVADR和LOVO-EVADR细胞组增殖和迁移能力均有不同幅度的增高,并且过表达 EVADR 的结直肠癌细胞上皮化标志物 E-cadherin 表达明显减少,而间质化标志物 Snail、Slug、ZEB1和ZEB2 表达增多。E-cadherin 表达的降低标志细胞发生上皮间质化(EMT),肿瘤分化程度低,并且更加容易发生淋巴结转移,提示患者预后不良[7- 9],而 lncRNA是从Snail和Slug基因的下游区域产生,可增加这两种 EMT 诱导物的表达[10]。这就表明,lncRNA EVADR很有可能通 EMT调节了结直肠癌细胞的迁移。
上皮细胞发生 EMT 时,细胞基质、基质金属蛋白酶(MMP)和细胞间的连接黏附成分均会降低,细胞骨架的重构蛋白明显增多[7- 8]。已有研究陆续发现多种 lncRNA 通过靶向 Snail、ZEB 和Twist 等转录因子以及E-cadherin 等重要的细胞连接蛋白来调控 EMT的发生和发展,HOTAIR在结直肠癌中促进EMT进程可能通过Snail,显著促进结直肠癌细胞迁移和转移[11],BANCR可能通过影响 MEK 信号通路来诱导结直肠癌细胞 EMT 作用[12]。此外,最新的结果表明被 TGF- β活化的lncRNA-ATB通过上调ZEB1和ZEB2,诱导肝癌细胞的EMT并促进侵袭和转移[13- 14],这些当前的研究提供了非编码RNA在上皮可塑性生物调解中起重要和复杂作用的证据,并且可以作为治疗癌的潜在有效靶标候选物。由于lncRNA种类繁多,还有许多 EMT 相关lncRNA尚未被认识和研究,在结直肠癌中的作用尚未阐明,深入研究 EMT 相关 lncRNA 在肿瘤侵袭转移中的作用和机制,可以进一步认识和改善肿瘤治疗。
总之,本研究结果证实过表达 lncRNA EVADR促进了结直肠癌 HCT116、LOVO细胞的增殖和迁移,并且提示EVADR可能通过调节EMT来实现肿瘤的迁移作用。该结果为深入研究结直肠癌发生和发展的分子机制提供了重要的线索。
[1] Jemal A, Bray F, Center MM,etal. Global cancer statistics[J]. CA Cancer J Clin, 2011, 61:69- 90.
[2] Calon A, Espinet E, Palomo-Ponce S,etal. Dependency of colorectal cancer on a TGF-beta-driven program in stromal cells for metastasis initiation[J]. Cancer Cell, 2012, 22:571- 584.
[3] Gibb EA, Warren RL, Wilson GW,etal. Activation of an endogenous retrovirus-associatedc long non-coding RNA in human adenocarcinoma[J]. Genome Med, 2015,7:22,doi:10.1186/s13073- 015- 0142- 6.
[4] He YJ, Li WL, Liu BH,etal. Identification of differ-ential proteins in colorectal cancer cells treated with caffeic acid phenethyl ester[J]. World J Gastroenterol, 2014, 20:11840- 11849.
[5] Guttman M, Rinn JL. Modular regulatory principles of large non-coding RNAs[J]. Nature, 2012, 482:339- 346.
[6] Ponting CP, Oliver PL, Reik W. Evolution and functions of long non-coding RNAs[J].Cell, 2009, 136:629- 641.
[7] Pena C, Garcia JM, Silva J,etal. E-cadherin and vitamin D receptor regulation by SNAIL and ZEB1 in colon cancer: clinicopathological correlations[J]. Hum Mol Genet, 2005, 14:3361- 3370.
[8] He X, Chen Z, Jia M,etal. Downregulated E-cadherin expression indicates worse prognosis in Asian patients with colorectal cancer: evidence from meta-analysis[J]. PLoS One, 2013,8: e70858.doi:10.1371/journal.pone.0070858.
[9] Behrens J, Mareel MM, Van Roy FM,etal. Dissecting tumor cell invasion:epithelial cells acquire invasive properties after the loss of uvomorulin-mediated cell-cell adhesion[J]. J Cell Biol, 1989, 108:2435- 2447.
[10] Orom UA, Derrien T, Beringer M,etal. Long noncoding RNAs with enhancer-like function in human cells[J]. Cell, 2010, 143:46- 58.
[11] Tsuda M, Masuda T, Tozaki-Saitoh H,etal. P2X4 receptors and neuropathic pain[J]. Front Cell Neurosei, 2013,7:191.doi:10.3389/fncel.2013.00191.
[12] Ohata Y, Ogata S, Nakanishi K,etal. Expression of P2X4R mRNA and protein in rats with hypobarie hypoxia-indueed pulmonary hypertension[J]. Cire J, 2011, 75:945- 954.
[13] Fan Y, Shen B, Tan M,etal. TGF-beta-induced upregulation of malat1 promotes bladder cancer metastasis by associating with suz12, Clin[J]. Cancer Res, 2014, 20:1531- 1541.
[14] Yuan JH, Yang F, Wang J,etal. A long noncoding RNA activated by TGF-beta promotes the invasion-metastasis cascade in hepatocellular carcinoma[J]. Cancer Cell, 2014, 25:666- 681.

