TLR4及HGF在糖尿病肾病患者中的表达及其与疾病进展的关系
李晶,龙建武,李国娟,肖志芳,刘文
(南华大学附属南华医院 1.内分泌科,2.普外科,湖南 衡阳 421002)
糖尿病肾病(diabetic nephropathy,DN)是糖尿病的慢性并发症,其病理变化呈进行性进展。控制血压和血糖是其主要治疗方式,但不能完全阻止该疾病的发生、发展,引发终末期肾衰竭,导致患者死亡[1-2]。DN的发生与机体免疫系统功能紊乱及炎症反应密切相关,Toll样受体4(toll like receptor4,TLR4)是Toll样受体的一种,通过识别热休克蛋白及内毒素-脂多糖等内源性配体激活核因子-κB(endogenous ligand activated nuclear factor,NF-κB)刺激炎症因子转录、合成,激活炎症反应系统,释放大量炎症因子,导致炎症的发生[3-5]。肝细胞生长因子(hepatocyte growth factor,HGF)与DN的发生、发展也有密切关系,近些年已逐渐成为研究热点[6-8]。本研究重点探讨TLR4及HGF在DN中的表达并进一步分析其与疾病进展的关系。
1 资料与方法
1.1 一般资料
选取2014年9月-2016年9月本院收治的DN患者72例为研究对象。根据24 h pro高低将72例DN患者分为 24 h pro高组(24 h pro>2 000 mg,n=31)和 24 h pro低组(500 mg<24 h pro≤ 2 000 mg,n=41)。24 h pro高组:男性18例,女性13例;年龄38~61岁,平均(52.29±5.16)岁。24 h pro低组:男性26例,女性15例;年龄40~59岁,平均(49.34±5.53)岁。另选取同期在本院健康中心体检的健康人群20例作为对照组。男性11例,女性9例;年龄41~60岁,平均(50.29±5.19)岁。所有患者均符合中华中医药学会内科分会制定的DN诊断标准[9]。纳入标准:符合上述诊断标准者;轻度肾功能障碍者;24 h尿蛋白定量(24 h urinary protein quantitation,24 h pro)>500 mg者;近2周血压控制稳定者;排除标准:原发性肾病者;急性感染者;近2周内发生过糖尿病酮症酸中毒或其他严重急性并发症者;肾衰竭者;近1个月内服用对肾脏有损害药物者;伴有脑、心或肝等重要脏器严重疾病者;内分泌功能严重紊乱者;恶性肿瘤者;造血功能异常者。本研究通过本院伦理委员会批准并经患者及其家属知情同意。
1.2 方法
观察各项临床与生化资料,血尿常规检测:采集DN患者肾活检前1天及对照组患者清晨空腹静脉血4 ml,离心机(美国Thermo公司)1 000 r/min离心10 min分离血清,置入-20℃冰箱冷冻保存待测。另采集DN患者肾活检前1天及对照组患者尿标本,采用全自动生化仪(日本Toshiba公司)检测两组血肌酐(serum creatinine,Scr)、24 h pro及空腹血糖(fasting blood glucose,FBG),高压液相法测糖化血红蛋白(glycosylated hemoglobin,HbA1c),采用酶联免疫吸附法(enzyme linked immunosorbent assa,ELISA)试剂盒(上海拜力生物科技有限公司)测定3组血清中TLR4表达量及血清和尿液标本中HGF水平。
采用免疫组织化学法(免疫组化)检测3组患者肾组织标本中TLR4的表达情况:做常规石蜡切片,脱蜡处理;采用磷酸盐缓冲溶液(phosphate buffer solution,PBS)冲洗2~3 min,连续冲洗3次;用过氧化氢孵育10~12 min,PBS冲洗3次;采用1% Triton-100浸泡10~15 min,封闭,滴加一抗,常温下孵育12 h,PBS冲洗3次;滴加二抗,继续孵育20~25 min;使用二氨基联苯胺显色10 min左右,复染,脱水处理后封片。计算阳性细胞率[10],对肾小管上皮细胞中TLR4表达情况进行评分:0分为阴性表达;1分为阳性细胞率<25.0%;2分为25.0%≤阳性细胞率≤50.0%;3分为50.0%<阳性细胞率≤70.0%;4分为阳性细胞率>70.0%。0分为阴性表达;1~2分为低表达;3~4分为高表达。每张切片分别随机选15个视野(×100倍),取其平均值。
1.3 统计学方法
数据分析采用SPSS 16.0统计软件,计量资料以均数±标准差(±s)表示,两独立样本采用t检验或单因素方差分析,组间两两比较采用LSD-t检验,P<0.05为差异有统计学意义。
2 结果
2.1 3组一般资料比较
24 h pro高组与24 h pro低组相比较,病程差异有统计学意义(P<0.05);与对照组比较,DN组患者的收缩压高于对照组(P<0.05),舒张压也高于对照组(P<0.01),差异有统计学意义;而24 h pro高组和24 h pro低组血压(收缩压、舒张压)比较差异无统计学意义(P>0.05)。见表 1。
表1 各组基本情况比较 (±s)
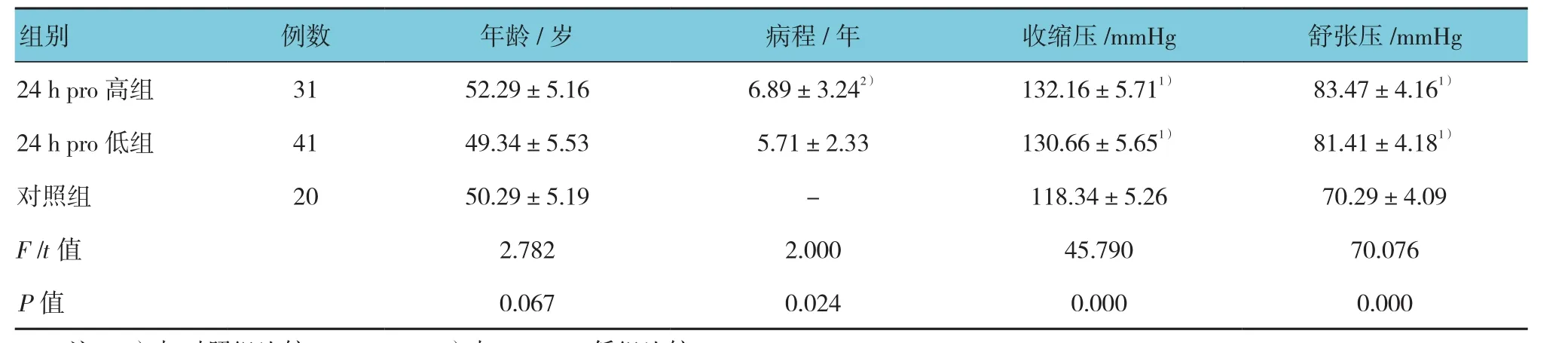
表1 各组基本情况比较 (±s)
注:1)与对照组比较,P <0.05;2)与24 h pro低组比较,P <0.05
?
2.2 3组肾组织中TLR4的表达比较
24 h pro高组、24 h pro低组及正常组的TLR4的 表 达 分 别 为(6.22±1.03)、(5.79±0.89) 及(1.88±0.46)pg/ml,3组间TLR4表达量差异有统计学意义(F=188.100,P=0.000)。DN各亚组患者肾组织中TLR4表达量高于对照组,差异有统计学意义(P<0.05),24 h pro低组与24 h pro高组比较差异无统计学意义(P>0.05)。免疫组化结果显示,对照组肾小管上皮细胞中TLR4阴性表达,而DN组患者肾小管上皮细胞中TLR4呈高表达,但24 h pro低组和24 h pro高组间TLR4表达无差异。见附图。

附图 3组肾组织中TLR4表达
2.3 3组血清与尿液中HGF、FBG、HbA1c、Scr及Ccr水平比较
3组的血清及尿液中HGF、FBG、HbA1c、Scr及Ccr水平差异有统计学意义(P<0.05)。DN各亚组患者的FBG、HbA1c、血清及尿液中HGF水平均高于对照组,差异有统计学意义(P<0.05);24 h pro高组Scr水平高于对照组和24 h pro低组,差异有统计学意义(P<0.05),而24 h pro低组Scr水平与对照组差异无统计学意义(P>0.05);24 h pro高组Ccr水平低于对照组和24 h pro低组(P<0.05),24 h pro低组Ccr水平与对照组差异无统计学意义(P>0.05)。见表2。
表2 3组血清及尿液中HGF、FBG、HbA1c、Scr及Ccr水平比较 (±s)

表2 3组血清及尿液中HGF、FBG、HbA1c、Scr及Ccr水平比较 (±s)
注:1)与对照组比较,P <0.05;2)与24 h pro低组比较,P <0.05
?
3 讨论
DN是糖尿病的3大微血管严重并发症之一,随着人口老龄化加剧,糖尿病发病率逐年增加,DN在糖尿病患者中的发病率高达30%~50%。DN患者本身存在糖代谢紊乱,而且多数患者合并心血管疾病等并发症,治疗较为复杂,预后也比一般肾病患者差[11]。DN发病机制的研究越来越多,但其发病机制仍未确切。
糖尿病属于代谢紊乱性炎症疾病的一种,炎症因子在糖尿病并发症的发生中起着不可忽视的作用。TLR4是一种巨噬细胞受体,其主要参与Gram阴性细菌的免疫过程,在抗感染中主要识别内毒素一脂多糖,作为重要的因子参与免疫反应上游的调节。已有研究证实,在大鼠模型中,高糖状态下肾小球系膜细胞的TLR4表达升高,且随剂量浓度升高而上升[12],TLR4介导LPS胞内信号传递涉及不同通路,但最终都要激活NF-κB或丝裂原活化蛋白激酶,从而启动细胞因子如白细胞介素18(interleukin-18,IL-18)、单核细胞趋化因子(monocyte chemotactic factor,MCP-1)及肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)等炎症因子的表达[13-14],而该炎症因子均参与DN的病理生理过程,且对DN的严重程度起决定性因素。有研究表明,DN患者肾小管的TLR4表达增加,且与糖化血红蛋白及肾小管间质巨噬细胞浸润程度成正相关,与肾小球滤过率成负相关。因此,DN患者在高糖刺激下,TLR4信号通路被激活,相关受体活化,进而促进IL-18、MCP-1及TNF-α等相关炎症因子的转录及释放,进一步导致肾间质纤维化及肾小球硬化的产生及发展[15]。免疫组化法检测结果显示,对照组肾小管上皮细胞中TLR4阴性表达,而DN组患者肾小管上皮细胞中TLR4呈高表达,但24 h pro低组和24 h pro高组间TLR4表达无差异,与危正南等[16]研究结果类似,提示DN患者肾组织中TLR4的表达量高于正常人群,但与24 h pro高低无相关性,或许是通过调控相关炎症因子的转录及释放引发DN,也为DN发病机制的探索提供一个新的靶点[17]。
HGF是由间质细胞分泌的一种多效性因子。有研究显示,HGF在糖尿病的发生、发展中起重要作用,肾脏病变如肾小球肾炎等可造成HGF分泌失调。急性肾损伤时,患者肾脏及血清中HGF水平急剧升高,促进肾上皮细胞增生,直接刺激血管新生,诱导肾小管形成、肾脏再生和修复[18-19]。研究显示,外源性注射HGF可以有效减轻肾组织损伤,促进肾小管上皮细胞DNA合成,防止肾间质纤维化及肾小球硬化,促进肾功能恢复[20-21]。但HGF在血清和肾组织中过度表达可加剧肾间质纤维化、肾小球硬化及肾小管囊性变[22-23]。有学者研究证实,在STZ制作的糖尿病肾病动物模型中,HGF呈先上升后下降趋势,在成模第8周其表达至高峰。此外,高糖状态可刺激白细胞介素6及胰岛素样生长因子1等细胞因子的表达,进而上调C-met的表达,又可诱导转化生长因子β等抑制HGF的表达,这类负反馈调节机制在肾间质纤维化及肾小球硬化等疾病中发挥重要作用[24-25]。研究显示[26],DN大鼠外源性注射HGF后,TGF-β1mRNA表达降低,24 h pro减少,DN大鼠肾脏形态及功能发生逆转。本研究结果中,HGF在DN的发生、发展中有作用,但未看到HGF下降趋势,是否与本研究入组患者为轻度肾功能损害者有关,还有待进一步的研究。早期检测HGF,可以辅助诊断DN,为DN的诊断和治疗提供一种新思路。
综上所述,DN患者肾组织中TLR4的表达与DN病情进展密切相关,为DN发病机制的探索提供新的思路和靶点,早期检测HGF,可以辅助诊断DN,但两者在糖尿病肾病的发生、发展过程中是否相互影响,目前还未得到证实,有待进一步研究。
[1]杨桢华, 陆晓华, 廖蕴华. 系膜细胞与糖尿病肾病及其微血管病理改变的研究进展[J]. 医学综述, 2012, 18(22): 3730-3732.
[2]WU X, ZHANG N, GAO Y. Research progress of traditional Chinese medicine treatment of diabeticnephropathy[J].Translational Medicine Research, 2014, 4(4): 16-20.
[3]黄瑛, 尹晶, 于秋爽, 等. 脂多糖对大鼠膀胱上皮细胞中Toll样受体4与核因子-κB表达的影响[J]. 新乡医学院学报, 2016,33(3): 169-173.
[4]LIN M, YIU W H, WU H J, et al. Toll-like receptor 4 promotes tubular inflammation in diabetic nephropathy[J]. Journal of the American Society of Nephrology, 2012, 23(1): 86-102.
[5]常微微, 贺连平, 姚应水. Toll样受体4与糖尿病肾病的发病机制相关性的研究进展[J]. 中国临床药理学杂志, 2015, 31(11):1066-1068.
[6]谈弘. 肝细胞生长因子在2型糖尿病肾病患者血清中的表达及临床意义[J]. 细胞与分子免疫学杂志, 2010, 26(6): 585-586.
[7]王明艳, 李兴, 郗彦芬. 肝细胞生长因子在2型糖尿病大鼠肾脏的表达[J]. 中国药物与临床, 2008, 8(2): 127-129.
[8]朱虹, 刘铁奇. 不同2型糖尿病肾病患者血清肝细胞生长因子水平的观察[J]. 中华全科医师杂志, 2015, 14(10): 765-767.
[9]栗德林. 糖尿病肾病诊断标准(讨论稿)[C]. //长春: 中华中医药学会内科分会第五届学术研讨会: 184-185.
[10]安玉, 刘志红. 糖尿病肾病病理改变与预后的关系[J]. 肾脏病与透析肾移植杂志, 2013, 22(4): 368-372.
[11]冯秉华, 史昌乾, 曹丽杰. 舒适护理在48例糖尿病肾病患者血液透析中的效果观察[J]. 武警后勤学院学报医学版, 2015,24(3): 221-222.
[12]KAURH, CHIENA, JIALALI. Hyperglycemia induces toll likereceptor 4 expression and activity in mouse mesangial cells:relevanceto diabetic nephropathy[J]. Am J Physiol Renal Physiol,2012, 303(8): 1145-1150.
[13]DOZ E, NOULIN N, BOICHOT E, et al. Cigarette smoke-induced pulmonary inflammation is TLR4/MyD88 and IL-1R1/MyD88 signaling dependent[J]. Journal of Immunology, 2008, 180(2):1169-1178.
[14]王瑜, 吕柳青, 张莉, 等. TLR4在糖尿病肾病大鼠肾组织中的表达[J]. 南昌大学学报医学版, 2013, 53(12): 11-15.
[15]臧丽, 王建平. TLR4与糖尿病肾病的研究进展[J]. 国际病理科学与临床杂志, 2010, 30(6): 523-526.
[16]危正南 , 李涛 , 张庆红 , 等 . MIF、TLR4、TNF-α 水平在糖尿病肾病患者中的变化及其临床意义[J]. 疑难病杂志, 2016,15(2): 165-168.
[17]秦宁宁, 王秋月. TLR4及相关炎性因子在糖尿病肾病中的表达及临床意义[J]. 中国老年学杂志, 2014, 34(13): 3648-3649.
[18]LIBETTA C, ESPOSITO P, SEPE V, et al. Acute kidney injury:effect of hemodialysis membrane on HGF and recovery of renal function[J]. Clinical Biochemistry, 2013, 46(1-2): 103.
[19]ZHOU D, TAN R J, LIN L, et al. Activation of hepatocyte growth factor receptor, c-met, in renal tubules is required for renoprotection after acute kidney injury[J]. Kidney International,2013, 84(3): 509-520.
[20]丘余良, 阮诗玮. 肝细胞生长因子对肾纤维化保护作用研究进展[J]. 中国中西医结合肾病杂志, 2008, 9(7): 653-655.
[21]MIZUNO S, MATSUMOTO K, NAKAMURA T. HGF as a renotrophic and anti-Affiliatedbrotic regulator in chronic renal disease[J].Frontiers in Bioscience A Journal & Virtual Library, 2008, 13(18):7072-7086.
[22]卫敏江, 吴伟岚, 陈敏怡. TGF-β与肝细胞生长因子在儿童原发性局灶节段性肾小球硬化肾组织中的表达[J]. 中国当代儿科杂志, 2010, 12(8): 630-633.
[23]孙春秀, 杜秋香, 徐宁, 等. 血清肝细胞生长因子检测在2型糖尿病肾病中的诊断价值[J]. 中国医学装备, 2015, 12(4):92-94.
[24]KAMIŃRSKA D, TYRAN B, MAZANOWSKA O, et al. Gene expression of INF-gamma, IL-10, IL-2, IL-6, PDGF-B i TGF-beta in kidney tissue after renal transplantation[J]. Polski Merkuriusz Lekarski Organ Polskiego Towarzystwa Lekarskiego, 2006,21(122): 148-150.
[25]DUDKOWSKA M, BAJER S, JAWORSKI T, et al. Antifolate/folate-activated HGF/c-Met signalling pathways in mouse kidneys-the putative role of their downstream effectors in crosstalk with androgen receptor[J]. Archives of Biochemistry &Biophysics, 2009, 483(1): 111-119.
[26]李兴, 张木勋. HGF对糖尿病肾病TGF-β1mRNA表达的影响[J].山西医科大学学报, 2006, 37(7): 703-706.

