甲氨蝶呤治疗系统性硬皮病的Meta分析
邓婉莹 ,王晓敏 ,张佳林 ,邱路萍 ,黄嘉祺 ,齐庆
(1.广州中医药大学第一临床医学院,广州 510405;2.广州中医药大学第一附属医院,广州 510405)
系统性硬皮病(Systemic sclerosis,SSc)是一种全身性的自身免疫性结缔组织病。其发病原因尚不明确,可能包括:自身免疫、血管内皮功能障碍、组织纤维化异常等病理生理过程[1-2];临床表现为皮肤内脏纤维化、微血管系统改变等特征[3],常累及心、肺及消化道等重要器官。SSc的死亡率高于其他风湿性疾病,特别是在弥漫性皮肤系统性硬皮病患者中,患者不良结局与死亡风险增加[4]。现阶段并无特效药和满意的治疗方法[5],慢性疼痛、器官功能障碍长期困扰SSc患者,生活质量下降。
甲氨蝶呤(Methotrexate,MTX)是最早应用临床并取得成功的抗叶酸制剂,自20世纪50年代以来,已广泛用于多种炎症性疾病及自身免疫性疾病的治疗中,并具有良好疗效[6]。MTX竞争性地抑制二氢叶酸还原酶,致胸苷酸受体和DNA合成受损,可通过免疫调节作用抑制多种促炎细胞因子,包括TNF、IL-1、IL-6等,同时可抑制抗原诱导的T细胞活化,减少T细胞增殖,发挥免疫抑制及抗炎效应扭转纤维化进程[7-9]。目前,国内外关于MTX治疗SSc的研究,由于样本量及检验效能的限制,尚缺乏相应的系统评价。因此,本研究通过对已发表的MTX治疗系统性硬皮病的RCT与队列研究,采用Meta分析方法对探讨甲氨蝶呤的有效性和安全性,为系统型硬皮病临床治疗提供依据。
1 资料与方法
1.1 纳入标准 检索甲氨蝶呤治疗系统性硬皮病的随机对照试验或队列研究,限中文和英文文献。病例均符合系统性硬皮病的诊断标准:年龄>18岁,性别不限,满足American College of Rheumatology系统性硬皮病标准[10]。无甲氨蝶呤治疗的禁忌症。干预措施:治疗组予甲氨蝶呤治疗,对照组用非甲氨蝶呤药物治疗。结局指标:改良Rodnan评分(Modified Rodnan skin score,mRSS)、一氧化碳弥散量(Diffusing capacity of carbon monoxide,DLco)、健康评估问卷-残疾指数量表(Healthassessment questionnaire disability index,HAQ-DI)以及双手握力。凡采用上述1项或多项结局指标的研究均纳入。
1.2 排除标准 ①无法提取全文、数据的研究;②排除信件、病例报导、综述类和动物研究;③未报告本次系统评价所关注结局数据的文献;④重复发表的文章;⑤非中文或英文研究。
1.3 检索资料 计算机搜索Embase,Cochrane Central Register of Controlled Trails,PubMed,万方数据库和中国期刊全文数据库(CNKI)。检索文献时间为1968年1月—2017年6月,并追踪纳入文献、相关研究的参考文献。中文检索词:“甲氨蝶呤”或“氨甲蝶呤”或“氨甲基叶酸”;“硬皮病”或“系统性硬皮病”或“皮肤硬化”。英文检索词:‘Scleroderma,Systemic’OR ‘Systemic Sclerosis’OR‘Sclerosis,Systemic’ OR ‘Systemic Scleroderma’ and‘Methotrexate’OR‘Methotrexate,(D)-Isomer’OR‘Methotrexate, (DL)-Isomer’OR ‘Mexate’OR‘Methotrexate Sodium’OR ‘Sodium,Methotrexate’OR ‘Methotrexate,Sodium Salt’OR‘Methotrexate,Disodium Salt’ OR ‘Methotrexate Hydrate’ OR‘Hydrate,Methotrexate’OR‘Methotrexate,Dicesium Salt’OR ‘Dicesium Salt Methotrexate’。以 PubMed为例,其具体检索策略见图1。

图1 PubMed检索策略
1.4 文献筛选与质量评价 由2名研究员独立阅读文献,进行筛选,交叉核对,有分歧时双方讨论,由第3位研究员进行仲裁。研究根据牛津英国循证医学中心进行评估。随机对照试验(RCT)按照Cochrane手册的偏倚风险评价工具评价纳入研究的偏倚风险。队列研究按照纽卡斯尔-渥太华量表(Newcastle-Ottawa scale)进行质量评价[11]。其中包括3个因素:研究对象的选择,研究组的可比性和结果的测量。除RCT外,每项研究分配0~9分(分值由星号表示)。6颗或更多星号的RCT和观察研究被认为是高质量。
1.5 统计学分析 对纳入的研究所提取的数据使用Cochrane协作网提供的RevMan 5.3软件进行统计分析[12-13]。连续变量采用均数差(MD)作为效应量,以95%置信区间(95%CI),检验水准为α=0.05。如果纳入的研究通过异质性检验,则进行Meta分析[14]。纳入的研究其异质性采用χ2检验,若纳入的研究间存在异质性时则进行亚组分析或敏感性分析。当P>0.05和Ι2<50%时,采用固定效应模型,当P<0.05和Ι2>50%时,采用随机效应模型。若临床异质性大和不可合并的研究结果,则进行描述性分析。
2 结果
通过全面的检索,检索收集相关文献297篇。其中64篇重复。210篇经过阅读标题及摘要后剔除,其中包括91篇与主题不符,70篇综述,49篇病例报道。阅读全文23篇后,19篇剔除,原因为12篇干预措施与纳入标准不符,1篇数据重复,2篇数据不完整,最终纳入4篇文献。见图2。
2.1 纳入文献的特征 纳入文献的一般情况包括国家、年龄、研究类型、性别、年龄、用药情况等,具体见表1。最终共4篇文献满足纳入标准及排除标准,纳入荟萃分析。其中3篇为RCT,1篇为队列研究。第1篇[15]及第2篇[16]RCT对照组均为安慰剂,第3篇[17]RCT以雷帕霉素作对照,第4篇[18]为队列研究,以非免疫抑制剂作为对照组。共238例患者,治疗组126例,对照组112例。所纳入的RCTs,2篇为随机对照双盲研究,1篇为随机对照单盲研究,1篇队列研究为前瞻性多中心的队列研究。4篇文献基线可比性良好,见表1。
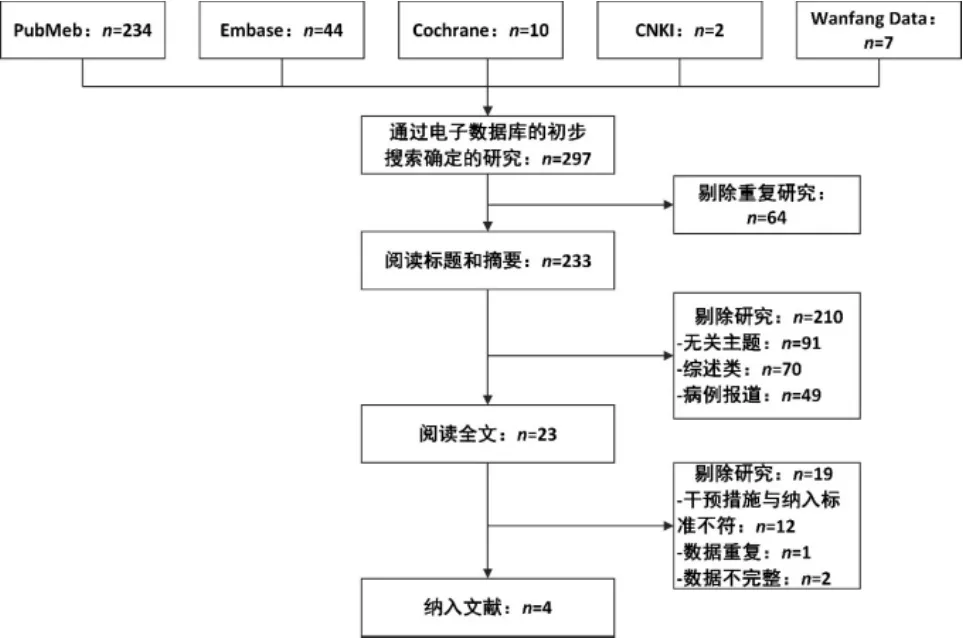
图2 献筛选流程

表1 纳入文献基本资料
2.2 纳入研究的方法学质量评价 纳入RCTs质量评价及风险评估见图3,队列研究质量评价见表2。4篇文献均为较高质量研究。3项[15-17]研究描述了具体的随机方法,并且均提及盲法,其中2篇[15-16]为双盲随机对照试验,1篇[17]为单盲随机对照试验。1篇队列研究[18]为前瞻性队列研究。纳入文献数据基本完整,3篇[16-18]报道了药物不良反应。

图3 .纳入文献质量评价及风险评估图

表2 Newcastle-Ottawa Scale(NOS)文献质量评价量表
2.3 Meta分析结果
2.3.1 改良Rodnan皮肤评分(mRSS) 共有4篇文献[15-18]报道2组患者皮肤评分。患者总数212例,异质性检验结果表明各研究间异质性较小(χ2=0.84,df=3;P=0.84,I2=0%),采用固定效应模型进行Meta分析,结果示:MTX改善mRSS明显优于对照组,结果差异有统计学意义。[MD=-1.95,95%CI(-3.63,-0.27),P=0.02],见图 4。
2.3.2 一氧化碳弥散量(DLco) 共有4篇文献[15-18]报道2组患者一氧化碳弥散量。患者总数193例,异质性检验结果表明各研究间异质性较小(χ2=5.09,df=3;P=0.17,I2=41%),固定效应模型 Meta分析结果示,2组数据在DLco上差异无统计学意义。[MD=0.02%,95%CI(-0.10,0.07),P=0.65],见图5。
2.3.3 健康评估问卷-残疾指数量表(HAQ-DI)共有3篇文献[16-18]报道2组患者HAQ-DI。患者总数169例,异质性检验数据表明各数据结果间异质性较小(χ2=0.00,df=2;P=1,I2=0%),固定效应模型 Meta分析结果示,2组数据在HAQ-DI上差异有统计学意义。[MD=-0.20,95%CI(-0.3,-0.1),P<0.000 1],见图6。
2.3.4 握力(grip strength) 共有2篇文献[15-16]报道2组患者握力。患者总数79例,异质性检验数据表明各数据结果间异质性较大(χ2=0.00,df=2;P=0.87,I2=52%),随机效应模型Meta分析结果示,2组数据在握力上差异有统计学意义。[MD=16.81 mmHg,95%CI(1.48,32.13),P=0.03)。根据肢体方位不同,分为左侧和右侧握力2个亚组,右侧握力组异质性检验差异有统计学意义(χ2=1.61,df=1;P=0.2,I2=38%),采用随机效应模型,分析结果示:[MD=22.29 mmHg,95%CI(5.08,39.51),P=0.01]。左侧握力组异质性检验差异无统计学意义(χ2=1.11,df=1;P=0.29,I2=10%),采用随机效应模型,分析结果示[MD=7.92 mmHg,95%CI(-11.84,27.68),P=0.43],见图7。
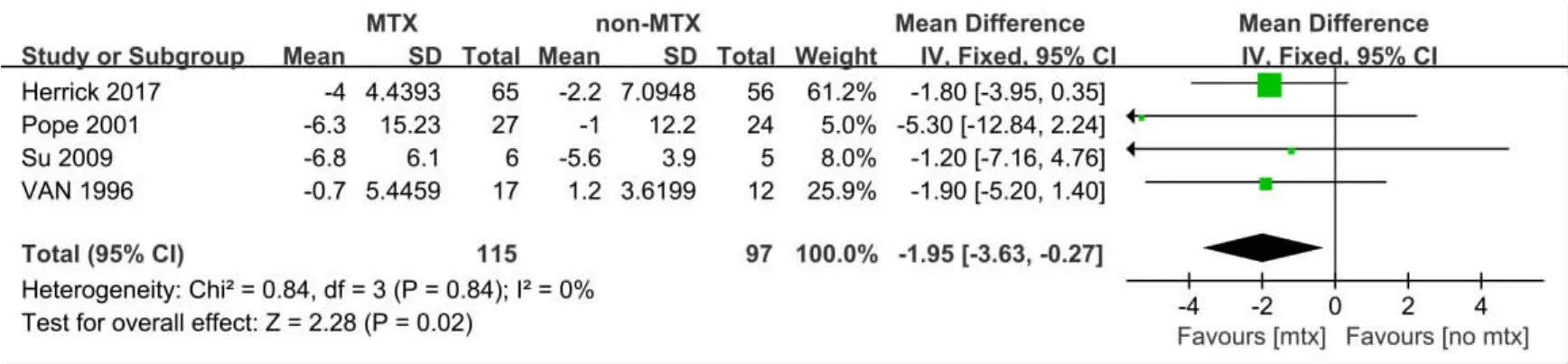
图4 2组mRSS的Meta分析(MEAN=均数;SD=标准差;IV=方差倒数权重法;Fixed=固定效应模型;CI=置信区间)

图5 2组DLco的Meta分析(MEAN=均数;SD=标准差;IV=方差倒数权重法;Fixed=固定效应模型;CI=置信区间)

图6 2组HAQ-DI的Meta分析(MEAN=均数;SD=标准差;IV=方差倒数权重法;Fixed=固定效应模型;CI=置信区间)
2.3.5 不良反应 纳入研究中,有3项研究报告了药物不良事件。Pope等[16]报告了1例因口腔溃疡退出治疗;Su等[17]报告了3例不良反应中,1例为全血细胞减少,停药后恢复正常;1例为呼吸衰竭合并心包积液,6个月退出研究,退出后3个月因感染死亡;1例为恶心呕吐,治疗6个月时退出研究,退出后4、5个月后死亡。Herrick等[18]报告了29例不良反应,未具体阐明不良反应内容。
2.3.6 敏感性分析 将固定效应模型与随机效应模型相互转换,分别评估单个研究对本次Meta分析结果的影响。其中,以改良Rodnan皮肤评分、一氧化碳弥散量、健康评估问卷-残疾指数量表作为结局指标,3项效应结果未发生明显变化,均稳定。以握力为结局指标时,剔除Van等[15]研究中左手握力后,握力合并效应结果变化为[MD=25.86 mmHg,95%CI(18.60,33.12),P<0.000 01],说明该研究结果的敏感性较高,结果稳健性较低,见图8。
3 讨论
甲氨蝶呤是叶酸拮抗剂之一,因疗效确切、价格低廉,广泛应用在多种自身免疫性疾病。追溯MTX治疗SSc的文献中,笔者发现2篇随机对照试验[15-16]显示临床医师运用MTX与安慰剂治疗SSc,运用mRSS评估皮肤厚度改善情况,发现两者结果差异无统计学意义,但mRSS评分有下降趋势。另一篇随机对照试验比较MTX与雷帕霉素对于皮肤厚度改善情况,结果示:P=0.033,差异有统计学意义。因报道结果不完全一致,故本Meta分析系统检索了MTX治疗SSc治疗效果的文献,应用软件Revman5.3对数据进行处理分析。
本荟萃分析显示:MTX治疗SSc中,改良Rodnan皮肤评分、握力、健康评估问卷-残疾指数量表评分改善差异有统计学意义;一氧化碳弥散量无统计学意义。敏感性分析总体效应值稳定,提示结果具有可信性。
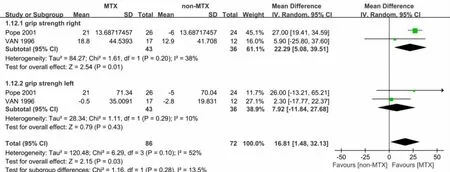
图7 2组握力的Meta分析(MEAN=均数;SD=标准差;IV=方差倒数权重法;Fixed=固定效应模型;CI=置信区间)
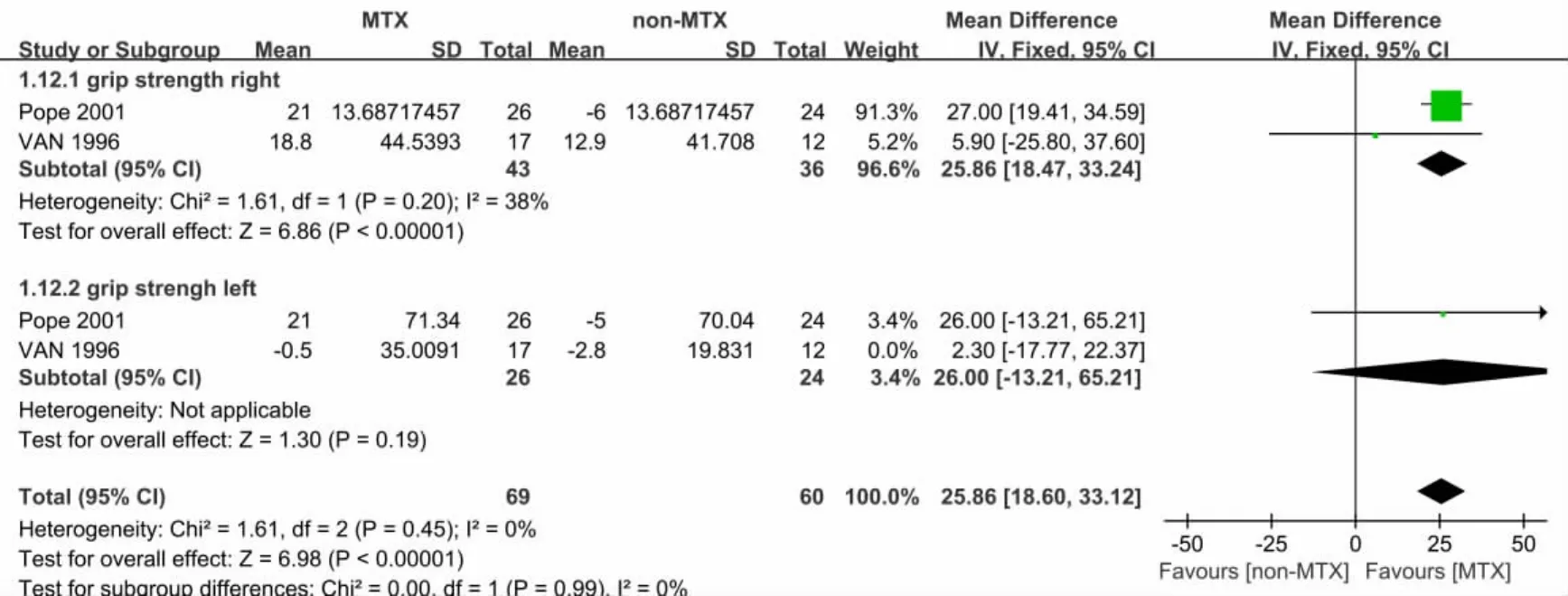
图8 2组握力的敏感性分析(MEAN=均数;SD=标准差;IV=方差倒数权重法;Fixed=固定效应模型;CI=置信区间)
皮肤受累是SSc的普遍特征,其特征在于皮肤增厚和硬化的程度不同。通常最早出现在手指和面部。有研究发现[19-20],在早期弥漫性系统性硬皮病中,皮肤厚度与内脏受累程度、死亡率呈正相关。既往报道MTX对SSc皮肤厚度改善结果不一,本研究示:2组差异有统计学意义,提示MTX可显著改善SSc患者皮肤受累情况,控制病情,见图4。因为内脏受累或恶化与皮肤增厚的程度关系密切[20],较高皮肤厚度进展率可预测内脏受累和死亡率[21]。因此,尽早、多次、长期测量mRSS,有助于评估疾病的进展和预后。
SSc肺部病变主要表现在肺纤维化,出现继发间质性肺疾病(Systemic sclerosis-interstitial lung disease,SSc-ILD),常以渐进性活动性呼吸困难、通气障碍、DLco降低等症状为主要临床表现,是SSc累及肺部的主要类型之一。SSc相关的ILD由各种组织病理学亚型组成,最常见的是非特异性间质性肺炎和常见间质性肺炎,受影响患者的预后较不伴肺部疾病的SSc患者差[22],是系统性硬皮病患者发病和死亡的主要原因[23]。弥散功能是肺换气功能的主要组成部分,通过肺功能检测DLco评估。纳入的4项研究中均检测DLco,通过荟萃分析所示,MTX治疗SSc中,DLco变化不明显,提示MTX对于肺的弥散功能无明显改善,见图5。值得注意的是,1969年Clarysee等[24]报告MTX致ILD,部分长期、大量使用MTX的患者有发生肺弥散功能下降的风险[25]。虽然本研究未发现MTX的应用明显加重肺换气功能障碍,但建议系统型硬皮病患者中ILD高风险的 Scl-70、Th/To、U11/12等抗体阳性的患者,谨慎使用本药。MTX治疗SSc患者前,应筛查患者自身抗体并定期评估肺功能。
有2项研究涉及握力,在握力上,笔者结合左侧与右侧的握力共同行荟萃分析,发现MTX在改善握力上有良好疗效,但异质性较大(I2=52%),为此,笔者做了一项敏感性分析,发现Van等[15]研究左侧握力数据与其余数据结果差异较大,排除该项研究后I2=0%,结果具有统计学意义。分析Van等[15]一文,追溯文中提及握力测量方法,未发现不合理处。为明确异质性大的原因,尝试与作者联系后未得到回复,无法收集原始数据,不排除因数据录入产生误差。
3项研究提及健康评估问卷-残疾指数量表评分(HAQ-DI),本研究发现MTX对于HAQ-DI评分有明显改善,可提高SSc患者生活质量。HAQ-DI的改善与MTX改善患者的皮肤状态、握力密不可分。因为皮肤纤维化的改善,提高手指各中小关节的活动度,从而握力得到改善,并且对全身各关节也有所改善,最终患者生活质量得以提高。
本研究共纳入4篇研究,均为较高质量研究,共238例患者。然而,系统性硬皮病在临床上为少见病,本研究的样本量相对较小,存在一定的局限性:①纳入文献只有4篇,均为国外研究,缺少国内相关研究;②缺少大样本随机对照试验;③缺少安全性评价。
本研究结果显示,MTX治疗SSc有效,可以改善皮肤状态,握力和生活质量,但未显示可改善肺弥散功能。MTX是治疗SSc患者皮肤硬化的优选方案,疗效明确,并且具有价格低廉的优势,大大降低患者医疗成本,有较好可推广性。本次Meta分析样本量较小,日后还可进一步进行多中心、大样本、随机双盲临床试验,提供更多高质量研究,并关注ILD及自身免疫抗体与甲氨蝶呤治疗系统性硬皮病的关系,为患者精准治疗提供依据。
[1]Trojanowska M.Cellular and molecular aspects of vascular dysfunction in systemic sclerosis[J].Nat Rev Rheumatol,2010,6:453-460.
[2]Denton CP.Therapeutic targets in systemic sclerosis[J].Arthritis Res Ther,2007,9 Suppl 2:S6.
[3]Plastiras SC,Toumanidis ST.Systemic sclerosis:the heart of the matter[J].Hellenic J Cardiol,2012,53:287-300.
[4]Tyndall AJ,Bannert B,Vonk M,et al.Causes and risk factors for death in systemic sclerosis:a study from the EULAR Scleroderma Trials and Research(EUSTAR)database[J].Ann Rheum Dis,2010,69:1809-1815.
[5]Johnson SR,Glaman DD,Schentag CT,et al.Quality of life and functional status in systemic sclerosis compared to other rheumatic diseases[J].J Rheumatol,2006,33:1117-1122.
[6]Cipriani P,Ruscitti P,Carubbi F,et al.Methotrexate:an old new drug in autoimmune disease[J].Expert Rev Clin Immunol,2014,10:1519-1530.
[7]赵云,李建勤,黄长征.细胞因子与硬皮病研究进展[J].中国中西医结合皮肤性病学杂志,2017,16(2):171-173.
[8]Genestier L,Paillot R,Fournel S,et al.Immunosuppressive properties of methotrexate:apoptosis and clonal deletion of activated peripheral T cells[J].J Clin Invest,1998,102:322-328.
[9]Chan ES,Cronstein BN.Molecular action of methotrexate in inflammatory diseases[J].Arthritis Res,2002,4:266-273.
[10]Preliminary criteria for the classification of systemic sclerosis(scleroderma)[J].Bull Rheum Dis,1981,31:1-6.
[11]Stefanantoni K,Sciarra I,Iannace N,et al.Occupational therapy integrated with a self-administered stretching program on systemic sclerosis patients with hand involvement[J].Clin Exp Rheumatol,2016,34 Suppl100:157-161.
[12]Stroup DF,Berlin JA,Morton SC,et al.Meta-analysis of observational studies in epidemiology:a proposal for reporting.Meta-analysis Of Observational Studies in Epidemiology(MOOSE)group[J].JAMA,2000,283:2008-2012.
[13]Clarke M,Horton R.Bringing it all together:Lancet-Cochrane collaborate on systematic reviews[J].Lancet,2001,357:1728.
[14]Hozo SP,Djulbegovic B,Hozo I.Estimating the mean and variance from the median,range,and the size of a sample[J].BMC Med Res Methodol,2005,5:13.
[15]Van Den Hoogen FH,Boerbooms AM,Swaak AJ,et al.Comparison of methotrexate with placebo in the treatment of systemic sclerosis:a 24 week randomized double-blind trial,followed by a 24 week observational trial[J].Br J Rheumatol,1996,35:364-72.
[16]Pope JE,Bellamy N,Seibold JR,et al.A randomized,controlled trial of methotrexate versus placebo in early diffuse scleroderma[J].Arthritis Rheum,2001,44:1351-1358.
[17]Su TI,Khanna D,Furst DE,et al.Rapamycin versus methotrexate in early diffuse systemic sclerosis:results from a randomized,singleblind pilot study[J].Arthritis Rheum,2009,60:3821-3830.
[18]Herrick AL,Pan X,Peytrignet S,et al.Treatment outcome in early diffuse cutaneous systemic sclerosis:the European Scleroderma Observational Study(ESOS)[J].Ann Rheum Dis,2017,76:1207-1218.
[19]Shand L,Lunt M,Nihtyanova S,et al.Relationship between change in skin score and disease outcome in diffuse cutaneous systemic sclerosis:application of a latent linear trajectory model[J].Arthritis Rheum,2007,56:2422-2431.
[20]Steen VD,Medsger TA Jr.Improvement in skin thickening in systemic sclerosis associated with improved survival[J].Arthritis Rheum,2001,44:2828-2835.
[21]Dobrota R,Maurer B,Graf N,et al.Prediction of improvement in skin fibrosis in diffuse cutaneous systemic sclerosis:a EUSTAR analysis[J].Ann Rheum Dis,2016,75:1743-1748.
[22]王云兵,杨朝晖.间质性肺疾病的诊治新进展[J].现代医药卫生,2016,32(15):2370-2373.
[23]Leroy EC.Sentinel signs and symptoms of systemic sclerosis[J].Curr Opin Rheumatol,1989,1:499-504.
[24]Clarysse AM,Cathey WJ,Cartwright GE,et al.Pulmonary disease complicating intermittent therapy with methotrexate[J].Jama,1969,209:1861-1868.
[25]Imokawa S,Colby TV,Leslie KO,et al.Methotrexate pneumonitis:review of the literature and histopathological findings in nine patients[J].Eur Respir J,2000,15:373-81.

