硬皮病患者皮损中Smad3与Smad7 mRNA的表达及检测意义
刘文丽,穆欣,张键
(西安交通大学第一附属医院,西安 710061)
硬皮病(Scleroderma,SD)是一种以皮肤变硬、增厚,伴有各种程度的慢性炎症浸润和显著的纤维增生性微血管病变及体液和细胞免疫改变为特征的自身免疫性疾病[1],其发病机制较为复杂,目前还不能完全阐明,可能与微血管病变、免疫反应、细胞外基质合成过多相关[1-3]。SD因其发病机制复杂而成为一种难治性疾病,危害程度大,可累及到皮肤以及包括心肺、消化道等在内的内脏器官,导致器官结构破坏和功能减退乃至衰竭,严重威胁人类健康和生命,给患者带来极大的经济及精神压力[3]。迄今的研究一致认为TGF-β在SD的发病过程中扮演重要角色,其中TGF-β/Smads信号传导途径异常可能发挥重要作用[4]。Smads家族作为TGF-β受体胞内激酶底物受到广泛关注,Smad3与Smad7是该信号转导通路中的重要分子,分别为受体活化型与抑制型Smads成员,参与介导多种纤维化疾病的发生[5]。本次研究通过检测正常皮肤与SD患者皮损中Smad3与Smad7 mRNA的表达,探讨其在SD发病机制中的潜在作用及临床诊断与治疗价值。
1 资料与方法
1.1 资料来源 本次研究共纳入2009年2月—2012年6月西安交通大学第一附属医院皮肤科门诊和住院收取的46例临床和病理确诊、未经治疗的SD患者作为研究对象。其中男14例,女32例,平均年龄(27.2±11.3)岁。对所有SD患者进行分型:28例为系统型硬化(Systemic sclerosis,SSc),18例为局限型硬皮病(Localized scleroderma,LSc)。根据皮肤病变过程对SD患者进行分期:14例为水肿期,17例为硬化期,15例为萎缩期。所有患者中18例出现关节痛、活动受限等现象,11例发生明显的肺纤维化,6例出现左心功能不全症状,5例出现高血压。患者的皮损取材集中在四肢、腹部、面部。所有患者均经组织病理学明确诊断,均具有典型的硬皮病皮肤临床表现;患者的病程均小于1年,收集皮损前4周均未服用任何可能导致皮肤硬化的药物,均未接受激素、免疫调节剂等治疗。排除合并其他皮肤病或发生皮肤溃烂的患者;排除近期进行过皮肤硬化症等治疗的患者;排除合并有严重原发性疾病及精神病患者,如心、脑血管,肝、肾、内分泌系统及造血系统等。另选取15例我院整形外科因美容进行手术切除患者的健康正常皮肤(取材部位集中在四肢、腹部、面部)作为对照。纳入研究的患者均告知本研究的目的及方法,所有患者均签署知情同意书,研究获得医院伦理委员会批准。
1.2 方法 标本常规石蜡包埋制成连续5 μm切片,采用原位RT-PCR法进行染色。石蜡包埋的新鲜组织切片常规脱蜡至水,蛋白酶K消化,过氧化物酶阻断。RT-PCR实验步骤:切片滴加10 μL逆转录反应体系,30℃孵育10 min,42℃孵育 30 min,99℃2 min灭活逆转录酶,冷却至5℃保持5 min;切片上滴加PCR反应体系40 μL,轻盖盖玻片,指甲油封闭后置于原位扩增板上;80℃热启动进行PCR扩增(其循环参数为:94℃变性1 min;51℃退火1 min;72℃延伸1 min,共30个循环,结束后72℃延伸10 min,4℃保存);去盖玻片,50mL/L小牛血清封闭液室温20 min;滴加SABC试剂室温下孵育20 min;滴加新鲜配制的AEC显色剂,水溶性封片剂封片,镜下观察结果。每次实验均设立阴性对照,阴性对照以双蒸水代替引物作为质控标准。
1.3 结果 原位RT-PCR结果判定标准根据Shimizu法[6]改良而成。在显微镜下(×400倍)随机选取5个视野(每个视野计数100个细胞),按照阳性细胞所占百分比(阳性率)及染色强度分级评分。根据阳性率分为4级,阴性为0分,阳性率<20%为1分,20%~50%为2分,>50%为3分;根据染色强度分为3级:无着色为0分,浅着色为1分,深着色为2分;上述2项积分相加:<2分为阴性(-),2分为弱阳性(+),3分为阳性(++),≥4分为强阳性(+++)。
1.4 统计学分析 所有数据均采用SPSS20.0统计软件进行统计分析,2组间比较采用Mann-Whitney U秩和检验,3组间比较采用Kruskal-Wallis H检验。2个变量之间相关分析采用Spearman秩相关。P<0.05为差异有统计学意义。
2 结果
2.1 SD患者皮损和对照组正常皮肤中Smad3 mRNA的表达 SD患者与对照组患者相比,性别、年龄等基本信息相比差异无统计学意义(P>0.05)。原位RT-PCR结果显示,SD患者皮损中Smad3 mRNA表达水平为:阴性0例,弱阳性4例,阳性12例,强阳性30例;对照组正常皮肤中Smad3 mRNA表达水平为:阴性0例,弱阳性4例,阳性7例,强阳性4例;2组相比SD患者皮损中Smad3 mRNA的表达水平显著高于对照组正常皮肤(P<0.05),见表1。典型患者的原位RT-PCR结果如图1与图2所示。

表1Smad3、Smad7 mRNA在SD组与对照组间的比较
2.2 SD患者皮损和对照组正常皮肤中Smad7 mRNA的表达 SD患者皮损中Smad7 mRNA表达水平为:阴性4例,弱阳性15例,阳性22例,强阳性5例;对照组正常皮肤中Smad3 mRNA表达水平为:阴性1例,弱阳性2例,阳性5例,强阳性7例;2组相比SD患者皮损中Smad7 mRNA的表达水平显著低于对照组正常皮肤(P<0.05),见表1。典型患者的原位RT-PCR结果如图3与图4所示。

图1 正常皮肤组织Smad3 mRNA的表达(原位 RT-PCR ×400)
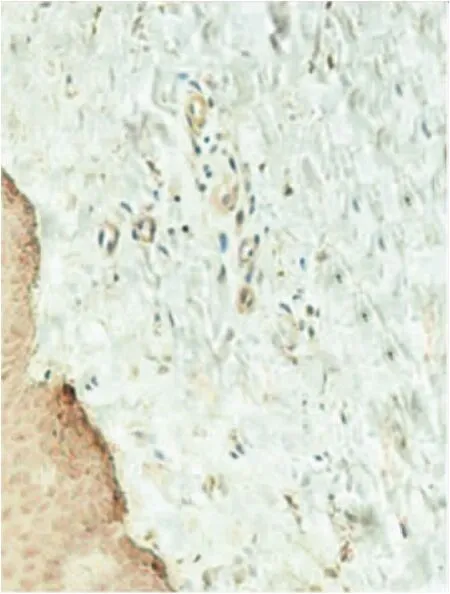
图2SD组织Smad3 mRNA的表达(原位RT-PCR×400)

图3 正常皮肤组织Smad7 mRNA的表达(原位RT-PCR ×400)
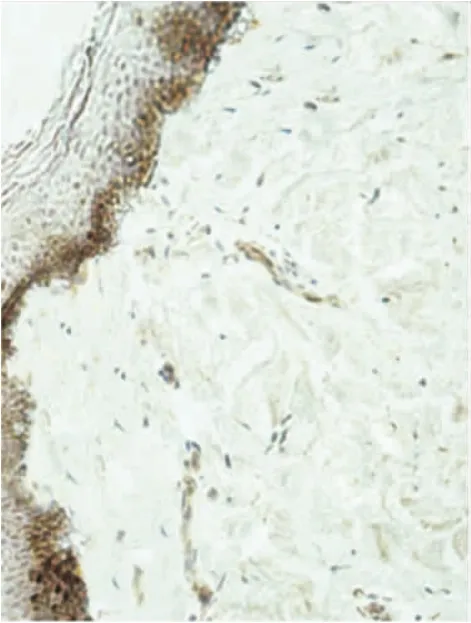
图4SD组织Smad7 mRNA的表达(原位RT-PCR×400)
2.3 SD患者皮损和对照组正常皮肤中Smad3与Smad7 mRNA的相关性分析 采用Spearman秩相关性分析对Smad3与Smad7 mRNA的相关性进行分析,结果显示:对照组正常皮肤中Smad3与Smad7的mRNA水平呈正相关(r=0.603,P<0.05),而SD患者的皮损中Smad3与Smad7的mRNA水平差异无统计学意义(r=-0.130,P>0.05),见表2。

表2 Smad3与Smad7的相关性分析
2.4 不同分型与分期SD患者皮损中Smad3与Smad7 mRNA水平的比较 对SD患者进行分型,SSc与LSc患者皮损中Smad3或Smad7 mRNA的表达水平相比差异无统计学意义(P>0.05)。根据皮肤病变过程对SD患者进行分期,不同分期患者皮损中Smad3或Smad7 mRNA的表达水平相比差异无统计学意义(P>0.05),见表 3。
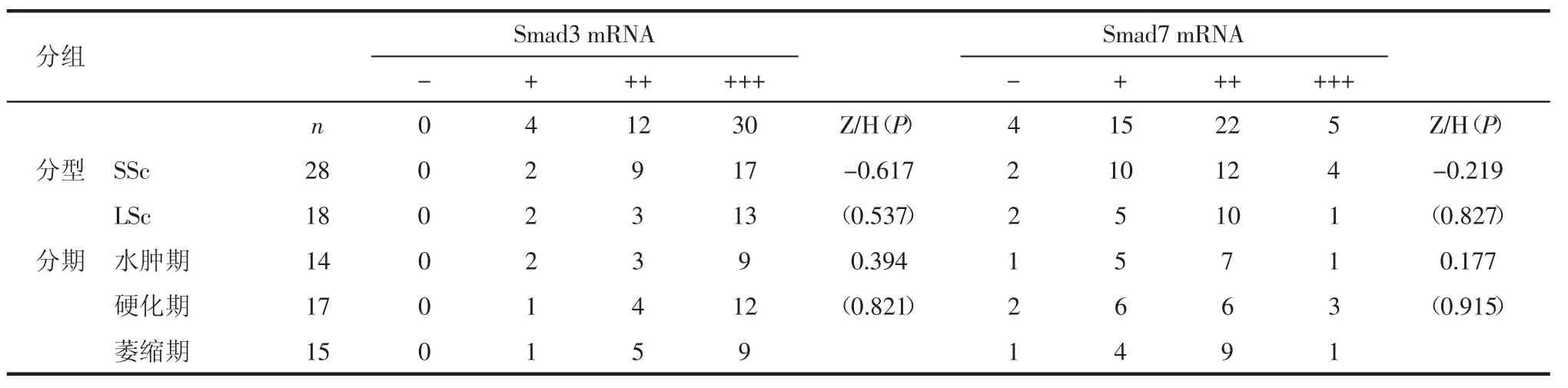
表3 Smad3、Smad7 mRNA在各分型与分期SD患者间的比较
3 讨论
笔者之前的研究显示,在组织水平上,SD患者皮损中Smad3的蛋白水平是升高的,Smad7的蛋白水平是降低的[7]。也有报道指出Smad3在体外培养的成纤维细胞中表达升高,Smad7在体外培养的成纤维细胞中表达降低[8]。在对其他组织或器官的纤维化研究中,如瘢痕疙瘩的纤维中,也曾发现Ⅰ、Ⅲ型胶原及Smad3 mRNA的表达量是升高的[9]。有关肾脏疾病的研究指出,除轻度IgA肾病外,其他所有类型病变肾小球均有TGF-β和Smad3 mRNA的表达增加[10]。本次研究通过检测正常皮肤与SD患者皮损中Smad3与Smad7 mRNA的表达,探讨其在SD发病机制中的潜在作用及临床诊断价值。
硬皮病是一种以皮肤变硬、增厚,伴有各种程度的慢性炎症浸润和显著的纤维增生性微血管病变及体液和细胞免疫改变为特征的自身免疫性疾病[1-3]。根据其发病累及范围不同,主要分为系统性硬皮病(SSc)和局限性硬皮病(LSc)2 种类型[2,11]。SD患者症状轻者可致残、毁容,症状重的可导致死亡。在美国,SSc的5年生存率为50%,与肿瘤相当,而内脏器官的纤维化是引起硬皮病患者高死亡率的最重要因素。SD的发病机制相当复杂,目前还不能完全阐明。纤维化的发生是胶原蛋白等细胞外基质(ECM)合成与降解不平衡的结果。TGF-β是最强的ECM沉积促进剂,它能使ECM的合成增加、降解减少[12]。在硬皮病的发生发展过程中,TGF-β一方面能直接促进成纤维细胞增殖,另一方面可通过Smads依赖通路在转录或转录后水平调节胶原蛋白等ECM基因的表达[13]。
Smad3属于受体活化型,参与多种基因的转导,Smad3增加不仅通过增加胶原的合成,而且通过减少金属蛋白酶的降解和增加金属蛋白酶抑制剂的合成促进纤维化的发生[14]。本次研究显示SD患者皮损中Smad3 mRNA表达量升高,提示Smad3 mRNA表达升高可能是导致TGF-β作用增强,胶原过度沉积及组织纤维化的重要因素。Smad7为抑制型Smad,组成TGF-β信号环路的负性调节信号[15]。报道指出体外培养SD成纤维细胞中基础水平及TGF-β诱导Smad7的表达能力明显受损。本次研究发现SD患者皮损中Smad7 mRNA的表达量显著低于对照组正常皮肤,Smad7 mRNA的降低可能导致成纤维细胞在TGF-β刺激下过度活化。
本次研究中,对照组正常皮肤中Smad3与Smad7 mRNA的水平呈正相关,而SD患者的皮损中Smad3与Smad7 mRNA的水平间无显著相关性。正常情况下,细胞内TGF-β/Smad信号的激活在时间及空间上是紧密配对的,即信号激活的同时伴随抑制信号的发生。在SD患者皮损中Smad3与Smad7 mRNA水平之间的不同步性打破了TGF-β/Smad信号的平衡,为SD的发病提供了基础。
综上所述,本次研究表明,与健康正常的皮肤相比,SD患者的皮损中Smad3 mRNA发生上调,Smad7 mRNA发生下调。这种变化导致Smad3与Smad7 mRNA水平之间的相关性缺失。这可能是TGF-β介导的SD患者生理平衡改变与SD病理发生的关键因素。因此,SD患者Smad3与Smad7 mRNA的检测可能对SD患者的诊断与治疗提供新的思路。
[1]Tan CK,Suresh E.Cervical and lumbar paraspinal calcinosis in systemic sclerosis[J].Reumatismo,2016,68:203-205.
[2]王文惠,杨卫华,张冬英,等.系统性硬皮病患者Th17水平与疾病活动相关性[J].现代仪器与医疗,2016,22(5):87-88.
[3]Crincoli V,Fatone L,Fanelli M,et al.Orofacial manifestations and temporomandibular disorders of systemic scleroderma: an observational study[J].Int J Mol Sci,2016,17:E1189.
[4]Zhu H,Luo H,Li Y,et al.MicroRNA-21 in scleroderma fibrosis and its function in TGF-β-regulated fibrosis-related genes expression[J].J Clin Immunol,2013,33:1100-1109.
[5]Miyazawa K,Miyazono K.Regulation of TGF-β family signaling by inhibitory smads[J].Cold Spring Harb Perspect Biol,2017,9:a022 095.
[6]Kunz PL,Reidy-Lagunes D,Anthony LB,et al.Consensus guidelines for the management and treatment of neuroendocrine tumors[J].Pancreas,2013,42:557-577.
[7]刘文丽,张键,穆欣,等.Smad3和Smad7蛋白在硬皮病患者皮损中的表达及意义[J].陕西医学杂志,2015,44(12):1631-1632.
[8]施健,曹双林,花卉,等.体外培养硬皮病成纤维细胞Smad3及Smad7mRNA的表达[J].临床皮肤科杂志,2012,41(8):463-465.
[9]Duan WJ,Yu X,Huang XR,et al.Opposing roles for Smad2 and Smad3 in peritoneal fibrosis in vivo and in vitro[J].Am J Pathol,2014,184:2275-2284.
[10]Burke M,Pabbidi MR,Farley J,et al.Molecular mechanisms of renal blood flow autoregulation[J].Curr Vasc Pharmacol,2014,12:845-858.
[11]刘影,陈德宇,熊霞.幼年系统性硬皮病的研究进展[J].中国皮肤性病学杂志,2017,31(1):95-97.
[12]Meng XM,Nikolic-Paterson DJ,Lan HY.TGF-β:the master regulator of fibrosis[J].Nat Rev Nephrol,2016,12:325-338.
[13]Moritz RJ,LeBaron RG,Phelix CF,et al.Macrophage TGF-β1 and the proapoptotic extracellular matrix protein BIGH3 induce renal cell apoptosis in prediabetic and diabetic conditions[J].Int J Clin Med,2016,7:496-510.
[14]张丽霞,周竹,王倩,等.Cthrc1及TGF-β1/Smad信号通路在硬皮病成纤维细胞中的表达及其意义[J].中国皮肤性病学杂志,2015,29(4):345-348.
[15]Lukas D,Yogev N,Kel JM,et al.TGF-β inhibitor Smad7 regulates dendritic cell-induced autoimmunity[J].Proc Natl Acad Sci USA,2017,114:E1480-E1489.

