不同NDF与NFC比例饲粮对肉用绵羊瘤胃发酵参数及甲烷排放动态变化的影响*
丁静美,邓凯东,张 蓉,马 涛,刁其玉,成述儒,周丽雪,屠 焰*
(1. 中国农业科学院饲料研究所/农业部饲料生物技术重点试验室,北京 100081; 2. 甘肃农业大学 动物科学技术学院,甘肃 兰州 730070; 3.金陵科技学院 动物科学与技术学院,江苏 南京 210038)
反刍动物采食饲料后通过瘤胃微生物发酵产生甲烷,不仅造成能量的浪费,还引起温室效应。因此,甲烷减排一直是研究的热点[1]。甲烷产生与瘤胃pH、氨态氮(NH3-N)、挥发性脂肪酸(VFA)等瘤胃发酵参数密切相关[2-4]。而瘤胃发酵参数与饲粮的采食时间、饲粮的品质有关[3],所以甲烷排放可能与采食时间有关。研究表明,适当提高饲粮中精料水平不仅可以提高饲料的利用率,可降低甲烷的排放量。多数研究都集中在饲粮NFC/NDF对山羊[5]、奶牛[6]、肉牛等[7]瘤胃发酵参数的影响,刘洁[8]在肉羊中仅研究饲粮NFC/NDF与瘤胃参数之间的关系,赵一广[9]明确了肉用绵羊甲烷排放与瘤胃液pH、乙酸占总挥发酸(TVFA)的比例间的线性关系,但并未阐明甲烷排放的规律,尤其是不同时间点甲烷排放量规律的研究。因此,本研究通过测定不同时间点瘤胃液瘤胃发酵参数及甲烷产量,旨在通过瘤胃发酵参数研究甲烷排放规律,为成年肉羊甲烷排放提供理论基础。
1 材料与方法
1.1 试验动物
本试验于2016年5月至2016年8月在北京昌平区中国农业科学院南口中试基地完成。选用12只安装永久瘤胃瘘管的杜泊×小尾寒羊杂交羯羊(50.9±2.8) kg,清晨空腹称重后,佩戴耳标和进行除虫处理后,随机分成4组,每组3只。
1.2 试验设计与饲粮
采用4×4完全拉丁方试验设计。共进行4期试验,每期4个试验处理。每期试验中, 各处理组饲喂NDF与NFC比例分别为3.6、2.7、1.7、1.05的全混合饲粮,饲粮以玉米秸秆为粗饲料、玉米和豆粕为精饲料原料。饲粮成分及营养成分见表1。
每期试验持续23 d(包括10 d预饲期和13 d正式期)。试验羊均按维持水平饲喂,本试验在维持体重的情况下进行饲喂,本试验在维持体重的情况下进行饲喂,在正式试验前,根据NRC(2007)《绵羊饲粮标准》[10]中的单倍维持需要量进行预试验,当每只羊体重基本保持不变时确定为饲喂量,每日饲喂两次(08:00和16:30),自由饮水。
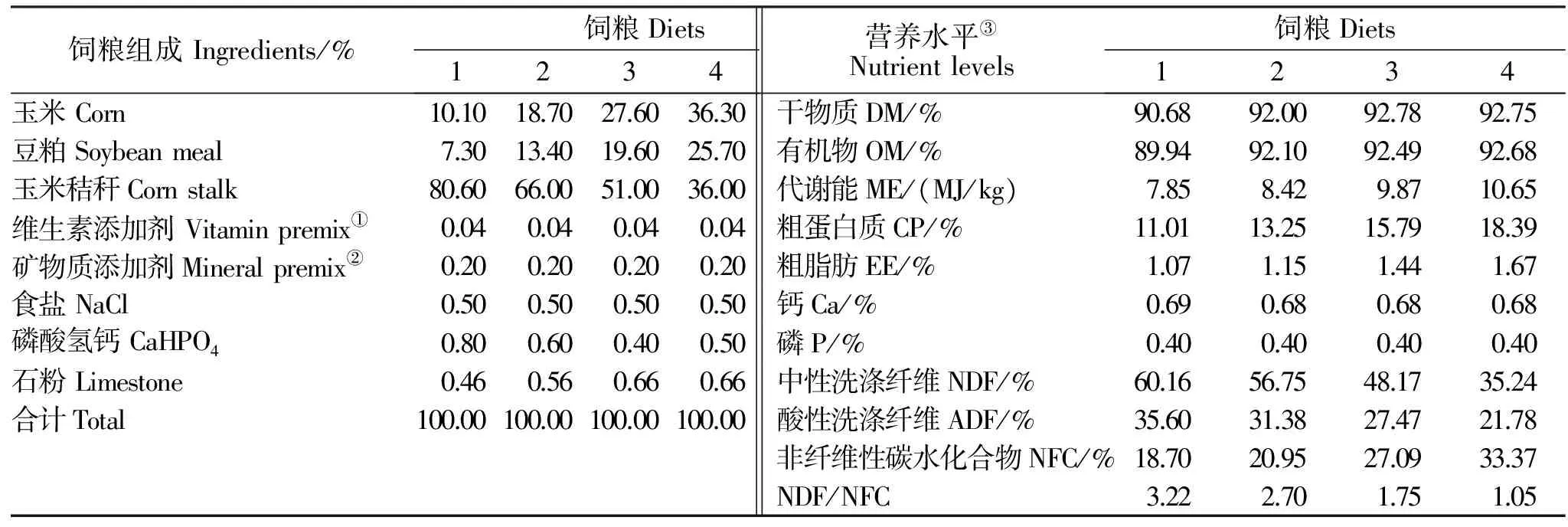
表1 试验饲粮组成及营养水平(干物质基础)Table 1 Composition and nutrient levels of experimental diets (DM basis)
注:①维生素添加剂为每千克饲粮提供:VA 15 000 IU, VD 5 000 IU, VE 50 mg;②微量元素添加剂为每千克饲粮提供: Fe 90 mg, Cu 12.5 mg, Mn 130 mg, Zn 100 mg, Se 0.3 mg, I 1.5 mg, Co 0.5 mg;③NFC为计算值, 其他营养水平均为实测值 NFC=100-(NDF + CP +EE + ash)[11]。
Notes:①Provided per kg of TMR: VA 15000IU, VD 5000IU, VE 50 mg;②Provided per kg of TMR: Fe 90 mg, Cu 12.5 mg, Mn 130 mg, Zn 100 mg, Se 0.3 mg, I 1.5 mg, Co 0.5 mg;③Nutrient levels are measured values, except for ME and NFC, NFC=100-(NDF + CP +EE + ash)[11].
1.3 测定项目
1.3.1 甲烷排放量 在每期试验正式期的第1~12天进行气体代谢试验:在第1、4和6天分3批(4只羊/批,每处理1只)将试验羊分别移入4个呼吸代谢室内,适应24 h后,测定随后48 h内每只羊的甲烷日产量,利用Sable系统连接的呼吸代谢箱进行测定CH4、CO2排放量(GGA,Los Gatos Research,California,USA)及O2的消耗量(FC-10氧气测定仪,Sable Systems International,Henderson,NV,USA)[12]。
1.3.2 瘤胃液pH、NH3-N和VFA 每期试验正试期第13天的8:00、10:00、12:00、14:00和16:00,分别通过每只羊的瘤胃瘘管,用200 mL注射器连接一段塑料软管插入瘤胃食糜中,采集约 50 mL 瘤胃液,用便携式电子pH计(Testo-206,TESTO Industry Corp.,德国),立即测定瘤胃液pH,随后用灭菌的四层纱布过滤瘤胃液,滤液置于-20 ℃保存,用于检测VFA和NH3-N。NH3-N采用苯酚-次氯酸钠比色法[13]测定;VFA参照Cao的方法[14],采用气相色谱仪(GC-128,上海仪电分析仪器有限公司,上海,中国)内标法进行测定,内标物为2-EB。
1.4 统计分析
采用SPSS19.0统计分析软件中的一般线性分析对数据进行有重复值的方差分析,各时间点均值采用contrasts进行多重比较。统计分析的显著性水平为0.05,数据均用“平均值±标准误”表示。
2 结果与分析
2.1 瘤胃液pH
表2为不同NDF/NFC饲粮对瘤胃液pH的影响。随着NDF/NFC比例的降低,饲粮4瘤胃pH在饲喂后0 h显著低于其他三种饲粮(P<0.05),其他三种饲粮间差异不显著(P>0.05);在饲喂后6~8 h内,饲粮1显著高于其他三种饲粮(P<0.05)。随着饲喂时间的变化,各饲粮间瘤胃pH呈现先下降后上升的趋势。饲粮1、2在饲喂4 h后pH显著低于其他时间点(P<0.05),而饲粮3、4在饲喂2 h后pH显著低于其他时间点(P<0.05)。
2.2 瘤胃液NH3-N
从表3知,在饲喂后的同一时间点内随着NDF/NFC比例的降低,瘤胃NH3-N逐渐升高。在饲喂后0 h内,四种饲粮之间差异极显著(P<0.05);饲喂后4 h、6 h、8 h内,饲粮1的NH3-N显著低于其他三种饲粮(P<0.05)。随着时间的变化,NH3-N呈现先升高后降低的趋势,饲喂2 h后,饲粮1、2和3的NH3-N显著高于其他时间点(P<0.05)。而饲粮4在0 h时,NH3-N的浓度显著高于其他时间点(P<0.05)。
2.3 瘤胃液VFA
从表4知,总挥发酸是各脂肪酸浓度值相加的结果,然后计算各酸占总挥发酸的比例。乙酸占TVFA的比例在饲喂后0、4、8 h后,饲粮1显著高于其他三种饲粮(P<0.05);丁酸在饲喂0、2 h 内,饲粮4显著高于其他三种饲粮(P<0.05)。乙酸/丙酸在饲喂4 h后,饲粮1显著高于其他三种饲粮(P<0.05)。随着时间点的变化,各时间点的乙酸、丙酸以及丁酸的变化不显著(P>0.05),但是乙酸/丙酸呈现逐渐升高后降低的趋势,四种饲粮的0 h显著高于其他时间点(P<0.05)。
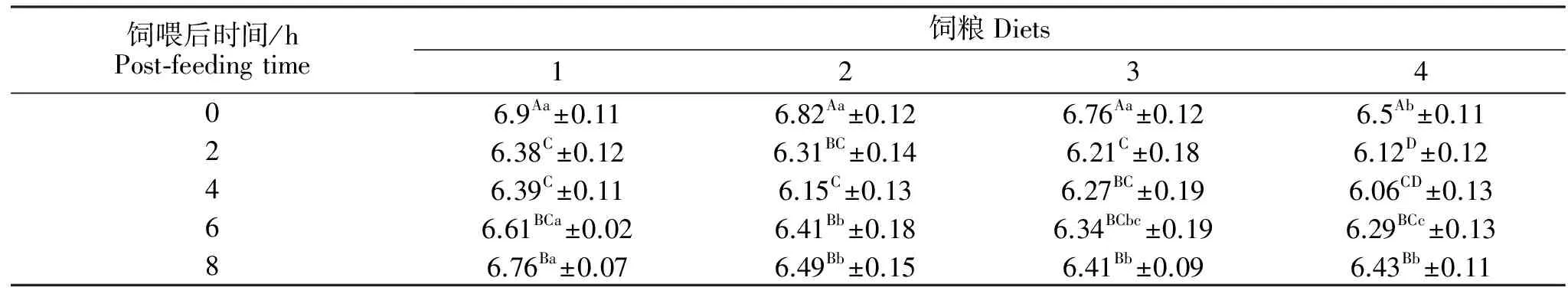
表2 不同 NDF/NFC饲粮对各时间点瘤胃液pH的影响Table 2 Effect of different NDF/NFC dietary on the pH of rumen liquid at different time
注:a,b,c,d:同行均值带不同肩标差异显著(P<0.05)。A,B,C,D:同列均值带不同肩标差异显著(P<0.05)。下同。
Notes:a,b,c,d: In the same row, values with different superscripts differ significantly (P<0.05). A,B,C,D: In the same column, values with different superscripts differ significantly (P<0.05). The same below.

表3 不同 NDF/NFC饲粮对各时间点瘤胃液NH3-N(mg/100 mL)的影响Table 3 Effects of different NDF/NFC dietary on ruminal concentrations of NH3-N (mg/100 mL) at different time

表4 不同NDF/NFC饲粮对各时间点瘤胃液挥发性脂肪酸的影响Table 4 Effect of different NDF/NFC dietary on ruminal concentrations of volatile fatty acids at different time
2.4 甲烷排放
从表5知,随着NDF/NFC比例的降低,饲喂后0~2 h、2~4 h、7~8 h内,饲粮4的甲烷排放量均显著低于其他三种饲粮(P<0.05)。随着时间的变化,甲烷排放量呈现出先下降后上升的趋势。在饲喂后0~2 h内,四种饲粮均甲烷排放量显著高于其他时间段(P<0.05)。

表5 饲粮NDF/NFC对甲烷排放量(L/2 h)的影响Table 5 Effect of different NDF/NFC dietary on methane emission (L/2 h)
3 讨 论
3.1 饲粮NFC/NDF对瘤胃发酵参数的影响
瘤胃液pH是衡量瘤胃发酵的一个最直观指标,它受到唾液分泌、VFA等影响,其波动的根本原因就是饲粮结构的改变和采食时间的变化[15]。本研究中,NDF/NFC为1.05的饲粮pH显著低于NDF/NFC为3.6、2.70、1.75的饲粮。与刘洁[8]、赵国琦[15]的结果一致。同时,随着采食时间的推移,本研究结果表明各处理组的饲粮瘤胃pH呈现先降低后升高的趋势,与韩昊奇等[5]研究结果一致,可能是因为瘤胃有机物的降解产生有机酸从而降低瘤胃pH。对于瘤胃液pH随着NDF的降低而降低的原因,一是NFC比例升高,能够产生大量的有机酸,从而pH逐渐降低;二是NDF含量降低,动物反刍次数相应减少,与有机酸中和的唾液也随着减少,pH降低[5]。
瘤胃液NH3-N也是衡量瘤胃发酵的指标,它是饲料蛋白质降解率和微生物利用效率的综合结果,在一定程度上反映了瘤胃微生物分解含氮物质及其利用情况。本研究结果显示,随着NDF/NFC为1.05的瘤胃NH3-N显著高于NDF/NFC为3.6、2.70、1.75的饲粮,与周永康等[17]、林淼等[18]的研究结果一致。因为随着NDF水平的降低、NFC的比例升高,更多的物质增强了微生物的活性和对蛋白质的降解的能力。同时NH3-N在酸性环境下形成NH4+固定起来,不被瘤胃壁吸收,所以随着NDF水平的降低,pH逐渐降低,从而NH3-N浓度显著升高。同时随着饲喂时间的变化,呈现先升高后降低的趋势,均在2 h时达到最低值。这与刘洁[8]的研究一致。主要是因为随着时间的推移,微生物降解的蛋白质逐渐减少,更多的NH3-N被用于合成菌体蛋白。
挥发性脂肪酸是衡量瘤胃发酵的另一项指标。反刍动物机体70%~80%的可消化能来自于挥发酸,是反刍动物赖以生存、保证正常活动的主要能源来源,参与机体的各种代谢[19]。饲粮中的碳水化合物经过瘤胃微生物的发酵产生乙酸、丙酸、丁酸、戊酸等一些短链挥发性脂肪酸,因此,瘤胃的发酵类型受到饲粮的类型的影响[20]。前人研究表明,随着饲粮中NFC比例的升高,总TVFA也随之升高,乙酸、乙酸/丙酸的比例逐渐降低,丙酸的比例逐渐升高[10]。但是本试验总VFA不受饲粮NDF/NFC的影响,与Lascano和Kljak[21]研究一致。NDF/NFC为1.05饲粮乙酸、乙酸/丙酸的比例显著低于其他三种饲粮,丙酸的比例显著高于其他三种饲粮,可以推出瘤胃发酵模式由乙酸模式进丙酸模式。本试验在维持饲喂水平进行,随着NDF水平降低,绵羊的采食量逐渐降低,发酵底物减少,TVFA降低,而丙酸、丁酸的含量增加,可以说明机体合成更多的能量用于代谢,减少甲烷的产生,提高饲料的利用效率。
3.2 饲粮NDF/NFC对肉羊甲烷排放的影响
反刍动物的瘤胃是一个动态发酵罐,它能够将动物采食的植物纤维等碳水化合物转化为挥发性脂肪酸,进而在甲烷菌的作用下生成甲烷以嗳气的形式排出体外。研究表明,甲烷排放与饲粮的营养水平[1]、时间的变化有关。马燕芬等[22]利用Sable系统控制的呼吸头箱测定计算奶山羊24 h内的甲烷排放量,发现在饲喂后0~3 h内,甲烷排放量最高。Mathers 和Walters[23]在饲喂肉羊的2 h后,碳水化合物的发酵速率随着时间的变化差距很大,并且甲烷排放量在饲喂后30 min后达到最高,直到下一次饲喂时产量达到最高。本研究随着饲喂后时间的推移,甲烷排放量、瘤胃发酵参数pH、各种挥发酸的比例均呈现出先下降后上升的趋势,在饲喂后2内,甲烷排放量最高。这说明反刍动物采食后,饲料在瘤胃开始发酵,产生大量的CH4,然后通过反刍,将气体以嗳气的形式排除体外,随着时间的推移,饲料可发酵量逐渐减少,则产气量逐渐降低。Aguerre等[24]、赵一广[9]结果表明随着精料水平的升高,瘤胃pH液、挥发酸与甲烷产量成线性正相关。本试验的结果在同一时间点内甲烷排放量随着饲粮NDF/NFC比例的降低有降低的趋势,但是甲烷排放量与瘤胃液pH、乙酸占总挥发酸的比例线性不显著(P= 0.22,0.192)。可能是因为跟甲烷排放的效率有关,即在可发酵的有机物的基础上,甲烷排放量跟饲粮NDF/NFC的比例以及瘤胃pH、乙酸占总挥发酸的比例有关。研究表明,饲粮可发酵有机物的影响甲烷排放最主要的途径是影响瘤胃液pH,进而影响瘤胃微生物区系[25]。在维持水平,本试验还要对单位可发酵有机物的甲烷排放、瘤胃微生物区系进一步研究。
甲烷的排放量不仅与瘤胃发酵参数有关系,还与动物的品种、环境有关。饲喂量越多,则甲烷排放量逐渐升高,但是会降低饲料的利用率。可以适当的降低饲喂量,采取少喂勤添的方式,则可相对降低瘤胃的甲烷的产量,提高饲粮的利用率,增加饲料的转化率。
4 结 论
在维持饲喂水平,基于瘤胃发酵参数和不同时段内甲烷排放数据,NDF/NFC比例为1.05的饲粮在0、6、8 h内瘤胃较低,乙酸占总挥发酸的比例低,甲烷排放量较少。在维持饲粮水平,甲烷排放量随着瘤胃发酵参数的动态变化而变化,动物在采食后0~2 h内,甲烷排放量最高。
[1] 丁静美, 邓凯东, 成述儒, 等. 反刍动物饲粮纤维组分与甲烷排放的研究进展[J]. 家畜生态学报, 2016,37(11):1-5.
[2] 孙德成, 赵智力, 魏曼琳, 等. 不同精粗料比全混合日粮对奶牛瘤胃指标的影响[J]. 饲料研究, 2008(10):47-50.
[3] 冯仰廉, 李胜利, 赵广永, 等. 牛甲烷排放量的估测[J]. 动物营养学报, 2012,24(1):1-7.
[4] 韩继福, 冯仰廉. 阉牛不同日粮的纤维消化,瘤胃内VFA对甲烷产生量的影响[J]. 中国兽医学报, 1997(3):278-280.
[5] 韩昊奇, 刘大程,高 民, 等. 不同NFC/NDF比对奶山羊瘤胃微生物及瘤胃pH变化的影响[J]. 动物营养学报, 2011,23(4):597-603.
[6] LASCANO G J, HEINRICHS A J. Rumen fermentation pattern of dairy heifers fed restricted amounts of low, medium, and high concentrate diets without and with yeast culture[J]. Livestock Science, 2009,124(1-3):48-57.
[7] 张莹莹,王聪,刘强, 等. 不同精粗比饲粮对晋南牛瘤胃发酵特性和养分消化代谢的影响[J]. 动物营养学报, 2014,26(8):2 365-2 372.
[8] 刘洁, 刁其玉, 赵一广, 等. 饲粮不同NFC/NDF对肉用绵羊瘤胃pH、氨态氮和挥发性脂肪酸的影响[J]. 动物营养学报, 2012,24(6):1 069-1 077.
[9] 赵一广. 肉用绵羊甲烷排放的测定与估测模型的建立[D].北京:中国农业科学院, 2012.
[10] NATIONAL RESEARCH COUNCIL N. Nutrient requirements of small ruminants[M].Washington,D C:National Academies press,2006.
[11] SOEST P J V, ROBERTSON J B, LEWIS B A. Methods for Dietary Fiber, Neutral Detergent Fiber, and Nonstarch Polysaccharides in Relation to Animal Nutrition[J]. Journal of Dairy Science, 1991,74(10):3 583-3 597.
[12] DENG K D, DIAO Q Y, JIANG C G, et al. Energy requirements for maintenance and growth of Dorper crossbred ram lambs[J]. Livestock Science, 2012,150(S1-3):102-110.
[13] BRODERICK G A, KANG J H. Automated simultaneous determination of ammonia and total amino acids in ruminal fluid and in vitro media 1[J]. Journal of Dairy Science, 1980,63(1):64-75.
[14] CAO Y C, YANG H J. Ruminal digestibility and fermentation characteristics in vitro of fenugreek and alfalfa hay combination with or without the inoculation of Neocallimastix sp. YAK11[J]. Animal Feed Science and Technology, 2011,169(1-2):53-60.
[15] 赵国琦, 贾亚红, 陈小连, 等. 不同NDF/NFE比的日粮对山羊瘤胃发酵参数影响的研究[J]. 中国畜牧杂志, 2006,42(13):29-33.
[16] RAMIN M, HUHTANEN P. Development of equations for predicting methane emissions from ruminants[J]. Journal of Dairy Science, 2013,96(4):2 476-2 493.
[17] 周永康, 郝青, 庞清刚, 等. 不同SC/NSC日粮对徐淮白山羊瘤胃发酵的影响[J]. 中国饲料, 2008(5):16-20.
[18] 林淼, 张建刚, 陈志远, 等. 饲粮中性洗涤纤维与非纤维性碳水化合物比例对湖羊瘤胃还原硝态氮的影响[J]. 动物营养学报, 2014,26(12):3 659-3 665.
[19] 杨宏波,刘红, 占今舜, 等. 不同精粗比颗粒饲料对断奶公犊牛瘤胃发酵参数和微生物的影响[J]. 草业学报, 2015(12):131-138.
[20] 汪水平, 王文娟, 王加启, 等. 日粮精粗比对奶牛瘤胃发酵及泌乳性能的影响[J]. 西北农林科技大学学报(自然科学版),2007,35(6):44-50.
[21] LASCANO G J, HEINRICHS A J. Rumen fermentation pattern of dairy heifers fed restricted amounts of low, medium, and high concentrate diets without and with yeast culture [J]. Livestock Science, 2009,124(1-3):48-57.
[22] 马燕芬, 杨淑青, 薛瑞婷, 等. 饲粮NFC/NDF对奶山羊甲烷和二氧化碳排放量的影响[J]. 动物营养学报, 2013,25(5):996-1 003.
[23] MATHERS J C, WALTERS D E. Variation in methane production by sheep fed every two hours.[J]. Journal of Agricultural Science, 1982,98(98):633-638.
[24] AGUERRE M J, WATTIAUX M A, POWELL J M, et al. Effect of forage-to-concentrate ratio in dairy cow diets on emission of methane, carbon dioxide, and ammonia, lactation performance, and manure excretion[J]. Journal of Dairy Science, 2011,94(6):3 081-3 093.
[25] JAS V K, RUSSELL J B. The effect of pH on ruminal methanogenesis.[J]. FEMS Microbiology Ecology, 1996,20(4):205-210.

