细粒棘球蚴GST-mu2基因的克隆、表达及重组蛋白反应原性研究*
陈 英,乔 军,孟庆玲*,钟文强,刘田莉,贡莎莎,才学鹏
(1.石河子大学 动物科技学院,新疆 石河子 832003;2.中国农业科学院 兰州兽医研究所,甘肃 兰州 730046)
细粒棘球蚴病俗称包虫病,是由细粒棘球绦虫(Echinococcusgranulosus,Eg)中绦期幼虫寄生于人、畜脏器内引起的一种严重危害人类健康和畜牧业发展的人畜共患寄生虫病,可导致严重的公共卫生问题[1-2]。绵羊是Eg最适宜的中间宿主,发病后使羊发育不良,生长缓慢,给畜牧业造成较重的经济损失[3-4]。该病呈世界性分布,在我国许多牧区广泛流行。新疆是我国五大牧区之一,是受该病流行最为严重的地区之一,北疆绵羊的平均感染率为61.2%,南疆地区绵羊平均感染率为 38.9%[3,5],尤其牧场放牧的绵羊感染率较高。
目前,细粒棘球蚴病的血清学诊断仍然存在特异性较低、敏感性不高等问题[6-7]。因此,筛选具有强特异性和反应原性的抗原蛋白是克服现有血清学诊断缺点的前提。尽管现在已经发现和鉴定了囊液、粗提原头节蛋白、EgAgB、抗原5、EG95等Eg抗原蛋白[8-12],然而囊液、粗提原头节抗原虽然敏感性较高,但特异性较差,与多房棘球绦虫、猪带绦虫发生交叉反应[13-14];EgAgB、抗原5和Eg95等抗原虽然特异性较高,但敏感性较差,给确诊带来困难[15-17]。因此候选基因的筛选与获得显得尤为重要。谷胱甘肽S-转移酶mu 2(Glutathione s-transferase mu 2, GST-mu2)参与宿主--寄生虫之间的相互作用,并对细胞的黏附、信号的传导、移动以及侵袭等生命活动有重要的影响,同时也与免疫逃避密切相关[18]。本试验旨在通过筛选、克隆Eg GST-mu2蛋白基因, 对其重要功能位点、结构域和抗原表位进行生物信息学分析,并将该基因在大肠杆菌中诱导表达,通过Western blot鉴定表达的pET-GST-mu2重组蛋白能否与Eg阳性血清发生特异性反应,从而分析其是否具有反应原性,为进一步利用GST-mu2蛋白作为Eg感染诊断的候选抗原奠定基础。
1 材料与方法
1.1 菌株与试剂
Eg病料组织采自新疆乌鲁木齐市动物疾病防控中心绵羊的肝脏,标本采集后立即冻存于-80 ℃冰箱保存。pET-28a菌种、菌株E.coliDH5α、E.coliBL21(DE3)均由石河子大学动物科技学院寄生虫实验室保存;组织RNA提取试剂盒、反转录试剂盒、PCR 反应试剂、DNA Marker、pMD19-T载体、T4 DNA 连接酶、内切酶EcoRⅠ、HindIII、蛋白Marker均购自TaKaRa公司。DNA凝胶回收试剂盒和质粒小量提取试剂盒购自天根生化科技(北京)有限公司。Eg绵羊阳性血清由中国农科院兰州兽医所提供;HRP标记的兔抗绵羊IgG、cECL Western Blot Kit购自北京康为世纪生物科技有限公司。
1.2 总RNA的提取
从新疆乌鲁木齐市动物疾病防控中心采集感染Eg绵羊的肝脏,将囊液抽取于1.5 mL的EP管内,12 000 rpm离心10 min,将离心后的上清液置于-20 ℃保存,将含有原头蚴的样本用TaKaRa公司的组织 RNA提取试剂盒提取总RNA,用反转录试剂盒反转录成cDNA,于-20 ℃保存。
1.3 Eg GST-mu2引物的设计与合成

1.4 Eg GST-mu2的RT-PCR扩增、克隆
采用20 μL反应体系:H2O210 μL,PCR Mixture 7 μL,提取的cDNA模板2 μL,上下游引物各0.5 μL,进行PCR扩增。Eg GST-mu2基因扩增条件:95 ℃预变性5 min;94 ℃变性40 s,59 ℃退火40s,72 ℃延伸55 s,32个循环;72 ℃延伸10 min;将RT-PCR产物在1.0 %的琼脂糖凝胶上跑电泳,并对扩增的PCR产物纯化回收。
1.5 目的基因的序列测定及分析
将回收的EgGST-mu2基因片段与pMD19-T载体4 ℃过夜连接后转至E.coliDH5α感受态细胞,经氨苄抗性平板筛选后挑取单菌落扩增培养,提取质粒,经PCR和EcoR I、Hind III双酶切鉴定后,送往北京华大基因科技股份有限公司测序。利用生物学在线分析软件将测序结果用在线软件MotifScan (http://myhits.isb-sib.ch/cgi-bin/motif_scan)预测蛋白的糖基化位点、磷酸化等修饰位点。TMHMM Server v.2.0 (http://www.cbs.dtu.dk/services/TMHMM-2.0/)进行结构域预测。通过DNASTAR (Jameson Wolf方法)对Eg GST-mu2蛋白的抗原表位进行预测,通过DNAMAN软件对不同物种间的GST氨基酸序列进行同源性比对与遗传进化分析。
1.6 原核表达质粒Eg GST-mu2的构建
将pMD-GST-mu2质粒与pET-28a原核表达载体用限制性核酸内切酶EcoRI 和Hind III于37 ℃进行双酶切。分别回收目的基因EgGST-mu2片段和载体片段,在T4 DNA 连接酶作用下4 ℃过夜连接后转化至E.coliDH5α感受态细胞中,在Kana抗性平板37 ℃过夜培养,挑取单菌落,再经PCR和双酶切方法筛选重组质粒pET-GST-mu2。
1.7 重组蛋白Eg GST-mu2的诱导表达
将重组质粒pET-GST-mu2转化至E.coliBL21(DE3)感受态细胞中,经Kana抗性筛选,挑取阳性克隆,吸取300 μL菌液接种到Kana抗性的液体LB培养基中,37 ℃培养至OD600nm值约为0.6~0.8,加入终浓度为0.8 mmol/L的IPTG进行诱导表达。
1.8 重组蛋白 GST-mu2的SDS-PAGE和Western blot鉴定分析
分别诱导0 h、4 h、6 h、8 h后收集菌液,进行SDS-PAGE分析。离心收集300 mL菌液,加8 mL的Lysis Buffer 裂解菌体,经反复冻融3~4次后,超声破碎1 h,直至菌体呈现清亮为止;将菌体于4 ℃,8 000 r/min离心10 min,分别取沉淀与上清进行SDS-PAGE电泳,从而进行目的蛋白的可溶性分析。选择重组菌表达量最高时的表达产物进行Western blot检测,以绵羊细粒棘球蚴阳性血清为一抗,HRP标记的兔抗绵羊IgG为二抗,分析Eg重组蛋白pET-GST-mu2的反应原性。
2 结果与分析
2.1 Eg GST-mu2基因的RT-PCR扩增结果
经1.0%琼脂糖凝胶电泳分析,检测得到660 bp的目的条带,与GenBank中提供的EgGST-mu2基因片段大小一致(图1)。对阳性克隆pD-GST-mu2菌液进行PCR扩增,结果可扩增得到GST-mu2大小一致的基因片段。

图1 Eg GST-mu2基因 RT-PCR扩增结果M: DNA分子质量标准; 1-3: RT- PCR产物Fig.1 Amplification of Eg GST- mu2 gene by RT- PCRM: DL-2000 DNA Marker; 1-3: RT-PCR amplified product
2.2 Eg GST-mu2基因的序列测定及分析
经测序,该基因开放阅读框为660 bp,编码219个氨基酸。经DNAMAN软件分析显示,与GenBank中检索的EgGST-mu2基因序列同源性为99.85%,仅在第454个碱基处由A变为G,对应的氨基酸由赖氨酸变为谷氨酸。通过生物信息学分析发现,该蛋白含有2个PKC磷酸化位点,2个N端酰基化位点, 3个CKⅡ磷酸化位点,1个TYR磷酸化位点,通过在线软件TMHMM Server v.2.0分析无跨膜结构域;抗原表位集中区在28-70、147-219位(图2)。
与其它寄生虫的GST氨基酸序列的同源性和遗传进化分析显示,EgGST与猪带绦虫GST(TaeniasoliumGST,TaesolGST)同源性为85%,与多房棘球绦虫(Echinococcusmultilocularis,EmGST)同源性为76%,EgGST与微口膜壳绦虫(Hymenolepismicrostoma,HymemicGST)同源性为67%,与猬迭宫绦虫(Spirometraerinaceieuropaei,SpierinGST1)的同源性高于50%(图3、4)。

图2 Eg GST-mu2 cDNA的核苷酸序列及其推导的氨基酸序列引物序列(下划线);N端酰基化位点(斜体);CKⅡ磷酸化位点(阴影部分);PKC磷酸化位点(虚线)TYR磷酸化位点(波浪线);抗原表位集中区(方框)Fig.2 Nucleotide sequence and deduced amino acid sequence of Eg GST-mu2 cDNAPrimer sequence (underlined); N-terminal acylation site (red); CKⅡphosphorylation site (shade); PKC phosphorylationsite (imaginary line); TYR phosphorylation site (wave); Epitope concentration region (square frame)

图3 不同寄生虫间GST蛋白的氨基酸序列比较Fig.3 Comparison of amino acid of GST protein among different parasites

图4 几种代表性的蠕虫GST蛋白基因的系统进化树Fig.4 Phylogenetic analysis of several representativeworm based on GST gene
2.3 pET-GST-mu2重组表达载体构建及鉴定
用EcoRI和HindIII分别对pD-GST-mu2和pET-28a质粒进行双酶切,并回收目的基因片段和pET-28a 载体片段,将两个片段用T4 DNA 连接酶过夜连接后转至E.coliDH5α感受态细胞,菌液PCR可扩增出目的基因片段(图5)。用EcoR I/Hind III双酶切得到660 bp的目的条带和5 369 bp的pET-28a片段(图6),表明成功构建了pET-GST-mu2重组原核表达载体。
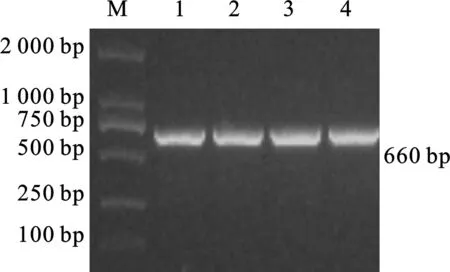
图5 pET-GST-mu2 载体PCR鉴定M. DNA分子质量标准;1-4. 菌液PCR产物Fig.5 Identification of pET-GST-mu2 by PCRM. DNA molecular quality standard;1-4. The bacterialPCR products

图6 pET-GST-mu2双酶切鉴定结果M. DNA分子质量标准; 1. 双酶切对照;2-3. pET-GST-mu2双酶切产物Fig.6 Double enzyme digestion results of pET-GST-mu2M.DL-5000 DNA Marker; 1. Double enzyme digestion control;2-3. The products of pET-GST-mu2 by double enzyme digestion
2.4 重组蛋白GST-mu2在大肠杆菌中的诱导表达及SDS-PAGE与Western blot分析
将鉴定正确的pET-GST- mu2转化至BL21(DE3)感受态细胞,经0.8 mmol/L的IPTG诱导表达0 h、4 h、6 h、8 h后,SDS-PAGE电泳分析显示,在约32 kDa处出现融合蛋白带,其中8 h时表达量最高(图7)。Western blot结果显示,在相对分子质量约32 kDa处可见特异反应条带,表达的重组蛋白GST-mu2能与绵羊Eg阳性血清发生反应,提示重组蛋白GST-mu2具有较好反应原性(图7)。

图7 重组蛋白GST-mu2 SDS-PAGE及Western blot分析M. 蛋白分子质量标准;1. pET- GST- mu2菌经IPTG诱导4h表达产物;2. pET- GST- mu2菌经IPTG诱导6 h表达产物;3. pET- GST- mu2菌经IPTG诱导8 h表达产物;4. pET-28a菌经IPTG诱导8h表达产物;5. pET- GST- mu2菌经IPTG诱导0 h表达产物;6-7. 经IPTG诱导的重组蛋白Fig.7 SDS-PAGE and Western blot analysis of recombinant protein GST-mu2M. Protein molecular quality standand;1. Expression product of pET-GST-mu2 after inducing 4 h with IPTG;2. Expression product of pET-GST-mu2 after inducing 6 h with IPTG;3. Expression product of pET-GST-mu2after inducing 8 h with IPTG;4. Expression product of pET-28a after inducing 8 h with IPTG;5. Expression productof pET-GST-mu2 after inducing 0 with IPTG;6-7. Recombined protein induced by IPTG.
3 讨 论
GST-mu2广泛存在于动物、植物、酵母、细菌等生物体内,是由多个基因编码、具有多种功能的超家族酶[19]。它能够使毒素分子失活从而转变为水溶性化合物,因此是多数生物体内重要的解毒系统[18]。此外,在寄生虫研究中还发现GST-mu2可作为强保护性抗原、能有效降低机体虫荷与排泄物虫卵数量及影响成虫生殖的能力[19]。
至今已经被发现和鉴定的具有诊断价值的Eg抗原蛋白主要包括囊液抗原、粗提原头节蛋白抗原、Eg95、EgAgB和抗原5等,其中囊液抗原(HCF)被认为是诊断包虫病的主要抗原,Zheng等[11]研究发现,囊液抗原的敏感性为75%~95%,但其特异性不高,可与其他绦虫病(例如多房棘球绦虫、猪带绦虫、牛带绦虫)、线虫病或吸虫病血清发生交叉反应[13],从而影响到实际诊断的准确性。然而,抗原5、Eg95、EgAgB、抗原特异性虽然高,但其敏感性较差,难以确诊[5,11,17]。因此筛选具有一定诊断意义的抗原显得尤为重要。GST目前已被广泛用作寄生虫感染的最佳候选疫苗,且已有相关研究表明疟原虫、肝片吸虫、血吸虫及猪带绦虫等它们的GST-mu2具备较好的抗原性与免疫原性,是WHO提出的6个最具有潜力的候选疫苗分子之一[18]。但是关于细粒棘球蚴绦虫的GST-mu2的研究至今未见详细报道。在对寄生虫的研究中还发现,GST-mu2还参与细胞的抗氧化和自由基的抗损害作用,具有很强的免疫调控功能,在逃避宿主免疫反应过程中扮演着极其重要的角色[19]。此外,该酶与宿主与人之间其基因结构与功能方面还存在着一定的差异,这也是它能作为药物靶标、诊断抗原或候选疫苗分子的基础[19-20]。戴佳琳等对猪带绦虫谷胱甘肽转移酶GST-mu2进行了原核表达及免疫学研究,结果表达的重组蛋白可被感染猪带绦虫的病人及猪血清所特异性识别[18]。且姜片吸虫和曼氏血吸虫的GST-mu2重组疫苗已被证实,对牛、羊都具有较好的抗体反应与较强的抗感染作用[18]。因此,在细粒棘球蚴的研究中GST-mu2蛋白有望作为很好的候选诊断抗原分子。
为了筛选和鉴定反应原性强的Eg诊断抗原,本研究通过对EgGST-mu2基因进行扩增、克隆,测序后对其重要功能位点、结构域以及抗原表位进行分析,并亚克隆至表达载体pET-28a中,成功构建pET-GST-mu2原核表达载体。然后转化至感受态细胞E.coliBL21中,通过IPTG进行诱导表达,通过SDS-PAGE检测到约31 kDa的蛋白特异性条带。Western blot鉴定显示,GST-mu2重组蛋白能特异性识别Eg阳性血清,证实此蛋白具有较好的反应原性,具有作为Eg诊断候选抗原的潜在价值。
[1] LORENZO C, LAST JA, GONZLEZ-SAPIENZA G G. The immunogenicity of Echinococcus granulosus antigen 5 is determined by its post-translational modifications[J]. Parasitology, 2005, 131(5): 669-677.
[1] 朱佑明,李文桂. 细粒棘球绦虫分子生物学研究进展[J]. 中国寄生虫病防治杂志,2005, 18(3):217-220.
[3] 于晶峰,李滨,刘晓松,等.细粒棘球蚴线粒体CO1基因的克隆与序列分析[J].中国人兽共患病学报,2015, 31(6):532-536.
[4] 李岩,闫江林,李静,等.新疆绵羊棘球蚴病流行情况调查分析[J].石河子大学学报(自然科学版), 2005, 2(31): 60-63.
[5] 王琦. 八种重组抗原对肝细粒棘球蚴病诊断价值的初步鉴定[D]. 银川:宁夏医科大学, 2012.
[6] 刘田莉, 乔 军, 孟庆玲,等. 细粒棘球蚴RTN4基因的克隆及序列分析[J]. 西北农林科技大学学报(自然科学版),2016, 44(3):17-22.
[7] MARSLAND B J, TISDALL D J, HEATH D D, et al. Construction of a recombinant orf virus that expresses an Echinococcus granulosus vaccine antigen from a novel genornic insertion site[J].Arch Virol,2003,148(3): 555-562.
[8] 王立英,伍卫平,朱雪花.2004-2008 年全国包虫病疫情分析[J.]中国人兽共患病学报,2010,26(7):699-701.
[9] 焦伟,付承, 刘万里,等. 细粒棘球绦虫5种天然抗原制剂诊断效能的初步评价[J.]中国寄生虫学与寄生虫病杂志,2013,31(5):357-362.
[10] 李娜, 赵嘉庆, 赵殷奇,等. 细粒棘球蚴抗原Eg-01042的筛选、表达、纯化及免疫原性的初步研究[J]. 宁夏医科大学学报,2016, 38(6): 609-614.
[11] ZHENG H, ZHANG W, ZHANG L, et al. The genome of the hydatid tapeworm Echinococcus granulosus[J]. Nat genet, 2013, 45(10): 1 168-1 175.
[12] 李滨.细粒棘球蚴的流行病调查及CO1与ND1基因序列分析[D].呼和浩特:内蒙古农业大学, 2013.
[13] LIGHTOWLERS M W, LAWRENCE S B, GAUCI C G, et al. Vaccination against hydatidosis using a defined recombinant antigen [J]. Parasite Immunol, 1996, 18(9): 457-462.
[14] TRAN M H,PEARSON M S,BETHONY J M,et al.Tetraspanins on the surface of schistosoma mansoni are protective antigens against schistosomiasis[J]. Nat Med, 2006, 12(7): 835-840.
[15] 曹春宝,马秀敏,丁剑冰,等.细粒棘球绦虫egG1Y162抗原基因的克隆及序列分析[J].中国寄生虫学与寄生虫病杂志,2009, 27(2):177-179.
[16] 贾如. 细粒棘球蚴Eg95基因的克隆、原核表达及抗体制备[D].合肥:合肥工业大学, 2009.
[17] LI J, ZHANG W B, LOUKAS A, et al. Functional expression and characterization of Echinococcus granulosus thioredoxin peroxidase suggests a role in protection against oxidative damage [J]. Gene, 2004, 326: 157-165.
[18] 戴佳琳,黄江,廖兴江,等.猪带绦虫谷胱甘肽转移酶GST的原核表达及免疫学研究[J].中国人兽共患病学报, 2010, 26(2): 107-110.
[19] 李灵鸽. 旋毛虫谷胱甘肽S-转移酶的克隆表达及鉴定[D].郑州:郑州大学,2015.
[20] 冯雪,王彬,孙艳香,等.谷胱甘肽硫转移酶的研究进展[J].生物学教学,2012,37(6):5-6.

