睾酮对动物生殖和生长发育影响的研究进展*
张阳海,李 永,曹 迪,鱼 婷,高佳阳,潘传英
(西北农林科技大学 动物科技学院,陕西 杨凌 712100)
睾酮(testosterone, T)主要由雄性的睾丸间质细胞(Leydig cells, LCs)产生,由雌性的卵泡膜细胞产生,受下丘脑-垂体-性腺轴(HPG)和许多细胞因子的调控。T对促进性器官发育、精子发生和早期卵泡发育,以及维持第二性征等具有重要意义。T也参与其他组织器官的生理活动,如维持骨量、保护神经和心血管系统、调节皮脂分泌等[1]。T水平异常可导致精子发生受阻、排卵障碍和体内激素水平失衡,进而诱发中老年男性迟发型性腺功能减退症、雌性多囊卵巢综合症、骨质疏松和痤疮等疾病[2-5]。目前,针对这些疾病主要采用T补充疗法和药物抑制疗法。虽然可以缓解症状,但也存在许多副作用[2,6]。因此,阐明T的来源途径和作用机制,以找寻一种长期有效又无毒副作用的治疗方式,是当前研究中亟待解决的问题。目前,关于T的研究多在大鼠和小鼠等模式动物上开展,而哺乳动物LCs分化发育的作用机理,以及T作用于生殖、骨骼、皮肤、心脑血管等系统的信号通路不甚清楚。为此,本文从LCs的分化和成熟、T的合成和合成调控以及T对动物生殖与生长发育的影响等方面进行综述,以期为T的进一步研究提供参考。
1 睾丸间质细胞的分化和成熟
在雄性睾丸中,合成和分泌睾酮的细胞称为LCs,由德国解剖学家Franz Leydig最早在大鼠睾丸间质中发现并命名[7]。哺乳动物LCs分为两种类型,即胚胎期的胎儿型睾丸间质细胞(fetal Leydig cells, FLCs)和出生后生成的成熟睾丸间质细胞(adult Leydig cells, ALCs)[7]。在啮齿类动物中,FLCs的数量在出生后一周内逐渐减少,仅一小部分存留于成年体内;与此同时,ALCs代替FLCs成为最主要的睾酮合成细胞[7-8]。众多研究表明,ALCs不是由FLCs直接分化形成。存在于睾丸间质腔隙的睾丸间质干细胞(stem Leydig cells, SLCs)才是ALCs真正的细胞来源[8-10]。迄今为止,科学家们对于FLCs和SLCs的细胞来源做了大量研究,提出了多种可能:前者包括神经嵴细胞、体腔上皮细胞和血管周细胞,后者包括血管平滑肌细胞和管周间质细胞,但目前尚无确凿证据表明其细胞来源[7,11]。
SLCs作为LCs的干细胞,主要起维持LCs数量的作用。因此,通过移植SLCs来治疗T缺乏及其并发症是目前最具前景的治疗方法。2006年,Ge等[12]从7 d的大鼠睾丸中分离出了一类具有自我更新和分化为LCs能力的细胞,并成功建立其培养体系,首次在大鼠上证实了SLCs的存在。Landreh等[13]从人睾丸中成功分离出睾丸管周细胞,并发现其具有SLCs的细胞特性。2011年,本课题组Yu等[14]成功从仔猪睾丸中分离得到猪SLCs,并建立其短期培养体系。迄今为止,相比于大鼠SLCs,其他哺乳动物SLCs长期培养体系还未完全建立[15],SLCs的研究仍有很大的发展空间。
SLCs分化为ALCs需经历睾丸间质祖细胞(progenitor Leydig cells, PLCs)和未成熟的睾丸间质细胞(immature Leydig cells, ILCs)两个过渡阶段[11]。在该过程中,HPG轴协同IGF-1、PDGFa、TGFα等细胞因子共同调控LCs的增殖、分化和成熟,其中以垂体分泌的LH起主导作用[7,11]。在LCs成熟过程中,细胞体积逐渐增大,形态由梭形逐渐变为圆形;细胞质内脂滴含量减少,光面内质网数量增多;细胞分化程度越来越高,类固醇激素合成酶和相关转运蛋白的表达增强。最终,在ALCs阶段,促黄体素受体(luteinizing hormone recepter, LHR)和类固醇激素合成酶的表达量达到顶峰[16]。
2 睾酮的合成与合成调控
T是雄性体内最主要的性激素,以胆固醇为原料在LCs中合成。LH是T合成过程中主要的调节激素,通过激活cAMP和Ca2+这两个信号分子,促进T产生。T的合成同时受到FGFs、IGF-1、EFGα、TGFα和TGFβ等细胞因子的旁分泌作用。
2.1 睾酮的合成
ALCs是合成T最主要的细胞类型,而PLCs和ILCs由于分化程度不高,类固醇激素合成酶不能完全表达,故该阶段主要生成其他雄激素代谢产物[11]。ALCs合成T主要包括三个步骤(图1)[11,17-19]。
2.1.1 胆固醇从线粒体膜外转运到膜内 细胞内的胆固醇来源广泛,可由内质网合成,也能由细胞内的脂滴转化得来;细胞外的低密度脂蛋白(LDL)和高密度脂蛋白(HDL)都可作为胆固醇的前体物质,在人LCs中,细胞外的LDL通过受体介导的内吞作用进入细胞,而啮齿类动物主要通过B类Ⅰ型清道夫受体(scavenger receptor B1, SRB1)将HDL转移至胞内[18-19]。随后,TSPO(translocator proteins)将胆固醇从线粒体膜外转运到膜内;在此过程中,垂体释放LH,促使类固醇激素合成急性调节蛋白(steroidogenic acute regulatory protein, StAR)表达,进一步促进胆固醇转运[17]。
2.1.2 胆固醇转化为孕烯醇酮 胆固醇在线粒体内膜的胆固醇侧链裂解酶细胞色素P450(cholesterol side-chain cleavage enzyme, P450scc)的催化下生成孕烯醇酮(pregnenolone,PREG)[11]。
2.1.3 PREG转化为T PREG转运至光面内质网后,被3β-HSD酶解为孕酮(progesterone),随后在17-20裂解酶细胞色素P450(17a-hydroxylase/17,20-lyase, P450c17)的作用下先后生成17-羟孕酮(17-OH-progesterone)和雄烯二酮(androstenedione),后者经17β-HSD的作用生成T[11]。
在该合成过程中还生成17-羟孕烯醇酮、脱氢表雄酮和雄烯二醇等中间产物,此处并未列出。
2.2 睾酮的合成调控
T的合成和分泌主要受HPG轴调节。垂体分泌LH,激活第二信使,动员胆固醇生成T。除此之外,FGFs、IGF-1、TGFα、25-羟基胆固醇和TGFβ等细胞因子也能影响T合成。
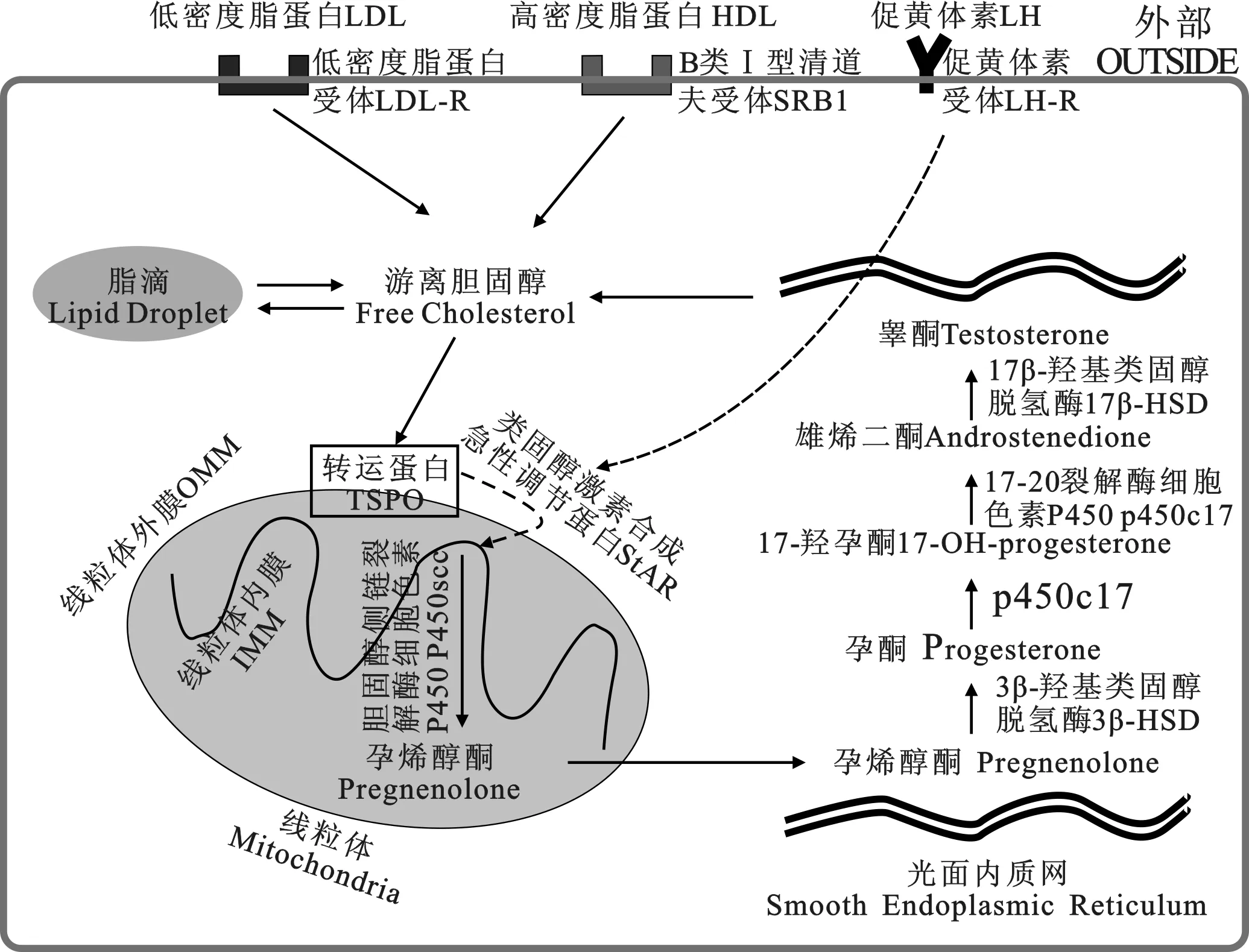
图1 ALCs中睾酮合成途径[11,17-19]Fig.1 Biosynthesis pathway of testosterone in ALCs
下丘脑分泌促性腺激素释放激素(gonadotropin-releasing hormone, GnRH)促使垂体释放LH,LH与LCs细胞膜上的受体特异性结合,激活腺苷酸环化酶,促使胞内cAMP水平升高,激活PKA。随后PKA通过基因作用促进StAR表达,加速胆固醇转运[17]。Costa等[20]在小鼠中发现,LH可通过激活PKA和PKC,促使T型钙离子通道开放,使Ca2+大量涌入LCs细胞内,影响T的合成。推测除cAMP以外,Ca2+也可能作为LH调节T合成的第二信使。
T合成和分泌过程除了受经典的LH调控以外,某些睾丸内旁分泌因子和体内其他激素也能影响T合成和分泌[8],例如支持细胞(sertoli cells,SCs)能分泌FGFs、IGF-1、TGFα和EFGα等多种细胞因子参与T合成过程,其中IL-1α、生长激素和胰岛素可以通过调节IGF-1的表达,间接影响T合成;巨噬细胞与LCs直接接触或通过分泌25-羟基胆固醇和其他细胞因子,影响LCs正常发育和功能发挥。此外,TGFβ、IL-1、TNF-α、干扰素-γ等因子能抑制类固醇激素合成酶的活性,从而减少T的生成[21]。而GnRH和内皮素-1可与LCs细胞膜上的特异性受体结合,刺激Ca2+浓度升高,增强T生成能力[22]。除上述因子的调节作用以外,降钙素、促肾上腺释放激素等物质也影响T合成,但其具体机制尚不清楚。
3 睾酮对生殖与生长发育的影响
3.1 睾酮对生殖的影响
T作为哺乳动物体内重要的性激素之一,对维持雄性和雌性正常生殖功能具有重要意义。对雄性来说,T在胚胎期影响胎儿性别分化,而在初情期后主要调控精子发生并维持雄性第二性征;对雌性来说,T主要具有促进卵泡发育成熟和排卵的作用。
3.1.1 T对雄性生殖的作用 雄激素受体(androgen receptor, AR)属于类固醇激素核受体家族的一员,是T和双氢睾酮(dihydrotestosterone, DHT)发挥作用的中介物质[1]。通过构建敲除AR基因(AR knockout, ARKO)的小鼠模型,发现小鼠睾丸内与精子发生相关的蛋白质表达量改变,表现为生精障碍[23],提示AR作为T功能发挥的中介物质,对精子发生有着重要意义。目前生殖细胞(germ cells, GCs)上是否存在AR仍有争议,但可以确定其对精子发生无影响[23]。而SCs、管周肌样细胞(peritubular myoid cells, PMCs)和LCs中均证实存在AR表达,针对这些细胞类型构建的ARKO小鼠表现为精子发生受阻[24],证实了T可通过AR作用于这些细胞,调控精子发生。

SCs的AR表达呈生精细胞发育阶段依赖性调控[24-25]。SCs受T调节作用,分泌多种信号因子,为GCs的增殖分化提供支持和营养作用。SC-ARKO小鼠表现为生精过程阻滞,精子缺失甚至不育[24]。SCs还可形成血睾屏障(blood-testis barrier, BTB),使GCs免受外界不良环境的影响,为精子发生创造独特环境[26]。而T可以调节BTB相关蛋白质的表达,维持BTB的完整性,保障精子正常发生[27]。
PMCs具有丰富的AR且持续稳定表达[24]。Chen等[28]发现,PMC-ARKO小鼠精原细胞大量缺失,表明T可能作用于PMCs,间接维持精原干细胞数量。Norton等[29]研究表明,PMCs受T刺激,合成并分泌旁分泌因子(P-Mod-S),以维持SCs正常功能,调控精子发生。Welsh等[30]还发现,PMC-ARKO小鼠LCs发育异常,提示PMCs也可能通过旁分泌作用影响LCs发育。
LCs不仅是合成和分泌T的细胞,也是T作用的靶细胞。O'Hara等[31]在LC-ARKO小鼠模型上发现LCs无法分化为ALCs,猜测T可能通过自分泌作用影响LCs发育。而在同样的研究模型上还发现LCs合成的类固醇合成酶类减少[23],表明缺乏T会影响自身的合成量。目前所知有两条通过负反馈作用于HPG轴从而抑制T自身生成水平的途径[7]:当睾丸内睾酮水平过高时,T反作用于下丘脑,促使GnRH释放,影响LH和促卵泡素(follicle-stimulating hormone, FSH),一方面,LH直接作用于LCs,减少睾酮的生成;另一方面,FSH促使SCs释放雄激素结合蛋白(androgen binding protein, ABP),ABP可与T结合,减弱T活性,从而达到控制局部T水平的作用。
因此,睾酮能调控SCs、PMCs、LCs等细胞,发挥正常功能,促进精子发生相关蛋白质和细胞因子的表达,维持雄性正常生殖活动。目前,除T与AR结合发挥生物学效应的基因作用研究较为透彻外,其余两条非基因组作用仍存在疑点。例如,除SCs细胞,该途径是否在其他细胞中也同样适用;被T激活的Erk是否能直接调控ARE影响基因转录;以及在Ca2+通路中是否与T结合的膜受体为G蛋白偶联受体等,这些问题仍有待进一步研究。
3.1.2 睾酮对雌性生殖的作用 在雌性卵巢中,T受LH调控生成于卵泡膜细胞,随后进入颗粒细胞转化为E[32]。Sen等[33]通过基因敲除手段,去除雌性小鼠卵巢AR,结果显示卵泡发育受损,提示T能结合AR调控卵泡细胞发育。AR在卵泡发育早期表达量较高,之后随着卵泡发育逐渐减少,表明T可能只参与早期卵泡发育阶段[32]。T主要通过增加卵巢内促卵泡素受体(follicle- stimulating hormone recepter, FSHR)、IGF-1及其受体的表达,提高FSH和IGF-1活性,从而促进卵泡发育[34-35]。此外,T对维持子宫内膜组织内环境稳定和乳腺发育也起着重要作用[36-37]。
适量的T能促进卵泡发育和排卵,但水平过高可能会引发雌性生殖疾病[3]。多囊卵巢综合症(polycystic ovary syndrome, PCOS)是一种常见的排卵障碍疾病,临床表现为卵泡发育障碍、高雄激素血症和胰岛素抵抗[38]。近年来,针对PCOS提出的“胎儿期编程学说”可作为T水平过高引发PCOS的证据之一,即胎儿在母体T高水平环境的刺激下,改变T合成相关物质的表达,最终引起一系列PCOS临床表现[39]。高水平T导致PCOS的作用机制可能为:①调节卵巢内某些细胞因子的表达,影响卵巢正常生理功能[38];②刺激FSHR大量表达,导致颗粒细胞过早增殖、卵泡提前发育,使卵泡未完全发育成熟就已发生闭锁[38];③早期卵泡发育过快,可供选择的优势卵泡太多而发生紊乱,导致大量卵泡处于生长停滞期[40]。
3.2 睾酮对生长发育的影响
T作为哺乳动物体内一种重要的激素,除了发挥与生殖相关作用以外,还广泛参与机体各项生命活动,对蛋白质合成、骨量维持、皮脂分泌、神经系统和心血管系统的保护等方面有重要意义[1]。
T对骨量维持十分重要,一方面能通过促进成骨细胞的分化发育来维持骨骼生长,另一方面能抑制骨吸收,改善骨质疏松[4]。中老年男性由于T水平低下,容易引起骨质疏松,使骨折发生率升高[4]。Gill等[41]研究发现,T能提高大鼠骨细胞中TGFβ的水平,从而维持骨量平衡。Huang等[42]研究表明,ARKO小鼠抑制了骨髓间充质干细胞(BMSCs)向成骨细胞分化的能力,但促进了BMSCs脂肪形成,这可能是由于T结合AR后调节IGF导致的。Steffens等[43]通过抑制大鼠T生成,发现其体内破骨细胞数目增多;而对照组补充T后,破骨细胞数目呈T剂量依赖性减少,证实了T能维持骨量平衡。Finkelstein等[44]对抑制E水平的男性采用T补充治疗后,仍无法改善其骨质疏松症状,表明在性激素T和E中,后者可能在成年男性骨代谢中占主导地位。此外,TNF、IL等细胞因子也参与T调节骨细胞生长过程,但具体作用机制仍存在争议[43]。
T能调节多种细胞因子,发挥神经保护作用。对患有神经性退行疾病的老年人进行T补充治疗,患者的记忆力和认知水平明显得到提高[45]。Li等[46]在雄性SAMP8小鼠上发现,T可以上调海马神经元细胞SYN的表达,猜测可能对改善认知能力有帮助;洪雷等[47]研究发现,生理水平的T能提高亚急性衰老小鼠的学习记忆能力,这可能是通过改善海马CA1区形态和神经元数量实现的;而Qiu等[48]研究表明,T能调控成年雄性小鼠海马区SRC-1的表达,猜测可能也与学习记忆能力的改善有关。2015年,Bing等[49]研究报道,DHT可以通过PI3K/Akt途径上调seladin-1、bcl-xl等表达,减少bax表达量,从而显著降低了大鼠c6神经胶质细胞的凋亡率,最终发挥神经保护作用。此外,T的脑保护作用还涉及抗自由基、抗神经细胞凋亡、调节神经元毒性易感性等多种机制,调控网络十分复杂,还需进行长期深入的研究。
T能通过基因作用和非基因作用介导心肌细胞、血管内皮细胞和血管平滑肌细胞等心血管系统主要功能细胞,参与心血管疾病的调节[50]。Nheu等[51]发现,T能激活内皮细胞PI3K/Akt、ERK1/2等信号途径,磷酸化eNOS,促进NO合成。Deenadayalu等[52]以猪冠状动脉为试验材料,发现T可以刺激冠脉平滑肌合成NO,促进cGMP生成并激活PKG,从而舒张血管。此外,T还可以抑制血压、血脂和血糖的升高,改善内皮损伤、细胞增殖迁移能力减弱、血管衰老等心血管疾病,对心血管系统起到一定的保护作用。但T在心血管疾病中的作用是复杂且有争议的,许多病理机制尚未完全阐明,仍需深入研究。
皮肤可表达AR和多种类固醇激素合成酶。相对于其他皮肤结构来说,皮脂腺和毛囊对雄激素敏感度更高,更易引起皮肤病的发生。在痤疮患者中测得AR和5α-还原酶表达量最高,使得T更多的向活性更强的DHT转化,刺激皮脂过度分泌,更易引发痤疮。痤疮发病的作用机制尚不明确,猜测可能是T通过影响FGFR2[5]、IGF-1[53-54]和TNFα等[55]细胞因子,增强皮脂分泌水平。而在皮肤的毛囊细胞中,T和DHT会导致毛囊缩小,毛发周期缩短,最终形成雄激素源性脱发(AGA)。毛发生长周期复杂,受TGFβ-1、TGFβ-2、DKK-1和IGF-1等细胞因子调控,T和DHT可以诱导上述因子表达,影响毛发生长[56]。此外,Kretzchumar等[57]发现,AR可能通过β-连环蛋白/Wnt信号通路,参与毛囊发育和皮脂腺分化。
T能广泛参与机体生命代谢活动,除了对骨骼、脑组织、心血管系统和皮肤等有影响以外,还能促进蛋白质合成、影响糖脂代谢和维生素表达,并产生免疫抑制作用。T可以改变某些因子分泌,影响细胞生长发育和凋亡。但在不同组织器官参与调节的因子不同,导致T对机体的作用机制可能有着多种实验结论;即使是同种因子,其发挥的作用可能也不同。目前的研究不能完全解释T的作用机制,仍有待进一步研究。
4 问题与展望
雄性LCs受HPG轴调控,合成并分泌T;T通过与AR结合的基因调控或其他非基因调控,影响动物生殖和生长发育过程中P-Mod-S、IGF、NO等物质的表达。因此,LCs和T的正常功能发挥,对保障动物健康有重要意义。但迄今为止,LCs分化发育的调控,以及T影响动物体内各组织器官的作用机制还未研究清楚。例如:①SLCs作为LCs的前体细胞,其起源和长期培养体系尚未完全建立;②LCs的分化发育及合成T的过程,受多种激素和因子的影响,是十分复杂的调控系统。但先前的研究并未完全阐明该调控系统,且某些尚未研究的物质可能也参与其中;③T调控生殖细胞和其他体细胞的信号通路众多,包括T的基因作用和非基因作用,涉及AR、Erk、CREB、Ca2+等多种物质参与。目前,对该方面研究还不够清楚,T在其中所扮演的角色还有待查明。因此,关于T的作用机制还需科学家们继续补充完善,以期为研究T和相关生理过程提供参考资料。
[1] DAVEY R A, GROSSMANN M.Androgen receptor structure,function and biology:from bench to bedside[J].The Clinical Biochemist Reviews,2016,37(1):3-15.
[2] BAAS W, KÖ HLER T S.Testosterone replacement therapy and voiding dysfunction[J]. Translational Andrology and Urology,2016,5(6):890-897.
[3] SEN A, PRIZANT H, LIGHT A, et al.Androgens regulate ovarian follicular development by increasing follicle stimulating hormone receptor and microRNA-125b expression[J]. Proceedings of the National Academy of Sciences of the United States of America, 2014, 111(8):3 008-3 013.
[4] VANDERSCHUEREN D, LAURENT M R, Claessens F, et al.Sex steroid actions in male bone[J]. Endocrine Reviews,2014,35(6):906-960.
[5] MELNIK B C.Role of FGFR2-signaling in the pathogenesis of acne[J].Dermato-Endocrinology, 2009,1(3):141-156.
[6] ANAISSIE J, ROBERTS N H, WANG P, et al.Testosterone replacement therapy and components of the metabolic syndrome[J].Sexual Medicine Reviews,2017,5(2):200-210.
[7] POTTER S J, KUMAR D L, DE FALCO T.Origin and Differentiation of Androgen-Producing Cells in the Gonads[J].Results and Problems in Cell Differentiation,2016,58:101-134.
[8] WEN Q, CHENG C Y, LIU Y X.Development, function and fate of fetal Leydig cells[J]. Seminars in Cell & Developmental Biology,2016,59:89-98.
[9] KAFTANOVSKAYA E M, LOPEZ C, FERGUSON L, et al.Genetic ablation of androgen receptor signaling in fetal Leydig cell lineage affects Leydig cell functions in adult testis[J].Faseb Journal,2015,29(6):2 327-2 337.
[10] SHIMA Y, MATSUZAKI S, MIYABAYASHI K, et al.Fetal leydig cells persist as an androgen-independent subpopulation in the postnatal testis[J].Molecular Endocrinology, 2015,29(11):1 581-1 593.
[11] TEERDS K J, HUHTANIEMI I T.Morphological and functional maturation of Leydig cells: from rodent models to primates[J].Human Reproduction Update,2015,21(3):310-328.
[12] GE R S, DONG Q, SOTTAS C M, et al.In search of rat stem Leydig cells: identification, isolation, and lineage-specific development[J].Proceedings of the National Academy of Sciences of the United States of America,2006,103(8):2 719-2 724.
[13] LANDREH L, SPINNLER K, SCHUBERT K, et al.Human testicular peritubular cells host putative stem Leydig cells with steroidogenic capacity[J].The Journal of Clinical Endocrinology and Metabolism,2014,99(7):1 227-1 235.
[14] YU S, ZHANG P, DONG W, et al.Identification of stem leydig cells derived from pig testicular interstitium[J].Stem Cells International,2017;2017:2740272.
[15] 于帅,张阳海,潘传英.睾丸间质干细胞增殖分化及其调控[J].中国生物化学与分子生物学报,2017,33(1):30-37.
[16] CHEN H, GE R S, ZIRKIN B R.Leydig cells: From stem cells to aging[J].Molecular and Cellular Endocrinology,2009,306(1/2):9-16.
[17] LEE J, TONG T, DUAN H, et al.Regulation of StAR by the N-terminal domain and coinduction of SIK1 and TIS11b/Znf36l1 in single cells[J].Frontiers in Neuroendocrinology, 2016,7:107.
[18] SHEN W J, AZHAR S, KRAEMER F B.ACTH regulation of adrenal SR-B1[J].Frontiers in Endocrinology,2016,7:42.
[19] MILLER W L, BOSE H S.Early steps in steroidogenesis: intracellular cholesterol trafficking[J]. Journal of Lipid Research,2011,52(12):2 111-2 135.
[20] COSTA R R, REIS R I, AGUIAR J F, et al.Luteinizing hormone (LH) acts through PKA and PKC to modulate T-type calcium currents and intracellular calcium transients in mice Leydig cells[J].Cell Calcium,2011,49(3):191-199.
[21] HALES D B.Testicular macrophage modulation of Leydig cell steroidogenesis[J].Journal of Reproductive Immunology,2002,57(1/2):3-18.
[22] 徐文丹,代晓南,崔毓桂.睾丸雄激素合成的调节机制及其研究进展[J].国际生殖健康/计划生育杂志,2014,33(6):428-433.
[23] CHANG C, LEE S O, WANG R S, et al.Androgen receptor (AR) physiological roles in male and female reproductive systems: lessons learned from AR-knockout mice lacking AR in selective cells[J].Biology of Reproduction,2013,89(1):21.
[24] SMITH L B, WALKER W H.The regulation of spermatogenesis by androgens[J].Seminars in Cell & Developmental Biology,2014,30:2-13.
[25] LUCAS T F, NASCIMENTO A R, PISOLATO R, et al.Receptors and signaling pathways involved in proliferation and differentiation of Sertoli cells[J].Spermatogenesis,2014,4:e28138.
[26] JIANG X H, BUKHARI I, ZHENG W, et al.Blood-testis barrier and spermatogenesis: lessons from genetically-modified mice[J].Asian Journal of Andrology,2014,16(4):572-580.
[27] LIE P P, CHENG C Y, MRUK D D.Signalling pathways regulating the blood-testis barrier[J].The International Journal of Biochemistry & Cell Biology,2013,45(3):621-625.
[28] CHEN L Y, BROWN P R, WILLIS W B, et al.Peritubular myoid cells participate in male mouse spermatogonial stem cell maintenance[J].Endocrinology,2014,155(12):4 964-4 974.
[29] NORTON J N, SKINNER M K.Regulation of Sertoli cell differentiation by the testicular paracrine factor PModS: potential role of immediate-early genes[J].Molecular Endocrinology,1992,6(12):2 018-2 026.
[30] WELSH M, MOFFAT L, BELLING K, et al.Androgen receptor signalling in peritubular myoid cells is essential for normal differentiation and function of adult Leydig cells[J].International Journal of Andrology,2012,35(1):25-40.
[31] O'HARA L, MCLNNES K, SIMITSIDELLIS I, et al.Autocrine androgen action is essential for Leydig cell maturation and function, and protects against late-onset Leydig cell apoptosis in both mice and men[J].FASEB Journal,2015,29(3):894-910.
[33] SEN A, HAMMES S R.Granulosa cell-specific androgen receptors are critical regulators of ovarian development and function[J].Molecular Endocrinology,2010,24(7):1 393-1 403.
[34] DU X, LI Q, PAN Z, et al.Androgen receptor and miRNA-126*axis controls follicle-stimulating hormone receptor expression in porcine ovarian granulosa cells[J].Reproduction,2016,152(2):161-169.
[35] KNAPCZYK-STWORA K, GRZESIAK M, DUDA M, et al.Effect of flutamide on folliculogenesis in the fetal porcine ovary--regulation by Kit ligand/c-Kit and IGF1/IGF1R systems[J].Animal Reproduction Science,2013,142(3-4):160-167.
[36] GIBSON D A, SIMITSIDELLIS I, COUSINS F L, et al.Intracrine androgens enhance decidualization and modulate expression of human endometrial receptivity genes[J].Scientific Reports,2016,28;6:19970.[2016-12-17].doi:10.1038/strep19970.
[37] HICKEY T E, ROBINSON J L, CARROLL J S, et al.Minireview: The androgen receptor in breast tissues: growth inhibitor, tumor suppressor, oncogene?[J].Molecular Endocrinology,2012,26(8):1 252-1 267.
[38] DUMESIC D A, RICHARDS J S.Ontogeny of the ovary in polycystic ovary syndrome[J].Fertility and Sterility,2013,100(1):23-38.
[39] JAHROMI M S, TEHRANI F R, Noroozzadeh M, et al.Elevated expression of steroidogenesis pathway genes; CYP17, GATA6 and StAR in prenatally androgenized rats[J].Gene,2016,593(1):167-171.
[40] 郭保平,徐明龙,胡进,等.DHEA诱导雌性大鼠PCOS模型早期性器官及其相关激素变化的研究[J].畜牧兽医学报,2015,46(8):1 348-1 355.
[41] GILL R K, TURNER R T, WRONSKI T J, et al.Orchiectomy markedly reduces the concentration of the three isoforms of transforming growth factor beta in rat bone, and reduction is prevented by testosterone[J].Endocrinology,1998,139(2):546-550.
[42] HUANG C K, LAI K P, LUO J, et al.Loss of androgen receptor promotes adipogenesis but suppresses osteogenesis in bone marrow stromal cells[J].Stem Cell Research,2013,11(2):938-950.
[43] STEFFENS J P, COIMBRA L S, ROSSA C Jr, et al.Androgen receptors and experimental bone loss - an in vivo and in vitro study[J].Bone,2015,81:683-690.
[44] FINKELSTEIN J S, LEE H, LEDER B Z, et al.Gonadal steroid-dependent effects on bone turnover and bone mineral density in men[J].The Journal of Clinical Investigation,2016,126(3):1 114-1 125.
[45] KAWATO S.Role of androgen in the elderly. Modulation of synaptic plasticity by brain-synthesized androgens[J].Clinical Calcium2013,23(8):1 141-1 150.
[46] LI S, KANG L, ZHANG Y, et al.Detecting the presence of hippocampus membrane androgen receptors in male SAMP8 mice and their induced synaptic plasticity[J].Molecular and Cellular Endocrinology,2015,414:82-90.
[47] 洪雷,吴赛珠,邢晓雯,等.生理水平的雄激素对亚急性衰老小鼠学习记忆能力的影响[J].中华老年心脑血管病杂志,2010,12(4):344-347.
[48] QIU L, ZHAO Y, GUO Q, et al.Dose-dependent regulation of steroid receptor coactivator-1 and steroid receptors by testosterone propionate in the hippocampus of adult male mice[J].The Journal of Steroid Biochemistry and Molecular Biology,2016,156:23-31.
[49] BING L, WU J, ZHANG J, et al.DHT inhibits the Abeta25-35-induced apoptosis by regulation of seladin-1, survivin, XIAP, bax, and bcl-xl expression through a rapid PI3-K/Akt signaling in C6 glial cell lines[J].Neurochemical Research,2015,40(1):41-48.
[50] FORADORI C D, WEISER M J, HANDA R J.Non-genomic actions of androgens[J].Frontiers in Neuroendocrinology,2008,29(2):169-181.
[51] NHEU L, NAZARETH L, XU G Y, et al.Physiological effects of androgens on human vascular endothelial and smooth muscle cells in culture[J].Steroids,2011,76(14):1 590-1 596.
[52] DEENADAYALU V, PUTTABYATAPPA Y, LIU A T, et al.Testosterone-induced relaxation of coronary arteries: activation of BKcachannels via the cGMP-dependent protein kinase[J].American Journal of Physiology.Heart and Circulatory Physiology,2012,302(1):H115-H123.
[53] ZHOU B R, HUANG Q H, XU Y, et al.Dihydrotestosterone induces SREBP-1 expression and lipogenesis through the phosphoinositide 3-kinase/Akt pathway in HaCaT cells[J].Lipids in Health and Disease,2012,11:156.
[54] KIM H J, KOBAYASHI M, SASAKI T, et al.Overexpression of FoxO1 in the hypothalamus and pancreas causes obesity and glucose intolerance[J].Endocrinology,2012,153(2):659-671.
[55] 单雨婷,路永红,杜秀君,等.雄激素及雄激素受体在痤疮发病中的作用[J].皮肤病与性病,2016,38(2):108-112.
[56] INUI S, ITAMI S.Androgen actions on the human hair follicle: perspectives[J].Experimental Dermatology,2013,22(3):168-171.
[57] KRETZSCHMAR K, COTTLE D L, SCHWEIGER P J, et al.The androgen receptor antagonizes wnt/beta-catenin signaling in epidermal stem cells[J].The Journal of Investigative Dermatology,2015,135(11):2 753-2 763.

