一株植物乳杆菌体外抗氧化和耐药性的研究
,,,,, , ,,*
(1.东北农业大学乳品科学教育部重点实验室,黑龙江哈尔滨 150030; 2.中垦华山牧乳业有限公司,陕西渭南 714019)
在氧化呼吸过程中会产生活性氧化代谢物(ROM),会损伤蛋白质和核酸、氧化磷脂壁并改变低密度脂蛋白,过多的代谢物还会损伤细胞造成疾病,如动脉粥样硬化、关节炎、糖尿病、神经退化性疾病、心血管疾病和癌症[1-2]。为抵抗ROM,人体合成的抗氧化物酶和抗氧化物及食物中存在的抗氧化物一起形成了生物氧化剂的屏障。然而,在某些情况下,防御系统并不能保护机体不受到氧化应激。因此,增加抗氧化防御力是维护人类健康和预防疾病的重要部分[3]。在这方面,人类开拓了一个新的领域,通过益生菌的活性去抵抗过氧化物造成的应激。
联合国粮农组织和世界卫生组织将益生菌定义为“当达到一定数量时,对宿主有益的活性微生物”[4],其中乳杆菌和双歧杆菌应用最为广泛,经常有研究报道其具备的各种功能性[5]。尽管益生菌作用的分子机制还没有完全阐明,但其调节肠道菌群,改善肠道上皮屏障功能的益生作用已经众所周知。起初,益生菌经常用于调节和改善肠道菌群平衡[6],现在,选择适当的益生菌应对特定的生理指标,开发益生菌新的益生特性已经发展起来[7],比如预防和治疗腹泻、加强自身免疫和调节高胆固醇血症等[8]。而鉴定益生菌的安全性是开发功能性菌株的前提,菌株安全性鉴定可以从多方面进行,如生物胺的检测、溶血检测、靛基质检测等,本研究进行的抗生素敏感性实验也是菌株安全性鉴定的一个重要环节。
植物乳杆菌KLDS 1.0386分离自中国内蒙古地区传统发酵乳制品,已有研究证明其具有良好的降胆固醇能力和肠胃耐受能力[9-12]。本实验通过7个体外抗氧化指标研究KLDS 1.0386的抗氧化能力,并通过10种常用抗生素检测其抗生素敏感性,为开发安全多功能益生菌和微生物制剂提供了数据支持。
1 材料与方法
1.1 材料与仪器
植物乳杆菌KLDS 1.0386(Lactobacillusplantarum) 由东北农业大学乳品科学教育部重点实验室提供。供试菌株在实验前需进行复苏与纯化,经MRS液体培养基,37 ℃培养,连续传代3次以恢复菌种活力用于后续实验;酵母粉 OXOID公司;蛋白胨、胰蛋白胨、大豆蛋白胨、酪蛋白胨、牛肉膏、氯化钠、硫酸亚铁、双氧水、无水乙醇、三氯化铁、铁氰化钾 奥博星生物技术公司;M17 海博生物技术有限公司;DPPH(1,1-苯基-2-三硝基苯肼)、邻二氮菲、半胱氨酸、抗坏血酸、TBA(叔丁醇)、BHT(2,6-二叔丁基-4-甲基苯酚)、氨苄西林、青霉素、亚胺培南、庆大霉素、红霉素、四环素、万古霉素、卡那霉素、林霉素、氯霉素 北京博奥拓达科技有限公司。
BCN1360型生物洁净工作台 北京东联哈尔仪器公司;DHP-9082型电热恒温培养箱 上海一恒科技有限公司;HVE-50全自动高压灭菌锅 HIRAYAMA;PL 2002电子天平 梅特勒-托利多仪器(上海)有限公司;GL-21M离心机 上海市离心机械研究所;生物显微镜 LEICA;DU 800紫外可见分光光度计 美国BECKMAN公司。
1.2 实验方法
1.2.1 MRS培养基 称取蛋白胨5 g,牛肉膏5 g,胰蛋白胨10 g,乙酸钠5 g,磷酸氢二钾2 g,葡萄糖20 g,酵母粉5 g,硫酸锰0.25 g,硫酸镁0.58 g,柠檬酸氢二胺2 g,吐温-80 1 g,牛肉膏5 g,加蒸馏水定容至1000 mL,高压灭菌(121 ℃,20 min)。
1.2.2 3种供试样品的制备 将活化好的菌株37 ℃培养18 h,8000 r/min离心20 min,收集上清,即发酵上清液。
将活化好的菌株37 ℃培养18 h,8000 r/min离心20 min,用PBS冲洗两遍,再次离心,收集菌体,重悬于PBS,使菌体浓度达到109CFU/mL,即细胞悬液。
菌体细胞破碎液的制备:参考Lin的方法[13],将菌悬液置于冰浴中,超声破碎菌体细胞(超声条件:800 W,超声3 s,停8 s,持续15 min),显微镜下观察无完整菌体,12000 r/min离心20 min,收集上清,即为菌体细胞破碎液。
1.2.3 过氧化氢耐受性的测定 将供试菌株在MRS培养基中按2%接菌量接入,再在培养基中加入过氧化氢溶液,使其浓度达到0、0.4、0.8、1.0 mmol/L,涡旋混匀,于37 ℃培养24 h,再次涡旋混匀,MRS液体培养基调零,600 nm波长条件下测样品吸光值[13]。
1.2.4 乳酸菌清除DPPH自由基能力的测定 在每种1 mL供试样品中加入0.2 mmol/L DPPH·的无水乙醇1 mL,充分振荡混匀,再在室温下避光反应30 min,6000 r/min离心10 min取上清,517 nm波长条件下测定样品吸光值(OD值)[13]。按照以下公式计算DPPH自由基的清除率:
DPPH·清除率(%)=[1-(样品-空白)/对照]×100
式中,空白为用1 mL无水乙醇取代1 mL DPPH·反应的吸光值;对照为PBS取代样品反应的吸光值,每组重复三次,取平均值。
1.2.5 乳酸菌清除羟自由基能力的测定 在反应体系中加入1 mL 2.5 mmol/L的邻菲罗啉,1 mL PBS(0.1 mol/L,pH7.2~7.4)和1 mL各供试样品充分混匀,再加入1 mL 2.5 mmol/L的硫酸亚铁,涡旋混匀,再加入1 mL 20 mmol/L的过氧化氢,37 ℃水浴1.5 h,在536 nm波长下测定样品吸光值[14]。按照下列公式计算乳酸菌清除羟自由基的能力:
羟自由基清除能力(%)=(样品-空白)/(对照-空白)×100
式中,空白为1 mL去离子水替代1 mL样品反应的吸光值;对照为1 mL去离子水替代1 mL过氧化氢反应的吸光值,每组重复三次,取平均值。
1.2.6 乳酸菌抗脂质过氧化能力的测定 在反应体系中加入1 mL亚油酸乳化液、0.5 mL PBS、0.2 mL 0.01%硫酸亚铁和0.2 mL 0.01%维生素C,再加入0.5 mL各供试样品,漩涡振荡1 min,置于37 ℃下避光反应12 h,再次漩涡混匀,取2 mL反应液加入0.2 mL 0.4%三氯乙酸,2 mL 0.8%硫代巴比妥酸和0.2 mL 0.4% BHT,漩涡振荡1 min,于沸水浴反应30 min,待样品冷却后加入2 mL氯仿,4000 r/min离心10 min,收集上清,532 nm波长条件下测定吸光值[14],按照下列公式计算乳酸菌抗脂质过氧化能力:
抗脂质过氧化能力(%)=(空白-样品)/空白×100
式中,空白为PBS代替样品反应的吸光值。
1.2.7 乳酸菌还原能力的测定 在反应体系中加入1 mL各供试样品,1 mL 1%的铁氰化钾,1 mL PBS(0.1 mol/L,pH7.2~7.4),漩涡混匀,在50 ℃水浴反应20 min后,冰浴或流水将样品迅速冷却,再加入1 mL 10%三氯乙酸,3000 r/min离心10 min,取2 mL上清液加入2 mL 0.1%的氯化铁,反应10 min,于700 nm波长条件下测样品吸光值,结果采用半胱氨酸作为阳性参照,将样品吸光值换算成半胱氨酸还原力[13]。
1.2.8 超氧阴离子清除能力的测定 在2.8 mL pH为8.2的0.05 mol/L Tris-HCl中加入0.1 mL 0.05 mol/L的邻苯三酚,0.1 mL各供试样品,漩涡混匀,室温避光反应4 min,再加入1 mL 8 mol/L 盐酸终止反应,于320 nm波长条件下测定样品吸光值[15],按照下列公式计算乳酸菌清除超氧阴离子能力:
超氧阴离子清除能力(%)=(1 - 样品/空白)×100
式中,空白为去离子水代替样品反应的吸光值。
1.2.9 螯合金属离子能力的测定 在1 mL各供试样品中加入0.05 mL 2 mmol/L的氯化亚铁,0.2 mL 2 mmol/L的菲咯嗪和2.75 mL去离子水,涡旋混匀,室温下反应10 min,562 nm波长条件下测样品吸光值[15],按照下列公式计算金属离子螯合能力:
螯合力(%)=[1-(样品 - 对照)/干扰]×100
式中,对照是去离子水代替样品反应的吸光值;干扰是去离子水代替氯化亚铁反应的吸光值。
1.2.10 抗生素敏感性检测 在无菌环境中,将不同浓度的抗菌药物溶液分别加到无菌的96孔板中,第1至第11孔加药液,每孔10 μL,第12孔作为生长对照不加药液,此时各管药物浓度依次为256、128、64、32、16、8、4、2、1、0.5、0.25 μg/mL,冻干后密封,-20 ℃保存备用,抗生素选择见表1。将活化好的KLDS 1.0386按1%接种量接种于MRS培养基中,37 ℃培养18 h,再将浓度相当于0.5麦氏比浊度(5×107CFU/mL)的菌悬液,经MRS稀释1000倍后,向每孔中加入100 μL,置于37 ℃培养24 h后,观察菌株的生长情况。以在小孔内完全抑制细菌生长的最低药物浓度为MIC(Minimum Inhibitory Concentration)。供试菌株对抗生素的敏感性以欧洲食品安全局(EFSA)关于细菌抗生素抗性的标准进行判定[16]。

表1 10种抗生素及分类Table 1 10 kinds of antibiotics and classification
1.3 数据处理
实验数据均以平均数±标准差来表示,采用SPSS 20.0软件对实验数据进行统计分析,应用单因素方差分析进行多组数据之间的比较,数据上角字母不同为差异显著(p<0.05),字母相同为差异不显著(p>0.05)。
2 结果与讨论
2.1 过氧化氢耐受性
过氧化氢作为羟自由基的前体参与氧化过程,是衡量菌体抗氧化能力的一个重要指标。如图1所示,植物乳杆菌接种之后在培养基中添加过氧化氢,使其达到不同梯度,过氧化氢的添加会抑制乳酸菌的生长。随着过氧化氢浓度的增加,乳酸菌生长的适应期明显延长,这表明过氧化氢的出现对菌体细胞造成了氧化损伤。
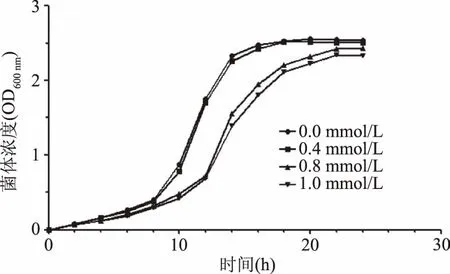
图1 植物乳杆菌KLDS 1.0386 过氧化氢耐受性Fig.1 Growth density of L. plantarum KLDS 1.0386 under oxidative stress
2.2 乳酸菌清除DPPH自由基能力
DPPH自由基的清除是应用最广泛的鉴定抗氧化能力的方法。这种方法基于抗氧化化合物(通常是酚类物质)对DPPH·的消耗。最常用评估DPPH·消耗的方法是采用分光光度计检测反应前后DPPH·的吸光值[17]。如表2所示,菌悬液的DPPH自由基清除率为46.10%,发酵上清液的清除率为45.07%,两者之间不具有显著差异(p>0.05),菌体细胞破碎液的DPPH自由基清除率为25.78%,低于菌悬液和发酵上清液,具有统计学意义(p<0.05)。
2.3 乳酸菌清除羟自由基能力
羟自由基是一种活性氧化物质,其会导致脂质和其他大量生物活性物质过氧化,从而导致人体细胞的损伤[18]。如表2所示,在羟自由基清除率水平上,菌悬液(52.73%)>菌体细胞破碎液(31.50%)>发酵上清液(17.93%),差异具有统计学意义(p<0.05)。
2.4 抗脂质过氧化能力
亚油酸可以被水中所含的活性氧化物质(ROS)所氧化,其发生的氧化反应会产生变色,而抗氧化剂会减轻变色的程度[14]。如表2所示,在抗脂质过氧化能力水平上,菌悬液(30.67%)>发酵上清液(20.03%)>菌体细胞破碎液(5.08%),差异具有统计学意义(p<0.05)。
2.5 还原能力
在此方法中,抗氧化物与铁氰化钾,三氯乙酸和氯化铁形成了一种彩色的复合物,反应复合物吸光值增加表明抗氧化活性的增加,反映了样品还原能力的程度[19]。如表2所示,在还原能力水平上,菌悬液(158.84 μmol/L)>菌体细胞破碎液(151.29 μmol/L)>发酵上清液(56.79 μmol/L),差异具有统计学意义(p<0.05)。
2.6 超氧阴离子清除率
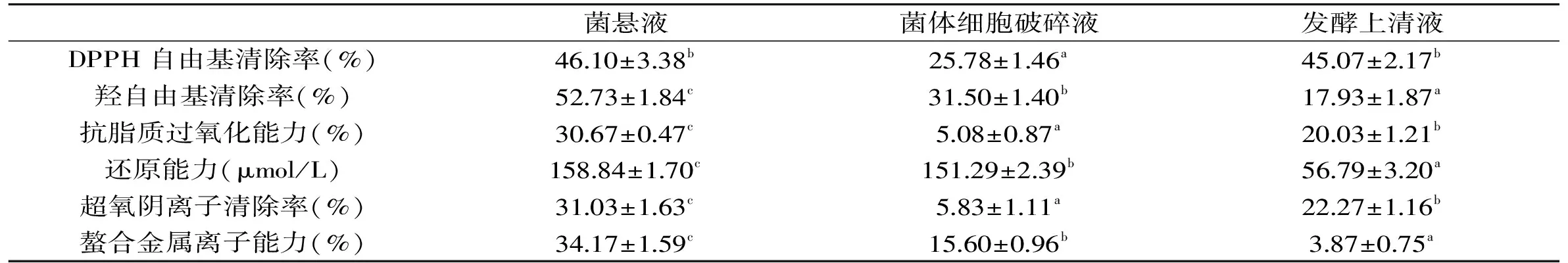
表2 植物乳杆菌KLDS 1.0386不同样品抗氧化能力Table 2 Antioxidant activity of different samples of L. plantarum KLDS 1.0386
2.7 螯合金属离子能力
过量的铁会导致细胞损伤,这是因为其在自由基反应的启动过程中起催化作用,所产生的氧自由基可能会破坏细胞脂质,核酸蛋白质和碳水化合物等物质,其结果会导致细胞功能和完整性的严重损伤[21]。如表2所示,在螯合金属离子能力水平上,菌悬液(34.17%)>菌体细胞破碎液(15.60%)>发酵上清液(3.87%),差异具有统计学意义(p<0.05)。
2.8 抗生素敏感性
按EFSA标准,选取7大类10种抗生素对KLDS 1.0386进行抗生素耐受性测试,如表3所示。评估作为食品或添加剂使用的细菌,菌株可以归类为对抗生素敏感或耐药。当菌株被一定浓度的某种抗生素抑制,该浓度等于或低于已建立的截止值(S≤x mg/L)时,该菌株被定义对该抗生素敏感(S);当菌株不被一定浓度的某种抗生素抑制,该浓度高于已建立的截止值(S>x mg/L)时,该菌株被定义为对该抗生素耐药(R)[22]。
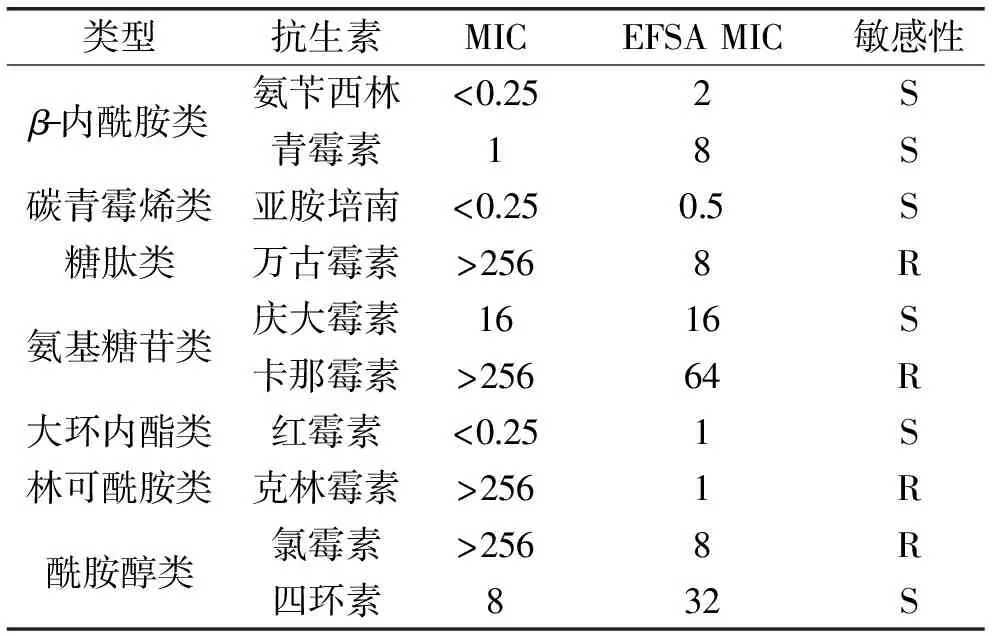
表3 抗生素对菌株KLDS 1.0386的MIC值结果(mg/L)Table 3 MIC value of the strain KLDS 1.0386 to antibiotics(mg/L)
KLDS 1.0386对氨苄西林和青霉素均表现出敏感(S),β-内酰胺类抗生素的作用靶点是青霉素结合蛋白(PBPs),PBPs可以催化细胞壁合成的最后步骤。内酰胺类抗生素抑制PBPs减少细胞壁交联,阻隔新细胞壁的生成,最后会导致青霉素诱导细胞死亡。最常见抵抗青霉素的机制是让青霉素酶失活,而在革兰氏阳性菌中容易发现青霉素抑制剂的存在[23];KLDS 1.0386对碳青霉烯类抗生素亚胺培南表现出高度的敏感性(S),碳青霉烯类抗生素通常被认为是治疗严重感染的最后防线,其可以用于抑制对β-内酰胺类抗生素有抗性的细菌[24];KLDS 1.0386对万古霉素表现出抗性(R),万古霉素是一种用于治疗革兰氏阳性菌急性感染的抗生素,其可以抑制革兰氏阳性菌肽聚糖的生物合成,阻止细菌萜醇的生物合成[25];KLDS 1.0386对庆大霉素体现出敏感(S),对卡那霉素体现出了抗性(R),氨基糖苷类抗生素采取主动运输进入细胞,抑制菌体细胞30s亚基核糖体蛋白质合成,用于治疗革兰氏阴性菌造成的严重感染[26];KLDS 1.0386对于红霉素和四环素的耐受性表现为敏感(S),对克林霉素和氯霉素具有耐药性(R),蛋白质生物合成抑制剂是最大的一类抗生素,占临床使用率的一半以上,大环内酯类、林可酰胺类和酰胺醇类抗生素的作用机制都是通过与核糖体50s亚基结合从而抑制菌体细胞蛋白质的合成,这三类抗生素具有良好的安全性[27-29]。
3 结论
对植物乳杆菌KLDS 1.0386的体外抗氧化性和抗生素敏感性进行检测,结果表明,随着过氧化氢浓度的增加会抑制菌株的生产,适应期明显延长;在羟自由基清除率、螯合金属离子能力和还原能力水平上,菌悬液>菌体破碎液>发酵上清液;在抗脂质过氧化能力和超氧阴离子清除率水平上,菌悬液>发酵上清液>菌体细胞破碎液;在DPPH自由基清除率水平上,菌悬液=发酵上清液>菌体细胞破碎液,总体来说,活体菌悬液的抗氧化性最佳,这可能是由于活性菌体表面具有一些活性物质,如蛋白质、多糖和脂磷壁酸等,这与Li等[30]对植物乳杆菌和双歧杆菌进行抗氧化研究的结果类似。
在抗生素敏感性上,植物乳杆菌KLDS 1.0386对氨苄西林、青霉素、亚胺培南、庆大霉素、红霉素和四环素表现出敏感(S);对万古霉素、卡那霉素、克林霉素和氯霉素表现为耐受(R)。
抗生素敏感性实验为菌株安全性鉴定的一个重要环节,所以在未来的研究中,我们可以对该菌株进行体内由氧化衰老造成的细胞损伤评价,并且从基因水平了解菌株的耐药机制以及从体内和体外多方面对此菌株安全性进行鉴定,为开发一株安全可靠具有益生功能的菌株和微生物制剂提供有价值的参考。
[1]Firuzi O,Miri R,Tavakkoli M,et al. Antioxidant therapy:Current status and future prospects[J]. Current medicinal chemistry,2011,18(25):3871-3888.
[2]Babbs C F. Free radicals and the etiology of colon cancer[J]. Free Radical Biology and Medicine,1990,8(2):191-200.
[3]Serafini M,Del Rio D. Understanding the association between dietary antioxidants,redox status and disease:Is the Total Antioxidant Capacity the right tool?[J]. Redox Report,2013,9(3):145-152.
[4]Joint F. WHO Expert consultation on evaluation of health and nutritional properties of probiotics in food including powder milk with live lactic acid bacteria[J]. Crdoba,Argentina. October,2001,8(5):1-4.
[5]Amaretti A,di Nunzio M,Pompei A,et al. Antioxidant properties of potentially probiotic bacteria:invitroandinvivoactivities[J]. Applied Microbiology and Biotechnology,2013,97(2):809-817.
[6]Pompei A,Cordisco L,Amaretti A,et al. Folate Production by Bifidobacteria as a Potential Probiotic Property[J]. Applied and Environmental Microbiology,2006,73(1):179-185.
[7]Guandalini S. Probiotics for prevention and treatment of diarrhea[J]. Journal of Clinical Gastroenterology,2011,45:S149-S153.
[8]Finch J,Munhutu M N,Whitaker-Worth D L. Atopic dermatitis and nutrition[J]. Clinics in Dermatology,2010,28(6):605-614.
[9]唐雅茹,国立东,王娜娜,等. 产胆酸盐水解酶乳酸菌的鉴定及其生物信息分析[J]. 食品工业,2016(4):184-187.
[10]唐雅茹,李柏良,李婉,等. 胆盐水解酶基因在植物乳杆菌KLDS1.0386中的表达研究[J]. 现代食品科技,2016(7):79-84.
[11]唐雅茹,于上富,国立东,等. 一株产胆盐水解酶植物乳杆菌的发酵培养基的优化[J]. 食品工业科技,2016(4):232-235.
[12]唐雅茹,于上富,国立东,等. 一株降胆固醇乳杆菌的筛选及其益生作用的研究[J]. 食品工业科技,2016(1):142-144.
[13]Lin M,Yen C. Antioxidative Ability of Lactic Acid Bacteria[J]. Journal of Agricultural and Food Chemistry,1999,47(4):1460-1466.
[14]Alam M N,Bristi N J,Rafiquzzaman M. Review oninvivoandinvitromethods evaluation of antioxidant activity[J]. Saudi Pharmaceutical Journal,2013,21(2):143-152.
[15]Tang W,Xing Z,Li C,et al. Molecular mechanisms andinvitroantioxidant effects of Lactobacillus plantarum MA2[J]. Food Chemistry,2017,221(7):1642-1649.
[16]Scientific Opinion on the maintenance of the list of QPS biological agents intentionally added to food and feed(2011 update)[J]. EFSA Journal,2011,9(12):2497.
[17]Oliveira G K F,Tormin T F,Sousa R M F,et al. Batch-injection analysis with amperometric detection of the DPPH radical for evaluation of antioxidant capacity[J]. Food Chemistry,2016,192(2):691-697.
[18]Hazra B,Biswas S,Mandal N. Antioxidant and free radical scavenging activity of Spondias pinnata[J]. BMC complementary and Alternative Medicine,2008,8(1):63.
[19]Jayaprakasha G K,Singh R P,Sakariah K K. Antioxidant activity of grape seed(Vitisvinifera)extracts on peroxidation modelsinvitro[J]. Food Chemistry,2001,73(3):285-290.
[20]Campos Chiste R,Freitas M,Zerlotti Mercadante A,et al. Superoxide Anion Radical:Generation and Detection in Cellular and Non-Cellular Systems[J]. Current medicinal chemistry,2015,22(37):4234-4256.
[21]Oboh G,Puntel R L,Rocha J B T. Hot pepper(Capsicum annuum,Tepin and Capsicum chinese,Habanero)prevents Fe2+-induced lipid peroxidation in brain -invitro[J]. Food Chemistry,2007,102(1):178-185.
[22]赵婷,姚粟,徐友强,等. 欧洲食品安全局(EFSA)细菌耐药性评估概述[J]. 食品与发酵工业,2014(10):162-167.
[23]Berger-B Chi B. Resistance mechanisms of Gram-positive bacteria[J]. International Journal of Medical Microbiology,2002,292(1):27-35.
[24]Dalmolin T V,Bianchini B V,Rossi G G,et al. Detection and analysis of different interactions between resistance mechanisms and carbapenems in clinical isolates of Klebsiella pneumoniae[J].Brazilian Journal of Microbiology,2017,48(3):493-498.
[25]Singh M,Chang J,Coffman L,et al. Hidden Mode of Action of Glycopeptide Antibiotics:Inhibition of Wall Teichoic Acid Biosynthesis[J]. The Journal of Physical Chemistry B,2017,121(16):3925-3932.
[26]Ngo H X,Garneau-Tsodikova S. Flipping the Switch "On" for Aminoglycoside-Resistance Enzymes:The Mechanism Is Finally Revealed![J]. Structure,2016,24(7):1011-1013.
[27]Gaillard T,Dormoi J,Madamet M,et al. Macrolides and associated antibiotics based on similar mechanism of action like lincosamides in malaria[J]. Malaria Journal,2016,15(1):85.
[28]Schwarz S,Shen J,Kadlec K,et al. Lincosamides,Streptogramins,Phenicols,and Pleuromutilins:Mode of Action and Mechanisms of Resistance[J]. Cold Spring Harbor Perspectives in Medicine,2016,6(11):a27037.
[29]Bougas A,Vlachogiannis I A,Gatos D,et al. Dual effect of chloramphenicol peptides on ribosome inhibition[J]. Amino Acids,2017,49(5):995-1004.
[30]Li X. Improved pyrogallol autoxidation method:a reliable and cheap superoxide-scavenging assay suitable for all antioxidants[J]. Journal of Agricultural and Food Chemistry,2012,60(25):6418-6424.

