一株产氢光合细菌的筛选及培养条件的优化*
张桂芝, 江 澜, 景佳佳
(重庆工商大学 环境与资源学院,重庆 400067)
氢能是人类未来的新能源[1],大规模的廉价的制氢技术开发已成为急需解决的问题[2]。微生物制氢是一条可行途径[3]。其成本低廉,环境友好,能在生产氢气的同时净化环境,因而被认为是目前最具发展潜力的制氢方法之一[4]。目前,对生物制氢的研究主要集中在厌氧发酵产氢[5]和光合生物产氢[6]。其中光合生物产氢是一类主要的研究方向[7]。光合细菌是一类具有原始光能合成体系的原核生物,光合细菌产氢是该类微生物利用太阳能分解有机物时维持质子和电子平衡的代谢过程[8]。光合细菌自身的产氢能力是光合细菌生物产氢技术的基础,为了得到高产氢效率的光合细菌,可以通过传统的方法从自然菌种中筛选高产菌种,为高效生物产氢技术提供优质菌种资源[9-10]。从猪粪废水中分离与纯化得到一株光合细菌。研究不同培养基、不同环境条件等因素对该光合细菌生长的影响,为后续产氢实验与应用研究奠定基础。
1 材料与方法1.1 实验材料1.1.1 菌种来源
以采集的重庆巴南区某养殖场猪粪废水为菌源。
1.1.2 培养基
光合细菌富集培养基配方:酵母膏0.8 g,NH4Cl1.0 g,CH3COONa3.0 g,NaHCO31.0 g,NaCl1.0 g,KH2PO40.2 g,MgCl2-6H2O 0.2 g,T.M1 mL,蒸馏水1 000 mL,pH值7.0。其中T.M储液的成分[11]:H3BO3(0.70 g/L),MnSO4-H2O(0.389 g/L),NaMoO4-2H2O(0.188 g/L),Cu(NO3)2-3H2O (0.01 g/L)。
固体平板培养基配方:琼脂25 g,CH3COONa1.5 g,NaCl1.0 g,NH4Cl0.5 g,NaHCO31.0 g,酵母膏0.1 g,MgCl20.2 g,KH2PO40.2 g,T.M储液1 mL,蒸馏水1 000 mL。
1.1.3 主要仪器
GYMJ-100高压灭菌锅,BH2000数码显微镜,UV-3100PC紫外可见分光光度计,Spx-250恒温光照培养箱,ZDS-10自动量程照度计,SP6890T气相色谱仪,FE20酸度计,HI9143溶解氧测定仪。
1.2 实验方法
1.2.1 光合细菌的分离和纯化
取2 mL猪粪废水于试管中,加入8 mL光合细菌富集液体培养基。胶塞密封,放置于恒温光照培养箱中,温度设为30 ℃,光照度设为3级,3 000 lux,培养5 d。再取培养液2 mL于试管中,加入8 mL光合细菌富集液体培养基。同样条件下培养,重复5次。得到细菌母液。将母液采用简单的平板划线法结合显微镜检测,分离得到光合厌氧产氢细菌。在培养后长出的单个微粉红色菌落上,分别挑取少许细胞接种在相同的固体平板培养基上,重复以上实验,直到分离得到纯化的菌落。最后将菌落接种至光合细菌富集液体培养基中进行扩大培养,气相色谱检测顶空气体,得到产氢光合细菌(图1)。
图1 扩大培养实验装置图Fig.1 Experimental apparatus
1.2.2形态学观察及生理生化实验
将分离得到的菌体作革兰氏染色和显微镜观察。活细胞吸收光谱的测定:取纯液体培养物5.0 mL,8 000 r/min离心5 min,用无菌生理盐水洗涤沉淀物,再离心、洗涤,反复3次,悬浮于60 %蔗糖溶液中,采用紫外可见分光光度计扫描菌悬液,记录吸光度值变化曲线。作细菌的糖发酵试验、甲基红试验。
1.2.3 培养基盐配比正交实验
初步培养表明培养基中盐配比显著影响细菌的生长,通改变细菌富集培养基配方中4种盐的浓度,设计四水平四因素正交试验。培养基盐配比正交试验因素水平表(表1)。
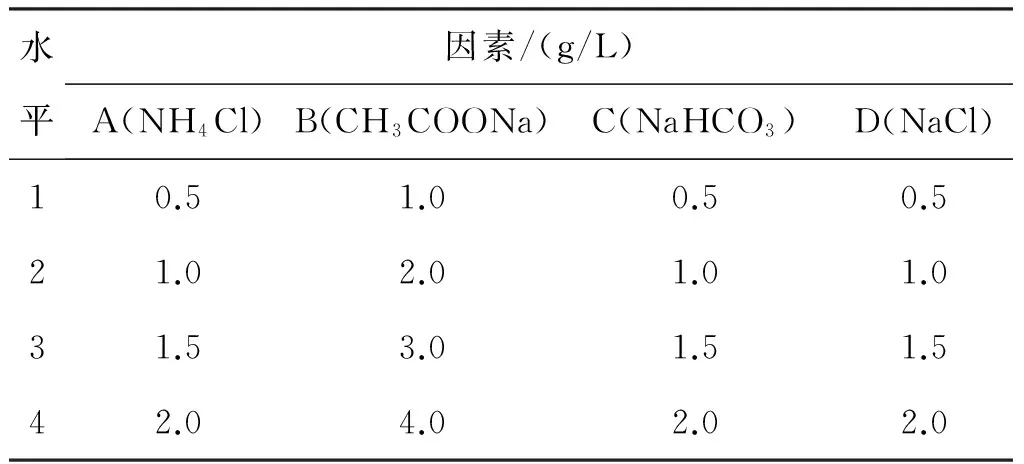
表1 正交实验因素水平表Table 1 The level-factors table of orthogonal test
按照扩大培养基基础配方及表1中水平将4种盐成分配制到16组50 mL比色管中。每支比色管中接种菌液5 mL,放置于光照培养箱中培养。
1.2.4 培养条件的优化
考察温度、pH、溶解氧、光照强度等因素对光合细菌生长影响,并进行动态培养与静态培养比较。
2 结果分析
2.1 光合细菌富集与染色观察
富集培养阶段,培养液呈深红棕色。经过纯化后,将菌种接种至扩大培养基中,在光照厌氧条件下,培养液开始时由透明变为微浑浊,继续培养,培养液将呈现淡红色,对数生长期之后培养液变为鲜红色,继续再培养后,菌液变为深红色,后期将出现团聚现象,并在培养瓶底部聚集成絮状或块状沉淀。在棉塞封口富氧情况下培养时,发现菌体也能生长,但生长缓慢,菌液颜色较浅,呈微红色。将对数生长期的菌体进行革兰氏染色观察,革兰氏染色阴性(图2)。

图2 革兰氏染色照片Fig 2 The photograph of Gram staining
2.2 光合细菌的生理生化试验及吸收光谱
菌体活细胞的特征吸收峰为370、494、525、580、793、852 nm。菌绿素A在803~890 nm有特征吸收峰,类胡萝卜素在450~530 nm有特征吸收峰。从图3可判断菌株含有菌绿素a和类胡萝卜素。糖发酵试验产气产酸、甲基红试验显微红色,呈弱阳性。结合其培养特征和吸收光谱特征,该菌与《伯杰细菌鉴定手册》所描述的光合细菌相吻合,初步鉴定该菌属于红螺菌科红螺菌属(Rhodospirillum),将其命名为PSB-ZF1。光合细菌菌株的鉴定除了采用传统的形态学特征与生理生化特征结合细菌鉴定手册鉴定外,还应结合其他的分类鉴定依据,如16S rRNA序列分析等分子生物学手段,只有这样才能鉴定到种[12],这有待于下一步研究。
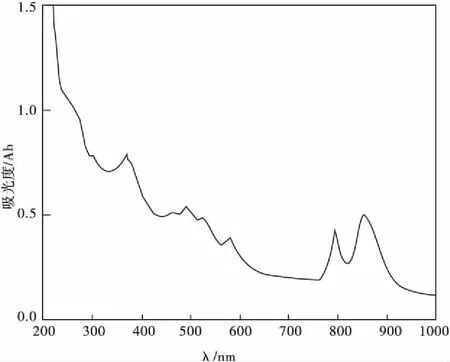
图3 菌体的光谱吸收曲线Fig 3 The spectrum absorption curve of bacteria
2.3 PSB-ZF1培养基配方的优化
实验条件设置为温度30 ℃,光照3 000 lux,pH 7.0,酵母膏含量0.2 g/L,接种量为5 mL,50 mL比色管培养,其他营养条件参照下列正交表。观测得到不同实验组菌液OD600值及极差分析如表2所示:

表2 正交实验结果表Table 2 The result of orthogonal experiment
从表2极差R值可以看出,因素影响光合细菌PSB-ZF1生长OD600值的主次顺序是:B>A>D>C,乙酸钠浓度对光合细菌生长的影响十分明显,碳酸氢钠浓度对生长的影响最小。培养基中的盐配比组成会影响细菌的生长,合适的培养基组成有益于微生物的生长,反之则抑制PSB-ZF1生长。根据表2均值大小,最佳培养基中盐的配方组合为A2、B3、C1、D2。
2.4 环境因素对PSB-ZF1生长的影响
2.4.1 温度对PSB-ZF1生长的影响
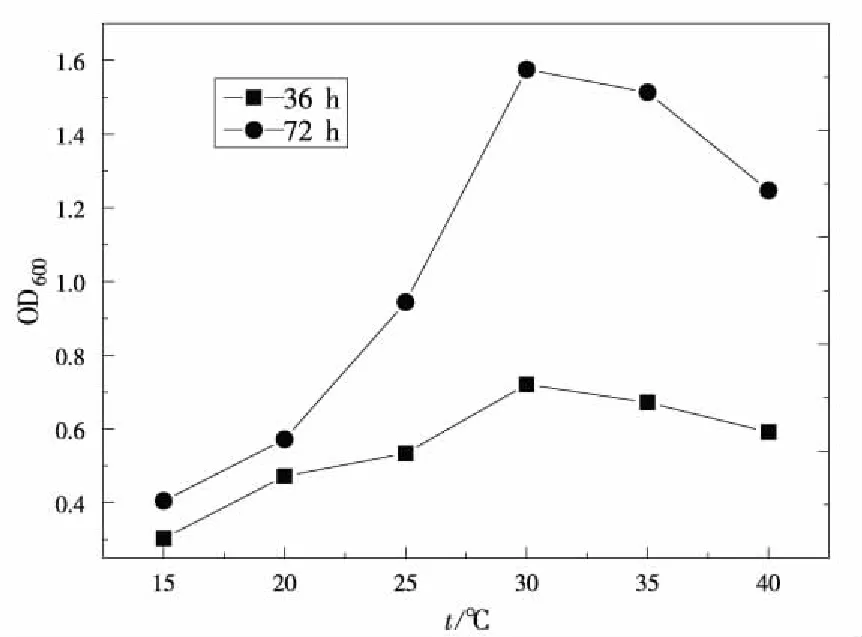
图4 不同温度下菌液吸光度值变化曲线Fig.4 The changing curve of OD600 versus culturetemperature
2.4.2 溶解氧含量的影响
采用通氧和通氮可控制培养基溶解氧浓度,通过不同溶氧量下PSB-ZF1培养物吸光度的测定以及对培养物状态及颜色的观察发现:光合细菌并不是严格厌氧细菌,在有氧条件下该微生物液可以生长。微氧或无氧环境更适合该微生物的生长,其中微氧环境又比完全无氧环境生长情况更好,说明PSB-ZF1生长还是需要微量氧气。通常厌氧细菌在低氧分压的条件下生长良好,而不能在空气或10%二氧化碳浓度下的固体培养基表面生长。PSB-ZF1不是专性厌氧菌,属于兼性厌氧细菌,即在较低氧分压条件下仍可以利用有机质进行氧化代谢和进行光合作用,比几乎完全厌氧条件下的代谢活动旺盛,同时,高氮气浓度下也不利于细菌的代谢生长,但相比富氧环境,PSB-ZF1生长要好。图5表明最佳溶解氧量为2.02 mg/L。
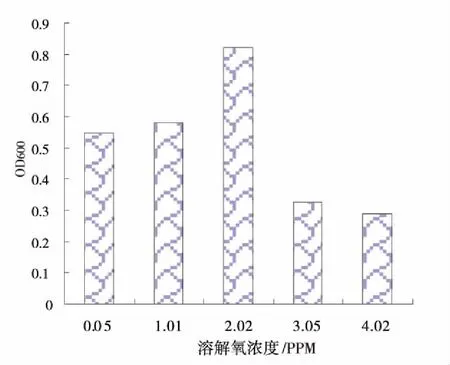
图5 不同溶解氧含量下培养72 h菌液吸光度值柱状图Fig 5 Bar chart of OD600 versus dissolved oxygenconcentration
2.4.3 pH值对PSB-ZF1生长的影响
当培养基初始pH为7时,PSB-ZF1的生长是最快的,偏碱性条件下的生长情况不如偏酸性条件好,而过酸或过碱环境都不利甚至抑制微生物的生长,如pH6.0和pH8.5时的OD值曲线所示。后期生长曲线都趋于平缓,表明PSB-ZF1生长速度减缓(图6)。由于氢离子浓度影响酶的活性,因此也影响PSB-ZF1的生长速率。pH对PSB-ZF1的生命活动的影响的可能原因为:一是强酸和强碱性条件会使蛋白质、核酸等生物大分子变性,影响其生物活性;二是pH的变化会引起PSB-ZF1细胞膜电荷变化,导致PSB-ZF1细胞吸收营养物质的能力改变;其三是pH的变化可能改变环境中营养物质的可给性。因此,可在PSB-ZF1培养过程应中加入pH缓冲系统,不断调整pH值,如磷酸氢钾/磷酸二氢钾系统。
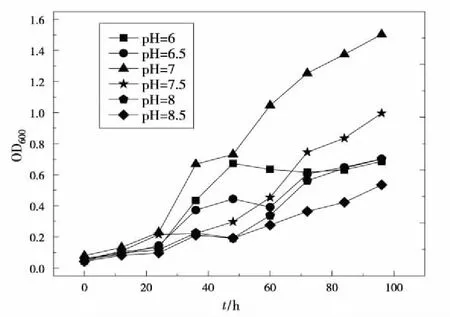
图6 不同培养基pH值条件下菌液吸光度值变化曲线Fig 6 OD600 change under different pH value of culture medium
2.4.4 光照强度对PSB-ZF1生长的影响
光能是光合细菌生长的必要条件,当光强过低或者无光照时,其生长将可能停止。固定其他培养条件,在不同的光照强度下,PSB-ZF1生长的快慢不同。不同光照强度下PSB-ZF1菌液OD值随时间变化曲线如图7所示:
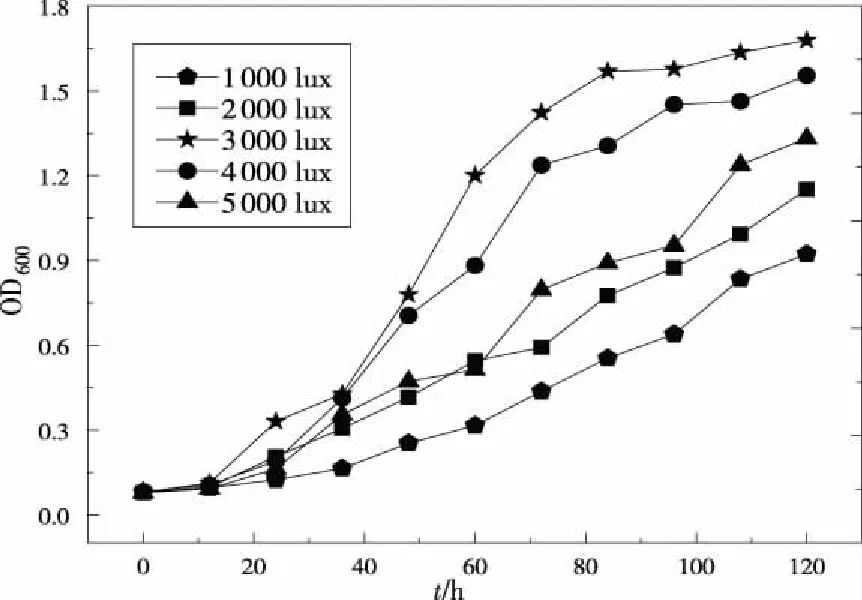
图7 不同光照强度下菌液吸光度值变化曲线Fig 7 OD600 change under different illumination intensities
由图7可发现,相比低的光照强度,高的光照强度有利于PSB-ZF1的生长,在低于3 000 lux光照强度条件下,由于供给细菌生长的光能不足,PSB-ZF1生长缓慢;但是在过高的光照强度下,由于入射光能超过了PSB-ZF1生长所需的最大吸收量,且对细菌生长的抑制作用也会影响PSB-ZF1的生长速率。在实验条件下,光照度控制在3 000 lux左右为宜。
2.4.5 动态培养与静态培养比较
动态培养PSB-ZF1的生长状况明显要好于静态组(图8)。静置培养时,由于重力沉降作用,PSB-ZF1及营养物都会出现分层现象,即大部分的PSB-ZF1都会集中在培养容器靠近底部的位置,就会造成局部的微生物过于集中,而营养物质供给不足,影响整个PSB-ZF1群落的生长。而搅拌就能消除这一现象,通过水利扰动,使营养物质均匀地分散在整个培养容器中,从而减小传质的扩散阻力,持续的供应PSB-ZF1生长。因而动态培养较静态培养更有利于PSB-ZF1的生长。
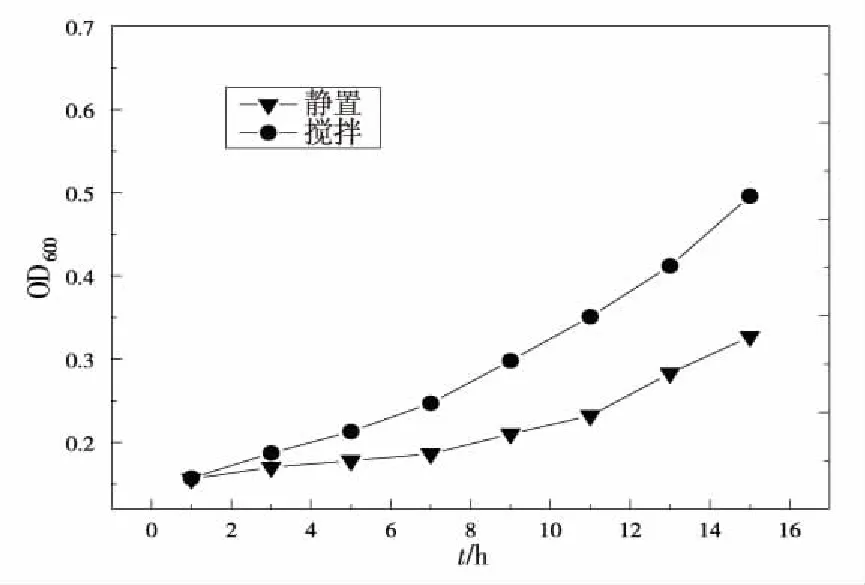
图8 静态培养与动态培养下菌液吸光度随时间变化曲线Fig.8 OD600 change under static and dynamic conditions
以最佳培养条件培养72 h,经测得PSB-ZF1培养液OD值,培养前为OD600为0.167,培养后OD600为1.998,颜色呈鲜红色,生物量充足,可以用于后续相关实验(图9)。

图9 培养前后菌液对比照片(A:0 h;B:72 h)Fig.9 Pictures of culture suspension for pre-culture andpost-culture(A:0 h;B:72 h)
3 结 论
从养殖场猪粪废水中通过富集、平板划线分离纯化得到一株光合细菌PSB-ZF1,初步鉴定该菌属于红螺菌科红螺菌属(Rhodospirillum)光合细菌。
光合细菌PSB-ZF1培养基优化配方为:氯化铵1.0 g,乙酸钠2.0 g,碳酸氢钠0.5 g,氯化钠1.0 g,磷酸二氢钾0.2 g,六水氯化镁0.2 g,T.M液1 mL,蒸馏水1 000 mL,酵母膏0.8 g时,能最大限度提供该PSB-ZF1生长的营养底物。
PSB-ZF1在搅拌状态下,接种量为10%,光强为3 000 lux,培养基溶解氧含量为2.0 mg/L、初始pH7.0时生长情况最佳。在此培养条件下培养72 h,可获得高浓度PSB-ZF1光合细菌菌液,利于后续产氢实验研究。
[1] 毛宗强.关注氢能发展氢能[J].求是,2005,16:60-61
MAO Z Q.Pay Attention to Hydrogen Energy and Develop Hydrogen Energy[J].Qiu Shi,2005,16:60-61
[2] 赵永志,蒙波,陈霖新,等.氢能源的利用现状分析[J].化工进展,2015,34 (9):3248-3255
ZHAO Y Z,MENG B,CHEN L X,et al.Utilization Status of Hydrogen Energy[J].Chemical Industry and Engine-eringe Progress,2015,34 (9):3248-3255
[3] 张桂芝.光合细菌生物制氢研究进展[J].重庆工商大学学报(自然科学版),2011,28(6):631-634
ZHANG G Z.Research Progress in Biological Hydrogen Production by Photosynthetic Bacteria[J].Journal of Chongqing Technology and Business University(Natural Science Edition),2011,28(6):631-634
[4] 赵微,张光明.光合细菌处理废水过程中生物产氢技术研究进展[J].中国生物工程杂志,2012,32(12):130-135
ZHAO W,ZHANG G M.Progress of Biological Hydrogen Production in Photosynthetic Bacteria Wastewater Treat-ment[J].China Biotechnology,2012,32(12):130-135
[5] 吴梦佳,隋红,张瑞玲.生物发酵制氢技术的最新研究进展[J].现代化工,2014,34(5):43-46
WU M J,SUI H,ZHANG R L.Recent Research Advances in Bio-fermentation Hydrogen Production Technology[J].Modern Chemical Industry,2014,34(5):43-46
[6] 任南琪,郭婉茜,刘冰峰.生物制氢技术的发展及应用前景[J].哈尔滨工业大学学报,2010,42(6):855-863
REN N Q,GUO W Q,LIU B F.Development and App-lication Prospect of Bio-hydrogen Production Technology[J].Journal of Harbin Institute of Technology,2010,42(6):855-863
[7] 孙绍晖,孙培勤,陈俊武.光生物制氢技术研究进展与经济分析[J].现代化工,2010,30(1):20-24
SUN S H,SUN P Q,CHEN J W.Development and Technoeconomic Analysis of Photobiological Hydrogen Production[J].Modern Chemical Industry,2010,30(1):20-24
[8] 朱章玉,俞吉安,林志新,等.光合细菌的研究及其应用[M].上海:上海交大出版社,1991
ZHU Z Y,YU J A,LIN Z X,et al.Research and App-lication of Photosynthetic Bacteria[M].Shanghai:Shanghai Jiaotong University Press,1991
[9] 李永峰,任南琪,杨传平,等.一株高效产氢产酸细菌的鉴定与产氢特性[J].中国环境科学,2005,25(2):210-213
LI Y F,REN N Q,YANG C P,et al.Preliminary Appraisal and H2-producing Characters of a Strain Highly Efficient H2-producing and Acid-producing Bacterium[J].China Environmental Science,2005,25(2):210-213
[10] 尤希凤.光合产氢菌群的筛选及其利用猪粪污水产氢因素的研究[D].郑州:河南农业大学,2005
NONG X F.Screening of Photosynthetic Bacteria Group and Study on Its Hydrogen Production Factors from Swine Manure Wastewater[D].Zhengzhou:Henan Agricultural University,2005
[11] 何春华.光合细菌的分离鉴定和生长条件优化及应用初探[D].哈尔滨:哈尔滨工业大学,2009
HE C H.Research on Separation,Identification,Growth Conditions of Photosynthetic Bacteria and Application Pre-test[D].Harerbin:Harerbin Institute of Techno-logy,2009
[12] 李永峰,任南琪,胡立杰,等.高效产氢新菌种的分离鉴定与16S rDNA全序列[J].哈尔滨工业大学学报,2005,37(3):287-289
LI Y F,REN N Q,HU L J,et al.Characterization of High and Sequence Analysis of 16S rDNA of a New Species of High Efficient Biohydrogen Production Anaerobe[J].Journal of Harbin Institute of Technology,2005,37(3):287-289

