基于吡啶-2,6-二甲酸的十三核钴(Ⅱ)配合物{[Co13(PYDC)16(H2O)24]·14H2O}6-的合成和结构
冯泳兰,许志锋,邝代治,唐斯萍,庾江喜,蒋伍玖,谭宇星,杨春林
(1.功能金属有机材料湖南省普通高等学校重点实验室,湖南 衡阳 421008;2.衡阳师范学院 化学与材料科学系,湖南 衡阳 421008)
许多功能配位合物具有微孔、电导、分子磁体、线性光学性质和催化作用以及生物活性等表现出潜在的应用价值而受到广泛重视[1]。钴是功能配位合物的重要材料,也为人体必需的微量元素之一,与含氮、氧等配基形成配位作用参与生命的活动。吡啶-2,6-二甲酸(H2PYDC)是一种生物体内具有生物活性的物质,也是一种灵活多变的多齿配体。吡啶-2,6-二甲酸与金属钴离子既可形成单平面型配合物Co(II)PYDC,也可形成双平面配合物Co(II)(PYDC)2[2-3],还能形成(PYDC)Co(II)(PYDC)Co(H2O)5[4-5]、及Co(II)(H2O)4桥联双[Co(II)(PYDC)2]配合物。我们在乙醇-水溶液中,CoCl2·6H2O与H2PYDC反应,获得一种Co(II)(PYDC)2和(PYDC)Co(II)(PYDC)Co(H2O)5及Co(II)(H2O)4[Co(II)(PYDC)2]2结构单元构筑的钴(II)配合物,本文报道标题配合物的合成及其晶体分子结构。
1 实验部分
1.1 试剂和仪器
所有试剂均为化学纯。IR用日本岛津FTIR-8700红外光谱仪(4 000 ~ 400 cm-1,KBr压片)测定;晶体结构用SMART APEX II型X射线衍射仪(德国布鲁克公司)测定。
1.2 配合物的合成
取0.237 9 g(1 mmol)CoCl2·6H2O和0.167 1 g(1 mmol) 吡啶-2,6-二甲酸,于30 mL 乙醇水(V/V1:1)溶液中,搅拌混合后,回流反应10 h,冷却,放置数天,析出红色晶体。IR(KBr):3 421.5(vs),3 421.5(vs),1 648.8(vs),1 593.1(vs),1 571.5(vs),1 458.1(m),1 433.0(m),1 396.4(vs),1 363.6(s),1 282.6(s),1 188.1(m),1 163.0(m),1 080.1(m),1 035.7(m),908.4(m),769.5(m),719.4(m),692.4(m),677.0(m),592.1(w),536.2(w),432.0(w),414.7(w)cm-1。
1.3 晶体结构分析
选取一颗0.15 mm×0.12 mm×0.10 mm的晶体,采用石墨单色化的MoKα射线(λ=0.071 073 nm),于293(2)K,以φ~ω扫描方式,在X-射线衍射仪上收集衍射数据。在1.72≤θ≤25.05°和h=-17~18,k=-14~18,l=-18~19范围内收集28 805个数据,其中独立衍射点12 930个(Rint=0.019 0),I>2σ(I)的可观察衍射为11 172个,晶体结构由直接法解出。由全矩阵最小二乘法结构精修。对全部非氢原子进行各向异性热参数修正,理论加氢法确定氢原子的位置坐标。最终收敛偏差因子为R1=0.043 7,wR2=0.108 6[对I>2σ(I)的衍射]和R1=0.051 0,wR2=0.114 5(对所有的衍射);w=1/[S2(Fo2)+(0.0499P)2+8.0856P],其中P=(Fo2+2Fc2)/3,S=1.040,(Δ/σ)max=0.001。衍射数据收集、还原用Saint程序,结构解析用Shelxtl程序完成。
配合物的晶体学数据和结构精修:实验式C112H124Co13N16O102,Fw=4 092.36,三单斜晶系,空间群P-1,晶胞参数:a=1.556 7(3) nm,b=1.574 1(4) nm,c=1.638 2(4) nm,=86.068(12),=69.026(11),β=76.402(12)°,V=3.665 8(15) nm3,Z=1,Dc=1.854 g/cm3,M r=4092.36,μ(MoKα)=1.558 mm-1,F(000)=2 075,R1=0.043 7,wR2=0.108 6[对I>2σ(I)的衍射]和R1=0.051 0,wR2=0.114 5(对所有的衍射)。差值Fourier图最高和最低残余电子密度峰(Δρ)max=1.803 e/nm3,(Δρ)min=-1.470 e/nm3。CCDC:695641。
2 结果与讨论
2.1 红外光谱
标题配合物的红外光谱特征较为明显。(1)在高频区3 423 cm-1处有一宽大的峰,表明有水分子的存在。(2)在1 648.8~1 593.1 cm-1出现尖锐而特强的多峰,应为羧基与钴(Ⅱ)离子配位后的羰基的反对称伸缩吸收峰,羰基的对称伸缩吸收峰在1 363.6 cm-1,尖锐而强的单峰,vas(CO2)未明显地向低频区移,vs(CO2)未明显地向高频区移,反对称与对称伸缩振动吸收峰波数差△v(CO2)=325~229 cm-1差别较大,说明在配合物中,羧酸根与中心钴(Ⅱ)离子以单齿配位[6]。(3)红外光谱分别出现536.2、432.0和414.7 cm-1弱吸收峰,表明分子有N-Co和O-Co键存在,与晶体分子结构相吻合。
2.2 晶体结构
配合物的主要键长和键角列于表1,分子结构如图1。从图1和键参数看出,配合物{[Co13(PYDC)16(H2O)24]·14H2O}6-由H2PYDC失去两个质子后,氮、氧原子与钴(Ⅱ)离子配位,形成晶体学不等价的钴(Ⅱ)配合物。整个配合物阴离子由一个{Co(II)(H2O)4[Co(II)(PYDC)2]2}2-(A)、四个[(PYDC)2Co(II)2(H2O)5](B)和两个[Co(II)(PYDC)2]2-(C)组成。其中(A)由一个μ-[Co(II)(H2O)4]2+桥联两个(C)的羰基,形成晶体学不对称结构单元的配合物,由(C)的一个羰基氧取代六水合钴(Ⅱ)离子的一个水分子,形成不对称结构单元的中性配合物[(PYDC)2Co(II)2(H2O)5](B)。另还存在14个未配位结晶水分子。
配合物(C)结构,PYDC2-的2个O原子和1个N原子与中心Co(Ⅱ)离子配位,每个三齿配体PYDC2-与Co(Ⅱ)离子形成2个由N→Co键稠合的五元环,除羧基氧(O37,O39,O41和O43)扭出平面外,Co(Ⅱ)PYDC几乎处于同一平面,2个Co(Ⅱ)PYDC平面交于中心金属原子,两平面并未垂直,形成83°二面角。N7-Co7-N8键角为172.9(2)°,因此,两平面并未形成线性中轴线,N7-Co7-O37键角为72.59(20)°,N7-Co7-O39键角为76.94(15)°,N8-Co7-O41键角为76.88(20)°,N8-Co7-O43键角为75.56(16)°,O37-Co7-O39键角为148.28(19)°,O41-Co7-O43键角为152.29(16)°,且对应的键长也各不相等,如Co7-N7键长0.202 7(13) nm,Co7-N8键长0.201 8(11) nm,因此,中心钴(II)离子与配基氧、氮原子配位形成六配位变形八面体构型,与钟新仙等报道的结构较类似[2]。
配合物(B)部分,H2PYDC失去质子后,2个PYDC2-基团以三齿的方式与Co(Ⅱ)离子配位,形成配合物(C)的结构之外,其中的1个PYDC2-利用羰基氧作为桥联配基原子,还与水合金属Co(Ⅱ)离子配位,羰基氧取代了其中一个水分子,成为>C=O→Co(Ⅱ)(H2O)5,这个与氧配位构成Co(Ⅱ)离子与配基原子组成六配位形式,赤道面是由4个水分子的O原子组成,PYDC2-基团的1个O29原子和另外1个水分子的O24原子占据轴向位置,Co5与氧组成的键长、键角均不相等,因此,中心钴(Ⅱ)的配位环境形成扭曲八面体构型[4]。
由1个配合物(C)利用羰基氧作为桥联配基原子与配合物(B)组装配合物(A),如图1(A),类似于O3取代了(C)轴向位置水分子的O24原子,构成由四水合钴(II)桥联双(C)的配合物阴离子{Co(II)(H2O)4[Co(II)(PYDC)2]2}2-(A),其Co1-O3和Co1-O3’键长0.204 1(4) nm,Co1-O1和Co1-O1’键长为0.206 8(4) nm,Co1-O2和Co1-O2’键长为2.112(4) nm,∠O3-Co1-O3、O1-Co1-O1’和O2-Co1-O2’键角180.0°;O3-Co1-O1和O3’-Co1-O1键角为88.92(19)°,O3-Co1-O1’和O3’-Co1-O1’键角为91.08(19)°,O3-Co1-O2和O3’-Co1-O2键长91.45(18)°,O3-Co1-O2’和O3’-Co1-O2键长88.55(18)°,因此,Co1与配基原子构成良好的对称,也是配合物(A)阴离子部分的对称中心。但虽是对称中心结构,Co1的配位环境仍为变形八面体构型。
在配合物中存在丰富而且较为复杂的氢键和弱作用力。在相邻的H和O原子之间,通过配体羧基的两个氧原子分别与配位水或结晶水形成氢键,氧原子之间,如O45-O10’、O50-O17(或34)’、O51-O16’形成弱作用力等,这些作用,把各个配位结构单元联结成三维结构。


图1 配合物的分子结构(结晶水、氢原子和氢键略)Fig.1 Molecular structure of the complex at 30 % probability thermal ellipsoids (crystal water,H atoms and hydrogen bonds are omitted for clarity)

表1 配合物的主要键长(×0.1nm)和键角(°)Table 1 Selected of Bond Lengths(×0.1nm) and Bond Angles(°) of the Complex
2.3 分子轨道组成研究
根据晶体结构的各原子坐标位置,考虑到配合物的对称性,为节省计算机时,除去晶体中的结晶水分子后,取其中一个结构对称单元分解成A、B和C三部分配合物,用于G98W[7]程序的rhf/sto-3g基组上,在P4计算机上进行量子化学单点计算,配合物计算涉及原子、原子基函和初始高斯函数分别为:A(75,334,1011);B(47,197,597);C(31,144,435)。
为探索配合物的成键特征,对配合物A、B和C的分子轨道进行系统分析,用参与组合的各类原子的轨道系数的平方和来表示该部分在分子轨道中的贡献,并经归一化,把配合物原子分为六部分:(a)Co原子,(b)配位氧原子O(1),(c)未配位氧原子O(2),(d)氮原子N,(e)碳原子C,(f)氢原子H。取前沿轨道及其附近轨道各5个,其分子轨道成份组成列于表2。
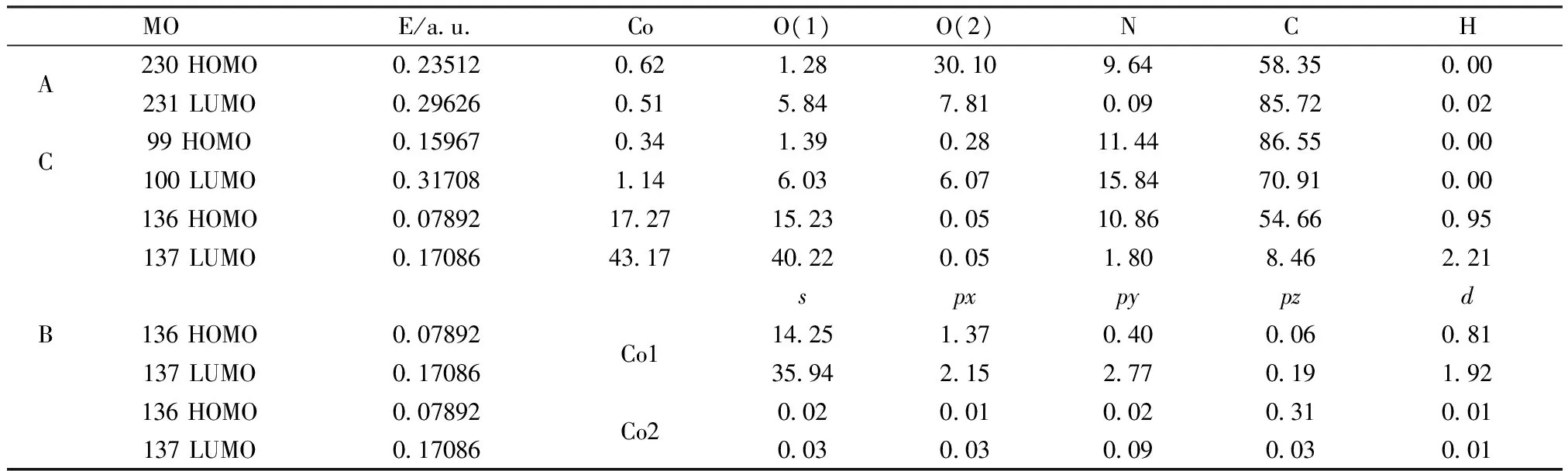
表2 配合物的前沿分子轨道组成(%)(rhf/sto-3g)Table 1 Frontier molecular orbitals composition of the complexes
从分子轨道成份表2可知,在前沿轨道及其附近轨道成份,有较明显变化,限于篇幅只讨论前沿分子轨道,配合物中,碳原子对HOMO的贡献最大A(58.35 %)、B(54.66 %)和C(86.55 %),其他原子对HOMO的贡献:A未配位羧基氧30.10 %、氮(9.64 %);B配位氧15.23 %、未配位羧基氧、氮(10.86 %);C配位氮11.44 %。氢原子对HOMO的贡献0~1 %。值得指出的是钴对HOMO的贡献,只在配合物B中达17.27 %,且B中配位氧、氮的贡献均较多,其中Co1原子比Co2原子对HOMO的贡献更多,并主要来自Co1原子的s轨道贡献14.25 %。
在最低未占分子轨道组成中,各原子对LUMO的贡献发生较明显变化,特别是B中钴原子对LUMO的贡献达43.17 %,其中35.94 %来自Co1原子s轨道的贡献。
[1] MATTHEWS R W,HAMER A D,HOOF D L,et al.Studies on metal carboxylates.Part IV.Pyridine-2,6-dicarboxylate complexes of cobalt(II),nickel(II),rhodium(II),and rhodium(III).Synthesis,spectral and magnetic properties,and a study of rhodium 3d binding energies by X-ray photoelectron spectroscopy[J].J.Chem.Soc.,Dalton Trans.,1973,10(10):1035-1038.
[2] 钟新仙,王湘利,蒋毅民.钴与吡啶-2,6-二甲酸配合物的合成与晶体结构[J].广西师范大学学报(自然科学版),2004,22(1):60-63.
[3] GOLENYA I A,BOYKO A N,KOTOVA N V,et al.Tris(2,2’-bipyridine-κ2N,N’) cobalt(Ⅲ) bis[bis(pyridine-2,6-dicarboxylato-κ3O2,N,O6) cobalt(Ⅲ)]perchlorate dimethyl formamide hemisolvate 1.3-hadrate[J].Acta Cryst.E.,2012,68:m1237-m1238.
[4] 刘彦波.吡啶-2,6-二羧酸桥联的双核钴配合物的磁性[J].分子科学学报,2009,25(1):69-71.
[5] 蒋毅民,王湘利,银秀菊.桥联双核配合物[(DPC)2Co2(H2O)]·2H2O的合成与晶体结构[J].无机化学学报,2004,20(2):175-177.
[6] NAKAMOTO K.无机和配合物的红外和拉曼光谱[M].黄德如,汪仁庆,译.北京:化学工业出版社,1991:255-265.
[7] AELEEN F,MICHAEL J F.Gaussian98 Users Reference [M].Gaussian:Inc.,Garnegie Office Park,Bldg.6 Pittaburgb,1999.
(编校 陈志敏)

