小角X射线散射波谱的定量作图分析法在作物淀粉研究中的应用
何 巍 范孝旭 王志峰 韦存虚,
小角X射线散射波谱的定量作图分析法在作物淀粉研究中的应用
何 巍1范孝旭1王志峰2韦存虚1,*
1扬州大学 / 江苏省作物遗传生理国家重点实验室培育点/ 粮食作物现代产业技术协同创新中心, 江苏扬州 225009;2扬州大学测试中心, 江苏扬州 225009
用小角X射线散射(small-angle X-ray scattering, SAXS)波谱可以定量分析淀粉的片层结构, 但缺乏波谱数据分析软件而且需要专业的数学公式推导, 严重制约了SAXS在淀粉研究中的应用。本文建立了一种简单的作图分析方法, 可定量测定SAXS波谱中的淀粉片层结构信息(峰强度、峰位置、半峰宽度和片层距离)。我们用该方法定量测定了不同晶体类型淀粉、不同直链淀粉含量的水稻淀粉、酸不溶淀粉和热不溶淀粉的SAXS波谱参数。结果表明, 片层结构与淀粉的植物来源有关, 而与淀粉晶体类型没有直接的相关性。相同植物来源的淀粉, 其直链淀粉含量与SAXS峰强度和半峰宽度呈显著负相关而与片层距离呈正相关。酸水解不影响淀粉片层厚度, 但明显改变片层峰强度和半峰宽度。加热处理也不影响淀粉片层厚度, 但破坏淀粉晶体结构导致片层峰强度随温度升高逐渐降低直至消失。该定量作图分析法操作简单、重复性好、可信度高, 可以在作物淀粉研究中广泛应用。
作物淀粉; 小角X射线散射波谱; 波谱参数; 定量作图分析法; 片层结构
淀粉是葡萄糖单元聚合而成的天然高分子化合物, 由直链淀粉和支链淀粉组装形成包含半晶体和无定形区域的颗粒结构, 一般分布在植物的种子、块根和块茎等贮藏组织中, 但也有少部分存在于植物的叶、茎、果实和花粉中。根据分子的链结构和聚集态结构, 一般可将淀粉结构分为5个层次, 即淀粉的颗粒结构(granule, 2~100 μm)、生长环结构(growth ring, 120~150 nm)、“止水塞”结构(blocklet, 20~500 nm)、无定形区和结晶区构成的片层结构(amorphous and crystalline lamellae, 8~11 nm)、支链淀粉和直链淀粉分子链结构(amylopectin and amylose chains, 0.1~1.0 nm)[1-2]。淀粉颗粒悬浮于水中, 在光学显微镜下呈现明暗相间的环带被称为生长环(growth ring), 分为半晶体生长环(semi-crystalline growth ring)和无定形生长环(amorphous growth ring)。半晶体生长环不易水解, 其厚度为120~400 nm, 由许多交替排列的9~10 nm基本单位构成, 每个基本单位都由晶体片层(crystalline lamella, 5~6 nm)和无定形片层(amorphous lamella, 2~5 nm)组成[3]。“止水塞”结构是由多个交替排列的晶体片层和无定形片层组成的球形结构, 其大小介于生长环与片层结构之间。一般认为, 支链淀粉分子侧链以双螺旋的形式组装成晶格, 形成晶体片层; 而直链淀粉分子和支链淀粉分子的分支点形成无定形片层[4]。无定形生长环容易被水解, 主要成分是直链淀粉, 其厚度不低于半晶体生长环[5]。
淀粉晶体片层与无定形片层交替排列构成半晶体生长环的基本重复单元, 而基本单元的尺寸进一步反映半晶体生长环的尺寸, 其中片层结构排列的一致性也反映淀粉内部结构的有序程度。研究淀粉片层结构有助于了解其结构特征、理解其亚或超分子聚合结构与淀粉特性的关系, 从而在作物品种培育和淀粉利用上提供重要信息[6]。目前研究淀粉片层结构主要依靠小角X射线散射(small-angle X-ray scattering, SAXS)技术, 该技术能够准确地探测物质内部几纳米至几百纳米范围的结构。淀粉SAXS波谱有一个主散射峰, 峰的位置与层状排列的结晶和无定形区域的平均总厚度相关[7]。此外, 峰强度取决于有序半结晶结构的量和/或相对于无定形背景的晶体和无定形薄片之间的电子密度差异[8]。峰的面积主要取决于淀粉半结晶区域的有序度[9]。目前对于该散射峰的分析主要基于原子物理学的公式拟合分析, 其操作不仅繁琐复杂, 而且需要专业的数学和软件编程专家共同参与才能完成, 严重制约了SAXS技术在淀粉研究中的应用。
为了促进SAXS技术在作物淀粉研究中的应用, 我们建立了一种简单方便的图形分析法, 用来定量获得SAXS波谱参数信息。我们利用该方法定量测定了不同晶体类型的植物淀粉、不同直链淀粉含量的水稻淀粉、酸水解和糊化的莲藕淀粉的SAXS波谱参数, 并分析了淀粉片层结构信息参数与淀粉晶体类型、直链淀粉含量、酸水解和糊化的关系。该研究结果为SAXS技术在作物淀粉研究中的应用提供重要的参考作用。
1 材料与方法
1.1 试验材料
水稻(L.)品种特青(Teqing)、龙特甫(Longtefu)、黄华占(Huanghuazhan)、桂花黄(Guihuahuang)、9311、日本晴(Nipponbare)、武香9915 (Wuxiang 9915)、武运粳8号(Wuyunjing 8)和玉米(L.)品种郑单958 (Zhengdan 958)的成熟种子采收于扬州大学试验田, 由扬州大学农学院刘巧泉教授提供。马铃薯(L.)块茎、莲藕(Gaertn.)根状茎、山药(Thunb.)根状茎、土茯苓(Roxb.)根状茎采购于扬州市农贸市场。
1.2 天然淀粉分离
参照Cai等[10]方法分离水稻淀粉, 参照Lin等[11]方法分离玉米淀粉, 参照Cai等[12]和Man等[13]方法分离马铃薯、莲藕、山药和土茯苓淀粉。
1.3 酸不溶莲藕淀粉制备
参照Cai等[14]方法制备酸不溶莲藕淀粉。将2 g天然莲藕淀粉悬浮于100 mL 2.2 mol L–1HCl溶液中, 于40°C分别水解4、8、12、16、24、36、48和72 h, 每天用手轻轻摇动3次以悬浮淀粉。水解结束后, 离心(5000×, 10 min)获得未水解淀粉残留物。将残留的淀粉用双蒸水清洗4次, 无水乙醇洗涤2次, 40°C干燥2 d, 然后被研磨成粉末, 过100目筛备用。
1.4 热不溶莲藕淀粉制备
参照Cai等[15]方法制备热不溶莲藕淀粉。将1 g天然莲藕淀粉悬浮于40 mL双蒸水中, 以1°C min–1的速度从室温加热至100°C, 期间每5 min用手摇动一次以悬浮淀粉沉淀。在50~100°C范围内, 每隔5°C将加热的淀粉取出, 立即放入冰浴中冷却, 4°C离心(5000×, 10 min)获得未溶解的淀粉沉淀。沉淀经双蒸水清洗4次, 无水乙醇洗涤2次, 40°C干燥2 d, 然后被研磨成粉末, 过100目筛备用。
1.5 淀粉SAXS波谱采集
采集淀粉SAXS波谱参考Yuryev等[8]方法并作一些修改。将天然、酸不溶和热不溶淀粉浸没在去离子水中, 4°C过夜, 5000×离心10 min, 弃上清液获得淀粉浆。用Bruker NanoStar型小角X射线散射仪分析, 采用Vantec 2000检测器和针孔准直技术, X射线源为铜旋转阳极(直径0.1 mm), 电压50 kV, 功率30 W, 装有交叉耦合Gobel镜, 产生波长为1.5418 Å的Cu Kα射线。光学部件和样品室均处于真空状态, 以减少空气散射。在X射线散射分析时, 保证淀粉浆在密封的容器内, 以防止水分散失。用DIFFRACplusNanoFit软件处理SAXS波谱, 获得波谱原始数据。
1.6 数据分析
数据均为平均值±标准偏差, 用SPSS 19.0统计分析软件进行方差分析(Tukey法,<0.05)和皮尔逊双变量相关分析。
2 结果与分析
2.1 淀粉SAXS波谱定量作图分析方法的建立
利用SAXS波谱数据中的散射角和散射强度数据作图, 并利用Photoshop图形软件进行波谱参数的定量测定(图1), 详细过程如下。(1)作图前先将导出的波谱数据中的散射强度进行等比例调整, 将所有样品数据以q = 0.2 Å–1处的散射强度为20作基准, 以排除样品之间淀粉浓度的差异。(2)利用常规数据作图软件(如Excel, Origin), 以散射角度(0.015~0.15 Å–1)为横坐标, 散射强度(0~1000)为纵坐标建立SAXS波谱图。(3)利用Photoshop图形软件打开波谱图, 选取Photoshop直线工具, 绘制一条与波谱峰底部两侧相切的基线(直线AB)。(4)从波谱峰最高点向X轴绘制一条垂直的峰位置线(线段CD)。(5)峰最高点至基线之间的峰位置线线段为峰强度线(线段CE)。(6)在峰强度线一半处(交点F)绘制与基线平行并与波谱峰两侧相交的线段为半峰宽线(线段GH)。(7)利用Photoshop测量工具, 测量峰强度线线段CE的长度与纵坐标线段IJ的长度, 其中线段IJ的选取可根据实验需要自行调整, 图1中线段IJ选取的长度对应的散射强度差值为200。(8)根据线段CE和线段IJ长度的比值, 并参考线段IJ对应的散射强度差值, 换算成峰强度(Imax= CE/IJ×200)。(9)利用Photoshop信息工具, 获取交点G对应于画布的横向标尺刻度值(XG)和交点H对应于画布的横向标尺刻度值(XH), 而两者的差值(XH-XG)即为线段GH的水平投影长度。(10)测量横坐标线段KL长度, 其中线段KL的选取可根据实验需要自行调整, 图1中线段KL选取的长度对应的散射角度差值为0.02 Å–1。(11)根据线段GH的水平投影长度和线段KL长度的比值, 并参考线段KL对应的散射角度差值, 换算成半峰宽[ΔS = (XH-XG)/KL×0.02 Å–1]。(12)利用Photoshop测量工具, 测量坐标原点(O)至峰位置线的水平距离(线段OD的长度), 并参考横坐标原点值(0.015 Å–1)和线段KL对应的散射角度差值(0.02 Å–1), 换算出波谱峰对应的散射角度(Smax= 0.015+OD/ KL×0.02 Å–1)。(13)根据公式(d = 2π/Smax)[8-9], 计算淀粉半晶体片层的厚度(d)。
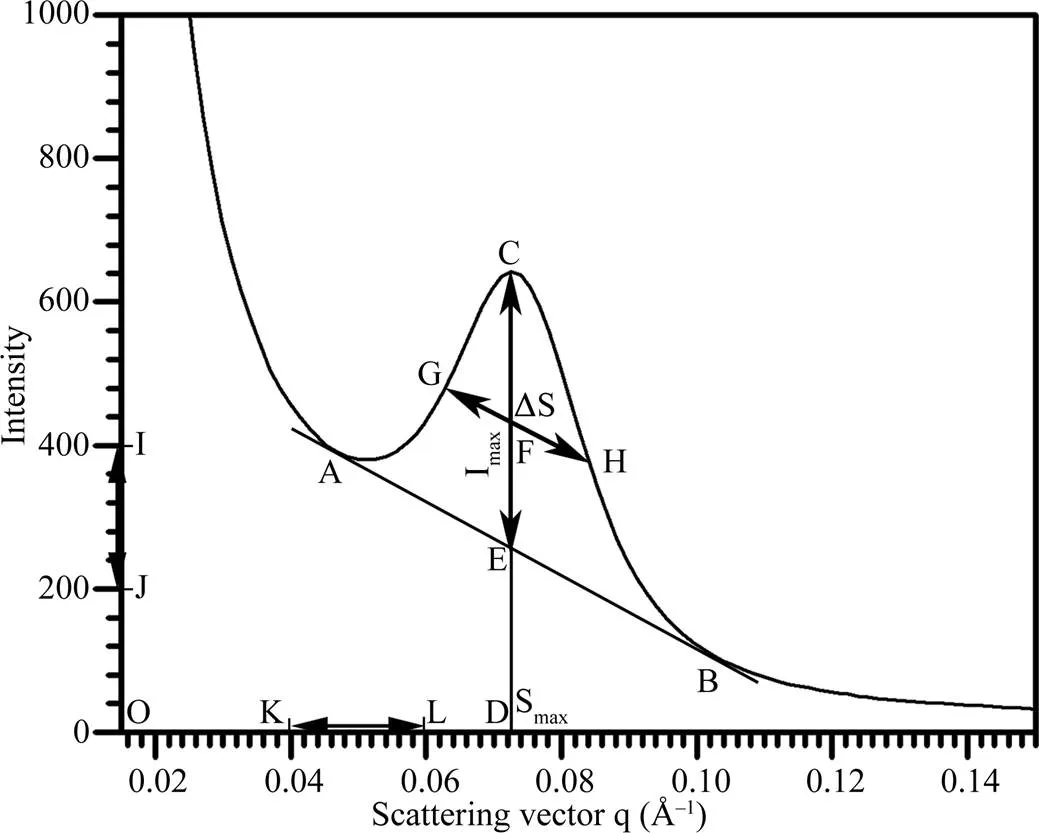
图1 淀粉SAXS波谱定量作图分析方法示意图
2.2 不同晶体类型淀粉的SAXS波谱参数
根据X-射线衍射波谱可将不同植物来源的淀粉分为A-、B-和C-型晶体淀粉[16]。为了分析淀粉片层结构与晶体类型的关系, 本文选取水稻和玉米淀粉代表A-型晶体、马铃薯和土茯苓淀粉代表B-型晶体、莲藕和山药淀粉代表C-型晶体, 对它们的SAXS波谱(图2)进行定量作图分析, 获得的波谱参数见表1。6种淀粉的峰强度分布在157.1~357.4, 散射峰位置分布在0.061~0.068 Å–1, 半峰宽度分布在0.015~ 0.023 Å–1, 片层距离分布在9.3~10.3 nm。根据6种淀粉的波谱参数结合它们的晶体类型表明, SAXS波谱参数与淀粉晶体类型无明显相关性, 这可能与植物的来源相关。
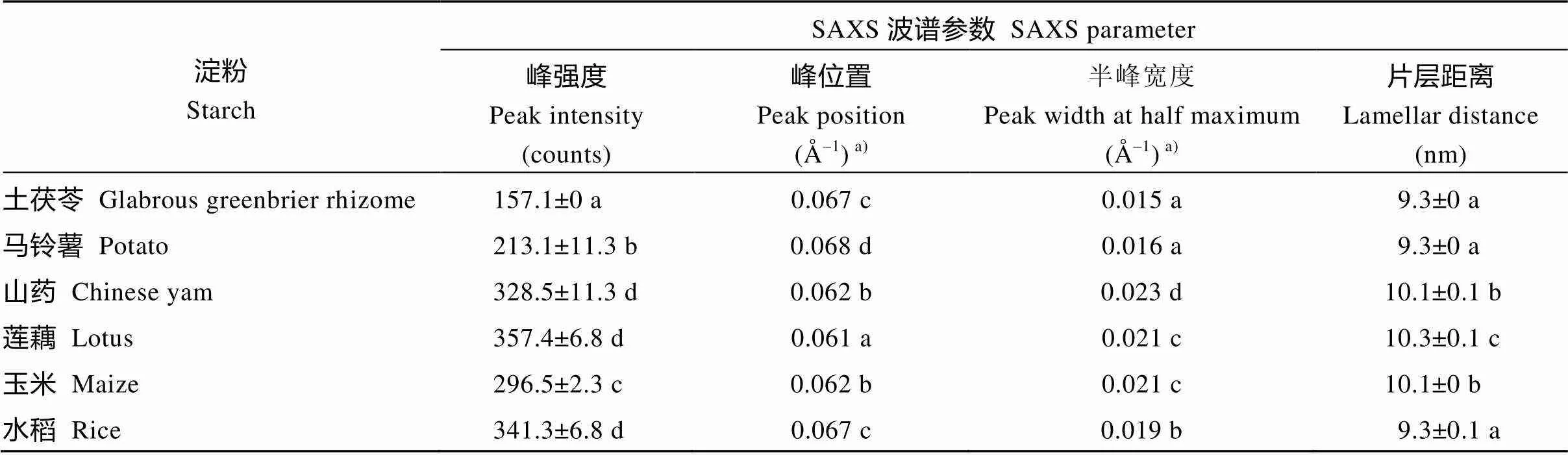
表1 不同植物来源淀粉的SAXS波谱参数
同一列数据后标以不同字母的数据在=0.05水平上差异显著。a)标准偏差的值太低被省略(<0.001)。
Values followed by different letters within the same column are significantly different at the 0.05 probability level.a)The SD is omitted due to its very low value (<0.001).
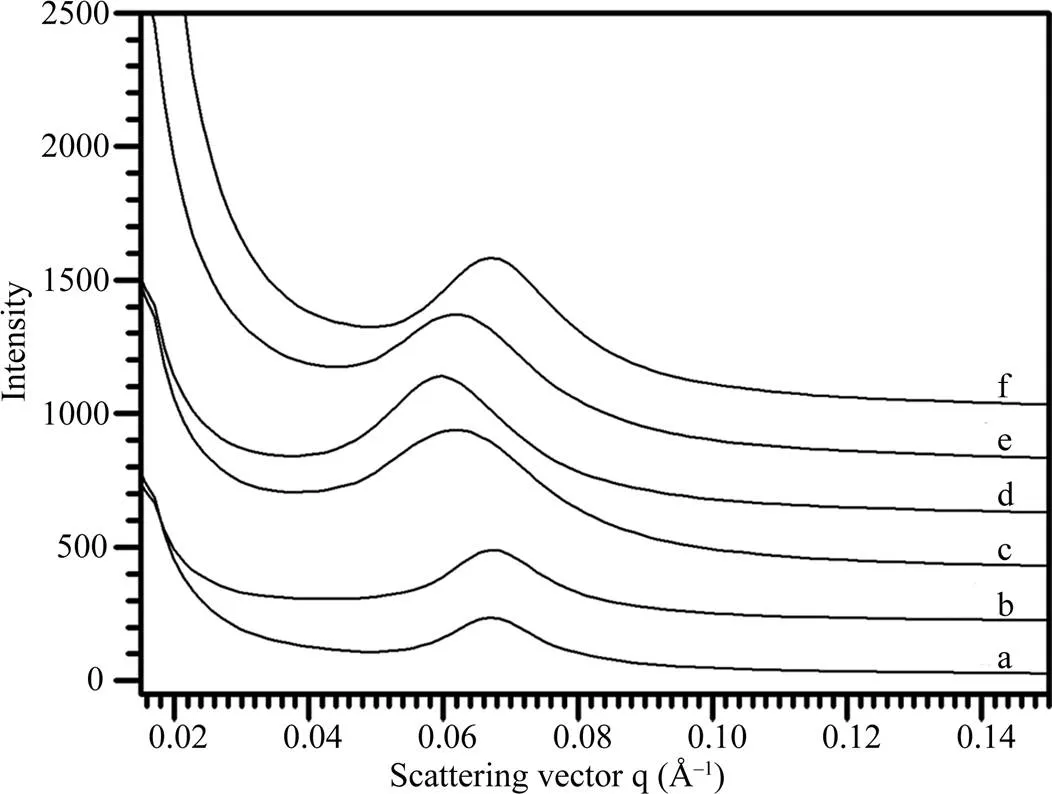
图2 不同植物来源淀粉的SAXS波谱图
a: 土茯苓; b: 马铃薯; c: 山药; d: 莲藕; e: 玉米; f: 水稻。
a: glabrous greenbrier rhizome; b: potato; c: Chinese yam; d: lotus; e: maize; f: rice.
2.3 不同直链淀粉含量淀粉的SAXS波谱参数
为研究直链淀粉含量与淀粉片层结构的关系, 选取不同直链淀粉含量的普通水稻淀粉为材料, 对它们的SAXS波谱(图3)进行定量作图分析, 获得的波谱参数见表2。这8种淀粉的峰强度分布在286.4~464.8, 散射峰位置分布在0.065~0.069 Å–1, 半峰宽度分布在0.018~0.021 Å–1, 片层距离分布在9.1~9.7 nm。以凝胶渗透色谱测得日本晴、武香9915、9311、武云粳8号、黄华占、桂花黄、龙特甫和特青淀粉的直链淀粉含量分别为15.5%、17.5%、18.0%、18.5%、18.7%、23.3%、26.3%和26.9%[10]。相关性分析表明, 8种水稻淀粉的直链淀粉含量与它们的峰强度(=-0.803,<0.05)、峰位置(=-0.786,<0.05)和半峰宽度(=-0.787,<0.05)呈显著负相关, 而与片层距离呈显著正相关(= 0.758,<0.05)。
2.4 酸不溶淀粉的SAXS波谱参数
利用盐酸对莲藕淀粉进行酸水解, 对酸水解不同时间后的淀粉残留SAXS波谱(图4)进行定量作图分析, 获得的波谱参数见表3。在整个酸水解过程中, 淀粉的散射峰位置和片层距离没有发生变化, 半峰宽度随着水解时间的延长而降低。峰强度在水解前期逐渐增加, 其中酸水解的前4 h显著增加, 然后在水解4 h与8 h之间缓慢增加; 水解8 h之后, 峰强度逐渐降低, 以至于水解48 h后看不到明显的散射峰。这些结果表明, 在酸水解早期阶段片层峰的强度增大, 而在酸水解的后期阶段片层峰的强度减小。
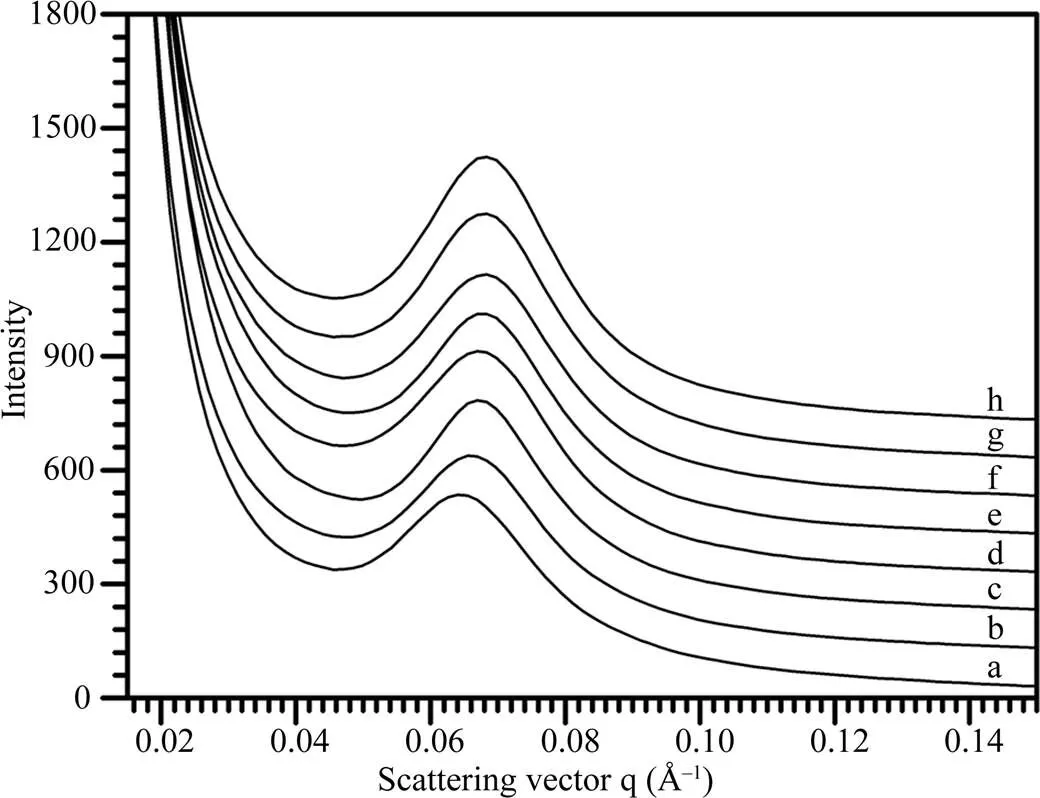
图3 不同直链淀粉含量稻米淀粉的SAXS波谱图
a: 龙特甫; b: 桂花黄; c: 特青; d: 武香9915; e: 黄华占; f: 武运粳8号; g: 9311; h: 日本晴。
a: Longtefu; b: Guihuahuang; c: Teqing; d: Wuxiang 9915; e: Huanghuazhan; f: Wuyunjing 8; g: 9311; h: Nipponbare.
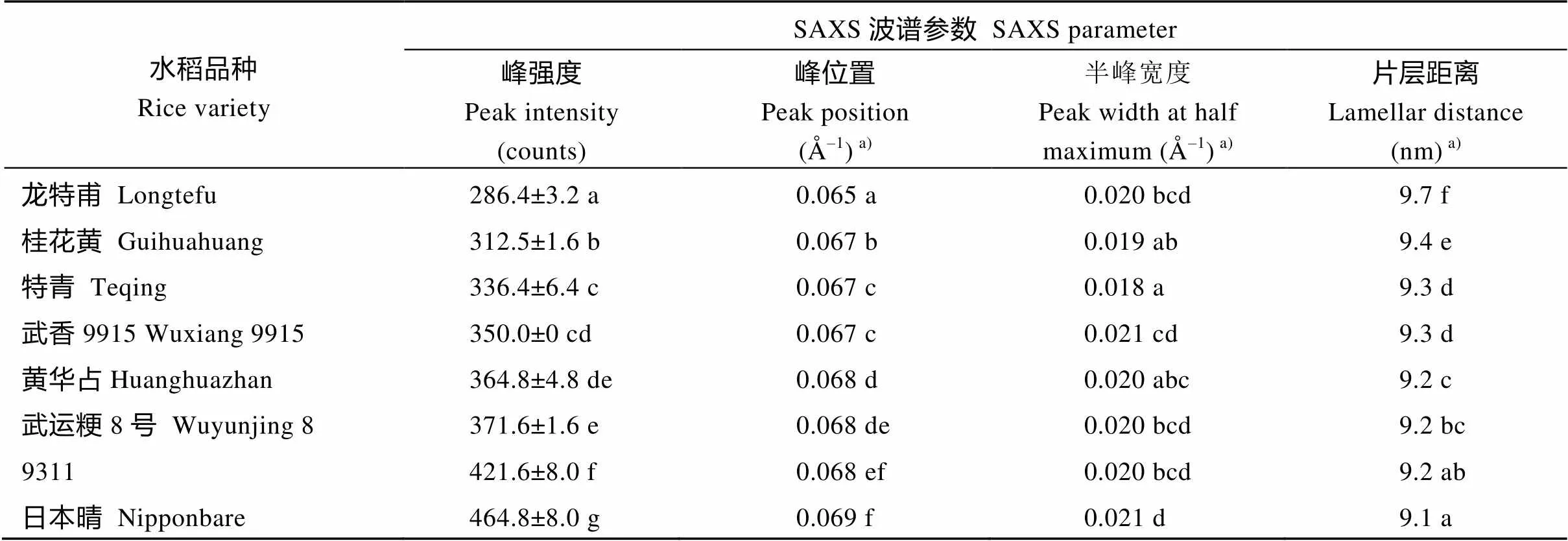
表2 不同直链淀粉含量水稻淀粉的SAXS波谱参数
同一列数据后标以不同字母的数据在=0.05水平上差异显著。a)标准偏差的值太低被省略。
Values followed by different letters within the same column are significantly different at the 0.05 probability level.a)The SD is omitted due to its very low value.
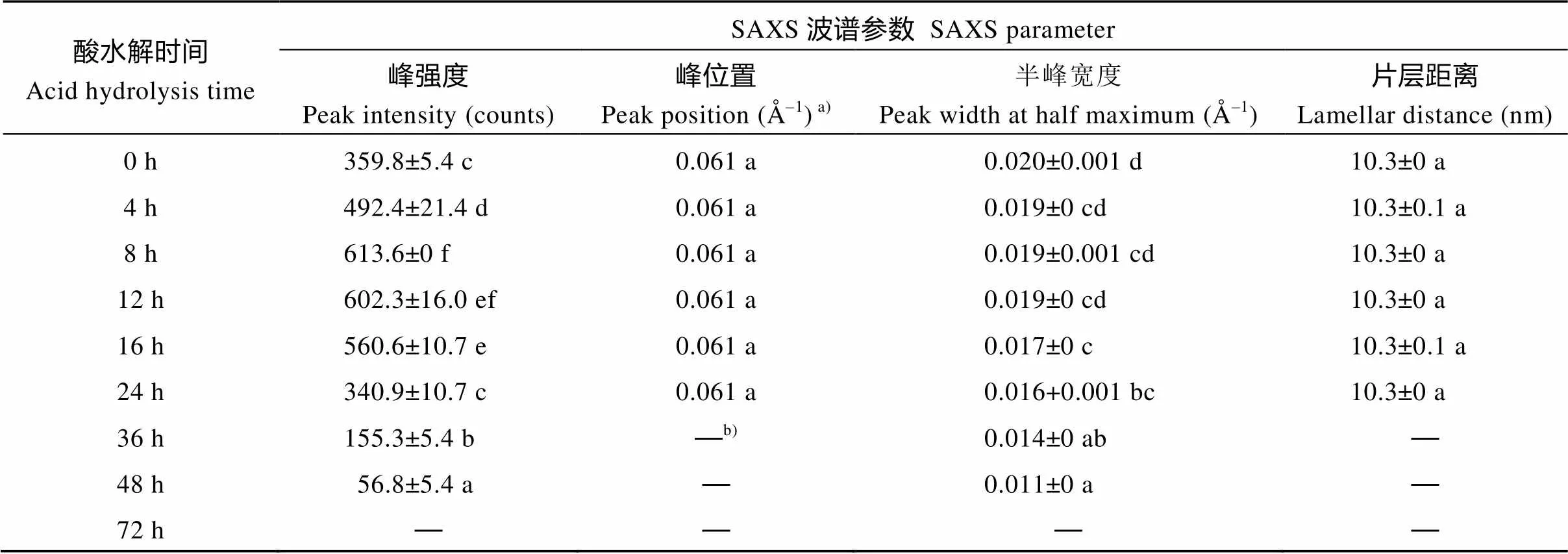
表3 酸不溶莲藕淀粉SAXS波谱参数
同一列数据后标以不同字母的数据在=0.05水平上差异显著。a)标准偏差的值太低被省略(<0.001)。b) “—”未检测到数据。
Values followed by different letters within the same column are significantly different at the 0.05 probability level.a)SD is omitted due to its very low value (<0.001).b) “—”data are not detected.
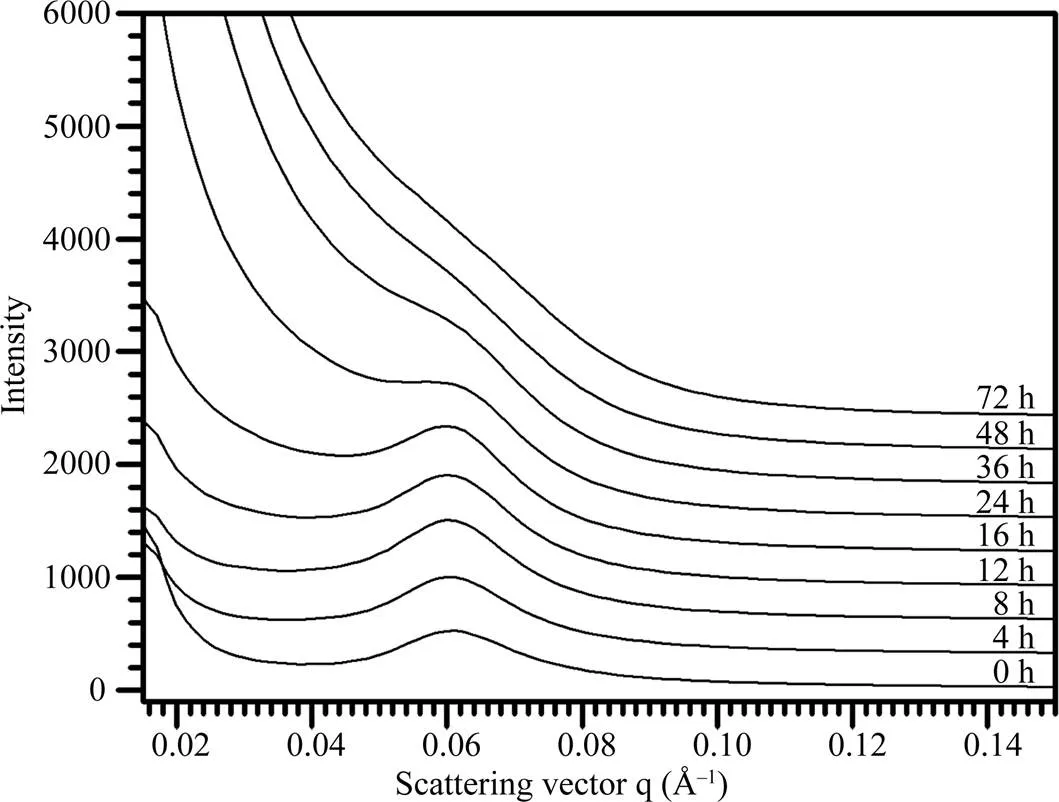
图4 酸不溶莲藕淀粉的SAXS波谱图
2.5 热不溶淀粉的SAXS波谱参数
淀粉在水中被加热糊化, 晶体片层被破坏。对不同温度处理下的淀粉SAXS波谱(图5)进行定量作图分析, 获得的波谱参数见表4。在整个糊化过程中, 淀粉的散射峰位置和片层距离没有变化, 峰强度和半峰宽度随温度的升高而降低。当温度超过75°C时, 淀粉完全被糊化, 因此无法观察到SAXS散射峰。
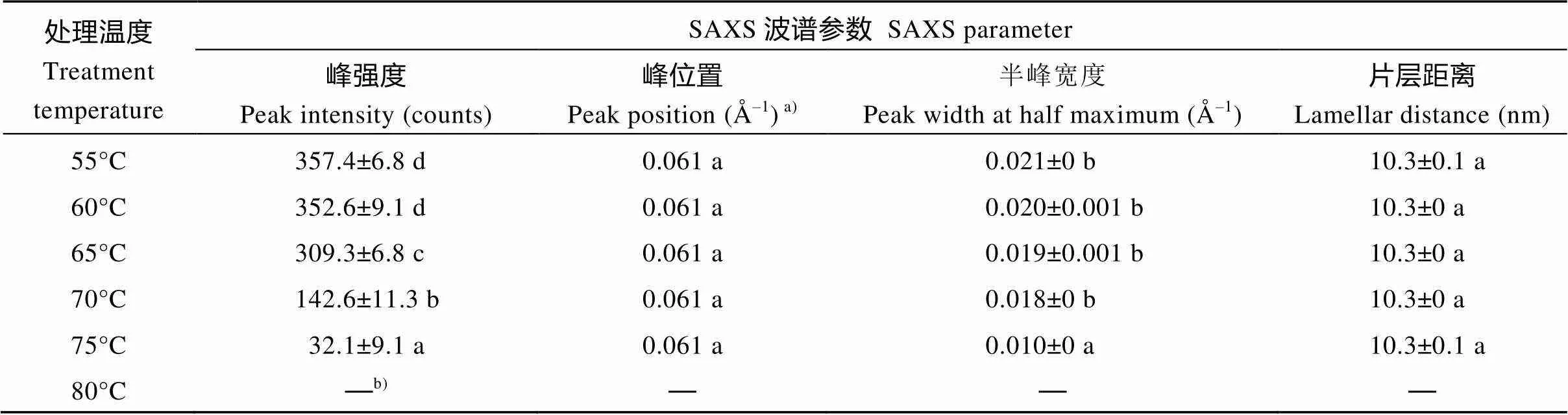
表4 热不溶莲藕淀粉的SAXS波谱参数
同一列数据后标以不同字母的数据在=0.05水平上差异显著。a)标准偏差的值太低被省略(<0.001)。b)“—”未检测到数据。
Values followed by different letters within the same column are significantly different at the 0.05 probability level.a)SD is omitted due to its very low value (<0.001).b)“—”: data are not detected.
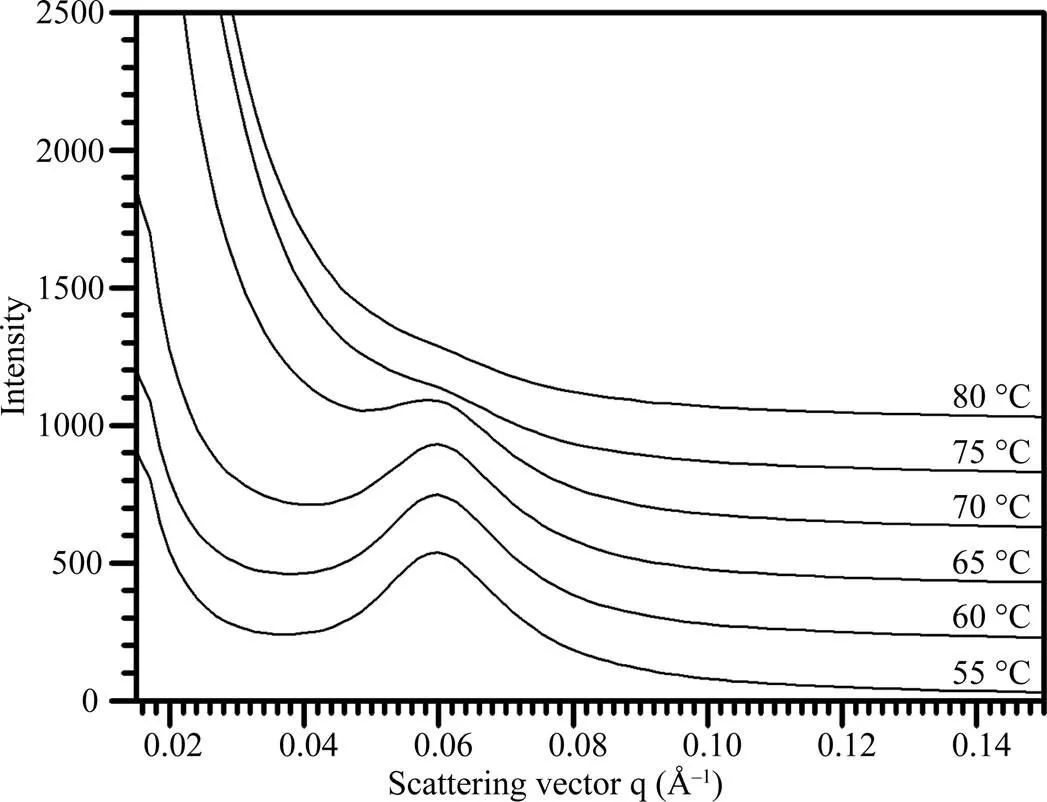
图5 热不溶莲藕淀粉的SAXS波谱图
3 讨论
淀粉SAXS波谱在散射角度为0.06 Å–1附近出现一个明显的主散射峰, 被认为是由支链淀粉侧链形成的交替排列的晶体和无定形片层结构产生的[9]。峰的位置取决于片层的大小, 并且在不同植物淀粉中可能不同, 而峰强度和峰面积主要取决于淀粉半结晶区域的有序度[9]。一般来说, 有两类方法用于从SAXS波谱数据中提取淀粉结构信息参数。一类方法基于直接观察到的强度分布的最小二乘法拟合, 而另一类基于傅里叶变换的强度分布的相关函数和界面分布函数[9,17]。2种方法虽然可以全面分析获取淀粉的结构信息, 但都需要专业的数学和软件编程专家参与, 制约了SAXS技术在淀粉结构研究中的应用。在国内, 王维等[18]基于原子物理学原理设计了SAXS分析软件(SAXS1.0), 可完成SAXS数据的Guinier作图、Porod作图以及分形维数的分析。虽然该软件可以用于分析淀粉SAXS数据获取结构信息, 但是由于软件本身缺乏稳定性, 操作步骤复杂, 拟合误差大等诸多原因, 在国内仍未得到广泛的应用。基于上述原因, 我们建立了一种作图分析方法, 可以定量测定SAXS波谱的峰强度、峰位置、半峰宽度和片层距离。与国内外的其他方法相比, 该方法具有操作简单, 重复性好, 可信度高等诸多优点, 可以广泛应用于原淀粉、水解淀粉和糊化淀粉等的片层结构研究中。
支链淀粉的侧链形成晶体片层, 一般认为, 短的侧链易形成A-型晶体, 而长的侧链易形成B-型晶体[16]。A-型淀粉仅含有A-型晶体, B-型淀粉仅含有B-型晶体, 而C-型淀粉目前认为包含A-和B-型晶体[16]。本文对不同植物来源的A-型淀粉(水稻和玉米淀粉)、B-型淀粉(马铃薯与土茯苓淀粉)、C-型淀粉(莲藕和山药淀粉)的SAXS波谱分析发现, 散射波谱峰的参数与淀粉晶体类型没有显著的相关性, 而与植物的来源可能有关, 这与Jenkins等[19]结果相一致。Cai等[20]对豌豆、蚕豆、山药、荸荠4种C-型淀粉研究表明, 它们的结构特性与功能特性均存在明显的差异。这些研究结果进一步表明, 淀粉的片层结构与晶体类型并不相关, 而是取决于不同的植物来源。Lin等[21]将莲藕淀粉按大小分为不同的颗粒级分, SAXS波谱分析表明, 淀粉半晶体片层厚度与颗粒大小无相关性, 而散射峰强度与颗粒大小呈显著的负相关。Salman等[22]对小麦淀粉的研究却表明, 大淀粉粒的半晶体片层厚度大于小淀粉粒的半晶体片层厚度, 散射峰强度也表现一定的差异。因此, 不同植物来源的淀粉, 其大小、形态、分子结构和晶体特性都有明显差异[23], 这些差异可能共同导致它们具有不同的片层结构。
本文利用作图分析法对不同直链淀粉含量的普通水稻淀粉的SAXS波谱分析表明, 散射峰的峰强度与直链淀粉含量呈显著的负相关, 这与Bocharnikova等[24]和Koroteeva等[25]结果相一致。淀粉半晶体片层由无定形片层和晶体片层交替排列形成, 前者主要由直链淀粉和支链淀粉的分支点组成, 后者由支链淀粉的侧链组成[8-9]。SAXS波谱的峰强度反映淀粉晶体和非晶体区域之间的电子密度差异[8]。直链淀粉含量增加, 导致淀粉晶体和非晶体区域之间的电子密度降低, 表现在SAXS波谱峰强度降低, 其影响因素可能是: 直链淀粉大分子与支链淀粉A链形成共结晶, 直链淀粉在无定形片层中的含量增加, 以及直链淀粉在晶体和无定形片层内部沿着片层层叠方向积累[8]。本文结果表明, 酸水解不影响淀粉片层距离; 但在酸水解的早期阶段, 淀粉SAXS波谱峰的峰强度逐渐增高, 而在酸水解后期阶段, 峰强度逐渐降低直至散射峰消失, 该结果与Wang等[26]研究相一致。Wang等[26]对豌豆淀粉进行酸水解研究揭示, 在水解的初始阶段非晶区更快的降解提高淀粉的相对结晶度, 这与散射峰强度显著增加保持一致; 随着非结晶区降解完成, 结晶和无定形区域的水解速率几乎相同, 从而造成相对结晶度缓慢增加, 这与散射峰强度缓慢增加保持一致。因此, 在酸水解的早期阶段, 酸优先降解无定形片层, 导致晶体片层和无定形片层之间的电子密度增加, 引起峰强度的增加; 而在酸水解的后期, 酸主要水解晶体片层, 晶体片层的降解导致峰强度降低; 当晶体片层完全被酸降解后, 淀粉散射波谱的散射峰消失[9,26]。本文结果还表明, 随着糊化温度的升高, 散射峰的峰强度逐渐降低直至消失, 这与Cameron等[5]结果相一致。淀粉糊化过程中, 随着温度的升高, 淀粉结晶区域被破坏, 晶体和无定形片层之间的电子密度降低; 当加热温度达到微晶熔融温度时, 晶体和无定形片层有序排列结构丧失, 导致糊化淀粉的散射峰消失[27]。
4 结论
淀粉SAXS波谱的作图分析法能够定量测定散射峰的峰强度、峰位置、半峰宽度和片层距离, 获得淀粉片层结构信息。利用该方法测定和比较分析不同晶体类型淀粉、不同直链淀粉含量的水稻淀粉、酸水解淀粉和糊化淀粉的SAXS波谱参数, 具有操作简单、重复性好、可信度高等优点, 可以广泛应用于作物淀粉片层结构的研究。
[1] Gallant D J, Bouchet B, Baldwin P M. Microscopy of starch: evidence of a new level of granule organization., 1997, 32: 177–191
[2] Tran T T B, Shelat K J, Tang D, Li E P, Gilbert R G, Hasjm J. Milling of rice grains: the degradation on three structural levels of starch in rice flour can be independently controlled during grinding., 2011, 59: 3964–3973
[3] Vandeputte G E, Delcour J A. From sucrose to starch granule to starch physical behaviour: a focus on rice starch., 2004, 58: 245–266
[4] Donald A M. Plasticization and self assembly in the starch granule.,2001, 78: 307–314
[5] Cameron R E, Donald A M. A small-angle X-ray scattering study of the annealing and gelatinization of starch., 1992, 33: 2628–2635
[6] Sanderson J S, Daniels R D, Donald A M, Blennow A, Engelsen S B. Exploratory SAXS and HPAEC-PAD studies of starches from diverse plant genotypes., 2006, 64: 433–443
[7] Waigh T A, Perry P, Riekel C, Gidley M J, Donald A M. Chiral side-chain liquid-crystalline polymeric properties of starch., 1998, 31: 7980–7984
[8] Yuryev V P, Krivandin A V, Kiseleva V I, Wasserman L A, Genkina N K, Fornal J, Blaszczak W, Schiraldi A. Structural parameters of amylopectin clusters and semi-crystalline growth rings in wheat starches with different amylose content., 2004, 339: 2683–2691
[9] Blazek J, Gilbert E P. Application of small-angle X-ray and neutron scattering techniques to the characterisation of starch structure: a review., 2011, 85: 281–293
[10] Cai J W, Man J M, Huang J, Liu Q Q, Wei W X, Wei C X. Relationship between structure and functional properties of normal rice starches with different amylose contents., 2015, 125: 35–44
[11] Lin L S, Guo D W, Zhao L X, Zhang X D, Wang J, Zhang F M, Wei C X. Comparative structure of starches from high-amylose maize inbred lines and their hybrids., 2016, 52: 19–28
[12] Cai C H, Cai J W, Zhao L X, Wei C X.gelatinization of starch using hot stage microscopy., 2014, 23: 15–22
[13] Man J M, Cai J W, Cai C H, Xu B, Huai H Y, Wei C X. Comparison of physicochemical properties of starches from seed and rhizome of lotus., 2012, 88: 676–683
[14] Cai J W, Cai C H, Man J M, Yang Y, Zhang F M, Wei C X. Crystalline and structural properties of acid-modified lotus rhizome C-type starch., 2014, 102: 799–807
[15] Cai C H, Cai J W, Man J M, Yang Y, Wang Z F, Wei C X. Allomorph distribution and granule structure of lotus rhizome C-type starch during gelatinization., 2014, 142: 408–415
[16] Cheetham N W H, Tao L. Variation in crystalline type with amylose content in maize starch granules: an X-ray powder diffraction study., 1998, 36: 277–284
[17] Pikus S. Small-angle X-ray scattering (SAXS) studies of the structure of starch and starch products., 2005, 13: 82–86
[18] 王维, 陈兴, 蔡泉, 默广, 陈中军, 李志宏, 张坤浩, 吴忠华. 小角X射线散射(SAXS)数据分析程序SAXS1.0. 核技术, 2007, 30: 571–575 Wang W, Chen X, Cai Q, Mo G, Chen Z J, Li Z H, Zhang K H, Wu Z H. Small angle X-ray scattering (SAXS) data analysis program SAXS1.0., 2007, 30: 571–575 (in Chinese with English abstract)
[19] Jenkins P J, Cameron R E, Donald A M. A universal feature in the structure of starch granules from different botanical sources., 1993, 45: 417–420
[20] Cai J W, Cai C H, Man J M, Zhou W D, Wei C X. Structural and functional properties of C-type starches., 2014, 101: 289–300
[21] Lin L S, Huang J, Zhao L X, Wang J, Wang Z F, Wei C X. Effect of granule size on the properties of lotus rhizome C-type starch., 2015, 134: 448–457
[22] Slaman H, Blazek J, Lopez-Rubio A, Gilbert E P, Hanley T, Copeland L. Structure-function relationships in A and B granules from wheat starches of similar amylose content., 2009, 75: 420–427
[23] Emmambux M N, Taylor J R N. Morphology, physical, chemical, and functional properties of starches from cereals, legumes, and tubers cultivated in Africa: a review., 2013, 65: 715–729
[24] Bocharnikova I, Wasserman L A, Krivandin A V, Fornal J, Blaszczak W, Chernykh V Y, Schiraldi A, Yuryrv V P. Structure and thermodynamic melting parameters of wheat starches with different amylose content., 2003, 74: 681–695
[25] Koroteeva D A, Kiseleva V I, Sriroth K, Piyachomkwan K, Bertoft E, Yuryev P V, Yuryev V P. Structural and thermodynamic properties of rice starches with different genetic background: Part 1. Differentiation of amylopectin and amylose defects., 2007, 41: 391–403
[26] Wang S J, Blazek J, Gilbert E, Copeland L. New insights on the mechanism of acid degradation of pea starch., 2012, 87: 1941–1949
[27] Cameron R E, Donald A M. A small-angle X-ray scattering study of the absorption of water into the starch granule., 1993, 244: 225–236
Application of Quantitative Graphical Method Based on Small Angle X-Ray Scattering Spectrum in Crop Starch Study
HE Wei1, FAN Xiao-Xu1, WANG Zhi-Feng2, and WEI Cun-Xu1,*
1Jiangsu Key Laboratory of Crop Genetics and Physiology / Co-Innovation Center for Modern Production Technology of Grain Crops, Yangzhou University, Yangzhou 225009, China;2Testing Center, Yangzhou University, Yangzhou 225009, China
Small-angle X-ray scattering (SAXS) spectrum can be used to quantify the lamellar structure of starch. However, the spectrum analysis lacks a special data analysis software and needs complicated mathematical equations for it, which seriously restricts the applications of SAXS technology in starch studies. In this study, a simple graphical method was established to quantitatively measure the SAXS spectrum parameters (peak intensity, peak position, peak width at half maximum, and lamellar distance). These parameters can reflect the information of starch lamellar structure. The SAXS spectra of starch with different crystal types, rice starch with different amylose contents, and acid-modified and gelatinized starch were all analyzed using the graphical method, showing that the lamellar structure of starch was related with the plant origin, but had no direct relationship with crystal types. For the starch from the same plant origin, the amylose content was significantly negatively correlated with peak intensity and peak width at half maximum, and positively correlated with lamellar distance of SAXS spectrum. The acid hydrolysis had no effect on lamellar distance of starch, but changed the peak intensity and peak width at half maximum of SAXS spectrum. Heating treatment also had no effect on lamellar distance of starch, but destroyed the crystalline structure, leading to the gradual decrease, even disappearance of peak intensity with increasing heating temperature. This study indicated that the quantitative graphical method is simple, good repeatable, and highly credible, and could be widely used in crop starch studies.
Crop starch; Small-angle X-ray scattering spectrum; Spectrum parameter; Quantitative graphical method; Lamellar structure
10.3724/SP.J.1006.2017.01827
本研究由国家自然科学基金项目(31570324)和江苏省高校优势学科建设工程项目资助。
This study was supported by the National Natural Science Foundation of China (31570324) and the Priority Academic Program Development of Jiangsu Higher Education Institutions.
韦存虚, E-mail: cxwei@yzu.edu.cn, Tel: 0514-87997217
E-mail: 1349765922@qq.com, Tel: 15380375313
2017-01-09; Accepted(接受日期): 2017-09-10; Published online(网络出版日期): 2017-09-28.
http://kns.cnki.net/kcms/detail/11.1809.S.20170928.1458.002.html

