不同磷水平下大麦分蘖期磷效率相关性状QTL定位分析
胡德益 蔡 露 陈光登,* 张锡洲 刘春吉
不同磷水平下大麦分蘖期磷效率相关性状QTL定位分析
胡德益1蔡 露1陈光登1,*张锡洲1刘春吉2
1四川农业大学资源学院, 四川成都 611130;2CSIRO Agriculture, 306 Carmody Road, St Lucia, QLD 4067, Australia
磷素营养与大麦品质及产量密切相关, 磷高效遗传机制和品种改良是近年的研究热点之一。本研究利用由大麦栽培品种Baudin和种质材料CN4079杂交构建的重组自交系(RIL)群体, 低磷胁迫(0.02 mmol L-1KH2PO4)与正常供磷(0.2 mmol L-1KH2PO4)条件下, 对地上部和地下部磷素利用效率、磷素吸收效率和干重, 以及分蘖数相关的QTL定位, 并预测相关位点基因。表型鉴定结果表明, 各性状在RIL群体中表现连续变异, 并存在超亲分离。两种磷水平下, 共检测到16个QTL, 分布在2H、3H和5H染色体上, 表型贡献率14.1%~28.5%。3H染色体上含有3个磷素利用效率位点, 其增效等位基因均来源于Baudin, 其中和与控制磷素吸收效率的和处于同一区段, 而与控制分蘖数的位点处于同一区段。5H染色体上含有3个磷素吸收效率位点, 其中和的增效等位基因来自CN4079, 且与控制磷素利用效率的和, 以及控制干重的和处于同一区段。在磷效率相关的4个区段中, 除所处区间仅含有磷酸代谢与磷脂代谢相关基因外, 其他区间均包含磷酸盐转运蛋白基因、磷酸代谢与磷脂代谢相关基因。
大麦; 磷效率; 分蘖期; 重组自交系; QTL定位
磷素是植物生长所需的大量营养元素之一, 土壤中总磷含量较为丰富, 但绝大部分磷素以有机态磷及Ca-P、Mg-P、Al-P、Fe-P与O-P等形态存在, 导致土壤有效态磷含量较低[1]。在低磷环境中, 植物通过调节自身生理活动摄取磷素。研究发现, 磷胁迫条件下, 作物可通过向根中分配更多比例的生物量尽量保证根系生长[2], 同时改善根系形态[3-4]与根构型[5]以获取更多磷素。但作物自身生理活动的改变不足以应对缺磷对其生长的影响, 缺磷导致作物小花数量减少, 从而显著降低产量[6]。研究表明, 同种作物不同基因型个体磷效率存在差异[7-9], 且作物磷效率为数量性状[10], 因此可通过定位研究发掘控制磷效率相关性状QTL。目前, 已经对水稻[11-12]、大豆[13-14]、菜豆[15]、油菜[16]等作物开展了磷效率相关位点的研究。Su等[17]在小麦中定位到20个地上部磷素吸收效率与磷素利用效率QTL, 富集于4B、5A、5D染色体上。进一步研究发现, 7个控制磷素吸收效率的QTL均与农艺性状相关[18]。Guo等[19]研究发现, 小麦1B、1D、4A和7A染色体上存在稳定的共同协调氮、磷、钾吸收效率与利用效率的QTL。Kjar等[20]在不同氮水平下对大麦成熟期磷含量进行QTL定位, 在2H和5H染色体上检测到与籽粒磷含量和秸秆磷含量的QTL, 表型贡献率为15%~45%。Gong等[21]通过不同磷水平的田间试验, 在2H和5H上定位了3个与磷素利用效率相关的QTL, 但仅在一年中检测到。
作为第四大谷类作物, 大麦(L.)的全球种植面积约56万公顷, 总产达1.2亿吨, 在我国种植面积约为1.62万公顷。磷素显著影响大麦产量与品质[22]。因此, 发掘大麦磷效率相关基因位点, 对利用分子标记辅助选育大麦磷高效品种, 促进大麦种植中磷肥减施增效具有重要的现实意义。大麦营养生长期是磷素需求最旺盛阶段, 值得深入解析该生育阶段磷素吸收和积累的规律与机制。然而, 目前对大麦磷素营养相关性状开展的QTL定位研究均基于对大田条件下成熟期的磷含量或磷素利用效率的测定, 未考虑苗期表达的相关基因/位点。本研究通过分析水培条件下大麦分蘖期磷效率相关性状QTL, 为大麦磷高效利用栽培品种的分子标记辅助育种提供参考。
1 材料与方法
1.1 试验材料
以大麦栽培品种Baudin为母本, 日本地方品种CN4079 (Australian Winter Cereals Collection编号为407903)为父本配制杂交组合, 采用单粒传种法构建F7:9RIL群体, 包含92个株系。
1.2 试验处理
设置2次独立试验(试验1和试验2), 均在四川农业大学成都校区教学科研园区带有防雨设施的大棚中进行。每次试验设低磷(LP)与正常(NP) 2个处理, 3次重复, 随机排列。供试营养液为Hoagland营养液与阿农微量元素混合液[19], 正常供磷水平营养液配方为KH2PO40.2 mmol L–1, K2SO40.75 mmol L–1, MgSO4·7H2O 0.65 mmol L–1, Ca(NO3)2·4H2O 2 mmol L–1, EDTA-Fe 0.1 mmol L–1, H3BO41×10–3mmol L–1, MnSO4·H2O 1×10–3mmol L–1, ZnSO4·7H2O 1×10–3mmol L–1, CuSO4·5H2O 0.5×10–3mmol L–1, (NH4)6Mo7O24·4H2O 0.05×10–3mmol L–1, 低磷胁迫水平将KH2PO4浓度调整为0.02 mmol L–1, 同时调整K2SO4浓度为0.84 mmol L–1以保证K+浓度为1.7 mmol L–1, 所有试剂均为分析纯。
选取亲本及RIL子代均匀饱满的种子经10% NaClO消毒1 min[15], 蒸馏水润洗3次, 置装有珍珠岩的育苗盘中。加入适量蒸馏水于室温下催芽, 出芽后采用1/4营养液, 1周后改用1/2营养液培养。待幼苗长至三叶一心时用海绵将幼苗固定于泡沫板上, 并转移至长60 cm、宽40 cm、高15 cm的水培槽中培养。每4 d更换一次营养液, 并间歇性通气, 每隔2 h通气2 h。检测并适时调整pH, 确保营养液pH保持在6.2左右, 适时补充蒸馏水, 保证营养液体积为36 L。
1.3 表型指标测定方法
于移苗后4周采样, 从每重复取样1株, 采样前先调查各株系分蘖数。样品经自来水洗净, 蒸馏水润洗, 吸水纸擦干后从根基处剪开, 根基以上作为地上部, 根基以下作为地下部, 分别装入信封袋中于105°C杀青30 min, 75°C烘干至恒重, 称重, 粉碎并过2 mm筛后用于植株磷含量的测定。
采用H2SO4-H2O2消化-钼锑抗比色法[23]测定磷含量。
磷素利用效率=∑干重/∑(磷含量×干重)
磷素吸收效率=∑(磷含量×干重)/3
用Microsoft Excel 2013整理数据和绘图, 用SPSS 17.0测验显著性和分析相关性。
1.4 遗传图谱构建及QTL定位
取亲本及RIL群体子代叶片150 mg, 用MiniBEST Plant DNA Extraction Kit快速提取试剂盒(TaKaRa)提取DNA, 并用0.5%琼脂糖凝胶电泳检测其质量。由澳大利亚Triticarte Pty. Ltd. (http://www. triticarte.com.au/)完成DArT标记的检测, 采用JointMap 4软件[24]进行连锁分析及构建遗传图谱。
采用MapQTL 6.0软件[25]进行QTL定位分析, Kmskal-Wallis test方法用于标记与表型间的初步测试, interval mapping (IM)法鉴定主效QTL, 迭代重复1000次, 显著水平为0.01, 当LOD>3.0时认为该区间可能存在一个QTL。QTL名称由性状字母“”+性状缩写字母+试验单位“”+染色体编号等几部分组成。
1.5 磷效率候选基因预测
在IPK Barley Blast Server (http://webblast.ipk- gatersleben.de/barley/index.php)数据库, 使用QTL间的分子标记序列与WGSMorex数据比对分析, 确定磷效率性状QTL区间的候选基因。同时, 提取候选磷酸盐转运蛋白(Pht)氨基酸序列, 在NCBI (https://blast.ncbi.nlm.nih.gov/Blast.cgi)数据库中进行BLASTP分析, 并参考已知的拟南芥、大麦、玉米等物种Pht氨基酸序列[26-28], 利用MEGA5.05软件(http://www.megasoftware.net/)的Neighbor-Joining Tree模型对候选Pht进行进化树分析, 设Bootstrap值为1000, 以明确候选Pht所属家族。
2 结果与分析
2.1 不同磷水平下的大麦表型变异
2种磷水平下, 除分蘖数及低磷胁迫条件下的磷素吸收效率以外, CN4079各表型值均显著高于Baudin (表1), RIL群体表型均呈现出连续分布的规律, 且存在显著的超亲分离现象(图1、图2和表1), 表明磷素利用效率、磷素吸收效率、干重与分蘖数均为多基因控制的数量性状。
2.2 磷吸收利用效率、干重及分蘖数的相关性
除正常供磷水平下地上、地下部磷素利用效率与地上部磷素吸收效率, 及地下部磷素利用效率与地下部干重相关性不显著外, 其余性状间表现出显著或极显著相关性。其中正常供磷水平下地上、地下部磷素利用效率均与地下部磷素吸收效率极显著负相关, 低磷胁迫条件下地上、地下部磷素利用效率均与地上、地下部磷素吸收效率极显著负相关, 其余性状间显著或极显著正相关(表2)。
2.3 遗传连锁图谱构建
共检测到亲本Baudin与CN4079间的948个多态性DArT标记, 去除冗余的共分离标记后, 得到542个DArT标记用于构建遗传图谱, 其中488个DArT标记覆盖总长821 cM的染色体, 其余54个DArT标记未能标记于染色体上, 标记间平均距离为1.68 cM, 最大遗传距离为21.3 cM, 位于4H染色体上。
2.4 磷吸收利用效率QTL分析
2种磷水平下共检测出10个地上部与地下部磷素利用效率、磷素吸收效率QTL, 均分布于3H与5H染色体上(图3和表3), 单个QTL可解释表型变异的14.1%~28.5%。
共检测到3个控制地上部磷素利用效率的QTL, 可解释表型变异的14.9%~26.4%。其中在4个环境中均被检测到, 其增效等位基因来源于CN4079。仅在低磷胁迫条件下被检测到, 说明其为低磷胁迫下特定表达的QTL, 其等位基因来源于Baudin。检测到2个控制地下部磷素利用效率的QTL与, 二者在4个环境中均被检测到, 可解释表型变异的14.1%~28.5%。
3个控制地上部磷素吸收效率的QTL, 可解释表型变异的14.9%~26.1%。其中与均仅在低磷胁迫条件下被检测出,仅在正常供磷水平下被检测出。2个控制地下部磷素吸收效率的QTL可解释表型变异的15.2%~20.1%。其中在3个环境中均检测出, 其增效等位基因来源于Baudin, 而仅在试验2低磷胁迫条件下被检测到, 其增效等位基因来自CN4079。
2.5 两种磷水平下干重、分蘖数QTL分析
共检测出4个与干重相关的QTL (表3), 其中在3个环境中被检测到, 可解释地上部干重表型变异的14.4%~16.8%;在4个环境中均被检测到, 可解释地上部干重表型变异的18.7%~24.6%;仅在试验2低磷胁迫条件下被检测到, 可解释地下部干重表型变异的16.7%。在4个环境中均被检测到, 可解释地下部干重表型变异的15.1%~16.9%。
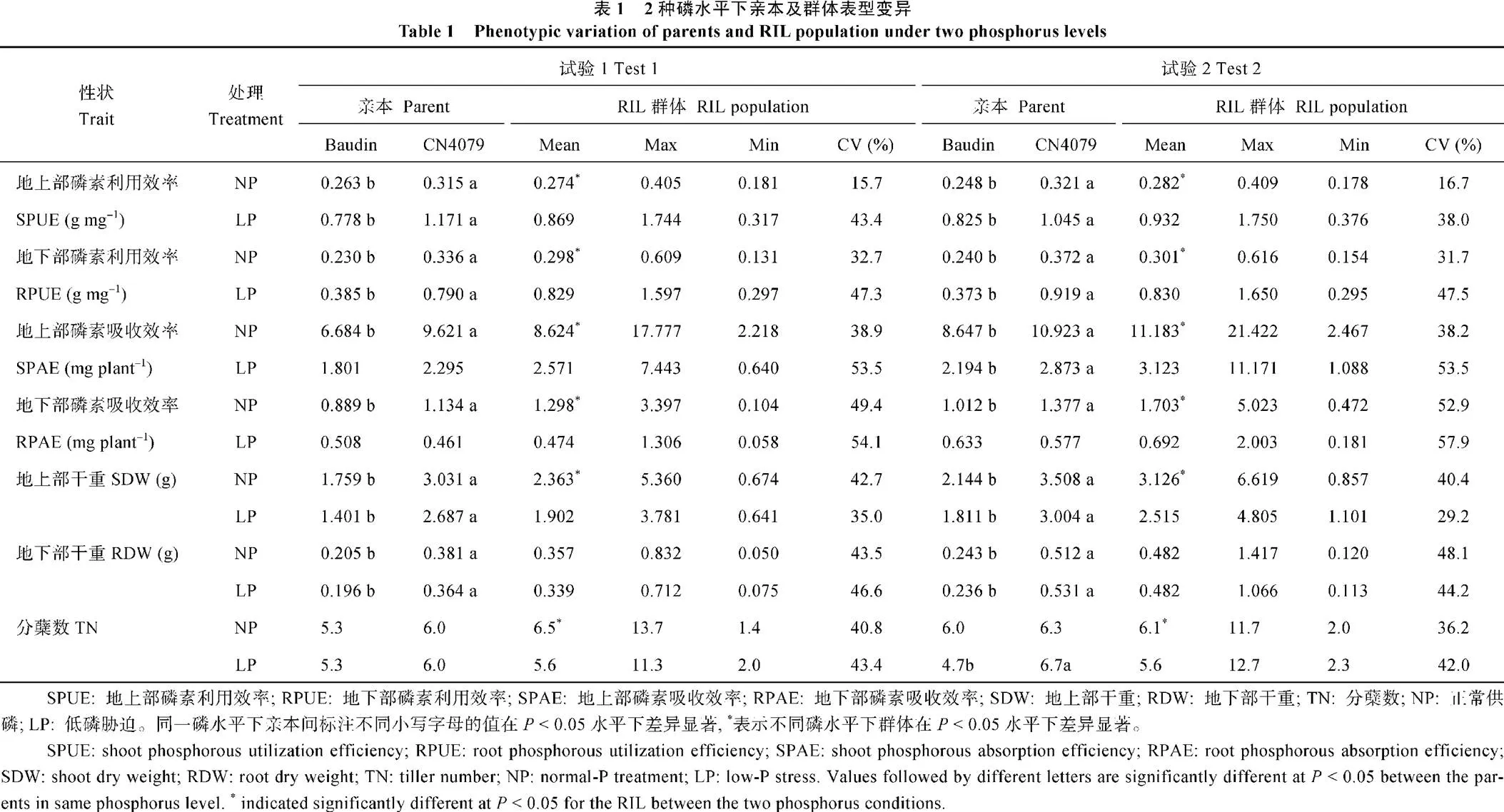
A、C、E和G: 正常供磷水平; B、D、F和H: 低磷胁迫条件。白色和黑色箭头分别指示亲本Baudin和CN4079测定值的位置。
A, C, E, and G: normal-P condition; B, D, F, and H: low-P stress. The white and black arrows show the positions of measured values of parents Baudin and CN4079, respectively.
2个与分蘖数相关的QTL被检测出, 等位基因均来源于CN4079。其中仅在正常供磷水平下被检测出, 可解释表型变异的16.1%~21.9%;在3个环境中被检测到, 可解释表型变异的14.3%~15.0%。
2.6 磷吸收利用效率候选基因预测结果
根据QTL定位结果, 10个磷吸收利用效率位点位于3H与5H染色体上的4个区间(图3), 进一步分析显示, 该4个区间共含有27个与磷素代谢紧密相关的基因(表4)。其中,所在区间含有3个候选基因, 为磷酸与磷脂代谢相关酶; 其他区间均包含3类与磷素代谢密切相关的基因, 为磷酸盐转运蛋白(Pht)、磷酸代谢相关酶与磷脂代谢相关酶。此外, Pht候选基因分析结果表明所在区域Pht候选基因、和所在区域Pht候选基因归属于Pht2家族,所在区域Pht候选基因、均归属于Pht1家族(图4)。
3 讨论
3.1 大麦响应磷胁迫的表型差异
本研究对大麦RIL群体磷素利用效率、磷素吸收效率、干重和分蘖数分析表明, 在4个环境中均表现出连续变异现象, 并存在明显的超亲分离现象, 这与水稻[29]、小麦[18]与大豆[30]相关性状变化规律一致。此外, 除地下部干重, RIL群体各性状均受磷水平影响显著, 对甘蓝型油菜[31]的研究表明, 磷胁迫条件下, 其磷素利用效率增加, 而干重、磷素吸收效率大幅降低, 这一结果与本研究一致。对小麦[18]和菜豆[32]分析发现, 不同磷水平下的磷效率与干重、分蘖数显著相关, 本研究中磷素利用效率、磷素吸收效率与干重、分蘖数亦显著相关。
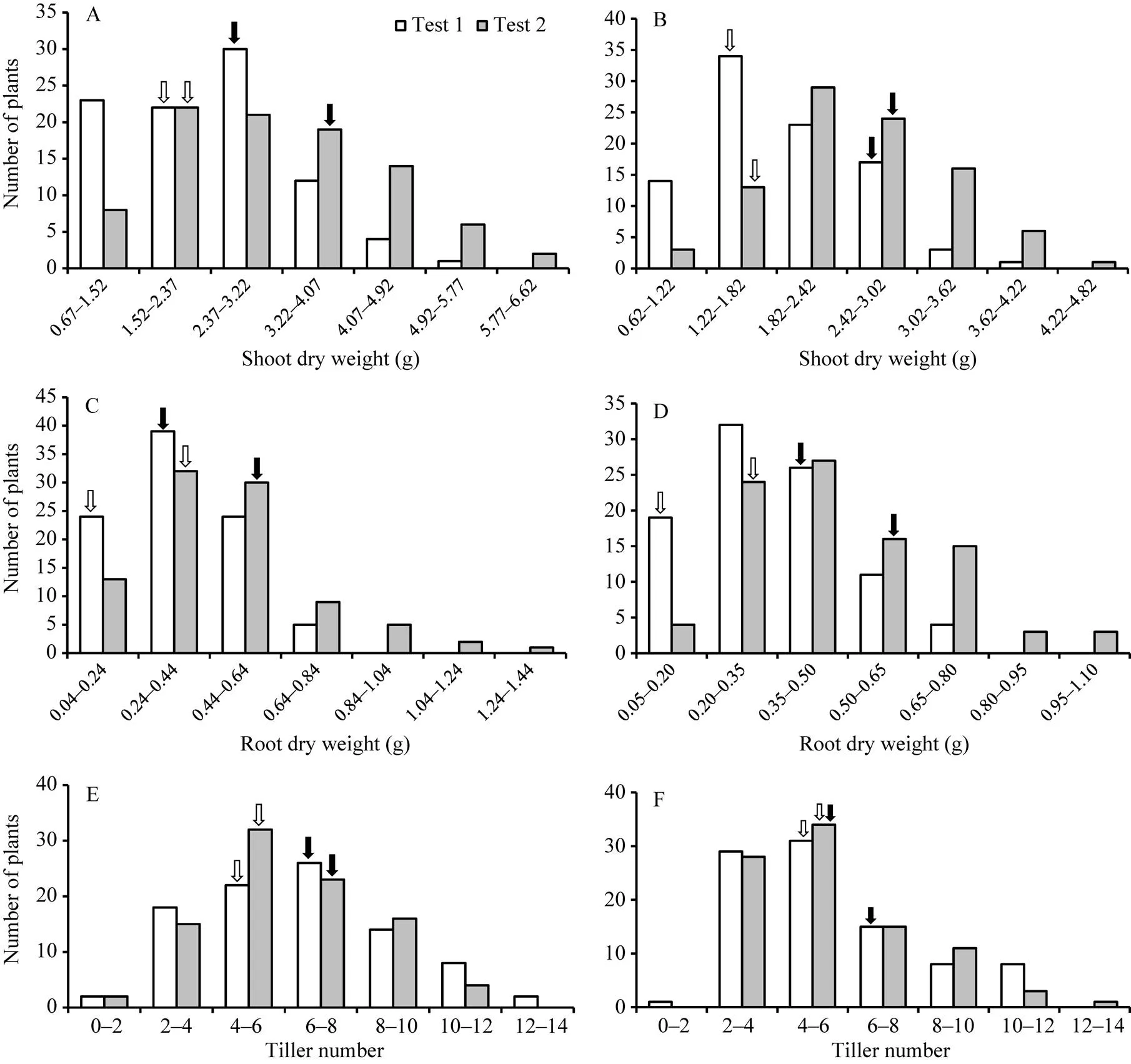
图2 RIL群体地上、地下部干重及分蘖数的频次分布
A、C和E: 正常供磷水平; B、D和F: 低磷胁迫条件。白色和黑色箭头分别指示亲本Baudin和CN4079测定值的位置。
A, C, and E: normal-P condition; B, D, and F: low-P stress. The white and black arrows show the positions of measured values of parents Baudin and CN4079, respectively.
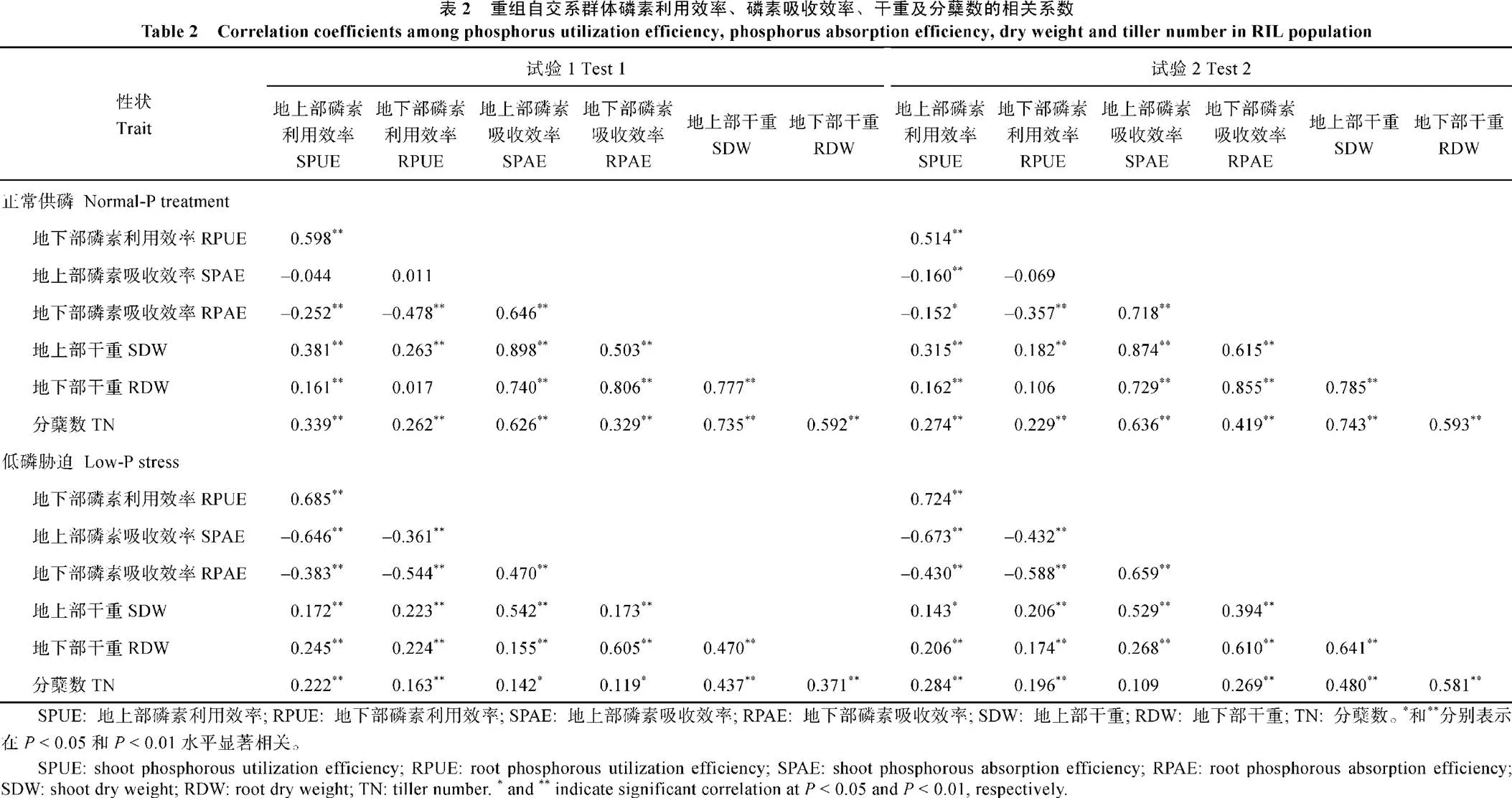
PUE: 磷素利用效率; PAE: 磷素吸收效率; DW: 干重。
PUE: phosphorus utilization efficiency; PAE: phosphorus absorption efficiency; DW: dry weight.
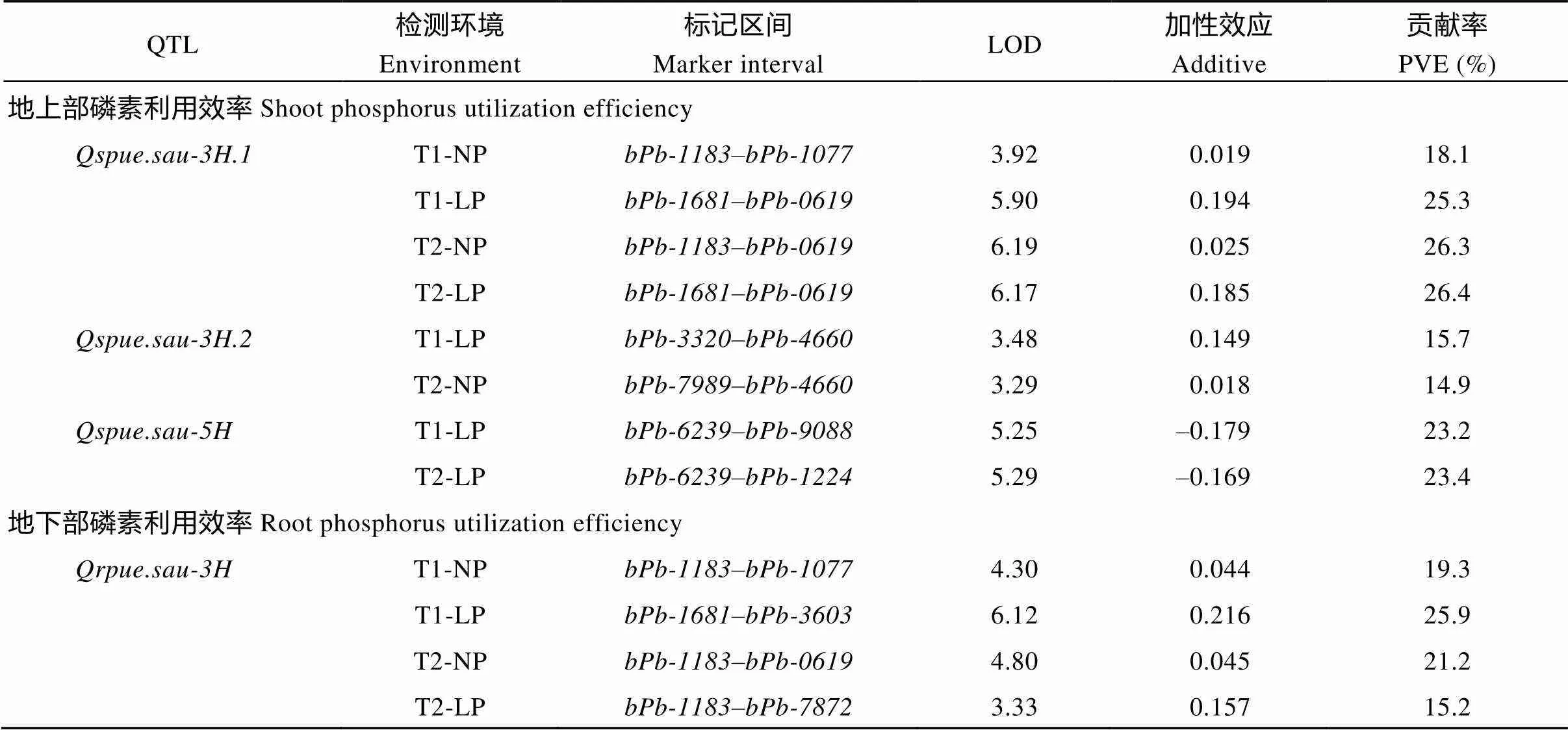
表3 两种磷水平下磷素利用效率、磷素吸收效率、干重及分蘖数QTL定位结果
(续表3)
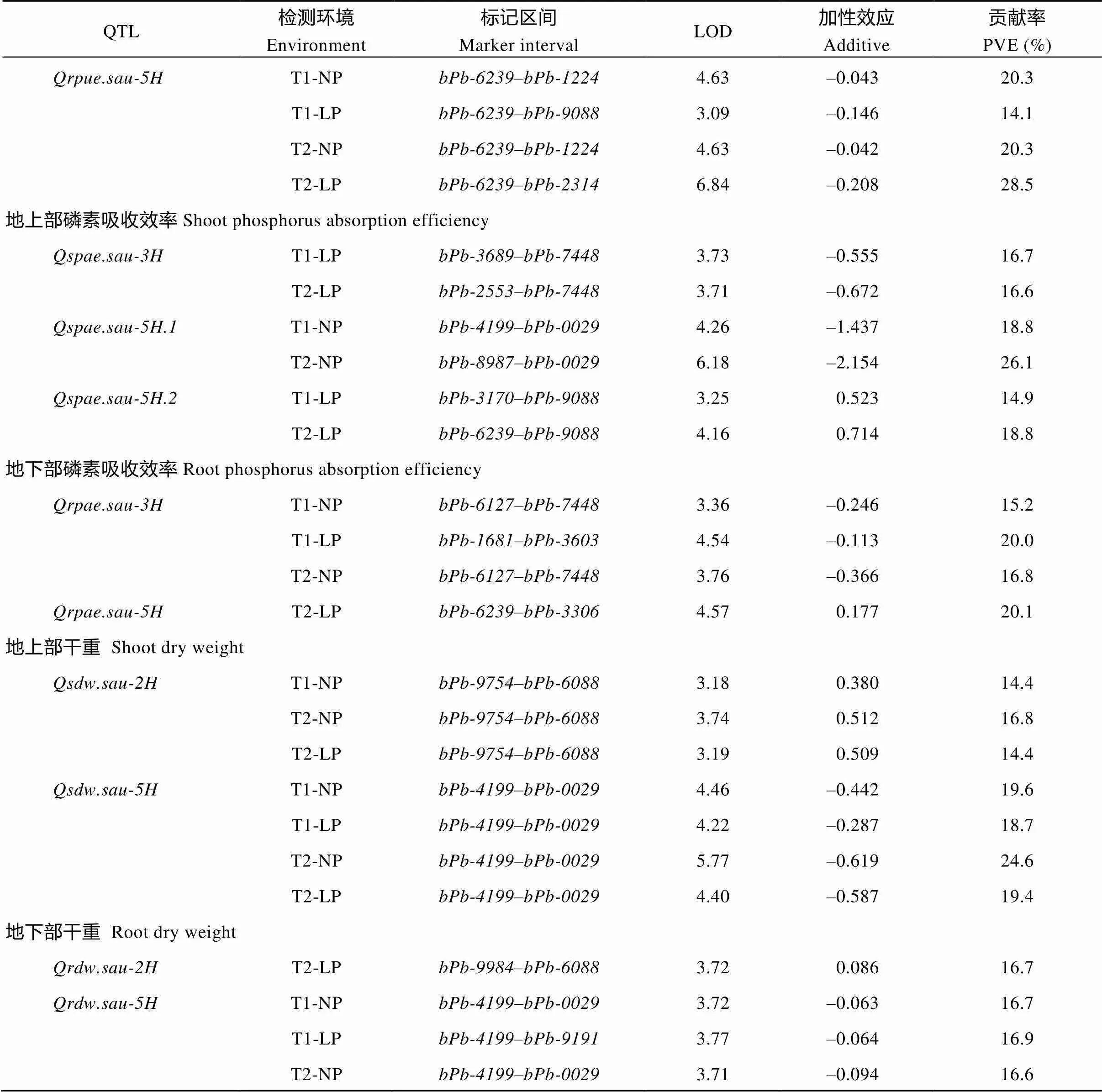
QTL检测环境Environment标记区间Marker intervalLOD加性效应Additive贡献率PVE (%) Qrpue.sau-5HT1-NPbPb-6239–bPb-12244.63–0.04320.3 T1-LPbPb-6239–bPb-90883.09–0.14614.1 T2-NPbPb-6239–bPb-12244.63–0.04220.3 T2-LPbPb-6239–bPb-23146.84–0.20828.5 地上部磷素吸收效率Shoot phosphorus absorption efficiency Qspae.sau-3HT1-LPbPb-3689–bPb-74483.73–0.55516.7 T2-LPbPb-2553–bPb-74483.71–0.67216.6 Qspae.sau-5H.1T1-NPbPb-4199–bPb-00294.26–1.43718.8 T2-NPbPb-8987–bPb-00296.18–2.15426.1 Qspae.sau-5H.2T1-LPbPb-3170–bPb-90883.250.52314.9 T2-LPbPb-6239–bPb-90884.160.71418.8 地下部磷素吸收效率Root phosphorus absorption efficiency Qrpae.sau-3HT1-NPbPb-6127–bPb-74483.36–0.24615.2 T1-LPbPb-1681–bPb-36034.54–0.11320.0 T2-NPbPb-6127–bPb-74483.76–0.36616.8 Qrpae.sau-5HT2-LPbPb-6239–bPb-33064.570.17720.1 地上部干重 Shoot dry weight Qsdw.sau-2HT1-NPbPb-9754–bPb-60883.180.38014.4 T2-NPbPb-9754–bPb-60883.740.51216.8 T2-LPbPb-9754–bPb-60883.190.50914.4 Qsdw.sau-5HT1-NPbPb-4199–bPb-00294.46–0.44219.6 T1-LPbPb-4199–bPb-00294.22–0.28718.7 T2-NPbPb-4199–bPb-00295.77–0.61924.6 T2-LPbPb-4199–bPb-00294.40–0.58719.4 地下部干重 Root dry weight Qrdw.sau-2HT2-LPbPb-9984–bPb-60883.720.08616.7 Qrdw.sau-5HT1-NPbPb-4199–bPb-00293.72–0.06316.7 T1-LPbPb-4199–bPb-91913.77–0.06416.9 T2-NPbPb-4199–bPb-00293.71–0.09416.6 T2-LPbPb-4199–bPb-00293.34–0.08215.1 分蘖数 Tiller number Qtn.sau-2HT1-NPbPb-9754–bPb-80523.591.05916.1 T2-NPbPb-9984–bPb-08275.061.02821.9 Qtn.sau-3HT1-LPbPb-3320–bPb-72783.310.92715.0 T2-NPbPb-3320–bPb-72783.260.84214.8 T2-LPbPb-3320–bPb-72783.150.87214.3
T1和T2分别表示试验1和试验2; NP和LP分别表示正常供磷和低磷胁迫。加性效应正值和负值分别表示增效等位基因来自CN4097和Baudin。
T1 and T2 represent Test 1 and Test 2, respectively; NP and LP indicate normal-P condition and low-P stress, respectively. PVE: phenotypic variation explained. The positive and negative additive effect indicate that the allele to increase the phenotypic value is from CN4097 and Baudin, respectively.
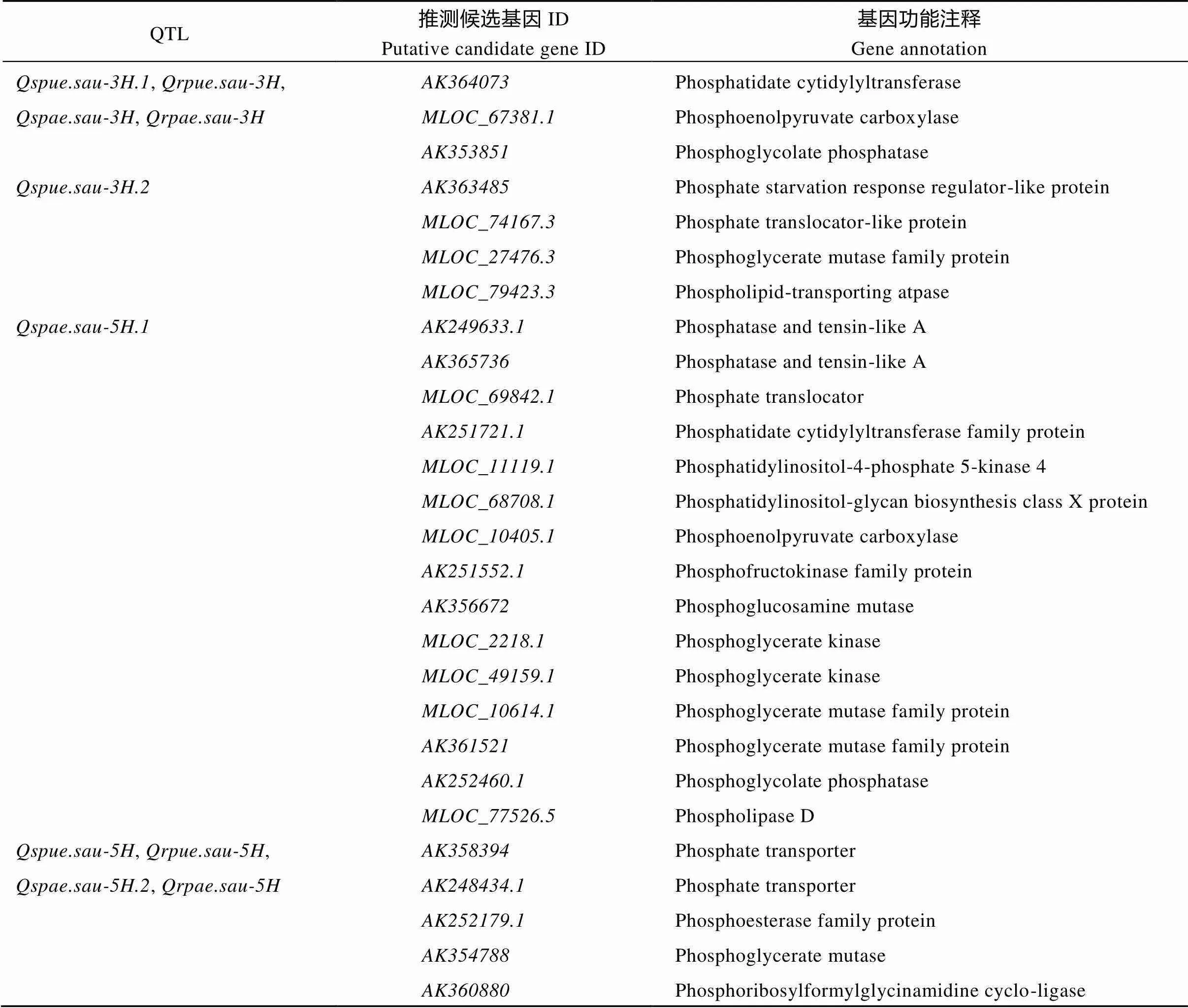
表4 大麦磷效率QTL区间候选基因预测结果
3.2 磷吸收利用效率QTL之间的关系
目前, 有关大麦磷吸收利用效率QTL定位研究比较缺乏, 均仅限于大田试验中成熟期的磷含量[20]或磷素利用效率[21], 且其位点均位于染色体2H和5H上, 受环境因素影响较大, 有的在两年田间试验中仅有一年能被检测出。现有研究对于大麦磷素吸收最旺盛的营养生长期相关QTL定位未见报道, 本研究分析大麦分蘖期磷素效率特征, 明确控制大麦分蘖期磷吸收利用效率相关QTL, 挖掘各QTL间的关系, 对揭示大麦营养生长时期磷吸收利用遗传机制具有一定的参考价值。
本研究定位到10个与磷吸收利用效率相关的QTL, 其中与位于同一区段, 在所有环境中均被检测出, 当前未有染色体3H上的磷相关位点报道, 说明与为大麦营养生长阶段新的磷素利用效率QTL, 遗传稳定性好。磷素吸收效率位点、与磷素利用效率位点、处于同一区段, 这一区间含有3个与磷素代谢紧密相关的基因, 作用于磷酸及磷脂代谢, 因此, 磷酸与磷脂代谢作为磷素代谢的重要组成, 影响大麦磷吸收利用效率。地上部磷素利用效率位点仅在部分环境中被检测到, 基因预测结果表明,所在区间内包含4个与磷素代谢紧密相关的基因, 分别为磷胁迫调节因子、磷酸盐转运蛋白、磷酸甘油变位酶和磷脂转运蛋白。基因组密切关联的物种间常具有线性的对应关系, 大麦和小麦间的基因序列具有较高度的共线性[33], 因此, 在小麦中通过中国春缺体试验发现的3A染色体上携带的抑制耐低磷胁迫特性基因[34]可能为本研究3H位点的同源基因。进一步对磷胁迫调节因子、磷酸盐转运蛋白的进化树分析表明, 二者均为Pht2蛋白, 研究表明, Pht2为一类在质体上表达的磷酸盐转运蛋白[35], 因此,与可能仅作用于地上部磷素利用。
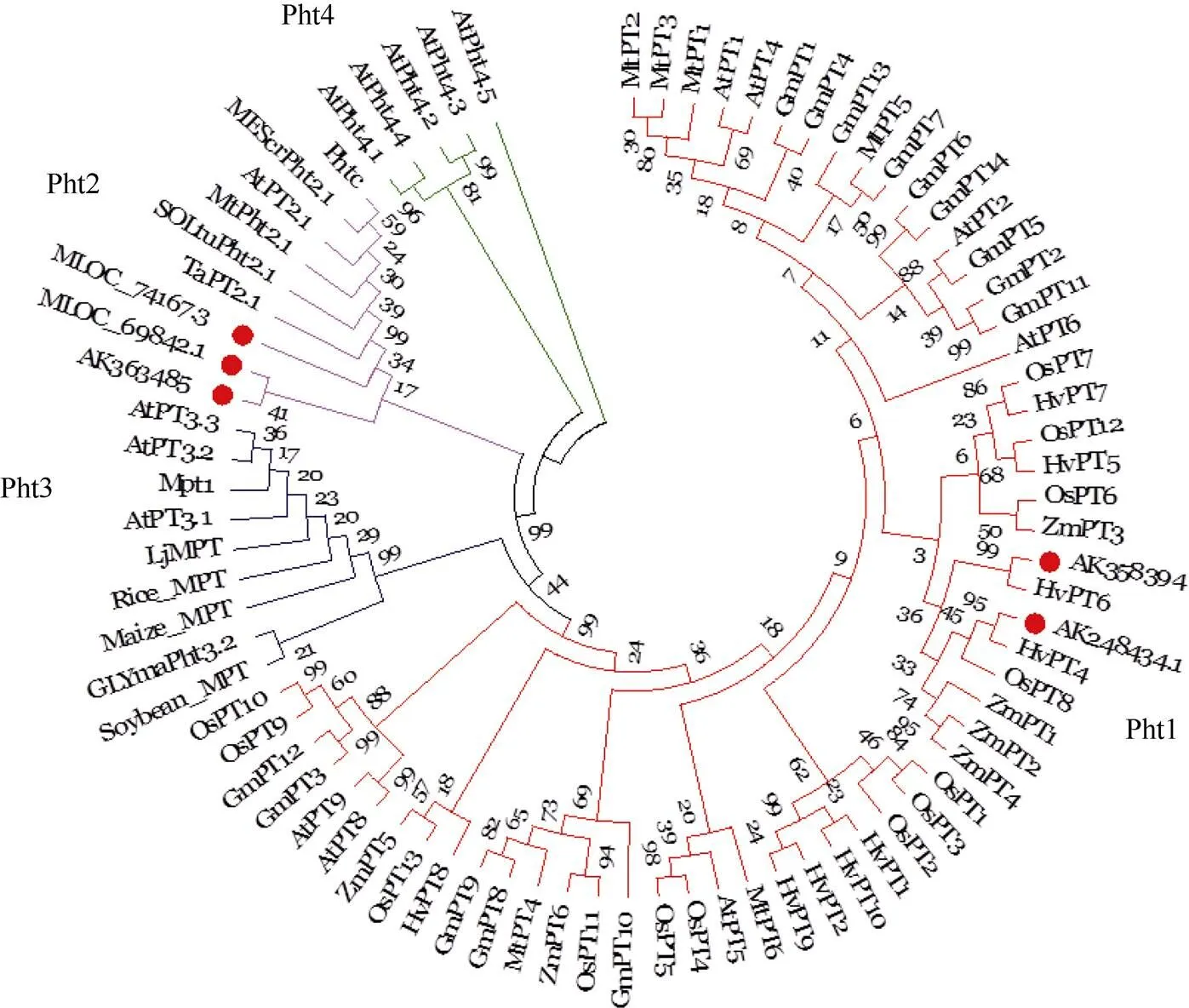
图4 磷酸盐转运蛋白家族候选基因系统进化树分析
红色、紫色、蓝色、绿色分枝分别表示Pht1家族、Pht2家族、Pht3家族、Pht4家族; 红色圆点表示预测的候选基因。物种与转运蛋白对应关系为拟南芥: AtPT 1~9、AtPT2.1、AtPT 3.1~3.3、AtPT 4.1~4.5; 大豆: GmPT 1~14、Soybean-MPT、GLYmaPht3.2; 大麦: HvPT 1~10; 蒺藜状苜蓿: MtPT 1~6、MtPht2.1; 水稻: OsPT 1~13、Rice-MPT; 玉米: ZmPT 1~6、Maize-MPT; 马铃薯: SOLtuPht2.1; 菠菜: Phtc; 冰叶日中花: MEScrPht2.1; 百脉根: Lj-MPT; 小麦: TaPT2.1; 欧洲白桦: Mpt1。
The evolutionary tree branch of red, purple, blue, green indicate the Pht1 family, Pht2 family, Pht3 family, and Pht4 family, respectively. Plant species and corresponding transporters are:: AtPT 1–9, AtPT2.1, AtPT 3.1–3.3, AtPT 4.1–4.5;: GmPT 1–14, soybean-MPT, GLYmaPht3.2;: HvPT 1–10;: MtPT 1-6, MtPht2.1;: OsPT 1-13, rice-MPT;: ZmPT 1–6, Maize-MPT;: SOLtuPht2.1;: Phtc;: MEScrPht2.1;: Lj-MPT;: TaPT2.1;: Mpt1.
磷素吸收效率与利用效率常受不同的遗传机制调节, 本研究中, 正常供磷水平下地上部磷素吸收效率与磷素利用效率相关性不显著, 定位结果也显示, 磷素利用效率位点与等位基因来源于Baudin, 而磷素吸收效率位点与等位基因均来源于CN4079。同时, 在以上检测到的位于同一区段的4个QTL中, 仅有在正常供磷水平下被检测出。基因功能分析发现,所在区段存在5个与磷素代谢密切相关的基因, 作用于磷酸盐转运、磷酸及磷脂代谢过程, 这其中包含2个Pht1蛋白, 其氨基酸序列分别与HvPT4、HvPT6相近。研究表明, Pht1为高亲和力转运蛋白, 在地上部与地下部均能作用于磷素吸收与转运[36], 而HvPT6是目前已知的唯一一个能够在较高磷水平下的表达的大麦Pht1蛋白[37]。相比于其他仅在低磷胁迫条件下被检测出的磷素吸收利用效率QTL, 根据等位基因来源, 说明Baudin在至区间内极有可能含有基因。
本研究定位的4个区段均存在磷素代谢相关基因富集现象。地上部磷素吸收效率位点所在区间含有15个与磷素代谢密切相关的基因, 作用于磷酸盐转运、磷酸及磷脂代谢过程, 其中, 预测的磷酸盐转运蛋白为Pht2家族蛋白。因此, 磷效率不仅受多位点控制, 同时还受同一位点多基因调控, 这可能是当前作物磷相关QTL定位结果重现性不理想的原因[21]。地上部磷素吸收效率位点与在染色体上距离相近, 但二者等位基因来源不同, 说明与为不同的控制位点。此外, 地上部磷素吸收效率位点与分别仅在正常供磷与低磷胁迫条件下被检测出, 说明二者分别在不同磷水平下作用于大麦地上部磷素吸收效率。
3.3 磷吸收利用效率与干重、分蘖数QTL之间的关系
研究表明, 欧洲油菜[16]与小麦[18]控制磷效率的QTL与控制干重的QTL位于同一区段, 这与本研究磷素利用效率、磷素吸收效率与干重在染色体5H上的位点分布情况相似。磷素利用效率QTL、与干重QTL、等位基因来源均为Baudin, 说明以上4个QTL高度连锁。同时, 磷素吸收效率与干重在4种环境下均极显著正相关, 表明磷素吸收效率对大麦营养生长阶段干物质积累至关重要。
此外, 磷素利用效率与分蘖数在4种环境下均极显著正相关, QTL定位结果显示, 磷素利用效率QTL与分蘖数QTL处于同一区段, 且二者等位基因均来源于同一亲本, 这一结果与小麦[18]、玉米[38]磷素利用效率QTL定位研究结果相似。正常供磷水平下磷素吸收效率与分蘖数极显著正相关, 而低磷胁迫条件下两次试验差异较大。这可能是因为磷素吸收效率与分蘖数均为数量性状, 受大量基因调控[39], 群体受低磷胁迫敏感程度存在较大的基因型差异, 低磷胁迫不仅影响分蘖数及干重, 对植株磷含量的影响更为显著, 而磷素吸收效率由干重与磷含量共同决定, 低磷胁迫使群体磷素吸收效率的变化朝着更加无序的方向发展。同时, 分蘖数是干重的重要构成要素之一[40], 本研究分蘖数在2种磷水平下与地上部干重均极显著正相关, 且在2H染色体上检测出位于同一区段分别控制分蘖数与地上部干重的QTL, 二者均在正常供磷水平下被检测到, 且等位基因均来源于CN4079, 说明CN4079在该区段含有同时控制正常供磷水平下分蘖数与干重的基因/QTL。
本研究检测到的磷效率及其相关QTL的遗传分析, 可为大麦高效吸收利用磷养分的分子育种工作提供一定的理论基础, 然而QTL粗定位精度仅有10~30 cM[41], 高级群体定位精度在1 cM左右[42], 本研究QTL定位精度在1~30 cM之间。因此, 可通过构建近等基因系等更高级群体对候选QTL进一步精细定位, 以揭示在同一物理区间内各QTL之间的关系。同时, 随着大麦基因组测序及功能序列组装信息的发布[43], 基于遗传稳定的QTL定位基因的图位克隆与研究具有广阔的研究前景。
4 结论
两种磷水平下, 在大麦分蘖期共检测到16个磷吸收利用效率及其相关性状的QTL, 分布在2H、3H、5H染色体上, 表型贡献率在14.1%~28.5%之间。磷素利用效率位点、与遗传稳定, 受环境影响较小; 而控制磷素吸收效率的位点均在一定程度上受环境限制。、为控制大麦磷素利用效率的新主效QTL, 且与磷素吸收效率的位点位于同一区段。、、、、与位于同一区段, 同时调控大麦磷素利用效率、磷素吸收效率及干重, 且含有Pht1家族的2个基因。同时, 本研究检测到的与大麦磷效率相关的4个区段均存在与磷素代谢相关基因富集现象。
[1] Schachtman D, Reid R, Ayling S M. Phosphorus uptake by plants: from soil to cell., 1998, 116: 447–453
[2] Hermans C, Hammond J P, White P J, Verbruggen N. How do plants respond to nutrient shortage by biomass allocation?, 2006, 11: 610–617
[3] Hammond J P, White P J. Sucrose transport in the phloem: integrating root responses to phosphorus starvation., 2008, 59: 93–109
[4] 唐宏亮, 申建波, 张福锁, Rengel Z. 磷和外源生长素对白羽扇豆(L.)根形态和生理特性的影响. 中国科学C辑: 生命科学, 2013, 43: 201–212 Tang H L, Shen J B, Zhang F S, Rengel Z. Interactive effects of phosphorus deficiency and exogenous auxin on root morphological and physiological traits in white lupin (L.)., 2013, 43: 201–212 (in Chinese)
[5] 赵静, 付家兵, 廖红, 何勇, 年海, 胡月明, 邱丽娟, 董英山, 严小龙. 大豆磷效率应用核心种质的根构型性状评价. 科学通报,2004, 49: 1249–1257 Zhao J, Fu J B, Liao H, He Y, Nian H, Hu Y M, Qiu L J, Dong Y S, Yan X L. The traits evaluation about root architecture of soybean core collection’s efficiency of phosphorus application., 2004, 49: 1249–1257 (in Chinese)
[6] Tiessen H. Phosphorus in the global environment: transfers, cycles and management., 1995: 27–42
[7] 郭程瑾, 李宾兴, 王斌, 李雁鸣, 肖凯. 小麦高效吸收和利用磷素的生理机制. 作物学报, 2006, 32: 827–832Guo C J, Li B X, Wang B, Li Y M, Xiao K. Physiological mechanisms of absorption and use of phosphorus with high efficiency in wheat cultivars., 2006, 32: 827–832 (in Chinese with English abstract)
[8] 韦还和, 孟天瑶, 李超, 张洪程, 戴其根, 马荣荣, 王晓燕, 杨筠文. 水稻甬优12产量13.5 t hm–2以上超高产群体的氮素积累、分配与利用特征. 作物学报, 2016, 42: 886–897Wei H H, Meng T Y, Li C, Zhang H C, Dai Q G, Ma R R, Wang X Y, Yang J W. Accumulation, distribution, and utilization characteristics of phosphorus in Yongyou 12 yielding over 13.5 t ha–1., 2016, 42: 886–897(in Chinese with English abstract)
[9] 蔡秋燕, 张锡洲, 李廷轩, 陈光登, 吴德勇. 磷高效野生大麦拔节期对植酸态有机磷的利用.中国农业科学, 2015, 48: 3146–3155Cai Q Y, Zhang X Z, Li T X, Chen G D, Wu D Y. The utilization of phytate organic phosphorus in P-efficient wild barley genotypes at jointing stage., 2015, 48: 3146–3155 (in Chinese with English abstract)
[10] 林海建, 张志明, 张永中, 高世斌, 潘光堂. 作物氮、磷、钾利用相关性状的QTL定位研究进展. 植物营养与肥料学报, 2010, 16: 732–743 Lin H J, Zhang Z M, Zhang Y Z, Gao S B, Pan G T. Advancement of QTL analysis for traits associated to N, P and K utilization., 2010, 16: 732–743 (in Chinese with English abstract)
[11] Wissuwa M, Yano M, Ae N. Mapping of QTLs for phosphorus-deficiency tolerance in rice (L.)., 1998, 97: 777–783
[12] Chin J H, Lu X, Haefele S M, Gamuyao R, Ismail A, Wissuwa M. Development and application of gene-based markers for the major rice QTL., 2010, 120: 1073–1086
[13] Li Y D, Wang Y J, Tong Y P, Gao J G, Zhang J S, Chen S Y. QTL mapping of phosphorus deficiency tolerance in soybean (L. Merr.)., 2005, 142: 137–142
[14] King K E, Lauter N, Lin S F, Scott M P, Shoemaker R C. Evaluation and QTL mapping of phosphorus concentration in soybean seed., 2013, 189: 261–269
[15] Yan X, Liao H, Beebe S E, Blair M W, Lynch J P. QTL mapping of root hair and acid exudation traits and their relationship to phosphorus uptake in common bean., 2004, 265: 17–29
[16] Yang M, Ding G D, Shi L, Xu F S, Meng J L. Detection of QTL for phosphorus efficiency at vegetative stage in., 2011, 339: 97–111
[17] Su J Y, Xiao Y M, Li M, Liu Q Y, Li B, Tong Y P, Jia J Z, Li Z S. Mapping QTLs for phosphorus-deficiency tolerance at wheat seedling stage., 2006, 281: 25–36
[18] Su J Y, Zheng Q, Li H W, Li B, Jing R L, Tong Y P. Detection of QTLs for phosphorus use efficiency in relation to agronomic performance of wheat grown under phosphorus sufficient and limited conditions., 2009, 176: 824–836
[19] Guo Y, Kong F M, Xu Y F, Zhao Y, Liang X, Wang Y Y, An D, Li S. QTL mapping for seedling traits in wheat grown under varying concentrations of N, P and K nutrients., 2012, 124: 851–865
[20] Kjar B, Jensen J. The inheritance of nitrogen and phosphorus content in barley analysed by genetic markers., 1995, 123: 109–119
[21] Gong X, Wheeler R, Bovill W D, McDonald G K. QTL mapping of grain yield and phosphorus efficiency in barley in a Mediterranean-like environment., 2016, 129: 1657–1672
[22] 唐旭, 陈义, 吴春艳, 杨生茂, 刘玉学, 吕豪豪, 马义兵, 李菊梅. 大麦长期肥料效率和土壤养分平衡. 作物学报, 2013, 39: 665–672Tang X, Chen Y, Wu C Y, Yang S M, Liu Y X, Lyu H H, Ma Y B, Li J M. Fertilizer efficiency and soil apparent nutrient balance for barley under long-term fertilization., 2013, 39: 665–672 (in Chinese with English abstract)
[23] 鲁如坤. 土壤农业化学分析方法. 北京: 中国农业科技出版社, 2000. pp 309–314 Lu R K. Analytical Methods of Soil and Agrochemistry. Beijing: China Agricultural Science and Technology Press, 2000. pp 309–314 (in Chinese)
[24] Van O J W. JointMap 4, Software for the calculation of genetic linkage maps in experimental populations. Wageningen, 2006 (http://www.kyazma.nl/docs/JM4manual.pdf)
[25] Van O J W. MapQTL version 6.0, Software for the mapping of quantitative trait loci in experimental populations of diploid species. Wageningen, 2009. https://www.kyazma.nl/docs/MQ6Manual. pdf
[26] Chen A, Chen X, Wang H, Liao D H, Gu M, Qu H Y, Sun S B, Xu G H. Genome-wide investigation and expression analysis suggest diverse roles and genetic redundancy of Pht1 family genes in response to Pi deficiency in tomato., 2014, 14: 61
[27] Karandashov V, Bucher M. Symbiotic phosphate transport in arbuscular mycorrhizas., 2005, 10: 22–29
[28] Guo B, Jin Y, Wussler C, Blancaflor E B, Motes C M, Versaw W K. Functional analysis of the Arabidopsis PHT4 family of intracellular phosphate transporters., 2008, 177: 889–898
[29] Li J Z, Xie Y, Dai A Y, Liu L F, Li Z C. Root and shoot traits responses to phosphorus deficiency and QTL analysis at seedling stage using introgression lines of rice., 2009, 36: 173–183
[30] 崔世友, 耿雷跃, 孟庆长, 喻德跃. 大豆苗期耐低磷性及其QTL定位. 作物学报, 2007, 33: 378–383Cui S Y, Geng L Y, Meng Q C, Yu D Y. QTL mapping of phosphorus deficiency tolerance in soybean (L.) during seedling stage., 2007, 33: 378–383 (in Chinese with English abstract)
[31] Zhang H W, Huang Y, Ye X S, Shi L, Xu F S. Genotypic differences in phosphorus acquisition and the rhizosphere properties of Brassica napus in response to low phosphorus stress., 2009, 320: 91–102
[32] Beebe S E, Rojaspierce M, Yan X L, Blair M W, Pedraza F, Munoz F M, Tohme J, Lynch J P. Quantitative trait loci for root architecture traits correlated with phosphorus acquisition in common bean., 2006, 46: 413–423
[33] Devos K M. Updating the ‘Crop Circle’., 2005, 8: 155–162
[34] 李玉京, 刘建中, 李滨, 李继云, 姚树江, 李振声. 普通小麦基因组中耐低磷胁迫特性的染色体控制. 遗传学报, 1999, 26: 529–538Li Y J, Liu J Z, Li B, Li J Y, Yao S J, Li Z S. Chromosomal control of the tolerance to phosphorus deficiency in genome ofChinese Spring., 1999, 26: 529–538 (in Chinese with English abstract)
[35] Versaw W K, Harrison M J. A Chloroplast phosphate transporter, PHT2;1, influences allocation of phosphate within the plant and phosphate-starvation responses., 2002, 14:1751–1766
[36] Mudge S R, Rar A L, Diatloff E, Smith F W. Expression analysis suggests novel roles for members of thefamily of phosphate transporters in Arabidopsis., 2002, 31: 341–353
[37] Preuss C P, Huang C Y, Gilliham M, Tyerman S D. Channel-like characteristics of the low-affinity barley phosphate transporter PHT1;6 when expressed in., 2010, 152:1431–1441
[38] Chen J, Xu L, Cai Y. QTL mapping of phosphorus efficiency and relative biologic characteristics in maize (L.) at two sites., 2008, 313: 251–266
[39] 李利华, 邱旭华, 李香花, 王石平, 练兴明. 低磷胁迫水稻根部基因表达谱研究. 中国科学C辑: 生命科学, 2009, 39: 549–558 Li L H, Qiu X H, Li X H, Wang S P, Lian X M. The research of rice root’s gene expression profile on the condition of phosphorus deficiency stress., 2009, 39: 549–558 (in Chinese)
[40] Kuraparthy V, Sood S, Dhaliwal H S, Chhuneja P, Gill B S. Identification and mapping of a tiller inhibition gene () in wheat., 2007, 114: 285–294
[41] Luo Z W, Wu C I, Kearsky M J. Precision and high-resolution mapping of quantitative trait loci by use of recurrent selection, backcross or intercross schemes., 2002, 161: 915–929
[42] Price A H. Believe it or not, QTLs are accurate., 2006, 11: 213–216
[43] The International Barley Genome Sequencing Consortium. A physical, genetic and functional sequence assembly of the barley genome., 2012, 491: 711–716
Mapping QTLs for Phosphorus Efficiency at Tillering Stage under Different Phosphorus Levels in Barley (L.)
HU De-Yi1, CAI Lu1, CHEN Guang-Deng1,*, ZHANG Xi-Zhou1, and Chunji LIU2
1College of Resources, Sichuan Agricultural University, Chengdu 611130, China;2CSIRO Agriculture, 306 Carmody Road, St Lucia, QLD 4067, Australia
Phosphorus (P) nutrition has close relationship with the quality and yield of barley and the genetic mechanism of P-efficient and variety improvement become hot research topics in recent years. In this study, we mapped quantitative trait loci (QTLs) for P-efficient traits using a recombinant inbred line (RIL) population derived fro ma cross between Baud in and CN4079. P-utilization efficiency (PUE), P-absorption efficiency (PAE), and dry weight (DW) of shoots and roots, as well as tiller number (TN) were evaluated in low-P (0.02 mmol L-1KH2PO4) and normal-P (0.2 mmol L-1KH2PO4) conditions. QTL sassociated with these traits were mapped onto a barley linkage map and their candidate genes were predicted. Phenotyping results showed continuous variation and transgressive segregation in all traits tested. A total of 16 QTLs were detected on chromosomes 2H, 3H, and 5H under low-P and normal-P conditions, with explained phenotypic variance ranging from 14.1% to 28.5%. Three QTLs associated with PUE were mapped on 3H and their positive alleles were all from Baud in. Among them,andwere located in common region with PAE lociand, whereaswas very closely tocontrolling TN. Three QTLs for PAE were mapped on 5H, among whichandwere from CN4079. The two PAE loci were located in adjacent region intervals of PUE lociandand DW lociand. In the four chromosomal fragments harboring P-efficiency loci, except forthat contained candidate genes in phosphoric acid metabolism and phospholipid metabolism, the remaining loci all containedgenes in phosphate transporter and related genes in phosphoric acid metabolism and phospholipid metabolism.
L.; Tillering stage; Phosphorus efficiency; RIL; QTL mapping
10.3724/SP.J.1006.2017.01746
本研究由国家自然科学基金项目(31401377), 四川省科技支撑计划项目(2014NZ0008)和四川省教育厅重点项目(14ZA0002)资助。
This study was supported by the National Natural Science Foundation of China (31401377), the Key Technology R&D Program of Sichuan Province (2014NZ0008), and the Key Project of Education Department of Sichuan Province (14ZA0002).
陈光登, E-mail: gdchen@sicau.edu.cn
E-mail: 934074633@qq.com
2016-12-12; Accepted(接受日期): 2017-07-23; Published online(网络出版日期):2017-08-10.
http://kns.cnki.net/kcms/detail/11.1809.S.20170810.1616.006.html

