姜黄素对Aβ25-35诱导的PC12细胞caspase-3、caspase-8和caspase-9表达的影响
商 华, 任宪辉, 杨红欣, 徐 凤△
(牡丹江医学院第二附属医院 1老年病科, 2检验科, 黑龙江 牡丹江 157010; 3铁北社区卫生服务中心, 黑龙江 牡丹江 157011)
姜黄素(curcumin)是从传统中药姜黄和郁金等姜黄属植物的根茎中提取出的一种低分子量酚类化合物,因其具有毒副作用小和生物学活性广泛等优势而受到广泛关注,具有抗炎、抗氧化、免疫调节、抗肿瘤和神经保护等多种药理作用[1]。近年来,国内外关于姜黄素用于阿尔茨海默病(Alzheimer disease,AD)治疗的研究报道较多,提示其在预防和治疗AD方面具有潜在的疗效[2-4]。AD是临床上常见的好发于老年人群的脑神经退行性疾病,也称为老年性痴呆症,其特征表现为进行性记忆丧失和(或)认知能力受损[5]。AD的主要病理特征包括β-淀粉样蛋白(amyloid-β,Aβ)聚集成老年斑、突触受损、小胶质细胞活化、氧化应激和线粒体功能障碍等[6]。研究发现,Aβ沉积引发的神经炎症反应在AD病程中起核心作用,最终导致突触和神经元的损害[7]。现阶段,对于AD的治疗方法十分有限,随着对AD研究的深入,天然药物在预防和治疗AD的作用日益受到重视[8-9]。但是,有关姜黄素治疗AD的作用是否与线粒体凋亡途径有关则鲜见报道。本研究利用β-淀粉样蛋白25-35(Aβ25-35)诱导大鼠肾上腺嗜铬细胞瘤PC12细胞,观察姜黄素对Aβ25-35诱导的PC12细胞存活率、乳酸脱氢酶(lactate dehydrogenase,LDH)释放率和细胞凋亡的影响,以及凋亡相关酶胱天蛋白酶(caspase)-3、caspase-8和caspase-9活性和表达的变化,探讨caspase-3、caspase-8和caspase-9在姜黄素抗Aβ25-35诱导的PC12细胞凋亡过程中的可能作用。
材 料 和 方 法
1 细胞株
PC12细胞购自上海中国科学院细胞库,置于含10%胎牛血清和1%抗生素(青霉素和链霉素)的高糖DMEM培养基中,37 ℃、5% CO2及饱和湿度下过夜培养。次日以无糖DMEM培养基更换高糖DMEM培养基,37 ℃、5% CO2及饱和湿度下培养。当细胞融合度达70%~80%时传代,贴壁后细胞呈梭型,并有较长的突触,取对数生长期细胞用于后续实验。
2 药物和试剂
姜黄素、Aβ25-35、AnnexinV-FITC/PI试剂盒和生物素标记的山羊抗兔IgG II 抗(Sigma);DMSO(AltochemLacq);DMEM培养基(HyClone Thermo);胎牛血清(Gibco);MTT(Amresco);LDH检测试剂盒(南京建成);兔抗人caspase-3、caspase-8和caspase-9单克隆抗体(Santa Cruz);其它试剂均为国产或进口分析纯。
3 仪器
HERAcell 240i CO2培养箱(Thermofisher Scientific);GS-15R低温高速离心机(Beckman Coulter);RT-6100酶标仪(Rayto);PowerPac HV电泳仪(Bio-Rad);FACScan流式细胞仪(BD)。
4 方法
4.1姜黄素的配制 将姜黄素溶于0.1% DMSO中,配制成40 μmol/L溶液,-20 ℃保存。临用时以0.1% DMSO稀释到所需浓度。
4.2Aβ25-35的配制 将Aβ25-35冻干粉溶于DMEM培养基,配制成200 μmol/L储备液,置于37 ℃培养箱孵育7 d,使之老化,过滤分装,-20 ℃保存。临用时以DMEM培养基稀释到所需浓度。
4.3MTT实验检测细胞活力 将对数生长期的PC12细胞按照5×107/L的密度接种于96孔板中,每孔100 μL,37 ℃、5% CO2及饱和湿度下培养24 h。参照文献[10]及预实验结果,每孔分别加入0[空白对照(blank control)组,加入与姜黄素等体积的DMEM培养基]、1.25、2.5、5、10、20和40 μmol/L的姜黄素,另设模型(model)组(加入与姜黄素等体积的DMEM培养基),37 ℃、5% CO2及饱和湿度下培养2 h后,除空白对照组外每孔分别加入40 μmol/L Aβ25-35,37 ℃、5% CO2及饱和湿度下继续培养24 h。PBS洗涤1次,每孔再分别加入0.5 g/L的MTT溶液,37 ℃、5% CO2及饱和湿度下培养1 h,吸取上清液。每孔分别加入100 μL DMSO以溶解紫色沉淀,室温摇床10 min,待完全溶解紫色沉淀后,于RT-6100酶标仪测定450 nm波长处吸光度(A),GraphPad Prism 5.0计算细胞存活率。每个剂量组设6个平行孔,取6孔平均值。
4.4LDH 释放实验 按方法4.3分组培养细胞,参考LDH检测试剂盒说明书,测定姜黄素对Aβ25-35诱导的PC12细胞LDH释放率的影响。每个剂量组设6个平行孔,取6孔平均值。
4.5Annexin V-FITC/PI双染流式细胞术分析细胞凋亡 将对数生长期的PC12细胞按照5×107/L的密度接种于96孔板中,每孔100 μL,在37 ℃、5% CO2及饱和湿度下培养24 h。参照MTT和LDH释放实验的检测结果,将PC12细胞随机分为空白对照(blank control)组(每孔加入与姜黄素等体积DMEM培养基)、模型(model)组(每孔加入与姜黄素等体积的DMEM培养基)、姜黄素10 μmol/L组(每孔加入10 μmol/L姜黄素)和姜黄素20 μmol/L组(每孔加入20 μmol/L姜黄素)。各组均于37 ℃、5% CO2及饱和湿度下培养2 h,除空白对照组外每孔分别加入40 μmol/L Aβ25-35,37 ℃、5% CO2及饱和湿度下继续培养24 h。1 200 r/min离心5 min,收集细胞,1 mL PBS冲洗2次,结合缓冲液中重悬成单细胞悬液;最后加入50 mg/L的Annexin V-FITC和PI液各5 μL,37 ℃、5% CO2及饱和湿度下培养60 min,用流式细胞术检测凋亡情况。每个剂量组设6个平行孔,取6孔平均值。
4.6凋亡相关酶活性的检测 按方法4.5分组培养细胞。严格按照caspase-3、caspase-8和caspase-9活性测定试剂盒说明进行检测,以酶标仪于波长405 nm处的吸光度(A)表示活性变化。每份样品检测6次,取平均值。
4.7Western blot检测凋亡相关酶的表达 收集分组培养的细胞,加入含有25 mmol/L HEPES、1% Tris-HCl、50 mmol/L NaCl、1 mmol/L EDTA、1 mmol/L EGTA、1 mmol/L PMSF和1 mg/L亮肽素的冰冷裂解缓冲液(pH 7.4),10 000 r/min、 4 ℃离心10 min,弃沉渣,收集上清液,BCA法测定总蛋白浓度。取30 μg蛋白上样后,进行10% SDS-PAGE。当电泳完成后,电转至0.45 μm的PVDF膜上,5%脱脂奶粉PBST (含25 mmol/L pH 7.5的Tris、150 mmol/L NaCl和0.1% Tween 20) 4 ℃封闭2 h。然后加入兔抗人caspase-3、caspase-8和caspase-9单克隆抗体(均以1∶1 000稀释),4 ℃孵育过夜。PBST洗涤后,加入生物素标记的山羊抗兔 II 抗(1∶500稀释)室温孵育2 h。PBST洗涤3次,每次5 min,ECL化学发光试剂显色,Bio-Rad凝胶成像系统对各组条带进行计值及统计分析。以β-actin为内参照,抗体孵育方法与上述方法相同,蛋白的相对表达水平=目标蛋白表达水平/β-actin蛋白表达水平。每份样品检测6次,取平均值。
5 统计学处理
用SPSS 17.0软件进行数据处理和统计分析。计量数据用均数±标准差(mean±SD)表示,多组间均数比较采用单因素方差分析,组间两两比较采用SNK-q检验,以P<0.05 表示差异有统计学意义。
结 果
1 姜黄素对Aβ25-35诱导的PC12细胞存活率的影响
MTT检测结果显示,与空白对照组比较,模型组Aβ25-35诱导的PC12细胞存活率显著降低,差异具有统计学意义(P<0.01);与模型组比较,预先加入10 μmol/L和20 μmol/L姜黄素可显著提高细胞存活率,差异具有统计学意义(P<0.05或P<0.01),见图1。
2 姜黄素对Aβ25-35诱导的PC12细胞LDH释放率的影响
与空白对照组比较,模型组Aβ25-35诱导的PC12细胞LDH释放率显著升高,差异具有统计学意义(P<0.01);与模型组比较,预先加入10 μmol/L和20 μmol/L姜黄素可显著降低LDH释放率,差异具有统计学意义(P<0.05或P<0.01),见图2。
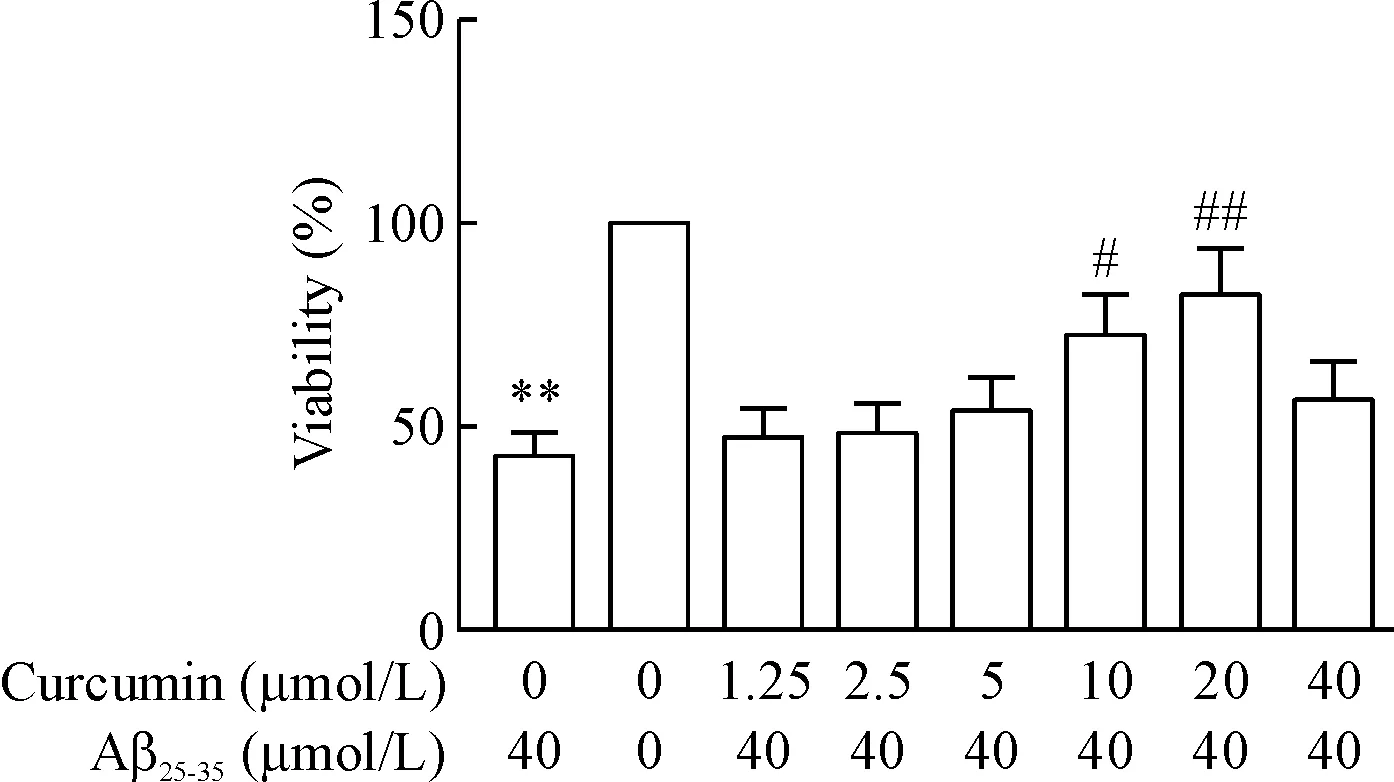
Figure 1. The effects of curcumin at different concentrations on the viability of the PC12 cells induced by Aβ25-35.Mean±SD.n=6.**P<0.01vsblank control group;#P<0.05,##P<0.01vsmodel group.
图1不同浓度姜黄素对Aβ25-35诱导的PC12细胞存活率的影响
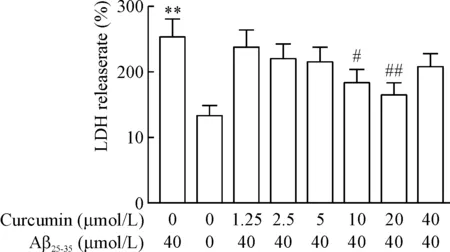
Figure 2. The effects of curcumin at different concentrations on the LDH release rates of the PC12 cells induced by Aβ25-35.Mean±SD.n=6.**P<0.01vsblank control group;#P<0.05,##P<0.01vsmodel group.
图2不同浓度姜黄素对Aβ25-35诱导的PC12细胞LDH释放率的影响
3 姜黄素对Aβ25-35诱导的PC12细胞凋亡的影响
流式细胞术检测结果显示,与空白对照组比较,模型组Aβ25-35诱导的PC12细胞凋亡率显著升高,差异具有统计学意义(P<0.01);与模型组比较,姜黄素10 μmol/L组和姜黄素20 μmol/L组细胞凋亡率显著降低,差异具有统计学意义(P<0.05或P<0.01),见图3。
4 姜黄素对Aβ25-35诱导的PC12细胞凋亡相关酶活性的影响
比色分析结果显示,与空白对照组比较,模型组Aβ25-35诱导的PC12细胞caspase-3、caspase-8和caspase-9的酶活性显著升高,差异具有统计学意义(P<0.01);与模型组比较,姜黄素10 μmol/L组和姜黄素20 μmol/L组细胞的caspase-3、caspase-8和caspase-9酶活性显著降低,差异具有统计学意义(P<0.05或P<0.01),见表1。
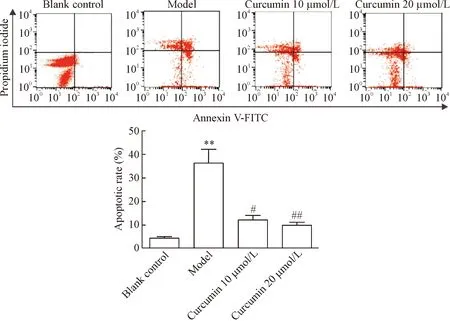
Figure 3. The results of flow cytometry analysis for determining the effects of curcumin on the apoptotic rates of the PC12 cells induced by Aβ25-35. Mean±SD.n=6.**P<0.01vsblank control group;#P<0.05,##P<0.01vsmodel group.
图3姜黄素对Aβ25-35诱导的PC12细胞凋亡的影响
表1姜黄素对Aβ25-35诱导的PC12细胞caspase-3、caspase-8和caspase-9酶活性的影响
Table 1. The effects of curcumin on the activity of caspase-3, caspase-8 and caspase-9 in the PC12 cells induced by Aβ25-35(Mean±SD.n=6)
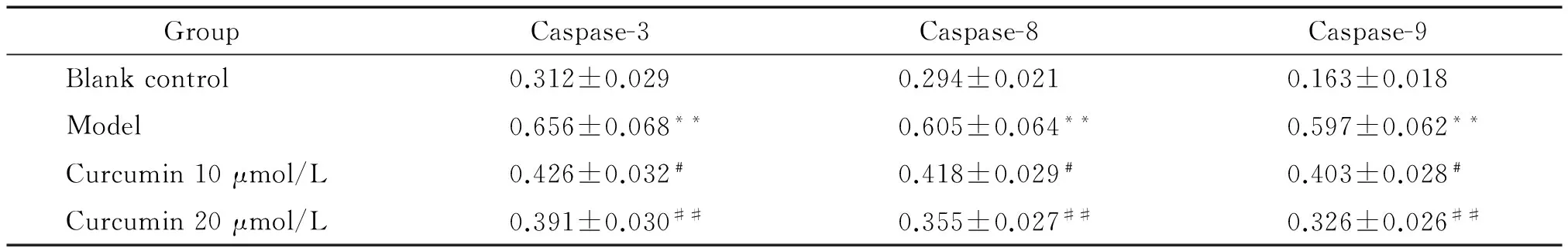
GroupCaspase-3Caspase-8Caspase-9Blankcontrol0.312±0.0290.294±0.0210.163±0.018Model0.656±0.068**0.605±0.064**0.597±0.062**Curcumin10μmol/L0.426±0.032﹟0.418±0.029﹟0.403±0.028﹟Curcumin20μmol/L0.391±0.030##0.355±0.027##0.326±0.026##
**P<0.01vsblank control group;#P<0.05,##P<0.01vsmodel group.
5 姜黄素对Aβ25-35诱导的PC12细胞凋亡相关蛋白相对表达的影响
Western blot分析结果显示,与空白对照组比较,模型组Aβ25-35诱导的PC12细胞caspase-3、caspase-8和caspase-9蛋白相对表达水平显著升高,差异具有统计学意义(P<0.01);与模型组比较,姜黄素10 μmol/L组和姜黄素20 μmol/L组细胞的caspase-3、caspase-8和caspase-9蛋白相对表达水平显著降低,差异具有统计学意义(P<0.05或P<0.01),见图4、表2。
讨 论
本研究发现,姜黄素可显著升高Aβ25-35诱导的PC12细胞的存活率。同时,本研究也发现,姜黄素可降低Aβ25-35诱导的PC12细胞LDH释放率。LDH是一种糖酵解酶,主要存在于机体组织细胞的胞质内,当细胞凋亡或坏死时,细胞膜结构损害或完全裂解,胞质内的LDH就会释放外泄到培养液里[11]。因此,测定LDH释放率可以间接反映细胞的损伤情况或药物对细胞的毒性作用[12]。以上结果提示,姜黄素对Aβ25-35诱导的PC12细胞具有一定的保护作用。

Figure 4. The effects of curcumin on the protein levels of caspase-3, caspase-8 and caspase-9 determined by Western blot.
图4Westernblot分析结果
表2姜黄素对Aβ25-35诱导的PC12细胞caspase-3、caspase-8和caspase-9相对表达水平的影响
Table 2. The effects of curcumin on the relative expression levels of caspase-3, caspase-8 and caspase-9 in the PC12 cells induced by Aβ25-35(Mean±SD.n=6)
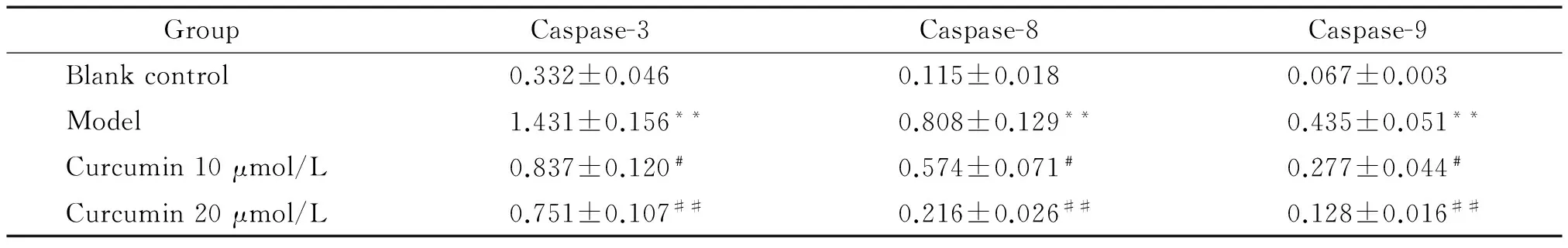
GroupCaspase-3Caspase-8Caspase-9Blankcontrol0.332±0.0460.115±0.0180.067±0.003Model1.431±0.156**0.808±0.129**0.435±0.051**Curcumin10μmol/L0.837±0.120﹟0.574±0.071﹟0.277±0.044﹟Curcumin20μmol/L0.751±0.107##0.216±0.026##0.128±0.016##
**P<0.01vsblank control group;#P<0.05,##P<0.01vsmodel group.
本研究中流式细胞术分析证实,姜黄素亦能抑制Aβ25-35诱导的PC12细胞凋亡。细胞凋亡是指发生在生理状态下的细胞程序性死亡,其特点是不发生炎症反应,细胞凋亡受分子水平的调控[13]。为探讨姜黄素抗Aβ25-35诱导的PC12凋亡的可能机制,本研究对凋亡相关蛋白caspase-3、caspase-8和caspase-9进行了检测。Caspases是一个在细胞凋亡中起关键作用的酶家族,是细胞凋亡的介导者和执行者,其激活或超量表达均会引起细胞发生凋亡,因此又称凋亡蛋白酶,对凋亡起关键作用[14]。有研究表明,细胞的凋亡是由于caspase逐步发生级联反应引起的[15]。Caspase-3位于caspases级联反应的下游,被认为是诱导细胞凋亡真正的实施者[16]。经典的细胞凋亡途径分为2条,包括细胞外途径和细胞内凋亡途径[17]。在细胞外途径中,死亡配体和相对应的受体结合形成死亡信号,接着再与信号传导分子相连接,进一步与caspase-8结合,形成死亡诱导信号复合物,从而使caspase-8活化,当caspase-8直接与caspase-3发生作用,caspase-3被激活,进而诱导细胞凋亡[18];而细胞内途径也称为线粒体途径,在此途径中,凋亡刺激因子与凋亡蛋白酶激活因子1(apopto-tic protease-activating factor 1,APAF1)形成多聚复合物,然后与胞质中的caspase-9前体结合,形成巨大复合物,巨大复合物引起caspase-9前体活化,caspase-9再激活下游的caspase-3,从而发生级联反应,最后诱导细胞凋亡[19]。本研究结果显示,姜黄素显著降低Aβ25-35诱导的PC12细胞caspase-3、caspase-8和caspase-9的活性并下调其表达。以上结果提示,姜黄素可能通过下调caspase-3、caspase-8和caspase-9的表达从而抑制Aβ25-35诱导的PC12细胞凋亡。
综上所述,姜黄素对Aβ25-35诱导的PC12细胞具有明显的保护作用,抑制其凋亡。姜黄素的抗凋亡机制可能与下调caspase-3、caspase-8和caspase-9表达有关。至于其它机制是否参与姜黄素抗Aβ25-35诱导的PC12细胞凋亡,如线粒体凋亡途径中的细胞色素C,将有待进一步探讨。
[1] 周晶晶, 郑昱辰, 李明月, 等. 姜黄素的药理作用研究进展[J]. 吉林医药学院学报,2016, 37(4):304-307.
[2] 叶莉莎, 韩 园, 刘启星, 等. 姜黄素对阿尔茨海默病大鼠学习记忆及HMGB1 和JNK 表达的影响[J]. 中国病理生理杂志, 2014, 30(6):1114-1118.
[3] 陈 鑫. 姜黄素对阿尔茨海默病小鼠学习记忆能力及海马细胞的影响[J]. 中国老年学杂志, 2016, 36(24):6056-6058.
[4] Gao S, Duan X, Wang X, et al. Curcumin attenuates arsenic-induced hepatic injuries and oxidative stress in experimental mice through activation of Nrf2 pathway, promotion of arsenic methylation and urinary excretion[J]. Food Chem Toxicol, 2013, 59(3):739-747.
[5] Carro E, Bartolomé F, Bermejo-Pareja F, et al. Early diagnosis of mild cognitive impairment and Alzheimer’s disease based on salivary lactoferrin[J]. Alzheimers Dement (Amst), 2017, 8:131-138.
[6] Kamat PK, Kalani A, Rai S, et al. Mechanism of oxidative stress and synapse dysfunction in the pathogenesis of Alzheimer’s disease: understanding the therapeutics stra-tegies[J]. Mol Neurobiol, 2016, 53(1):648-661.
[7] 安鹏远, 王钦文, 徐淑君. 不同聚集状态的Aβ寡聚体在阿尔茨海默病发生中的作用机制研究进展[J]. 生物化学与生物物理进展, 2016, 43(2):109-114.
[8] Abuznait AH, Qosa H, Busnena BA, et al. Olive-oil-derived oleocanthal enhances β-amyloid clearance as a potential neuroprotective mechanism against Alzheimer’s di-sease:invitroandinvivostudies[J]. ACS Chem Neuro-sci, 2013, 4(6):973-982.
[9] Ansari N, Khodagholi F. Natural products as promising drug candidates for the treatment of Alzheimer’s disease: molecular mechanism aspect[J]. Curr Neuropharmacol, 2013, 11(4):414-429.
[10] 孙小康, 陈生弟, 赵延欣, 等. 姜黄素抑制俘淀粉样蛋白25~35诱导PC12细胞凋亡的实验研究[J]. 上海医学, 2007, 30(11):843-846.
[11] 李 冷, 钟晓琴, 卢传坚, 等. 紫草素对人角质形成细胞HaCaT增殖抑制以及细胞毒性的初步研究[J]. 时珍国医国药, 2017, 28(4):857-860.
[12] Robey RW, Chakraborty AR, Basseville A, et al. Histone deacetylase inhibitors: emerging mechanisms of resistance[J]. Mol Pharm, 2011, 8(6):2021-2031.
[13] Emoto Y, Yoshizawa K, Kinoshita Y, et al. Green tea extract attenuates MNU-induced photoreceptor cell apoptosis via suppression of heme oxygenase-1[J]. J Toxicol Pathol, 2016, 29(1):61-65.
[14] 张 巍, 金 瑛, 朱文赫, 等. 肽基脯氨酰顺反异构酶抑制剂胡桃醌对宫颈鳞癌SiHa细胞凋亡的作用[J]. 中国病理生理杂志, 2015, 31(3):543-546.
[15] 石元英, 邓立东, 饶伟文, 等. 牡荆素对人肝细胞癌SMMC-7721细胞的增殖抑制作用及其机制的影响[J]. 中国医院药学杂志, 2016, 36(5):366-371.
[16] Langford MP, McGee DJ, Ta KH, et al. Multiple caspa-ses mediate acute renal cell apoptosis induced by bacterial cell wall components[J]. Ren Fail, 2011, 33(2):192-206.
[17] Walther U, Emmrich K, Ramer R, et al. Lovastatin lactone elicits human lung cancer cell apoptosis via a COX-2/PPARγ-dependent pathway[J]. Oncotarget, 2016, 7(9):10345-10362.
[18] Brasseur K, Auger P, Asselin E, et al. Parasporin-2 from a new bacillus thuringiensis 4R2 strain induces caspases activation and apoptosis in human cancer cells[J]. PLoS One, 2015, 10(8):e0135106.
[19] Means JC, Venkatesan A, Gerdes B, et al. Drosophila spaghetti and doubletime link the circadian clock and light to caspases, apoptosis and tauopathy[J]. PLoS Genet, 2015, 11(5):e1005171.

