胰岛素泵在住院糖尿病患者糖皮质激素治疗过程中的应用
史丽,任卫东,董运成,张丽茜,张志英,谷君,许峥嵘,袁小飞,杨金良,陈雷刚
(河北北方学院附属第一医院,内分泌科1、血液科2、风湿免疫科3、皮肤科4,河北张家口075000)
目前糖尿病已成为较为常见的慢性代谢性疾病之一,且我国已成为世界上糖尿患者数最多的国家。据相关调查显示,我国约有9 000万人患有糖尿病,发病率高达10%甚至更高[1-2]。随着糖尿病发病率以及患病率的不断增高、人类寿命的不断延长,糖尿病患者合并其他疾病的概率也随之明显增加[3]。糖皮质激素通常禁用于糖尿病患者,但由于糖皮质激素能够有效减轻炎症反应、抑制免疫反应、对抗过敏性疾病、对抗毒素等作用,故在多种急慢性疾病的治疗中具有不可忽视的应用价值[4-5],且在某些特殊疾病治疗中,糖皮质激素是不可替代的治疗用药[6]。但糖皮质激素对糖代谢过程具有较为严重的干扰作用,能够促使血糖水平的增高,加重糖尿病病情,导致多种不良反应的发生,尤其是大剂量糖皮质激素使用过程中,甚至可能导致糖尿病酮症酸中毒等严重并发症,同时也不利于各种糖尿病合并症的治疗与控制[7]。对于糖尿病合并其他必须使用糖皮质激素治疗的患者,在应用糖皮质激素治疗过程中,必须严格监控血糖变化,并调整血糖控制方案,将血糖水平控制在较为理想的水平,以减少糖尿病并发症、高血糖所致的各种不良反应,提高患者生活质量。本文旨在探讨糖尿病患者接受糖皮质激素治疗过程中胰岛素泵的应用价值。
1 资料与方法
1.1 一般资料选择2014年3月至2016年3月期间在河北北方学院附属第一医院内分泌科、血液病科、皮肤科、风湿免疫科住院治疗的糖尿病患者60例,所有患者均需要糖皮质激素治疗,其中男性38例,女性22例;年龄46~73岁,平均(58.8±11.6)岁;糖尿病病程3~21年,平均(12.4±8.9)年。所有患者均符合世界卫生组织于1999年推荐的糖尿病分型和诊断标准[8]。60例患者中伴有皮肤疾病24例,风湿免疫性疾病22例,血液系统疾病10例,其他必须接受糖皮质激素治疗的患者4例。排除标准:①严重心、脑血管疾病患者;②严重肝、肾、肺等重要脏器功能障碍性疾病患者;③糖皮质激素使用禁忌者;④糖尿病以外的其他内分泌疾病以及高血压患者;⑤近期急慢性感染性疾病者;⑥营养障碍性疾病者;⑦出凝血功能障碍者;⑧糖尿病严重并发症患者;⑨入院前1周内糖皮质激素、利尿剂、解热镇痛药等影响糖代谢的药物使用者。将60例患者以随机数表法分为观察组与对照组,每组30例,两组患者在性别、年龄、糖尿病病程、合并疾病、所用糖皮质激素、给药方式等方面比较差异均无统计学意义(P>0.05),具有可比性,见表1。
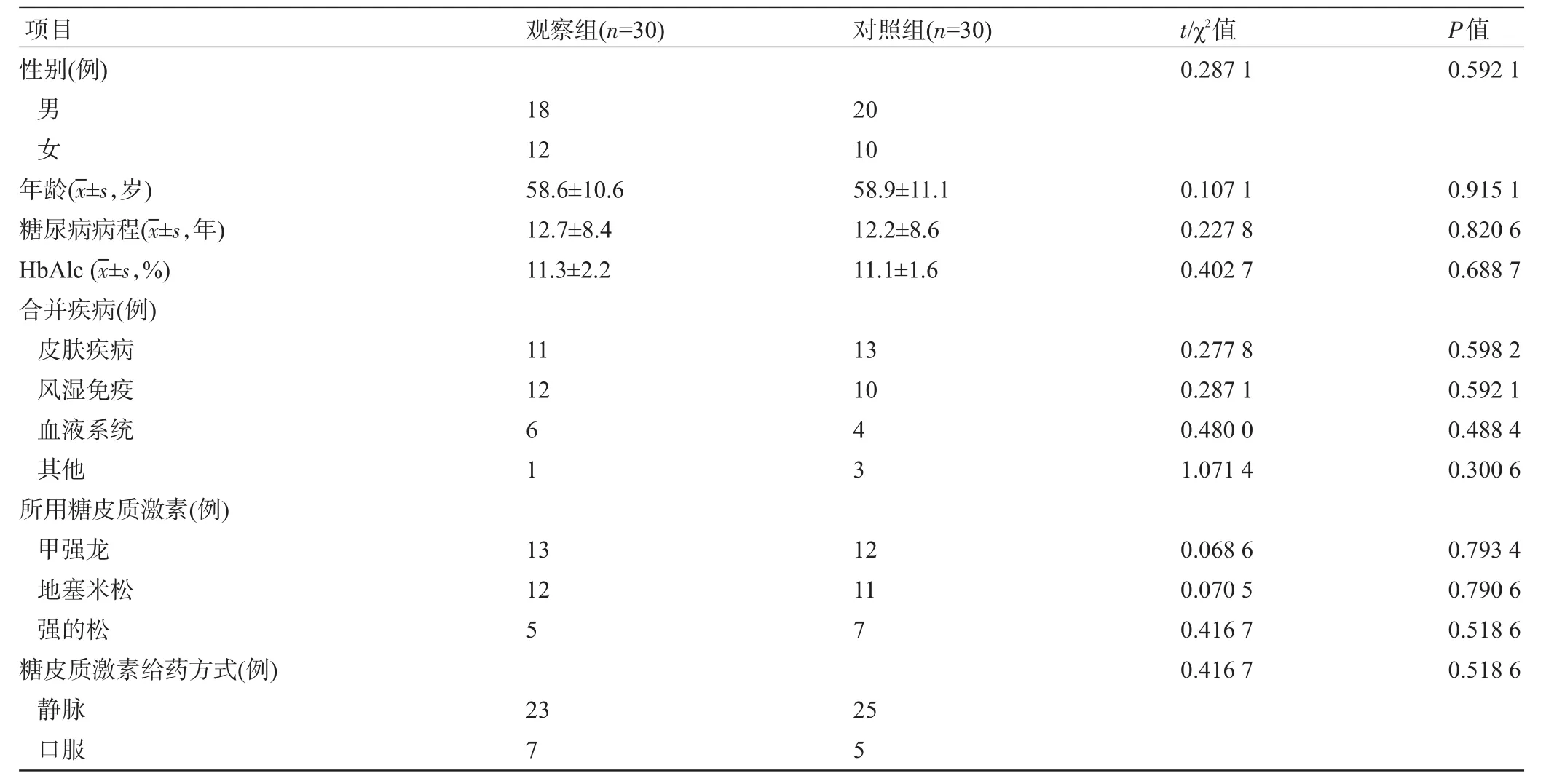
表1 两组患者的一般资料比较
1.2 方法
1.2.1 糖皮质激素治疗前准备所有患者入院后均根据具体病情给予相应的降压、调脂、扩血管、营养神经、抗感染、纠正电解质紊乱等针对疾病本身的治疗,待血糖控制平稳(空腹血糖4.4~7 mmol/L,餐后血糖4~10 mmol/L),且无其他应急情况存在,即开始试验。
1.2.2 糖皮质激素治疗60例患者分别根据具体病情给予甲强龙(注射用甲泼尼龙琥珀酸钠,Pfizer Manufacturing Belgium NV,国药准字:H20130301)、地塞米松(地塞米松磷酸钠注射液,天津金耀药业有限公司,国药准字:H12020514)静脉滴注或强的松(醋酸泼尼松片,浙江仙琚制药股份有限公司,国药准字:H33021207)口服治疗,剂量均换算为泼尼松:泼尼松5 mg相当于地塞米松0.75 mg相当于甲泼尼龙4 mg,给药剂量为30~252.5 mg,每日上午给药。
1.2.3 血糖控制方法两组患者均采用胰岛素治疗。若患者在本次入院治疗以前即已使用胰岛素,则胰岛素起始剂量不变,之前未使用胰岛素患者,则以0.5 U/kg计算胰岛素起始剂量。观察组给予门冬胰岛素(诺和锐,丹麦诺和诺德公司,国药准字:J20100124),以50%为基础剂量,模拟人体胰岛素分泌的模式以胰岛素泵(美敦力712型胰岛素泵)持续泵入,50%作为餐前剂量,分别于三餐前泵入。对照组则给予门冬胰岛素(诺和锐,丹麦诺和诺德公司,国药准字:J20100124)三餐前皮下注射,精蛋白生物合成人胰岛素(诺和灵N,诺和诺德(中国)制药有限公司,国药准字J20100031)睡前皮下注射。两组患者均固定每日7:00、12:00、17:00进餐,且每天每餐热量供给相对固定。两组患者经上述治疗2周后评价疗效。
1.3 观察指标
1.3.1 血糖监测采用雷兰动态血糖监测系统(DGMS,圣美迪诺公司)对受试者进行连续血糖监测,了解三餐前、三餐后2 h、睡前血糖,使用胰岛素泵患者加测凌晨3:00血糖,并根据血糖监测结果对胰岛素用量进行调整,1周后进行效果评价。
1.3.2 血糖变化对比两组患者空腹血糖(FPG)、糖皮质激素给药后4 h血糖。
1.3.3 血糖控制情况对比两组患者上述治疗及血糖监测1周后三餐前空腹血糖(FPG)、三餐后2 h(2 hPG)及睡前血糖。对比两组患者血糖达标时间、低血糖次数,计算血糖水平的标准差(standard deviation of blood glucose,SDBG)、平均血糖波动幅度(mean amplitude of glycemic ecxurions,MAGE)。
1.3.4 胰岛素用量详细记录两组患者治疗过程中的胰岛素使用剂量。
1.3.5 不良反应详细记录两组患者治疗过程中酮症酸中毒、高渗性昏迷、应激性溃疡等不良反应发生率。
1.4 统计学方法应用SPSS19.0统计软件进行数据分析,计量资以均数±标准差(x-±s)表示,两样本均数比较采用t检验,率的比较采用χ2检验,以P<0.05为差异具有统计学意义。
2 结果
2.1 两组患者糖皮质激素用药前后血糖比较两组患者糖皮质激素给药前血糖比较差异无统计学意义(P>0.05),给药后4 h,两组血糖均显著升高,且给药后4 h观察组显著低于对照组,差异均具有显著统计学意义(P<0.01)。观察组SDBG、MAGE均明显低于对照组,差异具有显著统计学意义(P<0.01),见表2。
表2 两组患者糖皮质激素用药前后血糖比较(±s)
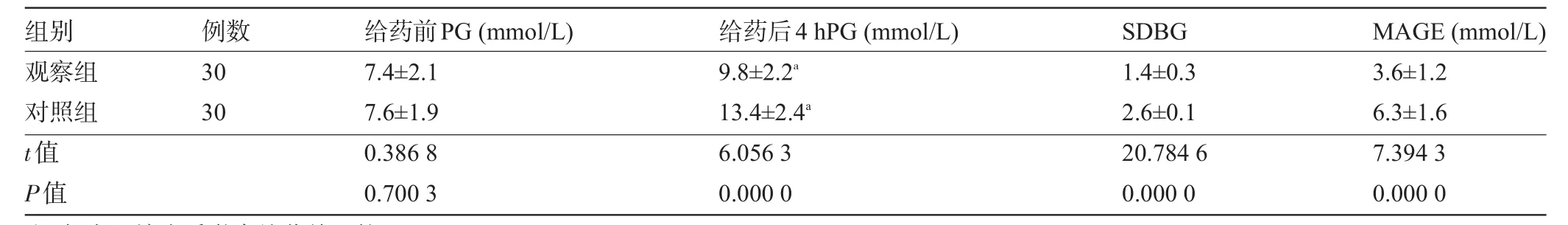
表2 两组患者糖皮质激素用药前后血糖比较(±s)
注:与本组糖皮质激素给药前比较,aP<0.01。
组别观察组对照组t值P值例数30 30给药前PG(mmol/L)7.4±2.1 7.6±1.9 0.386 8 0.700 3给药后4 hPG(mmol/L)9.8±2.2a 13.4±2.4a 6.056 3 0.000 0 SDBG 1.4±0.3 2.6±0.1 20.784 6 0.000 0 MAGE(mmol/L)3.6±1.2 6.3±1.6 7.394 3 0.000 0
2.2 两组患者血糖控制情况比较观察组患者FPG、2 hPG及睡前血糖均明显低于对照组,差异均具有显著统计学意义(P<0.01),见表3。
表3 两组患者血糖控制情况比较±s)
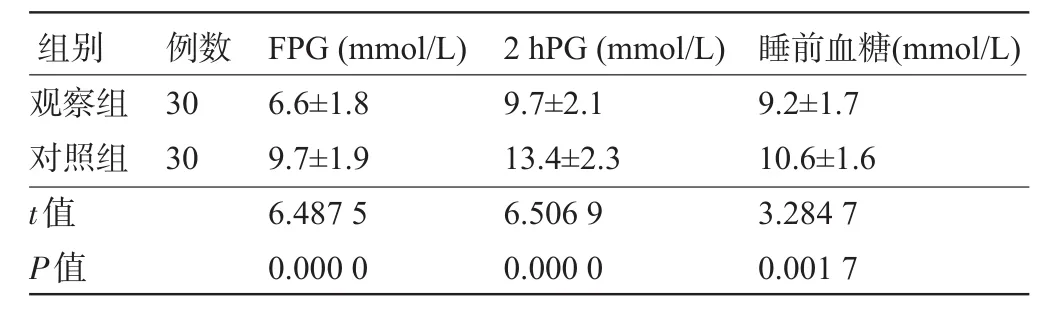
表3 两组患者血糖控制情况比较±s)
组别观察组对照组t值P值例数30 30 FPG(mmol/L)6.6±1.8 9.7±1.9 6.487 5 0.000 0 2 hPG(mmol/L)9.7±2.1 13.4±2.3 6.506 9 0.000 0睡前血糖(mmol/L)9.2±1.7 10.6±1.6 3.284 7 0.001 7
2.3 两组患者血糖达标时间、低血糖次数和胰岛素用量比较观察组患者血糖达标时间明显短于对照组,低血糖次数明显少于对照组,胰岛素用量明显低于对照组,差异均具有显著统计学意义(P<0.01),见表4。
表4 两组患者血糖达标时间、低血糖次数和胰岛素用量比较±s)
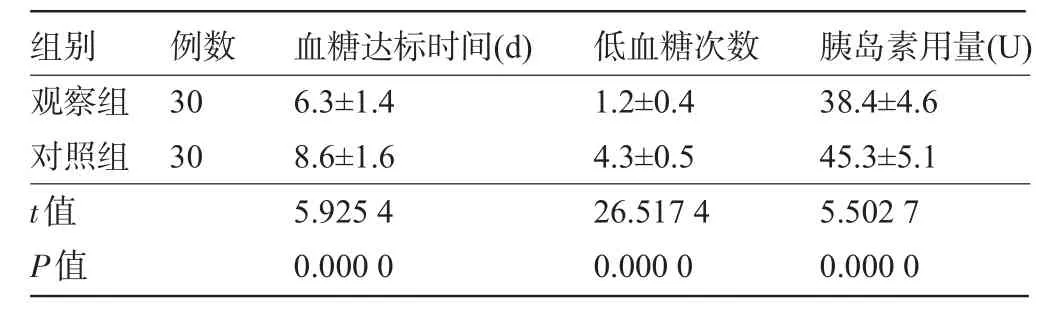
表4 两组患者血糖达标时间、低血糖次数和胰岛素用量比较±s)
组别观察组对照组t值P值例数30 30血糖达标时间(d)6.3±1.4 8.6±1.6 5.925 4 0.000 0低血糖次数1.2±0.4 4.3±0.5 26.517 4 0.000 0胰岛素用量(U)38.4±4.6 45.3±5.1 5.502 7 0.000 0
2.4 两组患者的不良反应比较两组患者治疗过程中均未见酮症酸中毒、高渗性昏迷、应激性溃疡等不良反应。
3 讨论
糖尿病病程长,多伴有多器官系统损害,最终可因并发症、合并症导致患者残疾或死亡。该病不仅对患者造成严重痛苦,同时也为患者的家庭、社会造成了沉重的负担。糖尿病患者机体胰岛素分泌明显不足,或受体对胰岛素的敏感性降低,这些改变不仅导致患者血糖的增高,也导致细胞能量代谢障碍,进而产生代谢性应激[9]。代谢性应激不仅能够激活导致下丘脑-垂体-肾上腺皮质轴系统,同时糖尿病患者糖皮质激素的负反馈机制也可被减弱,从而导致体内糖皮质激素水平增高,这也是糖尿病患者的一个重要表现[10]。
糖尿病患者机体免疫功能减低,可同时合并皮肤疾病、呼吸系统疾病、风湿免疫系统疾病、血液系统疾病等多种慢性疾病。上述部分疾病的治疗中,糖皮质激素的应用是无可替代的,且在多年的临床应用中取得了较为理想的疗效[11-12]。糖皮质激素也称为肾上腺皮质激素,在人体内是由肾上腺皮质分泌的一种类甾体激素,也可人工合成。该物质可用于普通抗菌药物难以达到理想疗效的严重急性呼吸综合征、败血症等多种疾病,能够有效对患者的糖、脂肪、蛋白质的生物合成与代谢产生调节作用,同时具有较强的抗炎、抗免疫应答、抗毒性、抗休克等多种临床作用[13]。临床应用过程中,糖皮质激素在严重感染性疾病、炎症性疾病、支气管哮喘、COPD等多种呼吸系统疾病、系统性红斑狼疮等自身免疫性疾病、过敏性鼻炎等过敏性疾病、多种皮肤疾病、各种休克、血液系统疾病以及变态反应性疾病中使用较为广泛,且均已取得了肯定的临床疗效。但糖皮质激素对患者血糖的影响是不可忽视的,也是临床在该药物使用过程中难以避免又较为棘手的一个问题。糖皮质激素能够在很大程度上升高患者血糖,加重糖尿病病情,严格来说,糖尿病患者应避免使用[14-15]。但由于不少糖尿病患者同时合并其他需要糖皮质激素治疗的疾病,而又无其他药物可替代,故糖皮质激素的使用也就不可避免。糖皮质激素对血糖的影响主要是通过对胰岛素的反调节作用来实现,而出现对胰岛素反调节的机制主要包括以下几点[16-18]:①促进肝糖原异生,加快脂肪分解,为糖异生提供足够相应的反应底物;②对肾上腺素、生长激素及胰高血糖素等导致血糖升高的激素的协同和允许作用;③对肌肉等外周组织摄取和利用葡萄糖的抑制作用;④胰岛素B细胞损伤作用;⑤近年来的研究提示,糖皮质激素还能够对葡萄糖刺激后的胰岛素释放起到明显抑制作用。通过上述机制,糖皮质激素能够导致患者血糖的明显增高,而这一作用的高峰主要出现在上午,且血糖波动幅度相对较大。这也为临床血糖控制提出了更高的要求[19]。
虽然对于糖尿病患者采用糖皮质激素治疗过程中的血糖波动特点已有多年的研究,且关于糖皮质激素对患者血糖的影响也已有较为明确的结论,但对于不同糖皮质激素种类对血糖的影响特点以及临床血糖控制措施的研究并未见明显的进展[20]。为了探讨糖皮质激素用于糖尿病患者合并疾病的治疗过程中患者的血糖控制方法,本研究选取60例需要糖皮质激素治疗的糖尿病患者,分别给予胰岛素持续泵入与胰岛素皮下注射两种方法控制血糖。结果显示,两组患者的血糖在糖皮质激素给药前差异无统计学意义(P>0.05),在给药后4 h均显著升高,且给药后4 h观察组显著低于对照组,差异有显著统计学意义(P<0.01);观察组SDBG、MAGE均显著低于对照组,差异有显著统计学意义(P<0.01)。糖皮质激素给药4 h后两组患者的血糖水平均明显增高,这一点充分说明糖皮质激素对患者血糖的影响是显著的。同时由于糖皮质激素给药后,即已开始了本研究中所用的血糖控制方法,且观察组采用的是胰岛素泵,而出现糖皮质激素给药后4 h观察组血糖水平显著低于对照组的结果,提示胰岛素泵进行血糖控制的效果较为理想。当然,仅凭这一点,说服力相对较弱,因此,又针对血糖的变化进行了进一步的对比研究。整个治疗过程中,观察组患者FPG、2 hPG及睡前血糖均显著低于对照组,差异有显著统计学意义(P<0.01)。本研究整个研究过程中均采用DGMS对患者进行连续血糖监测,其血糖监测值可信度高,时效性强,准确性高[21]。通过该系统对血糖变化幅度进行了测量和计算,结果显示,观察组患者SDBG、MAGE均显著低于对照组。上述结果充分表明,观察组的血糖波动幅度较小,其血糖控制效果明显优于对照组。总体来看,观察组血糖控制效果较好,但是否能够较快的将血糖控制在理想水平,且并不增加低血糖发生机会,并能够减少胰岛素的用量。为此,我们针对上述内容进行了对比分析。结果显示,观察组患者血糖达标时间显著短于对照组,低血糖次数显著少于对照组,胰岛素用量显著低于对照组,差异均有显著统计学意义(P<0.01)。上述结果充分说明,胰岛素持续泵入在糖尿病患者糖皮质激素治疗过程中的血糖控制中具有良好效果,能够更加有效的将血糖控制在较为理想的水平,且维持其波动幅度较小,同时并未增加不良反应或副作用[22]。
综上所述,糖皮质激素在糖尿病患者合并疾病的治疗中,对患者血糖影响较大,而胰岛素持续泵入能够有效控制血糖水平,并维持在较为理想的水平,且不增加不良反应发生率,值得临床推广。
[1] 刘梅.糖尿病的流行与遗传学因素的作用[J].医学理论与实践,2016,29(15):2006-2008.
[2] 王丹,郑代坤,郑胜.重庆市万州区2型糖尿病前期流行现状及其危险因素分析[J].现代预防医学,2016,43(10):1735-1738,1765.
[3] 田浩明,李舍予.长期血糖控制与糖尿病慢性血管并发症:循证治疗三十年[J].中华糖尿病杂志,2016,8(11):641-644.
[4] 刘琳.糖皮质激素作用机制的研究进展[J].肾脏病与透析肾移植杂志,2014,23(5):472-476.
[5] 李立博,刘瑞娟.糖皮质激素应用于疾病治疗的进展[J].临床合理用药杂志,2014,7(35):187.
[6] Di Dalmazi G,Pagotto U,Pasquali R,et al.Glucocorticoids and type 2 diabetes:from physiology to pathology[J].J Nutr Metab,2012,2012(12):525093.
[7] Carvalho LA,Urbanova L,Hamer M,et al.Blunted glucocorticoid and mineralocorticoid sensitivity to stress in people with diabetes[J].Psychoneuroendocrinology,2015,51(1):209-218.
[8] World Health Organization.Definition,diagnosis and classifications of diabetes mellitus and its complications.Report of a WHO consultation,Part1:Diagnosis and classification of diabetes mellitus[R].Geneva:WHO,1999.
[9] 姚美芳,孙雪,韩珏,等.2型糖尿病患者合并代谢综合征增加Framingham心血管危险评分[J].浙江大学学报(医学版),2016,45(3):268-274.
[10] 王翔,谢屹.辛伐他汀对糖尿病并微血管病变骨代谢应激氧化及肾功能的影响[J].山西医药杂志,2016,45(21):2537-2539.
[11] Sisi L,Emmanouil S,Annabel B,et al.Celecoxib reduces glucocorticoids in vitro and in a mouse model with adrenocortical hyperplasia[J].Endocrine Related Cancer,2016,23(1):15-25.
[12] Lems WF.Glucocorticoids:bad or safe for the bones?[J].RMD Open,2015,1(Suppl 1):e000050.
[13]赵赫,刘忠民.糖皮质激素在急危重症中的临床应用进展[J].中国急救复苏与灾害医学杂志,2016,11(3):303-306.
[14] 咸玉欣,李莉,孙瑞霞,等.糖尿病患者静脉滴注甲基强的松龙后动态血糖特征及胰岛素方案调整[J].中华内分泌代谢杂志,2014,30(6):468-472.
[15] 吴昌文,王凯,张志刚,等.26例原发性肾病综合症合并糖尿病用糖皮质激素时血糖的变化[J].医药前沿,2012,2(18):179.
[16] Revsin Y,de Kloet ER.When glucocorticoids change from protective to harmful.Lessons from a type 1 diabetes animal model[J].Medicina(BAires),2009,69(3):353-358.
[17] Gulliford MC,Charlton J,Latinovic R.Risk of diabetes associated with prescribed glucocorticoids in a large population[J].Diabetes Care,2006,29(29):2728-2729.
[18] 付建芳,涂艳阳,高彬,等.糖皮质激素治疗患者动态血糖特征及意义[J].实用预防医学,2011,18(1):113-115.
[19] Shpilberg Y,Beaudry JL,D'Souza A,et al.A rodent model of rapid-onset diabetes induced by glucocorticoids and high-fat feeding[J].Dis Model Mech,2012,5(5):671-680.
[20] Beaudry JL,Riddell MC.Effects of glucocorticoids and exercise on pancreaticβ-cell function and diabetes development[J].Diabetes/Metabolism Research&Reviews,2012,28(7):560-573.
[21] 陈媛媛,张华,黄高忠.老年2型糖尿病患者动态血糖监测下夜间低血糖与认知功能的关系[J].中华全科医师杂志,2016,15(1):43-46.
[22] Azevedo P,Costa J,Vaz-Carneiro A.Analysis of the Cochrane Review:Use of systemic corticosteroids for acute exacerbations of chronic obstructive pulmonary disease.Cochrane Database Syst Rev.2014,9:CD001288[J].Acta Med Port,2014,27(5):537-540.

