替米沙坦延缓大鼠视网膜衰老的作用及机制
朱江,施叶雯,周歆,姚倩,谢臣,康前雁
(1.西安市第四医院眼科,陕西西安710004;2.南昌大学医学院,江西南昌330031;3.西安交通大学第一附属医院眼科,陕西西安710061)
随着年龄的增大,机体器官会发生不可逆的功能退变和衰老。视网膜属于中枢神经系统的一部分,衰老对中枢神经系统的影响主要表现为皮质变薄、投射轴突减少、突触丢失、结构改变、神经元密度和树突减少以及功能退化等方面[1]。既往有研究证实,随着年龄增加,大鼠视网膜各层结构变薄,视网膜神经节细胞数量减少,双极细胞间突触联系减少,视细胞外节层增厚,而替米沙坦可使增厚的视细胞外节层变薄,从而延缓视网膜的衰老,但其潜在机制不明[2]。
视网膜衰老绝大多数的改变发生在光感受器细胞、视网膜色素上皮细胞和Bruch膜层面,这些改变包括细胞正常功能的丧失和细胞的丢失,研究显示这些改变可能是由氧化应激、炎症、慢性光损害及凋亡共同介导的[3]。替米沙坦是一种高效、长效、低毒的特异性血管紧张素Ⅱ(AngⅡ)受体1(AT1)拮抗剂,是临床高血压治疗的一线用药。眼球局部也存在肾素-血管紧张素系统,且AngⅡ水平很高,其受体在视网膜中的分布主要以AT1受体为主,它们共同介导的生物学效应在视网膜病变中起着重要的作用[4]。
很大比例的老年人都在长期服用替米沙坦,但替米沙坦对衰老视网膜作用的相关研究鲜有报道。本研究通过建立大鼠衰老视网膜模型,检测氧化应激相关蛋白Cu-Zn-SOD、NOX2、凋亡相关蛋白Bcl-2、Bax及p38 MAPK、κ基因结合核因子(nuclear factorκB,NF-κB)磷酸化水平的变化,探索替米沙坦延缓生理性视网膜衰老的潜在作用和机制。
1 材料与方法
1.1 实验动物分组和模型制作健康无眼疾SD大鼠40只,购自西安交通大学医学院实验动物中心[许可证号:SCXK(陕)2007-001],3个月龄大小,体重200~250 g,SPF级,雌雄不限,应用随机数表法将大鼠分为替米沙坦组和对照组,每组20只。饲养于18℃~22℃明暗各12 h的清洁级动物实验室内,9个月龄时开始给予干预,替米沙坦组给予每天8 mg/kg替米沙坦灌胃,对照组给予等量的生理盐水灌胃,至17个月龄[2]。本实验已通过“西安交通大学动物实验伦理委员会”批准。
1.2 实验材料和试剂替米沙坦(德国Boehringer-Ingelheim公司)、Cu-Zn-SOD抗体(武汉博士德生物工程有限公司)、NOX2抗体(美国Proteintech生物公司)、Bcl-2抗体(美国Proteintech生物公司)、Bax抗体(美国Proteintech生物公司)、SP-9001 HistostainTM-Plus Kit(北京中杉金桥生物技术有限公司)、ZLI-9017 DAB Kit(北京中杉金桥生物技术有限公司)、p38 MAPK抗体(美国CST生物公司)、p-p38 MAPK抗体(美国CST生物公司)、NF-κB抗体(美国CST生物公司)、p-NF-κB抗体(美国CST生物公司)、β-Actin抗体(北京全式金公司)、ECL发光液(美国Millipore公司)、PVDF膜(美国Millipore公司)
1.3 大鼠眼球样本的提取100 g/L水合氯醛(5 mL/kg)腹腔注射麻醉17个月龄大鼠。0.9%生理盐水200 mL经左心室灌注,灌注成功后摘取眼球,每只实验大鼠的一侧眼球用于HE和免疫组化染色,于4%多聚甲醛中固定24 h;另一侧眼球取下后沿角巩缘剪开,于4℃PBS中分离完整视网膜组织于灭菌EP管中,-80℃保存用于后续Western blot实验。
1.4 组织病理学染色和免疫组织化学染色取固定好的组织常规石蜡包埋、连续切片,片厚4 μm。常规二甲苯脱蜡、梯度乙醇水化,苏木素染色2 min;伊红染色5 min,梯度乙醇脱水、二甲苯透明、中性树胶封片。另取切片,常规二甲苯脱蜡、梯度乙醇水化,将切片置于金属抗原修复架上,浸入0.01 mol/L、pH=6.0的柠檬酸缓冲液中,微波中高火加热5 min至沸腾,低火加热12 min,修复完毕自然冷却至室温,3%H2O2去离子水孵育30 min,山羊血清37℃封闭1 h,分别滴加一抗:兔抗大鼠Cu-Zn-SOD抗体(1:400),兔抗大鼠NOX2抗体(1:200),兔抗大鼠Bcl-2抗体(1:100),兔抗大鼠Bax抗体(1:100),4°C过夜;复温30 min,生物素标记的山羊抗兔IgG二抗37℃孵育40 min,辣根酶标记链霉卵白素室温孵育30 min,DAB显色剂显色1 min,苏木素复染细胞核2 min,PBS返蓝5 min,梯度乙醇脱水、二甲苯透明、中性树胶封片。光镜下观察切片,利用Leica-Q550CW图像采集与分析系统在40倍物镜下进行图像采集,随机对每张切片上的视网膜选取5个视野,Image-Pro Plus 6.0分析每个视野下阳性表达部位的平均光密度。
1.5 Western blot取出视网膜组织,同一实验分组中4只大鼠的视网膜组织混合,加入含磷酸酶抑制剂的蛋白裂解液,冰浴下匀浆器充分匀浆裂解组织,4℃12 000 r/min离心20 min后取上清于新的灭菌离心管中,按体积比加入蛋白上样缓冲液,100℃煮沸蛋白样品。每个样品取10~20µg蛋白进行SDS-PAGE电泳,湿转法将蛋白转至PVDF膜,5%脱脂牛奶室温封闭1 h,分别孵育一抗:p-38 MAPK兔抗大鼠单克隆抗体(1:1 000),p-p38 MAPK兔抗大鼠单克隆抗体(1:1 000),NF-κB兔抗大鼠单克隆抗体(1:1 000),p-NF-κB兔抗大鼠单克隆抗体(1:1 000),β-Actin小鼠抗大鼠多克隆抗体(1:3 000),4℃过夜;复温30 min,TBST洗脱一抗,滴加山羊抗兔和或山羊抗小鼠二抗室温孵育1 h,TBST洗脱;ECL发光显影,采集图像,Image J软件分析每个条带的灰度值。
1.6 统计学方法应用SPSS13.0统计学软件对实验数据进行分析,计量资料以均数±标准差(x-±s)表示。对每组各个样本的均数总体进行Shapiro-Wilk正态性检验,经Levene检验方差齐性后,采用独立样本t检验进行显著性差异分析,以P<0.05为差异具有统计学意义。
2 结果
2.1 替米沙坦对衰老大鼠视网膜形态的影响对照组大鼠视网膜各层结构排列稍显紊乱,细胞形态大小不一,细胞数量减少;与对照组相比,替米沙坦组视网膜各层结构排列整齐,细胞形态基本一致,细胞丢失减少(见图1)。与对照组相比,替米沙坦组大鼠视网膜厚度增加,差异有统计学意义(t=6.863,P=0.000)。
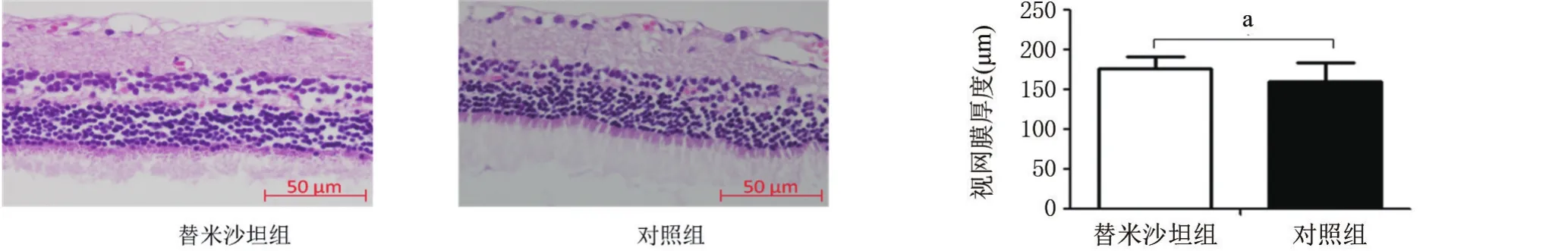
图1 两组大鼠视网膜病理组织学表现(HE×400)
2.2 替米沙坦对衰老大鼠视网膜内Cu-Zn-SOD、NOX2表达的影响替米沙坦组于神经节细胞层、内丛状层、内核层、外丛状层、光感受器细胞层的内节可见Cu-Zn-SOD强阳性表达,对照组Cu-Zn-SOD呈弱阳性表达。替米沙坦组及对照组的Cu-Zn-SOD均于内节表达相对明显,外核层及外节未见表达。替米沙坦组较对照组的Cu-Zn-SOD表达强度增强,差异具有统计学意义(t=5.273,P=0.000),见图2、图3。对照组于神经节细胞层、内丛状层、内核层、外丛状层、光感受器细胞层的内节可见NOX2强阳性表达,且NOX2于内节表达相对明显,外核层及外节未见表达,与对照组相比,替米沙坦组NOX2的表达呈弱阳性。因此替米沙坦组较对照组的NOX2表达减少,差异具有统计学意义(t=5.446,P=0.000),见图2、图3。
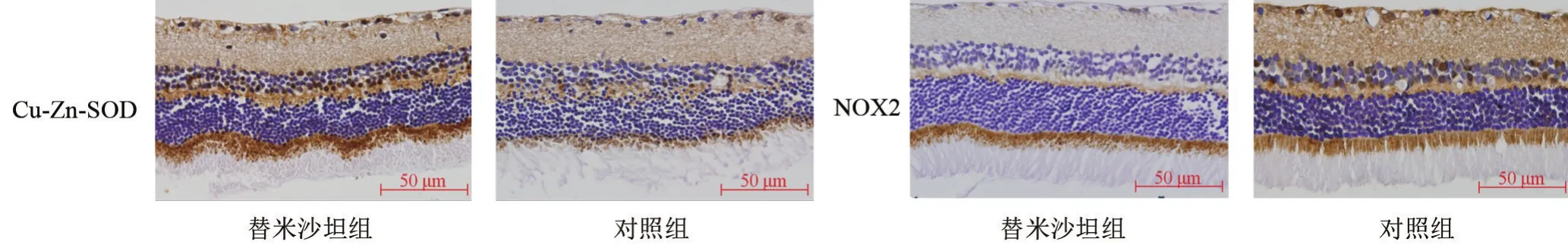
图2 替米沙坦组及对照组大鼠视网膜Cu-Zn-SOD及NOX2的表达(HE×400)

图3 替米沙坦组及对照组大鼠视网膜Bcl-2及Bax的表达(HE×400)
2.3 替米沙坦对衰老大鼠视网膜内Bcl-2、Bax表达及两者比值的影响替米沙坦组和对照组于神经节细胞层、内丛状层、内核层、外丛状层、内节可见Bcl-2弱阳性表达,外核层也可见少量Bcl-2弱阳性表达。替米沙坦组与对照组Bcl-2的表达差异无统计学意义(t=0.189,P=0.853),见图3、图4。替米沙坦组视网膜神经节细胞层、内丛状层、内核层、外丛状层、内节可见Bax强阳性表达,而对照组Bax的表达呈弱阳性。替米沙坦组较对照组的Bax表达增强,差异有统计学意义(t=2.729,P=0.016),见图3、图4。替米沙坦组Bcl-2/Bax比值较对照组降低,差异具有统计学意义(t=-2.700,P=0.001),见图5。
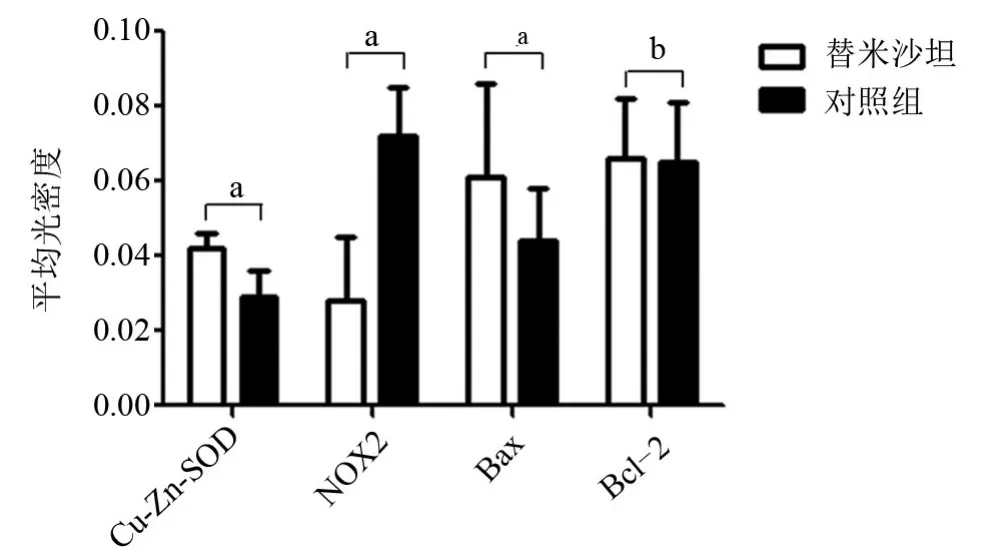
图4 两组大鼠视网膜Cu-Zn-SOD、NOX2、Bcl-2及Bax的平均光密度
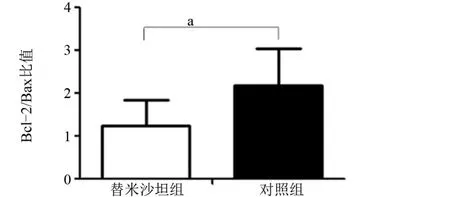
图5 两组大鼠视网膜的Bcl-2/Bax比值
2.4 替米沙坦对衰老大鼠视网膜内p38 MAPK、NF-κB磷酸化水平的影响与对照组比较,替米沙坦组p38 MAPK、NF-κB磷酸化水平均降低,差异有统计学意义(t=6.454,P=0.01;t=4.474,P=0.018),见图6。
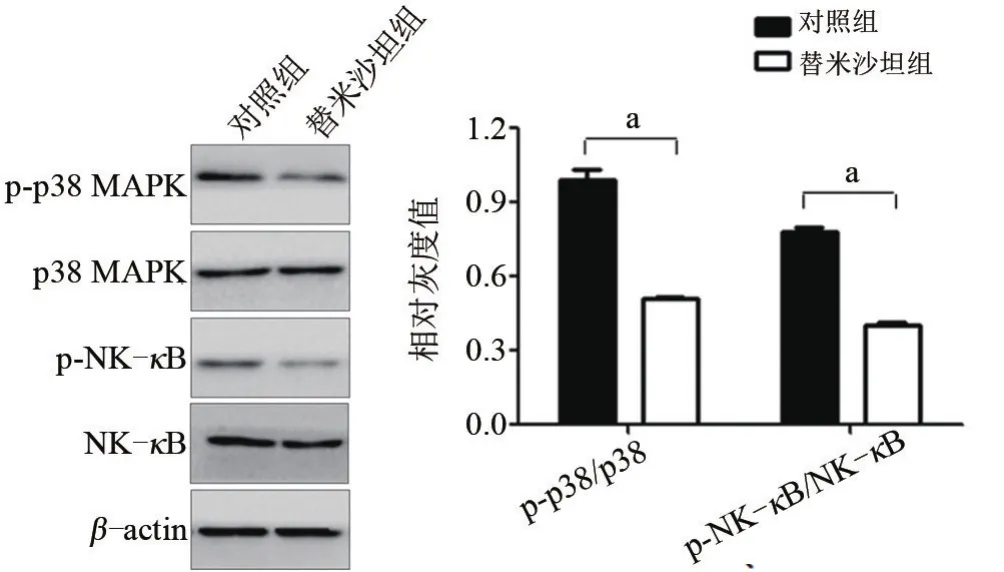
图6 两组大鼠视网膜p38 MAPK、NF-κB磷酸化水平的变化
3 讨论
视网膜局部AngⅡ表达水平很高,其受体在视网膜中的分布主要以AT1受体为主。沙坦类药物对诸多视网膜病变起保护作用:坎地沙坦对34%的2型糖尿病视网膜病变有治疗作用;氯沙坦可减少缺氧视网膜内皮细胞数的增加,抑制早产儿视网膜病变中新生血管的生成;沙坦类药物还具有剂量依赖性的降眼压作用[5-8]。
随着视网膜的衰老,视网膜平均厚度、神经节细胞数量、毛细血管数量、双极细胞突触结构体、感光细胞间连接、总蛋白等均较年轻时降低[9]。我们的既往研究表明,大鼠衰老后,视网膜总厚度及多层厚度均明显变薄,视网膜各层厚度占视网膜总厚度的构成比基本不变;且替米沙坦处理衰老大鼠8个月后,可以显著减少视网膜厚度的丢失,提示替米沙坦具有延缓视网膜衰老的作用,本研究的结果与既往研究结果一致[2]。且本研究通过检测氧化应激相关蛋白Cu-Zn-SOD、NOX2、凋亡相关蛋白Bcl-2、Bax及p38 MAPK、NF-κB磷酸化水平进一步探讨了替米沙坦对衰老视网膜的保护作用,发现替米沙坦作用衰老大鼠8个月后,可以增加Cu-Zn-SOD、Bax的表达,降低NOX2的表达及p38 MAPK、NF-κB的磷酸化水平,而替米沙坦对Bcl-2的影响不大。
Cu-Zn-SOD是内源性氧自由基清除剂的代表,能歧化超氧阴离子自由基,保护机体细胞和组织不受自由基的损害,延缓机体衰老过程。视网膜易于受到氧化刺激的破坏,而替米沙坦可以增加Cu-Zn-SOD的表达。NOX2是烟酰胺腺嘌呤二核苷酸磷酸(nicotinamide adenine dinucleotide phosphate,NADPH)氧化酶的催化亚基之一,其在衰老大鼠的角膜和晶状体上皮细胞中的表达明显升高,提示其可以介导体内活性氧产生,并且参与机体衰老的病理生理过程[10-11]。替米沙坦作用大鼠后,可以减少视网膜内NOX2、增加Cu-Zn-SOD的表达,提示替米沙坦可能通过调控氧化应激对抗机体衰老。
细胞凋亡也参与细胞衰老的过程[12]。Bcl-2和Bax是调控细胞凋亡的关键蛋白,两者比值(Bcl-2/Bax)升高,则细胞趋向存活;反之则趋向凋亡[13]。本研究中,替米沙坦可通过增加Bax的表达使Bcl-2/Bax比值较对照组降低,说明替米沙坦可以促进衰老视网膜细胞的凋亡。而增加衰老视网膜的凋亡,有助于消除机体内老化和具有潜在性异常生长的细胞,从而保持机体处于稳态起着重要的作用[14]。
本研究还发现,替米沙坦对MAPK及NF-κB信号通路有抑制作用。机体衰老后,体内肾素-血管紧张素系统活性增高,AngⅡ及AT受体含量增加,活性氧的合成增加,其可通过激活MAPK信号传导通路使NF-κB活化。NF-κB是参与一系列基因表达调控的关键性核转录因子。当血管周围的周细胞内NF-κB被激活时,促凋亡因子Bax会过度表达,引起周细胞凋亡、血流动力学异常、血视网膜屏障破坏及视网膜毛细血管通透性增高[15]。本研究发现NF-κB被抑制时,促凋亡因子Bax仍过度表达,提示Bax可能受到非NF-κB依赖途径的调控。而p38 MAPK信号通路也被证实参与氧化应激相关因子SOD和NOX2的调控。既往研究发现细胞衰老依赖于ROS激活p38 MAPK通路,p38 MAPK抑制剂能降低衰老相关基因p16的表达;且ROS较低的造血干细胞功能较强,p38 MAPK表达较低,p16基本不表达,提示在造血干/祖细胞的衰老中,p38 MAPK起着非常重要的作用[16-17]。且视网膜色素上皮细胞处于高糖环境时,p38 MAPK激活,并伴随着SOD的表达减少;而NOX2则能促进p38 MAPKs的激活[18-19]。因此,替米沙坦对细胞凋亡及氧化应激的调控可能与MAPK及NF-κB信号通路有关。
综上所述,替米沙坦可能通过p38 MAPK及NF-κB途径,减轻局部视网膜氧化应激反应,增加大鼠衰老视网膜的细胞凋亡程度,消除视网膜内老化和具有潜在性异常生长的细胞,延缓大鼠视网膜的衰老。
[1] Zarbin MA.Current concepts in the pathogenesis of age-related macular degeneration[J].Arch Ophthalmol,2004,122(4):598-614.
[2] 王静,康前雁.辛伐他汀和替米沙坦对大鼠视网膜衰老的延缓作用及其机制[J].中华实验眼科杂志,2016,34(5):414-419.
[3] Nag TC,Wadhwa S.Ultrastructure of the human retina in aging and various pathological states[J].Micron,2012,43(7):759-781.
[4] Danser AHJ,Derkx FHM,Admiraal PJJ,et al.Angiotensin levels in the eye[J].Investigative Ophthalmology&Visual Science,1994,35(3):1008-1018.
[5] Chaturvedi N,Porta M,Klein R,et al.Effect of candesartan on prevention(DIRECT-Prevent 1)and progression(DIRECT-Protect 1)of retinopathy in type 1 diabetes:randomised,placebo-controlled trials[J].Lancet,2008,372(9647):1394-1402.
[6] Sjolie AK,Klein R,Porta M,et al.Effect of candesartan on progression and regression of retinopathy in type 2 diabetes(DIRECT-Protect 2):a randomised placebo-controlled trial[J].Lancet,2008,372(9647):1385-1393.
[7] Lonchampt M,Pennel L,Duhault J.Hyperoxia/normoxia-driven retinal angiogenesis in mice:a role for angiotensin II[J].Invest Ophthalmol Vis Sci,2001,42(2):429-432.
[8] Moravski CJ,Kelly DJ,Cooper ME,et al.Retinal neovascularization is prevented by blockade of the renin-angiotensin system[J].Hypertension,2000,36(6):1099-1104.
[9] Cavallotti C,Artico M,Pescosolido N,et al.Age-related changes in the human retina[J].Can J Ophthalmol,2004,39(1):61-68.
[10] Inumaru J,Nagano O,Takahashi E,et al.Molecular mechanisms regulating dissociation of cell-cell junction of epithelial cells by oxidative stress[J].Genes Cells,2009,14(6):703-716.
[11] 李彬,阚红卫,武汪洋,等.老年大鼠角膜和晶状体上皮细胞NADPH氧化酶表达的研究[J].安徽医药,2012,16(10):1425-1427.
[12] Arend N,Wertheimer C,Laubichler P,et al.Idebenone prevents oxidative stress,cell Death and senescence of retinal pigment epithelium cells by stabilizing BAX/Bcl-2 ratio[J].Ophthalmologica,2015,234(2):73-82.
[13] Li W,Jiang Y,Sun T,et al.Supplementation of procyanidins B2 attenuates photooxidation-induced apoptosis in ARPE-19 cells[J].Int J Food Sci Nutr,2016,67(6):650-659.
[14] Li W.Phagocyte dysfunction,tissue aging and degeneration[J].Ageing Res Rev,2013,12(4):1005-1012.
[15] Nagisa Y,Shintani A,Nakagawa S.The angiotensinⅡreceptor antagonist candesartan cilexetil(TCV-116)ameliorates retinal disorders in rats[J].Diabetologia,2001,44(7):883-888.
[16] Probin V,Wang Y,Zhou D.Busulfan-induced senescence is dependent on ROS production upstream of the MAPK pathway[J].Free Radic Biol Med,2007,42(12):1858-1865.
[17] Jang YY,Sharkis SJ.A low level of reactive oxygen species selects for primitive hematopoietic stem cells that may reside in the low-oxygenic niche[J].Blood,2007,110(8):3056-3063.
[18] Sidarala V,Veluthakal R,Syeda K,et al.A novel polysaccharide compound derived from algae extracts protects retinal pigment epithelial cells from high glucose-induced oxidative damagein vitro[J].Biochem Pharmacol,2015,95(4):301-310.
[19] Xie P,Fujii I,Zhao J,et al.Phagocyte-like NADPH oxidase(Nox2)promotes activation of p38MAPK in pancreaticβ-cells under glucotoxic conditions:Evidence for a requisite role of Ras-related C3 botulinum toxin substrate 1(Rac1)[J].Biol Pharm Bull,2012,35(9):1447-1453.

