禾谷镰孢复合种毒素化学型及遗传多样性分析
马红霞,孙华,郭宁,张海剑,石洁,常佳迎
(河北省农林科学院植物保护研究所/农业部华北北部作物有害生物综合治理重点实验室/河北省农业有害生物综合防治工程技术研究中心,河北保定 071000)
0 引言
【研究意义】禾谷镰孢复合种(Fusarium graminearumspecies complex,FGSC)是引起中国玉米穗腐病的优势病原菌之一[1],病原菌通过气流传播[2-4]。该病原菌不仅可直接危害果穗,影响种子萌发,降低玉米品质及产量;其产生的毒素主要为雪腐镰刀菌烯醇(NIV)、脱氧雪腐镰刀菌烯醇(DON)及其衍生物15-ADON和3-ADON,对人畜健康造成很大威胁[5-9],给产后贮藏加工带来严重影响[10]。禾谷镰孢复合种有较高的遗传变异[11],不同地理环境其遗传变异率不同[12]。研究发现,2015年北方春玉米区玉米穗腐病的优势病原菌为禾谷镰孢复合种[13],但对引起该区域的穗腐病禾谷镰孢复合种的来源问题未见报道。对来自不同省份禾谷镰孢复合种的遗传多样性进行研究,明确各地种群和东北春玉米区种群间的亲缘关系,对病害防控和预测预报具有重要意义。【前人研究进展】禾谷镰孢复合种侵染谷物籽粒产生的毒素类型主要为单端孢烯族化合物,控制该化合物生物合成基因的研究较多。LEE等研究发现,Tri13和Tri7是镰孢菌单端孢烯族化合物决定生物合成最终产物为 DON还是NIV的关键基因[14-15];CHANDLER等[16]根据这2个关键基因设计了Tri7F/DON、Tri7F/NIV和Tri13F/DONR、Tri13NIVF/R等专化性引物,用于区分产DON和NIV毒素类型;董怀玉等[17]利用上述专化性引物对分离自中国北方春玉米区玉米籽粒的禾谷镰孢复合种进行产毒素化学型检测,发现F. graminearum只产生DON,F. asiaticum可以产生DON和NIV。Tri3控制C-15位置的乙酰化反应,JENNINGS等[18]根据基因序列设计引物用于进一步区分黄色镰孢(F. culmorum)产DON菌株的乙酰化产毒类型;李伟等[19]利用Tri3专化性引物发现长江流域产 3-AcDON毒素的F.asiaticum是引起小麦赤霉病的优势种群;纪莉景[20]采用Tri13和Tri3专化性引物分析禾谷镰孢的产毒类型,明确了中国禾谷镰孢产毒类型为NIV、15-ADON和3-ADON,并且它们的分布与地域有关。基于PCR的分子标记技术越来越多地应用于镰孢菌遗传多样性分析,例如随机扩增多态性DNA标记(RAPD)[21]、限制性片段长度多态性(RFLP)[22]、扩增片段长度多态性(AFLP)[23]、简单序列重复间区的DNA序列(inter simple sequence repeat,ISSR)[24]、延伸因子(EF-1α)[19]等。有关玉米穗腐病病原菌禾谷镰孢复合种的遗传多样性也有报道[20,25-26]。纪莉景[20]采用RAPD技术确定中国存在 3类禾谷镰孢进化群lineage7、lineage6和 lineage3,并发现每一类群内各地理来源菌株间存在丰富的遗传多样性;董怀玉等[25]利用禾谷镰孢复合种特异性引物 Fg16F/R,明确北方春玉米区玉米穗腐病病原菌禾谷镰孢复合种存在SCAR类型1和类型5;任旭[26]采用VNTR和SSR标记对禾谷镰孢复合种进行遗传多样性分析,表明产毒化学型和地域分布对多样性分析有一定影响。ISSR标记是基于PCR的分子标记技术,扩增谱带为显性,数据可靠且可重复,多态性较高,广泛应用于镰孢菌遗传多样性分析[11,27-30]。ALBAYRAK等[9]利用ISSR技术发现禾谷镰孢和黄色镰孢在种内和种间均具有遗传变异,且毒素类型和镰孢菌种类与地理区域有相关性。【本研究切入点】禾谷镰孢复合种目前为止已确定至少由 15种不同的病原菌组成[1]。不同地理来源的禾谷镰孢复合种产毒类型不同且存在较高的遗传变异。ISSR技术在镰孢菌种间和种内进行遗传分析过程中均能表现出明显的遗传差异性,可用于镰孢菌遗传多态性的分析研究,但用于玉米穗腐病病原菌禾谷镰孢复合种的遗传多样性分析未见报道。【拟解决的关键问题】采用基因Tri13和Tri3特异性引物分析不同省(自治区)禾谷镰孢复合种产毒类型,利用ISSR技术分析其遗传多样性,明确各地种群间的亲缘关系,为该病害流行、预测预报、防控及相关研究提供理论依据。
1 材料与方法
试验于 2015—2016年在河北省农林科学院植物保护研究所完成。
1.1 材料
于2015年采集北方春播区(甘肃、内蒙古、黑龙江、辽宁、吉林、山西、河北张家口及唐山)和黄淮海夏播区(河北石家庄、河南、山东、安徽、江苏)的玉米穗腐病病样,通过组织分离法分离得到92株禾谷镰孢复合种菌株(表1),采用艾德莱真菌基因组提取试剂盒提取这些菌株的菌丝DNA,-20℃保存备用。
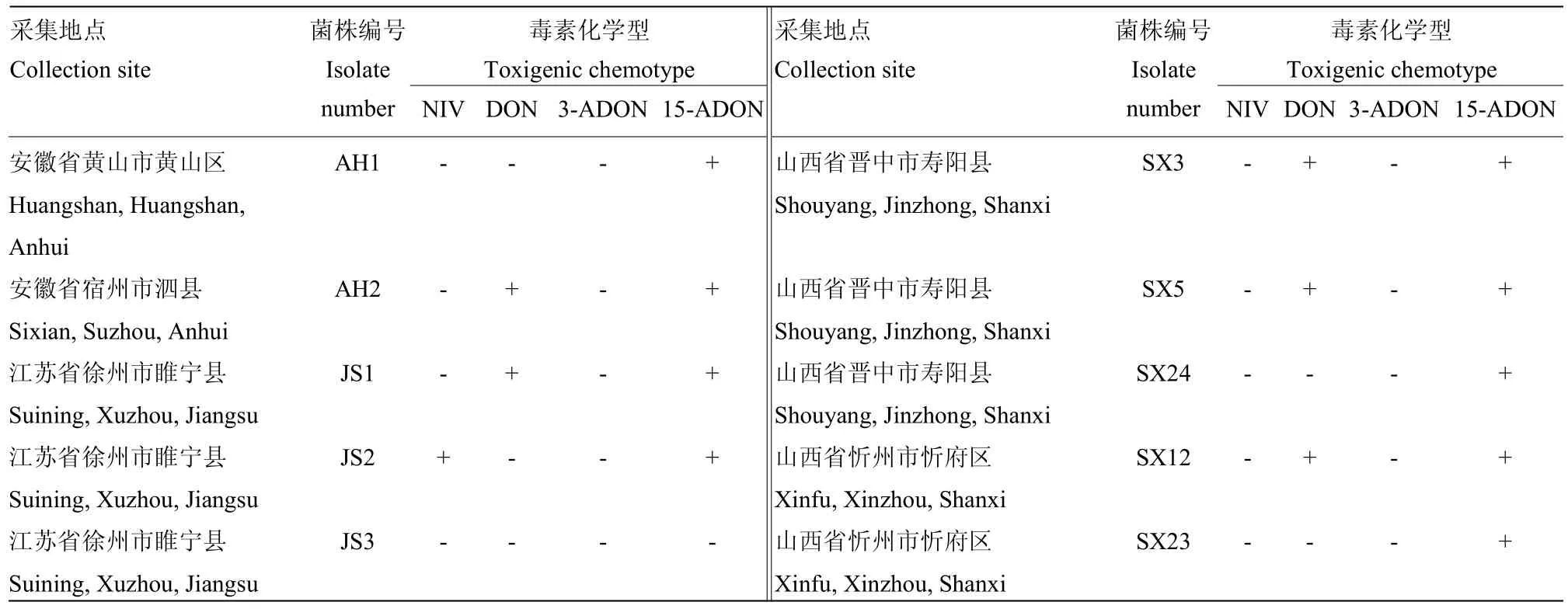
表1 供试禾谷镰孢复合种的来源、编号和毒素化学型Table 1 Origin, number and toxigenic chemotype of FGSC in this study
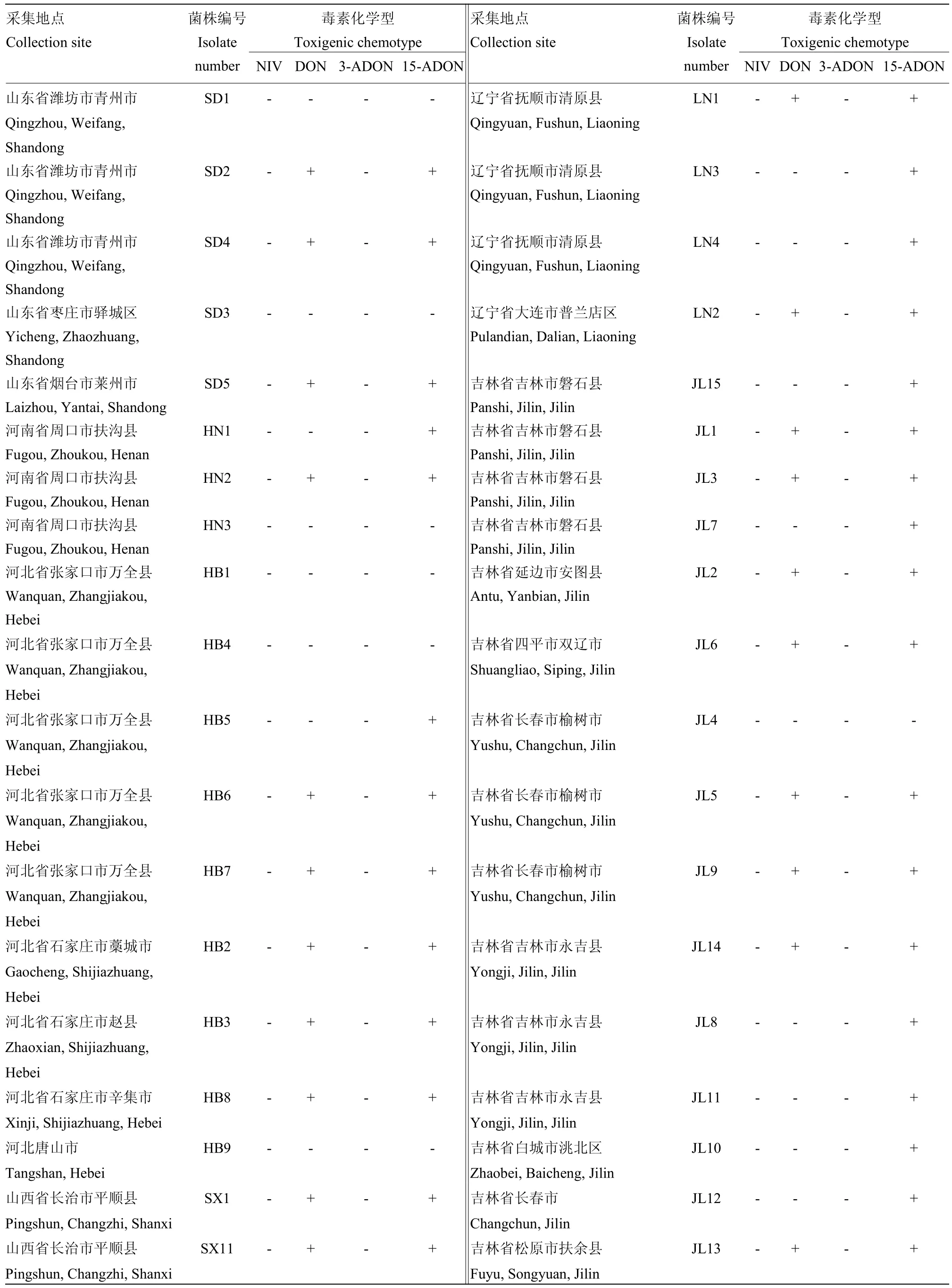
续表1 Continued table 1
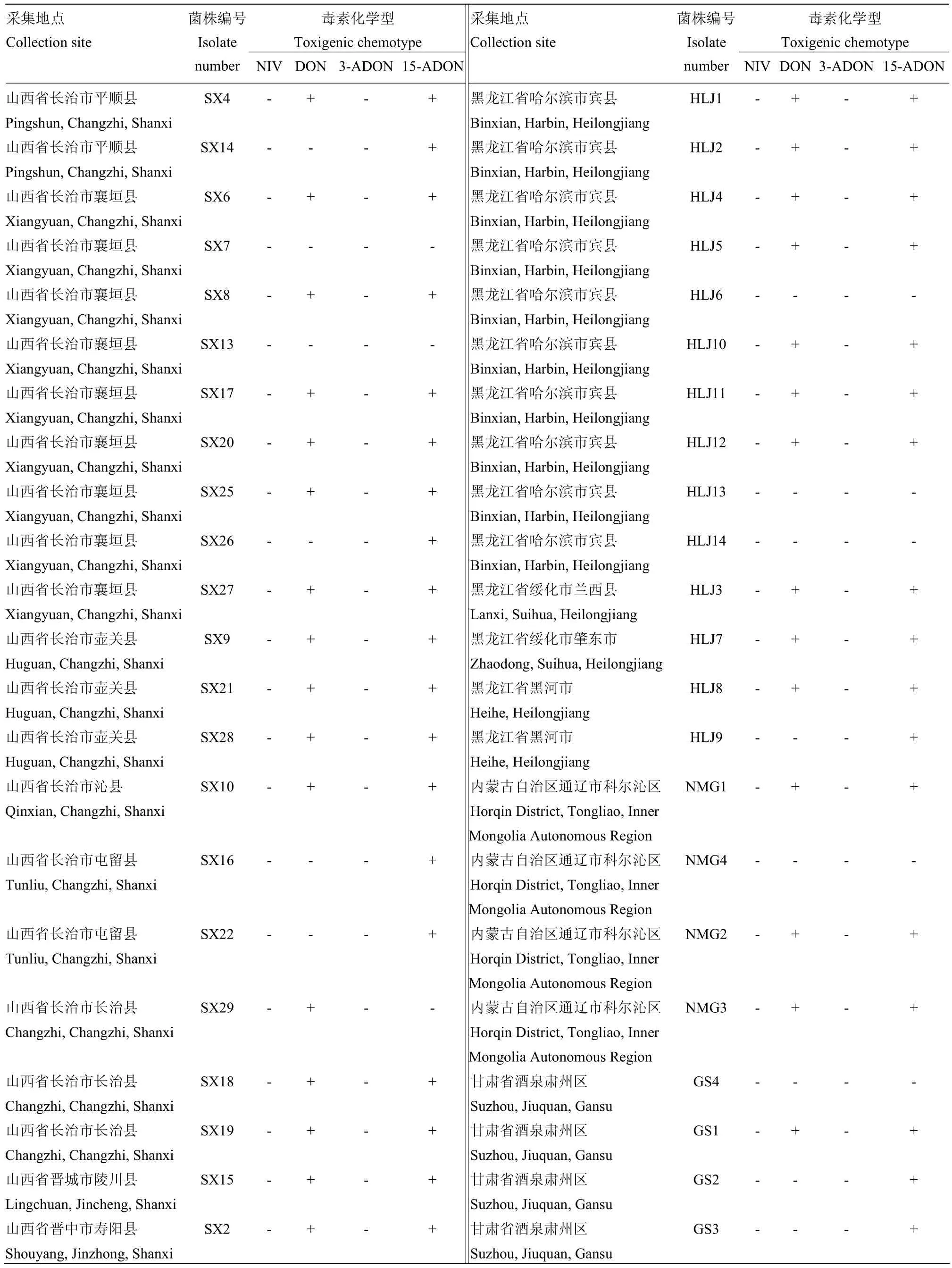
续表1 Continued table 1
1.2 禾谷镰孢复合种毒素化学型检测
根据Tri13和Tri3序列设计的特异性引物(表2)分析禾谷镰孢复合种的产毒类型。PCR反应体系为2×Es TaqMasterMix 12.5 μL,上下游引物(10 μmol·L-1)0.5 μL,Template 1 μL,加 ddH2O 补足至25 μL。PCR反应程序:94℃预变性5 min,94℃变性30 s,退火(视不同引物而定)45 s,72℃延伸1 min,35个循环,最后72℃延伸7 min。PCR扩增产物在1.0%琼脂糖凝胶上以120 V电泳30 min,使用GelDoc XR+凝胶成像系统照相。
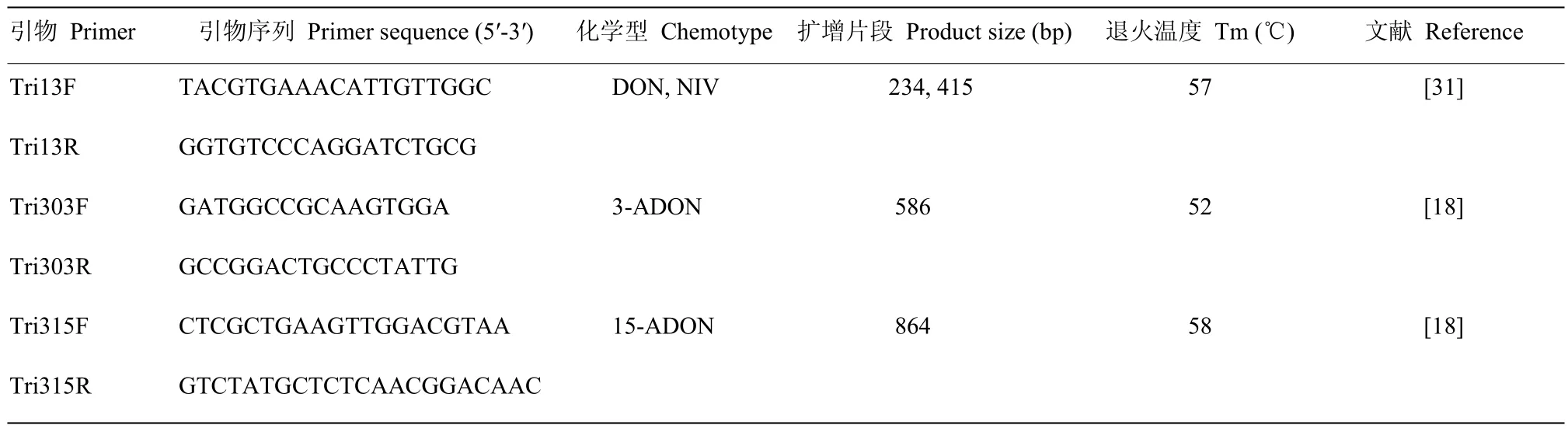
表2 本研究所用特异性引物Table 2 Specific primer pairs used in this study
1.3 ISSR分析
1.3.1 ISSR引物筛选 随机选择不同地区的4个菌株的DNA等量混合成DNA模板,对加拿大哥伦比亚大学(University of British Columbia,UBC)公布的100个ISSR引物进行初步筛选,选择扩增条带丰富、重复性好、信号强、背景清晰的引物用于全部 92个DNA样品的扩增。
1.3.2 ISSR-PCR体系及程序 PCR反应体系为2×Es TaqMasterMix 10 μL,Primer(10 μmol·L-1)1.5 μL,Template 1 μL,加 ddH2O 补足至 20 μL。采用的13个引物见表2。PCR反应程序:94℃预变性5 min,94℃变性30 s,退火(视不同引物而定)45 s,72℃延伸1.5 min,35个循环,最后72℃延伸7 min。
PCR扩增产物在1.0%琼脂糖凝胶上以120 V电泳30 min,使用GelDoc XR+凝胶成像系统照相。扩增出2种及以上不同的条带即为多态性引物。
1.3.3 数据分析 对ISSR电泳谱带进行记录,在相同位置出现条带的记为“1”,无条带的记为“0”,缺失条带记为“9”或“. ”。使用 Popgen32软件进行数据分析,计算 Shannon’s多样性指数、群体间的遗传距离和遗传相似性[32];利用NTsys2.10e软件,采用clustering模块中的SAHN进行UPGMA聚类分析,并构建供试菌株的系统聚类图。
2 结果
2.1 禾谷镰孢复合种毒素化学型PCR分析
利用引物Tri13F/Tri13R可同时鉴定NIV(415 bp)和DON(234 bp)(图1-A)。92株菌株只有江苏菌株JS2可产生NIV,有56个(60.87%)菌株可产生DON(表1),表明北方春玉米区和黄淮夏玉米区禾谷镰孢复合种产生的主要毒素化学型为 DON。引物Tri315F/Tri315R扩增的目的条带大约为 870 bp(图1-B),有76株(82.61%)菌株可产生15-ADON(表3)。引物Tri303F/Tri303R没有扩增出目的条带,表明92株菌株不能产生3-ADON。
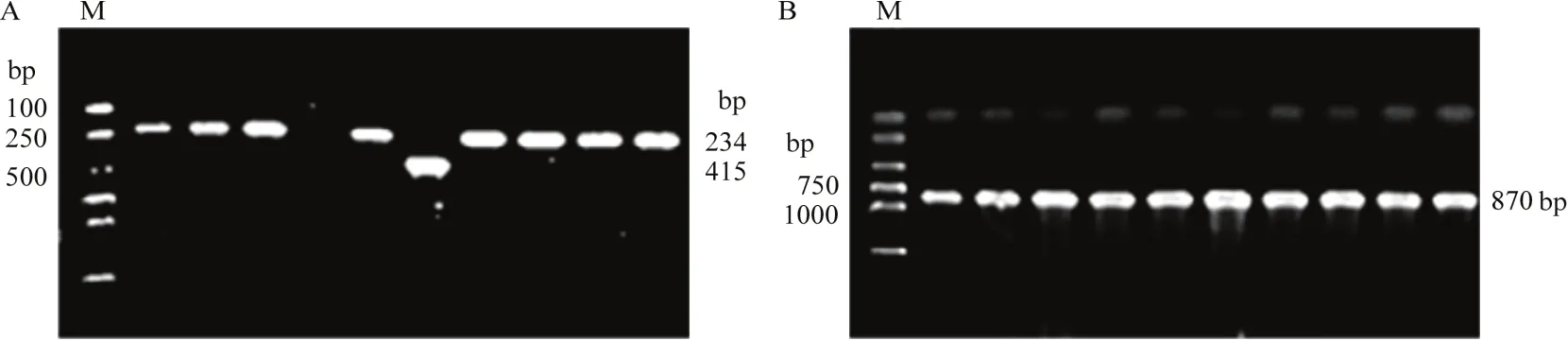
图1 部分禾谷镰孢复合种菌株产毒素化学型的PCR检测Fig. 1 Detection of toxigenic chemotypes of some FGSC isolates by PCR assay
综合分析表1和表3可知,仅有江苏菌株JS2能产生NIV和15-ADON;有55株(59.78%)可同时产生 DON和 15-ADON;有 20株(21.74%)仅产生15-ADON;山西菌株SX29只产生DON;但有15株(16.30%)即不产生DON也不产生NIV。
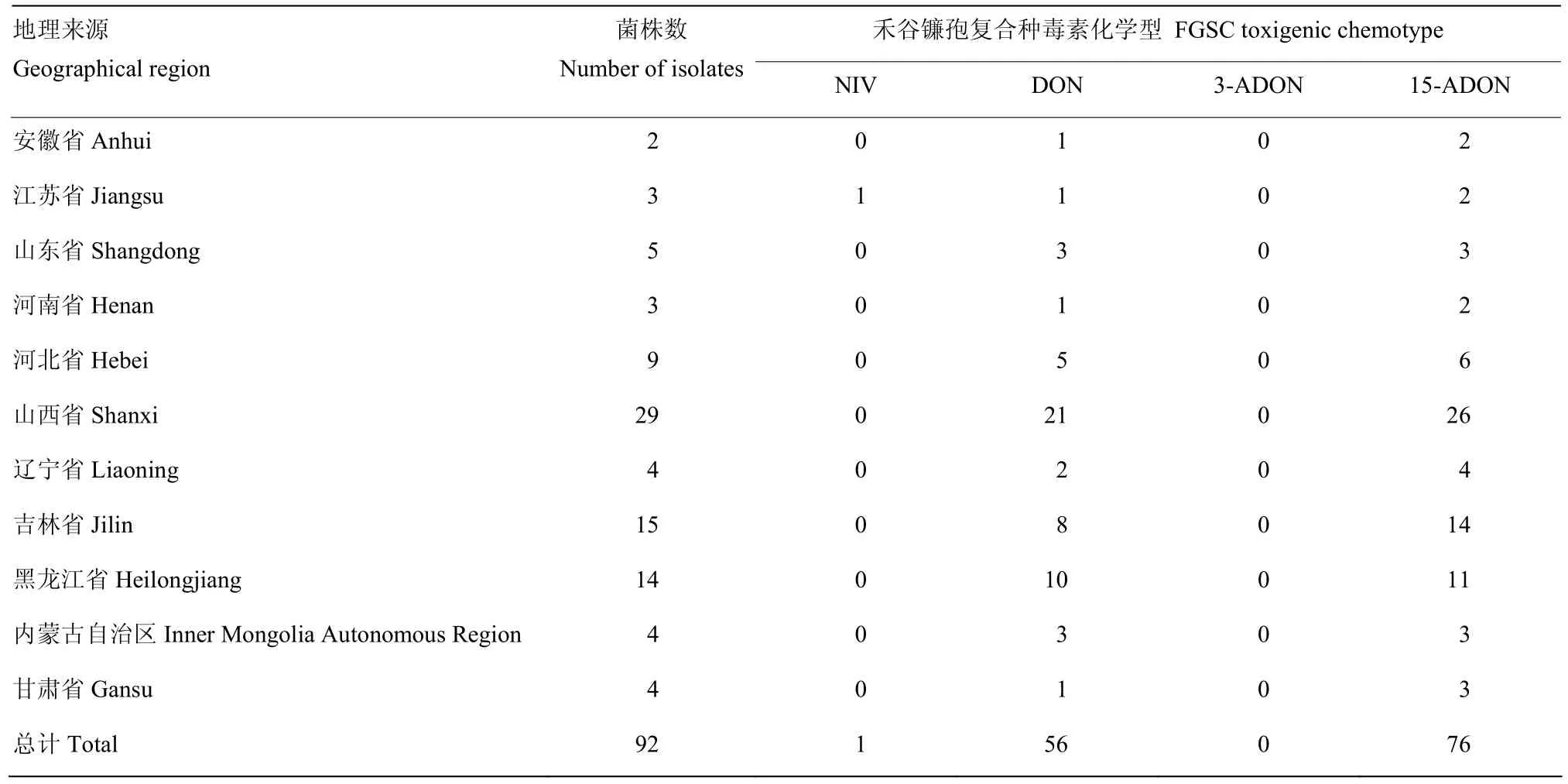
表3 禾谷镰孢复合种毒素化学型的地域差异Table 3 Regional variation in toxigenic chemotypes of FGSC
2.2 ISSR-PCR扩增
从100个引物中筛选出13个扩增条带丰富、重复性好、信号强、背景清晰的引物。所选的13个引物对11个省(自治区)的92个菌株进行ISSR-PCR扩增(图2),结果如表4所示。共获得102个条带,其中多态性条带101个,占99.02%。扩增的DNA片段大小在200—2 500 bp。不同引物扩增条带数不等,条带数在2—14条,多数为7—9条,平均每条引物产生多态性条带7.85条。其中866号引物扩增出的条带数最多(14条);而引物855扩增出的条带数最少(2条)。除引物855的多态性条带为50%外,其余引物均为100%。
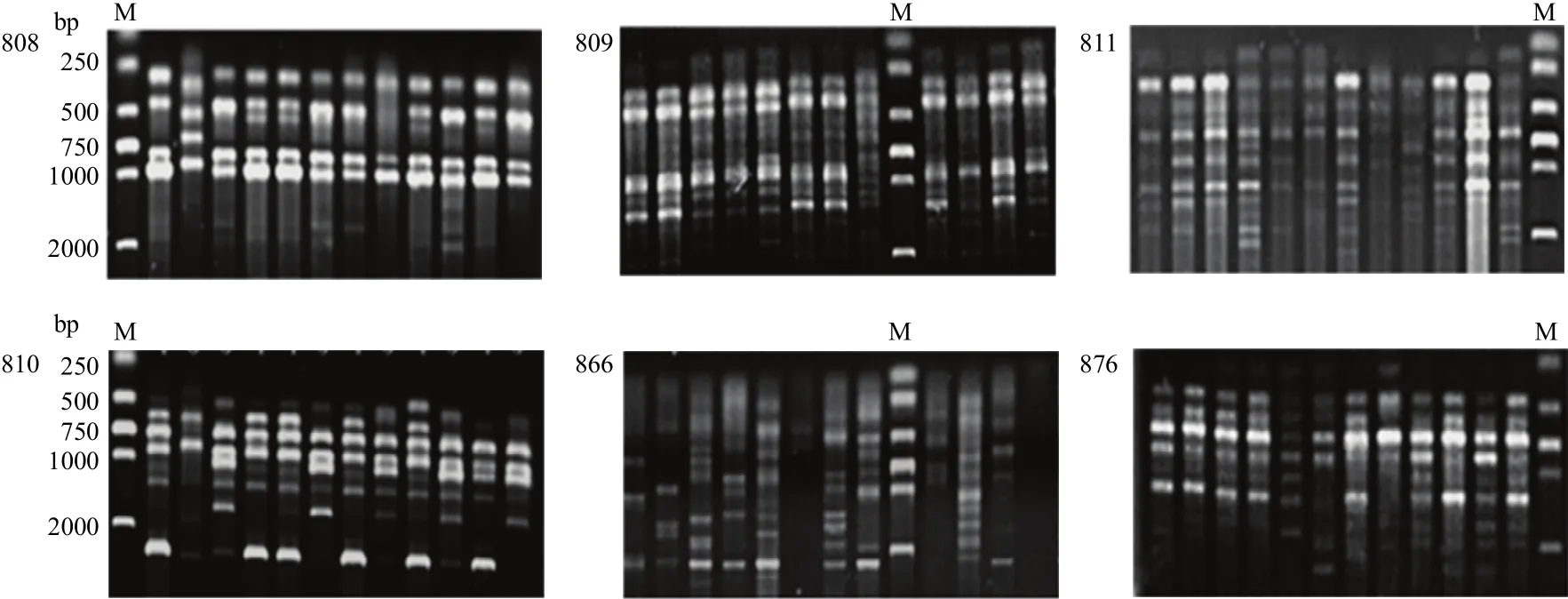
图2 6个引物对部分禾谷镰孢复合种菌株基因组DNA的ISSR-PCR扩增Fig. 2 Amplification of genome DNA of some FGSC isolates with 6 primers
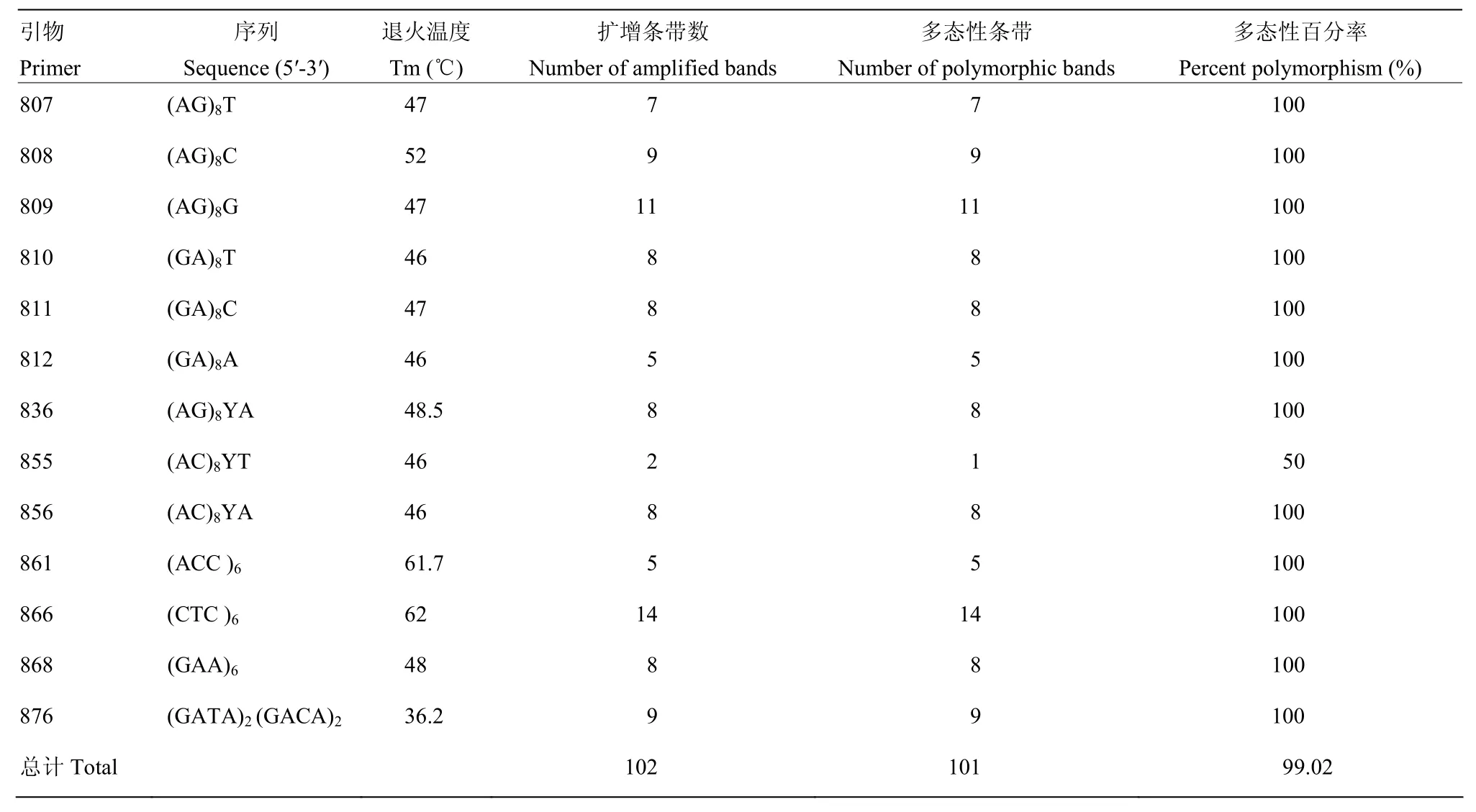
表4 ISSR引物扩增Table 4 The amplification with ISSR primers
2.3 不同地理种群禾谷镰孢复合种遗传多态性
对禾谷镰孢复合种菌株按不同省(自治区)来源分为11组,其多态性分析如表5所示。在群体平均水平上,多态性位点为101个,多态性位点比率为 99.02%,有效等位基因数(NE)为 1.5207,基因多样性指数(H)为0.3129,Shannon’s信息指数(I)为0.4774,表明禾谷复合种群体存在丰富的遗传变异。就各地区而言,H值在0.1421—0.3160,I值在 0.2075—0.4744,表明禾谷镰孢复合种的遗传多样性在不同地理种群间存在一定差异。河北、山西、黑龙江和吉林种群遗传多样性最高,内蒙古和辽宁种群次之,山东、江苏和甘肃种群较低,安徽和河南种群最低。
分析得到 11个地理种群总基因多样性 Ht为0.3101,各地理种群内基因多样性Hs为0.2257,地理群体间的基因多样性Dst为0.0844,表明相同省份来源的菌株具有较近的亲缘关系。地理种群间的基因分化系数Gst为0.2722,这说明不同地理种群间遗传变异占种群总遗传变异的 27.22%,大部分遗传变异(72.78%)发生在种群内。根据遗传分化系数估算的基因流的值 Nm=1.3372(>1),表明种群间存在一定的基因流动。
2.4 不同地理种群禾谷复合体遗传相似性
11个地理种群间的遗传距离和遗传相似系数如表6所示,不同地理种群间的遗传相似性为0.7920—0.9997,遗传距离为0.0003—0.2332。根据遗传相似性和遗传距离分析,河北、山西、黑龙江和吉林菌株群体间相似系数最大,遗传距离最小,亲缘关系最近;其次是山东与江苏菌株间,以及辽宁与吉林菌株间的亲缘关系较近,相似系数均为0.96;内蒙古、甘肃和河南的菌株与上述这些地区的亲缘关系较远;安徽和内蒙古菌株间的亲缘关系最远,相似系数为0.7920,遗传距离为0.2332。
2.5 禾谷镰孢复合体ISSR聚类分析
利用NTsys2.10e软件对92个菌株进行ISSR聚类分析,结果如图3所示,菌株间具有丰富的遗传多样性,相似系数在0.43—0.95。在相似系数为0.43时,所有的菌株被分成2大类群,Group 1包括4株北方春播区菌株(吉林、山西和河北张家口),这些菌株既不产生NIV也不产生DON;Group 2由余下的88株菌株构成,这些菌株产生的毒素类型主要为DON和 15-ADON,其来源于北方春播区(山西、黑龙江、吉林、辽宁、甘肃和河北张家口、唐山)和黄淮海夏播区(河北石家庄、河南、山东、江苏和安徽),虽然图3显示它们交叉聚在一起,但大部分春播区菌株聚在一起,较多的夏播区菌株聚在一起。
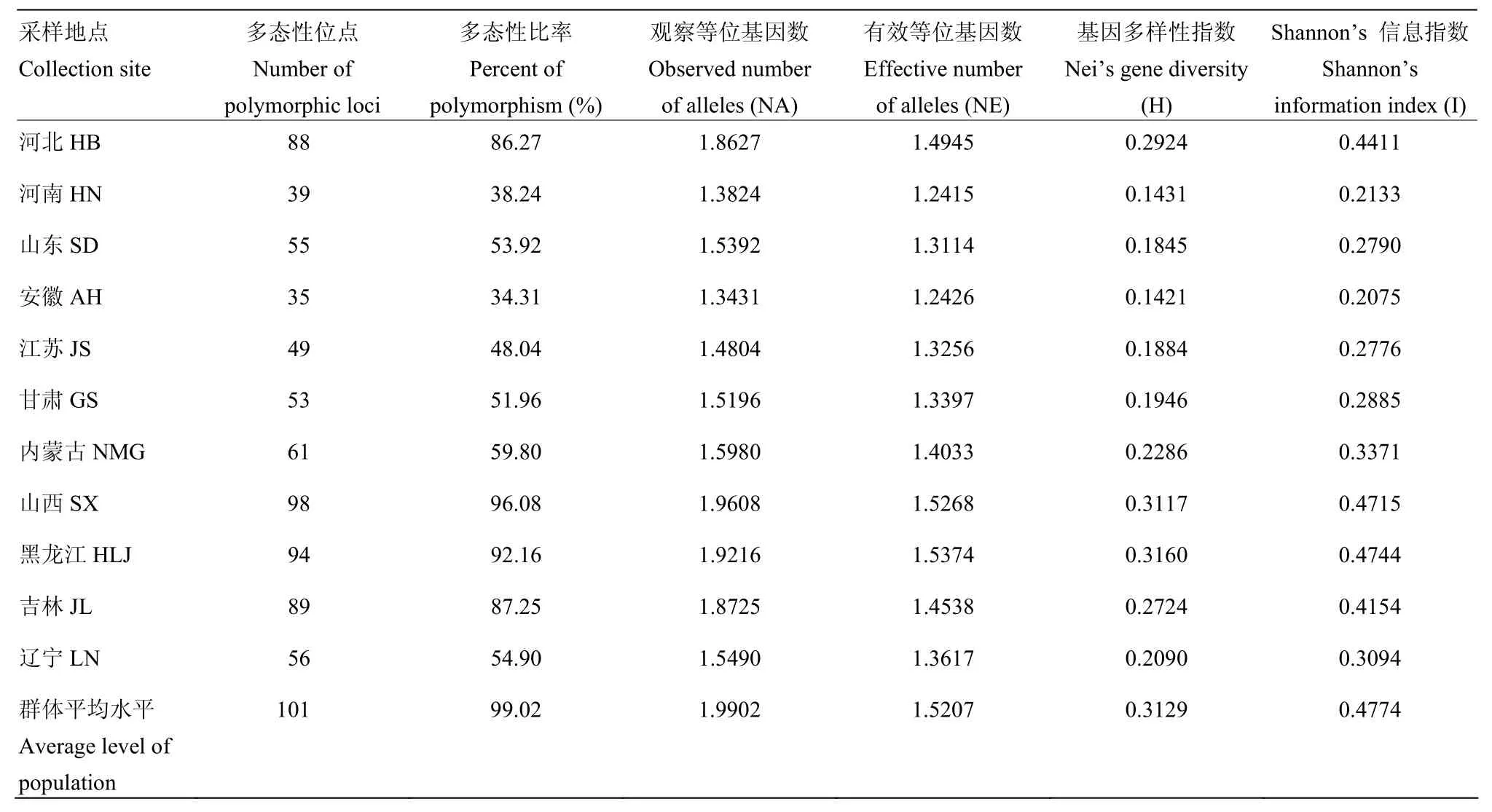
表5 禾谷镰孢复合种不同地理种群的遗传多样性水平Table 5 Genetic diversity parameters among geographic populations of FGSC
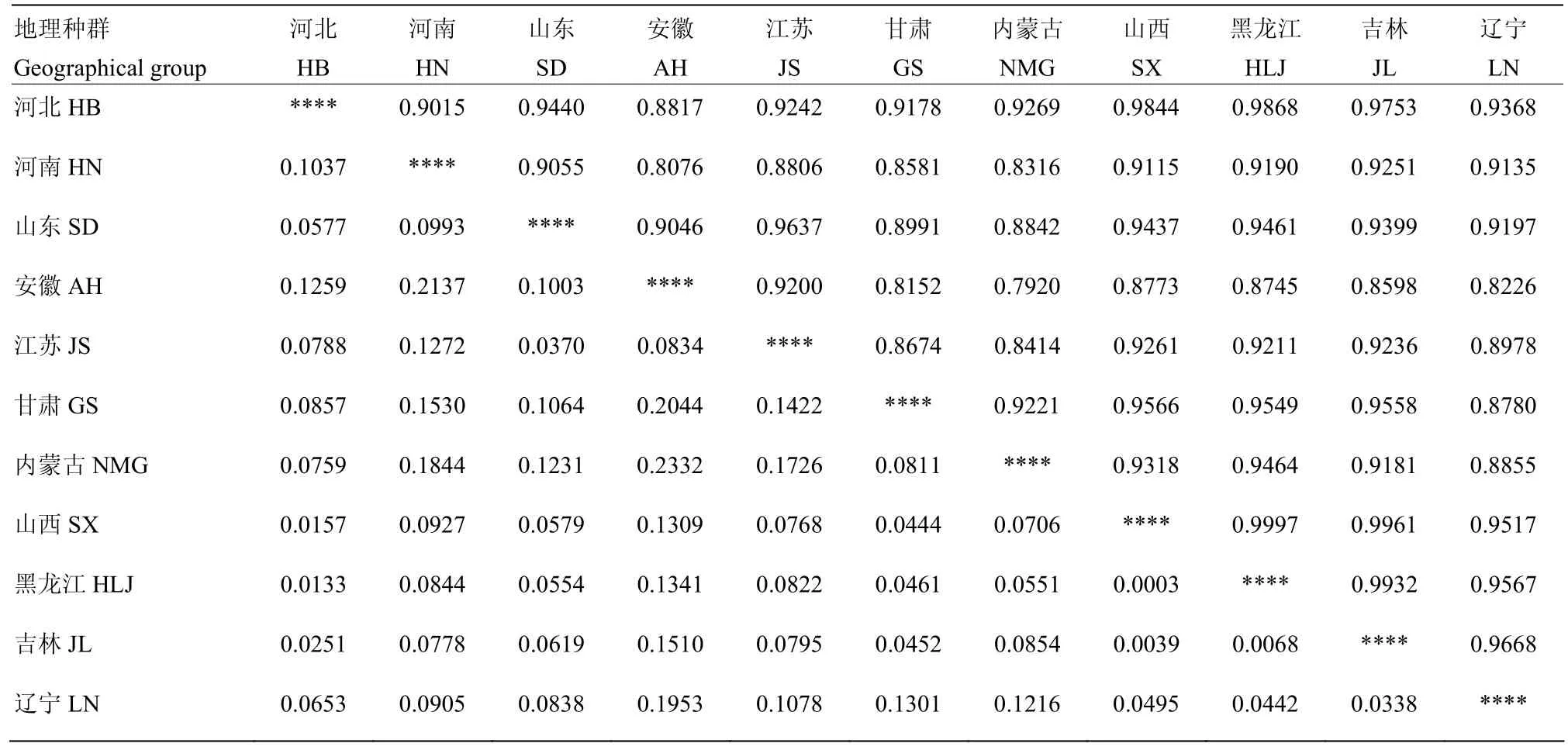
表6 禾谷镰孢复合种不同地理种群间的遗传相似性和遗传距离Table 6 Genetic identity and genetic distance among geographic populations of FGSC
在相似系数为0.56时,92个菌株可划分成9个群。A群和B群组成Group 1;C群由76.08%的菌株组成,该群在相似系数为0.664水平上又分成6个亚群,Ⅰ
亚群由34株春播区菌株(山西、吉林、黑龙江、内蒙古、甘肃和河北张家口)组成,Ⅱ亚群由 9个春播区菌株(内蒙古、山西、辽宁、吉林和黑龙江)和 7株夏播区菌株(山东、河南、江苏和河北石家庄)组成,Ⅲ亚群由5个春播区菌株(山西、吉林、黑龙江和辽宁)和 3株夏播区菌株(河北石家庄和江苏)组成,Ⅳ亚群由 1株吉林菌株组成,Ⅴ亚群由 9株春播区菌株(吉林、黑龙江、山西、甘肃和河北张家口)组成,Ⅵ亚群由3株山西菌株组成;D群由 1株安徽菌株构成;E群由 1株山西菌株和 3株夏播区菌株(江苏、山东和安徽)构成;F群由4株春播区菌株(内蒙古、黑龙江和河北唐山)构成;G群由2株春播区菌株(吉林和辽宁)和1株河南菌株构成;H群由1株河北张家口菌株构成;I群由4株春播区菌株(黑龙江、辽宁、山西和河北张家口)和1株山东菌株构成。
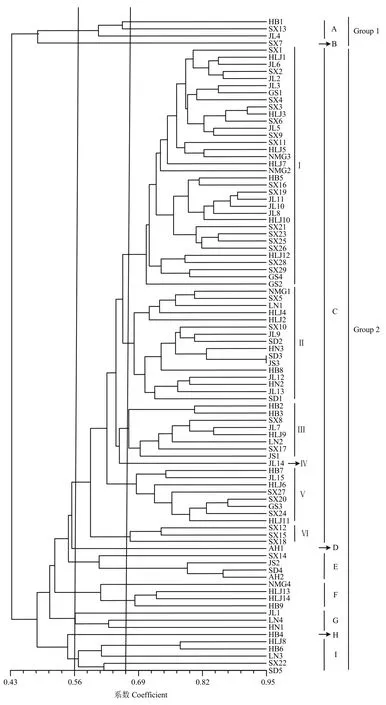
图3 禾谷镰孢复合种菌株的UPGMA聚类图Fig. 3 Dendrogram obtained by UPGMA clustering for FGSC isolates
3 讨论
镰孢菌属真菌是玉米上的重要病原菌,能够产生多种次生代谢产物,可引起玉米的穗腐病、茎腐病和根腐病等。其中禾谷镰孢复合种是引起玉米穗腐病的优势病原菌之一,禾谷镰孢复合种主要产生的毒素化学型为NIV和DON及其衍生物3-ADON和 15-ADON;化学型的产生类型与地域有一定的关系,在中国冷凉地区一般以15-ADON为主,温暖地区如长江流域以3-ADON和NIV为主[19-20]。本研究发现分离自春玉米区禾谷镰孢复合种的毒素化学型主要为DON和15-ADON,夏玉米区禾谷镰孢复合种产生的毒素化学型主要为 DON和15-ADON,个别菌株可产生NIV。该研究结果与以上结论一致。
基于 PCR的分子标记技术广泛应用于镰孢菌遗传多样性研究,大部分的分子标记技术以基因组DNA为靶标,比如 RAPD、RFLP等,还有部分以线粒体DNA为模板。ISSR标记技术是以基因组DNA为模板的技术,揭示的多态性较高,检测非常方便,广泛应用于镰孢菌多样性分析。本研究利用13个多态性丰富的ISSR引物对来自11个省(自治区)的92个禾谷镰孢复合种菌株进行遗传多样性分析,共扩增出 102个条带,其中多态性条带为 101个,多态性比率为99.02%,表明禾谷镰孢复合种群体存在丰富的遗传变异,这一结果与QU等[33]对禾谷镰孢菌群体的研究结果一致。
生物群体的遗传多样性是评价生物资源状况的重要依据之一,Nei’s基因多样性指数(H)和Shannon信息指数(I)是衡量生物遗传多样性的重要参数。本研究在群体平均水平上,H为0.3129,I为 0.4774,表明禾谷镰孢复合种存在较高的遗传多样性水平。11个地理种群的 H值和I值的计算结果趋势一致,均为河北、山西、黑龙江和吉林种群遗传多样性最高,安徽和河南种群最低。这可能与来自安徽和河南的菌株数目较少有关。何婧等[34]认为各采集地点禾谷镰孢菌数量的增加可提高遗传多样性水平。
不同地理种群总基因多样性(Ht)为0.3101,种群内基因多样性(Hs)为0.2257,地理种群间的基因分化系数(Gst)为0.2722,说明不同地理种群间存在一定的遗传变异,但大部分遗传变异(72.78%)发生在种群内。瞿波[35]通过AFLP标记技术发现同一来源地的菌株很难找到相同的个体,说明禾谷镰孢复合种群体内存在广泛的遗传变异。
根据遗传分化系数估算的基因流值 Nm=1.3372(>1),表明不同地理种群间存在一定的基因流动,这一结果通过对地理种群间亲缘关系的分析进一步得到证实。根据遗传相似性和遗传距离分析,发现河北、山西、黑龙江、吉林、辽宁、内蒙古和甘肃菌株群体间亲缘关系较近,山东、江苏、河南和安徽菌株间亲缘关系较近,安徽和内蒙古菌株间的亲缘关系最远,这表明菌株间的亲缘关系与地理来源有关。进一步对92个菌株的聚类结果分析发现,绝大多数北方春玉米区菌株(山西、黑龙江、吉林、辽宁、内蒙古和河北张家口及唐山)聚在一起,黄淮海夏玉米区菌株(河北石家庄、山东、江苏、安徽和河南)趋向在一起,而且各个地理来源的菌株趋向聚在一起,同样说明禾谷镰孢复合种间的遗传多样性与生态环境有关,这与前人研究结果一致。瞿波[35]认为中国的禾谷镰孢存在温暖型菌系和冷凉型菌系两种类型,具有明显的生态地理划分;何婧等[34]研究发现,禾谷镰孢复合种间遗传多样性与其地理来源有一定的关系;董怀玉等[25]通过对禾谷镰孢复合种 SCAR类型测定发现玉米穗腐病禾谷镰孢菌存在明显的生态地理类型。在相似系数为 0.664时,C群分为 6个亚群,其中Ⅱ和Ⅲ亚群均包含春玉米区菌株和夏玉米区菌株,说明这些菌株亲缘关系较近,表明春玉米区穗腐病病原菌以本地菌源为主,但不排除部分病原菌可从夏玉米区远距离气传的可能。下一步研究应加大上述区域穗腐病病原菌禾谷镰孢复合种的采集范围和数量,以明确春玉米区穗腐病病原菌禾谷镰孢复合种的来源。
4 结论
北方春玉米区和黄淮海夏玉米区引起玉米穗腐病的禾谷镰孢复合种主要毒素化学型为 DON和15-ADON。基于ISSR技术,表明禾谷镰孢复合种群体内存在丰富的遗传变异;相同地理来源的菌株有较近的亲缘关系,且不同地理种群间也存在一定的基因交流,遗传多样性水平与地理来源有关。
[1] 秦子惠, 任旭, 江凯, 武小菲, 杨知还, 王晓鸣. 我国玉米穗腐病致病镰孢种群及禾谷镰孢复合种的鉴定. 植物保护学报, 2014,41(5): 589-596.QIN Z H, REN X, JIANG K, WU X F, YANG Z H, WANG X M.Identification ofFusariumspecies andF. graminearumspecies complex causing maize ear rot in China.Journal of Plant Protection,2014, 41(5): 589-596. (in Chinese)
[2] 石洁. 玉米镰刀菌型茎腐、穗腐、苗期根腐病的相互关系及防治[D].保定: 河北农业大学, 2002.SHI J. Relationship and control ofFusariumstalk rot, ear rot and seeding root rot in maize[D]. Baoding: Hebei Agricultural University,2002. (in Chinese)
[3] 任金平, 吴新兰, 孙秀华. 吉林省玉米镰刀菌穗腐病和茎腐病病原菌传染循环研究. 玉米科学, 1995, 3(增刊1): 25-28.REN J P, WU X L, SUN X H. A study on infection cycle of pathogen of corn ear rot and stalk rot in Jilin Province.Journal of Maize Sciences, 1995, 3(Suppl. 1): 25-28. (in Chinese)
[4] 邹庆道, 许远, 王立, 陈捷. 玉米镰孢菌穗腐病和茎腐病侵染规律相互关系的研究. 沈阳农业大学学报, 2000, 31(5): 487-489.ZOU Q D, XU Y, WANG L, CHEN J. Relationship of infection cycle between ear rot and stalk rot in maize caused byFusarium.Journal of Shenyang Agricultural University, 2000, 31(5): 487-489. (in Chinese)
[5] 朱维芳. 玉米籽粒中镰孢菌的分离及相互作用对产毒的影响[D].保定: 河北农业大学, 2014.ZHU W F. The isolation ofFusariumspecies and the effect of interaction betweenFusariumspecies for mycotoxin accumulation[D].Baoding: Hebei Agricultural University, 2014. (in Chinese)
[6] 蔡静平, 刘新影, 翟焕趁. 禾谷镰刀菌 DON毒素生物合成调控研究进展. 河南工业大学学报(自然科学版), 2016, 37(1): 114-119.CAI J P, LIU X Y, ZHAI H C. Progress on the regulation of DON toxin produced byFusarium graminearum.Journal of Henan University of Technology (Natural Science Edition), 2016, 37(1):114-119. (in Chinese)
[7] CHAMPEIL A, DORÉ T, FOURBET J F.Fusariumhead blight:epidemiological origin of the effects of cultural practices on head blight attacks and the production of mycotoxins byFusariumin wheat grains.Plant Science, 2004, 166(6): 1389-1415.
[8] NICHOLSON P, SIMPSON D R, WILSON AH, CHANDLER E,THOMSETT M. Detection and differentiation of trichothecene and enniatin-producingFusariumspecies on small-grain cereals.European Journal of Plant Pathology, 2004, 110(5/6): 503-514.
[9] ALBAYRAK G, YÖRÜK E, GAZDAĞLI A, SHARIFNABI B.Genetic diversity amongFusarium graminearumandF. culmorumisolates based on ISSR markers.Archives of Biological Sciences, 2016,68(2): 333-343.
[10] 邢锦城. 禾谷镰刀菌致病相关基因的鉴定及其毒素DON特异亲和肽段的淘选[D]. 南京: 南京农业大学, 2010.XING J C. Identification of genes related to virulence ofFusarium graminearumand biopanning of DON toxin specific affinity peptides[D]. Nanjing: Nanjing Agricultural University, 2010. (in Chinese)
[11] ORTEGA L M, DINOLFO M I, ASTORECA A L, ALBERIONE E J,STENGLEIN S A, ALCONADA T M. Molecular and mycotoxin characterization ofFusarium graminearumisolates obtained from wheat at a single field in Argentina.Mycological Progress, 2016, 15:1.
[12] MIEDANER T, SCHILLING A G, GEIGER H H. Molecular genetic diversity and variation for aggressiveness in populations ofFusarium graminearumandFusarium culmorumsampled from wheat fields in different countries.Journal of Phytopathology, 2010, 149(11):641-648.
[13] 孙华, 张海剑, 马红霞, 石洁, 郭宁, 陈丹. 春玉米区穗腐病病原菌组成、分布及禾谷镰孢复合种的鉴定. 植物病理学报,doi:10.13926/j.cnki.apps.000161.SUN H, ZHANG H J, MA H X, SHI J, GUO N, CHEN D.Composition and distribution of pathogens causing ear rot in spring maize region and identification ofFusarium graminearumspecies complex.Acta Phytopathologica Sinica, doi:10.13926/j.cnki.apps.000161. (in Chinese)
[14] LEE T, HAN Y K, KIM K H, YUN S H, LEE Y W.Tri13andTri7determine deoxynivalenol- and nivalenol-producing chemotypes ofGibberella zeae.Applied and Environmental Microbiology, 2002,68(5): 2148-2154.
[15] BROWN D W, MCCORMICK S P, ALEXANDER N J, PROCTOR R H, DESJARDINS A E. Inactivation of a cytochrome P-450 is a determinant of trichothecene diversity inFusariumspecies.Fungal Genetics and Biology, 2002, 36(3): 224-233.
[16] CHANDLER E A, SIMPSON D R, THOMSETT M A,NICHOLSON P. Development of PCR assays toTri7andTri13trichothecene biosynthetic genes, and characterisation of chemotypes ofFusarium graminearum,Fusarium culmorumandFusarium cerealis.Physiological and Molecular Plant Pathology,2003, 62(6): 355-367.
[17] 董怀玉, 徐婧, 王丽娟, 刘可杰, 姜钰, 胡兰, 张明会, 徐秀德. 我国北方玉米子粒禾谷镰孢菌群产毒素化学型检测分析. 玉米科学,2014, 22(6): 126-130.DONG H Y, XU J, WANG L J, LIU K J, JIANG Y, HU L, ZHANG M H, XU X D. Molecular detection of mycotoxin chemotypes of seeds bornedFusarium graminearumclade on maize.Journal of Maize Sciences, 2014, 22(6): 126-130. (in Chinese)
[18] JENNINGS P, COATES M E, TURNER J A, CHANDLER E A,NICHOLSON P. Determination of deoxynivalenol and nivalenol chemotypes ofFusarium culmorumisolates from England and Wales by PCR assay.Plant Pathology, 2010, 53(2): 182-190.
[19] 李伟, 胡迎春, 陈莹, 张爱香, 陈怀谷. 长江流域禾谷镰孢菌群部分菌株系统发育学、产毒素化学型及致病力研究. 菌物学报, 2010,29(1): 51-58.LI W, HU Y C, CHEN Y, ZHANG A X, CHEN H G. Phylogenetic analysis, chemotype diversity, and pathogenicity of theFusarium graminearumclade in the Yangtze basin.Mycosystema, 2010, 29(1):51-58. (in Chinese)
[20] 纪莉景. 中国不同生态地区禾谷镰刀菌种群分化及遗传多样性分析[D]. 保定: 河北农业大学, 2007.JI L J. Population and genetic diversity ofFusarium graminearumclade from different ecological regions of China[D]. Baoding: Hebei Agricultural University, 2007. (in Chinese)
[21] 邹庆道. 玉米穗腐病和茎腐病镰孢菌病原学相互关系及遗传多态性研究. 植物病理学报, 2003, 33(1): 93-94.ZOU Q D. Studies on mutual relationship in etiology and genetic polymorphism ofFusariumfrom stalk rot and ear rot in maize.ActaPhytopathologica Sinica, 2003, 33(1): 93-94. (in Chinese)
[22] 孙枫. 禾谷镰孢菌群体遗传结构研究[D]. 南京: 南京农业大学,2004.SUN F. Population genetic structure ofFusarium graminearumspecies complex[D]. Nanjing: Nanjing Agricultural University, 2004.(in Chinese)
[23] 刘恒, 侯丽娟, 马红娜, 白耀博, 李强, 王保通. 陕西省小麦禾谷镰刀菌的遗传多样性研究. 植物病理学报, 2010, 40(6):615-621.LIU H, HOU L J, MA H N, BAI Y B, LI Q, WANG B T. Genetic diversity ofFusarium graminearumfrom wheat in Shaanxi Province.Acta Phytopathologica Sinica, 2010, 40(6): 615-621. (in Chinese)
[24] 洪旭. 四川省小麦赤霉病菌致病性分化及遗传多样性分析[D]. 雅安: 四川农业大学, 2012.HONG X. Studies ofFusariumspp. pathogenicity differentiation and analysis ofFusarium graminearumgenetic diversity in Sichuan[D].Yaan: Sichuan Agricultural University, 2012. (in Chinese)
[25] 董怀玉, 王大为, 王丽娟, 刘可杰, 姜钰, 徐秀德, 左驰. 北方春玉米区玉米穗腐病禾谷镰孢菌复合种 SCAR类型测定. 东北农业大学学报, 2015, 46(10): 23-28.DONG H Y, WANG D W, WANG L J, LIU K J, JIANG Y, XU X D,ZUO C. SCAR type detection ofFusarium graminearumclade species complex on spring maize producing areas of north China.Journal of Northeast Agricultural University, 2015, 46(10): 23-28. (in Chinese)
[26] 任旭. 我国玉米穗腐病主要致病镰孢菌多样性研究[D]. 北京: 中国农业科学院, 2011.REN X. Diversity analyses ofFusariumspp., the main causal agents of maize ear rot in China[D]. Beijing: Chinese Academy of Agricultural Sciences, 2011. (in Chinese)
[27] 李蕊倩, 何瑞, 张跃兵, 徐玉梅, 王建明. 镰刀菌ISSR标记体系的建立及遗传多样性分析. 中国农业科学, 2009, 42(9): 3139-3146.LI R Q, HE R, ZHANG Y B, XU Y M, WANG J M. Establishment of ISSR reaction system ofFusariumand its analysis of genetic diversity.Scientia Agricultura Sinica, 2009, 42(9): 3139-3146. (in Chinese)
[28] 王建明, 李蕊倩, 畅引东, 何瑞, 李新风, 徐玉梅, 高俊明. 尖孢镰刀菌及芬芳镰刀菌遗传多样性的ISSR分析. 植物病理学报, 2011,41(4): 337-344.WANG J M, LI R Q, CHANG Y D, HE R, LI X F, XU Y M, GAO JM. ISSR analysis of genetic diversity ofFusarium oxysporumandF.redolens.Acta Phytopathologica Sinica, 2011, 41(4): 337-344. (in Chinese)
[29] 李新凤. 山西镰刀菌种类鉴定及遗传多样性分析研究[D]. 太谷:山西农业大学, 2013.LI X F. The morphological identification and genetic diversity ofFusariumin Shanxi Province[D]. Taigu: Shanxi Agriculture University,2013. (in Chinese)
[30] BAYRAKTAR H, DOLAR F S, MADEN S. Use of RAPD and ISSR markers in detection of genetic variation and population structure amongFusarium oxysporumf. sp.cicerisisolates on chickpea in Turkey.Journal of Phytopathology, 2008, 156(3):146-154.
[31] WAALWIJK C, KASTELEIN P, VRIES I D, KERÉNYI Z, LEE T V D, HESSELINK T, KÖHL J, KEMA G. Major changes inFusariumspp. in wheat in the Netherlands.European Journal of Plant Pathology, 2003, 109: 743-754.
[32] NEI M. Genetic distance between populations.The American Naturalist, 1972, 106(949): 283-292.
[33] QU B, LI H P, ZHANG J B, XU Y B, HUANG T, WU A B, ZHAO C S, CARTER J, NICHOLSON P, LIAO Y C. Geographic distribution and genetic diversity ofFusarium graminearumandF.asiaticumon wheat spikes throughout China.Plant Pathology,2008, 57(1): 15-24.
[34] 何婧, 郭庆元, 王晓鸣, 宋利宁, 张维娜, 武小菲. 利用 ISSR技术分析禾谷镰孢菌群体遗传多样性的研究. 玉米科学, 2011, 19(2):129-134.HE J, GUO Q Y, WANG X M, SONG L N, ZHANG W N, WU X F.Study on genetic diversity ofFusarium graminearumpopulations causing maize stalk rot by ISSR analysis.Journal of Maize Sciences,2011, 19(2): 129-134. (in Chinese)
[35] 瞿波. 中国禾谷镰刀菌(Fusarium graminearum)的遗传多样性及其与尼泊尔、欧美菌系的比较[D]. 武汉: 华中农业大学, 2003.QU B. Genetic diversity ofFusarium gaminearumin China and its comparison with the isolates from of Nepal, Europe and USA[D].Wuhan: Huazhong Agricultural University, 2003. (in Chinese)

