肺腺癌患者EGFR基因突变与血清肿瘤标志物CEA的相关性研究*
林 牧,韩晓静,陈云华,唐 竹,陶 雪,马庆庆(贵州航天医院,贵州遵义563000)
肺癌是我国目前最为常见的恶性肿瘤[1],其发病率和病死率极高,居全球恶性肿瘤的首位。其非小细胞肺癌(NSCLC)所占比例为 75.0%~85.0%[2]。NSCLC 通常发现晚、进展快、预后差,其中肺腺癌占NSCLC的40.0%,且该类肺癌患者绝大部分在确诊时已处于晚期,病死率远高于其他恶性肿瘤[3-5]。在NSCLC分子靶向标志物中表皮生长因子受体(EGFR)基因突变是目前研究最为广泛、了解最为透彻、指南最为推荐的分子标志物[6-7]。表皮生长因子受体酪氨酸激酶抑制剂(EGFRTKI)靶向药物的发现给很多肺癌晚期患者带来了新的曙光,其为酪氨酸激酶受体抑制剂,可抑制酪氨酸磷酸化过程[8],阻断EGFR-KRAS-P3IK/蛋白激酶B等通路的信号传导,从而抑制肿瘤细胞生长[9]。新近研究显示,肺腺癌患者血清肿瘤标志物——癌胚抗原(CEA)与EGFR基因突变相关[10],但多数文献仅报道了CEA表达水平的正常或异常,并未从其水平梯度层面进行剖析[11]。本研究拟通过回顾性分析本院行EGFR基因检测的36例肺腺癌患者血清CEA水平,进一步对不同分层的CEA水平与EGFR基因突变情况进行相关性研究。
1 资料与方法
1.1 标本来源 选取2016年1月1日至2017年1月15日本院收治的肺腺癌患者36例,其中男27例,女9例;年龄 35~81岁,平均(63.6±0.78)岁。所有患者均经病理学和细胞学检查确诊为肺腺癌,所有标本均为病理组织标本和血标本。剔除信息不全的标本。
1.2 方法
1.2.1 血清CEA检测 采集患者治疗前晨起空腹静脉血3 mL,静置20 min后,室温下3 000 r/min离心10 min,分离血清后采用贝克曼化学发光免疫仪(DXI-800)检测CEA水平,严格按操作流程及试剂盒说明书操作,血清 CEA 水平以小于 5、5~20、>20 ng/mL 为界限分为3个层次。
1.2.2 EGFR基因检测 收集肺腺癌患者穿刺或纤维支气管镜采取的组织标本,用10%甲醛固定后进行石蜡包埋,切10张未染色石蜡切片。使用突变特异性扩增系统-聚合酶链反应方法进行29种EGFR基因热点突变检测,试剂购自厦门艾德生物医药科技有限公司,荧光定量聚合酶链反应采用ABI7500基因扩增仪。严格按仪器标准操作规程及试剂盒说明书操作。
2 结 果
2.1 EGFR突变状态 36例患者中EGFR突变30例(83.3%),其中19号外显子19-Del突变14例,20号外显子T790M突变2例,19号外显子19-Del突变合并20号外显子Ins突变2例,20号外显子20-Ins合并21号外显子L858R突变2例,21号外显子L858R突变10例。基因表型检测结果分布情况见表1。

表1 基因表型检测结果分布情况(n=36)
2.2 性别、CEA表达水平与EGFR基因突变的关系 女性、血清CEA≥5 ng/mL时,EGFR基因突变率更高,分别为100.0%、93.3%。见表2。
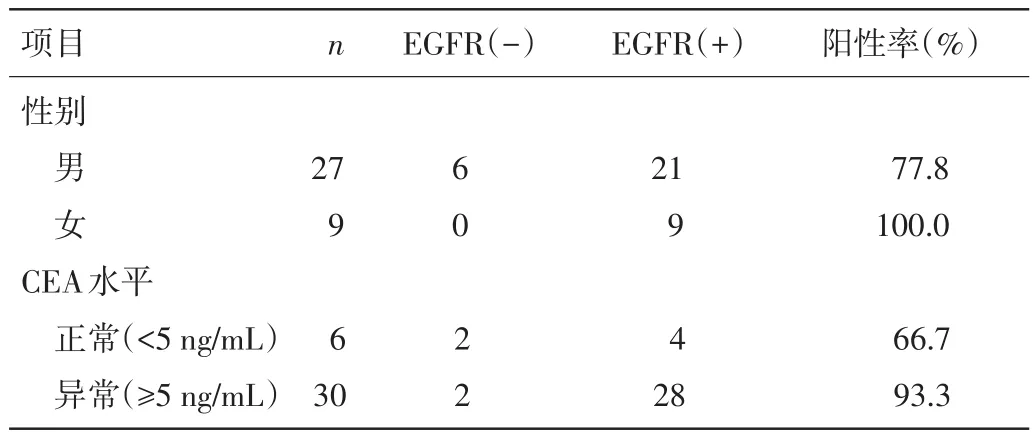
表2 性别、CEA表达水平与EGFR基因突变阳性率的关系
2.3 EGFR基因突变率与血清CEA水平的关系 以CEA水平作为自变量,以EGFR基因突变率作为因变量,根据原始数据作图。当CEA<5 ng/mL时,EGFR基因突变率为66.7%,当CEA为5~20 ng/mL时,EGFR基因突变率为90.0%,当CEA>20 ng/mL时,EGFR基因突变率为100.0%;EGFR基因突变率在CEA<5 ng/mL到5 ng/mL≤CAE≤20 ng/mL区域中,随着CEA水平增加,EGFR突变率显著上升。血清CEA水平升高,EGFR基因突变率随之上升。见图1。
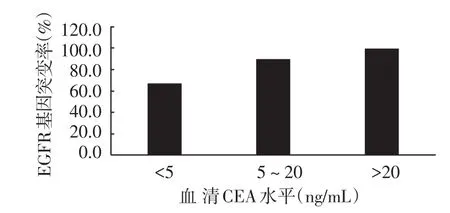
图1 EGFR基因突变率与血清CEA水平的关系
3 讨 论
近年来,随着基因组学和药物组学研究的深入,陆续发现许多原癌基因编码的蛋白可作为靶向治疗靶点,其中研究最为广泛和明确的即是EGFR家族。EGFR酪氨酸激酶活化是肿瘤信号传导和肿瘤细胞生长的必要条件,已成为目前肿瘤分子靶向治疗的一个最为重要的靶点。进行特异性酶抑制剂阻断酪氨酸激酶活化通路可控制肿瘤信号通路的传导,抑制肿瘤细胞生长,靶向使肿瘤细胞凋亡,发挥抗肿瘤作用[12]。
有研究证明,检测EGFR基因突变对预测EGFRTKI的疗效具有决定性意义[13]。EGFR基因热点突变(19号外显子缺失、21号外显子点突变)已被美国国立综合癌症网络指南、中国原发性肺癌诊疗规范定义为一线使用EGFR-TKI的先决条件,且是预测NSCLC疗效的前提[14]。
EGFR-TKI的广泛临床应用使NSCLC的治疗获得了突破性进展,使更多的晚期患者获益[15]。EGFR-TKI杀瘤机制是阻断络氨酸残基磷酸化过程[16],进一步阻止EGFR基因信号通路下游传导途径(EGFR-KRAS-P3IK/蛋白激酶B),进而抑制肺腺癌等肿瘤细胞增殖、迁徙、转移、血管生成[17]等一系列肿瘤细胞活动。但目前检测EGFR基因突变并无统一的方法,且技术门槛高、费用高,组织取材难、样本量少,受检测方法、费用、实验室等条件因素的影响,该治疗方案在临床上较难推广应用。因此,寻找替代或辅助EGFR基因突变检测指标的肿瘤标志物极为重要。
CEA是最早用于诊断NSCLC的肿瘤标志物之一,血清CEA水平与NSCLC疗效、患者预后等因素具有重要相关性。血清CEA水平高的NSCLC患者相较于血清CEA水平低的患者更能对EGFR-TKI分子靶向治疗敏感和有效[18]。
大量的研究证实了血清CEA水平与EGFR基因突变相关。王进峰等[19]研究结果证实,治疗前患者血清CEA水平与EGFR基因突变呈正相关,当血清CEA<50 ng/mL时,EGFR基因突变率随血清CEA水平升高而增加。日本学者SHOJI等[20]发现,48例肺腺癌患者血清CEA水平与EGFR基因突变直接相关,且肺癌患者EGFR基因突变与肿瘤复发时血清CEA水平有关,血清CEA水平高的肺腺癌患者EGFR基因突变率较高,血清CEA>5 ng/mL时,EGFR基因突变率为35.0%;CEA为5~20 ng/mL时,EGFR基因突变率为55.0%;CEA≥20 ng/mL时,EGFR基因突变率高达87.5%。本研究结果显示,EGFR基因突变率随血清CEA水平升高而升高。肺腺癌患者EGFR基因突变与血清CEA具有重要的联系,当CEA<5 ng/mL时,EGFR基因突变率为66.7%,当CEA为5~20 ng/mL时,EGFR基因突变率为90.0%,当CEA>20ng/mL时,EGFR基因突变率为100.0%;EGFR基因突变率在CEA<5 ng/mL到5 ng/mL≤CAE≤20 ng/mL区域中,随着CEA水平增加,EGFR基因突变率显著上升。
总之,检测肺腺癌患者血液CEA水平对EGFRTKI的疗效具有一定预测作用,在肺腺癌患者中,EGFR基因突变与血清CEA水平重要相关,血清CEA水平升高,EGFR基因突变率随之升高。但本研究纳入病例数较少,尚需扩大样本量进一步研究证实。
[1]支修益,石远凯,于金明.中国原发性肺癌诊疗规范(2015年版)[J].中华肿瘤杂志,2015,37(1):67-78.
[2]刘付东,孙晓凯,郑春早,等.2011—2014年江苏省盐城市恶性肿瘤发病和死亡分析[J].中国肿瘤,2017,26(2):86-90.
[3]周清华,范亚光,王颖,等.中国肺部结节分类、诊断与治疗指南(2016 年版)[J].中国肺癌杂志,2016,19(12):793-798.
[4]LORTET-TIEULENT J,SOERJOMATARAM I,FERLAY J,et al.International trends in lung cancer incidence by histological subtype:adenocarcinoma stabilizing in men but still increasing in women[J].Lung Cancer,2014,84(1):13-22.
[5]ASHWORTH A,RODRIGUES G,BOLDT G,et al.Is there an oligometastatic stateinnon-smallcelllungcancer:asystematicreviewoftheliterature[J].Lung Cancer,2013,82(2):197-203.
[6]GARON EB,RIZVI NA,HUI R,et al.Pembrolizumab for the treatment of non-small-cell lung cancer[J].N Engl J Med,2015,372(21):2018-2028.
[7]YANG JJ,CHEN HJ,YAN HH,et al.Clinical modes of EGFR tyrosine kinase inhibitor failure and subsequent management in advanced nonsmall cell lung cancer[J].Lung Cancer,2013,79(1):33-39.
[8]WU YL,ZHOU C,HU CP,et al.Afatinib versus cisplatin plus gemcitabine for first-line treatment of Asian patients with advanced nonsmall-cell lung cancer harbouring EGFR mutations(LUX-Lung 6):an open-label,randomised phase 3 trial[J].Lancet Oncology,2014,15(2):213-222.
[9]KORPANTY GJ,GRAHAM DM,VINCENT MD,et al.Biomarkers that currentlyaffectclinicalpracticeinlungcancer:EGFR,ALK,Met,ROS-1,and KRAS[J].Front Oncol,2014,4:204.
[10]ROMERO-VENTOSA EY,BLANCO-PRIETO S,GONZÁLEZ-PIÑEIRO AL,etal.PretreatmentlevelsoftheserumbiomarkersCEA,CYFRA21-1,SCC and the soluble EGFR and its ligands EGF,TGF-alpha,HB-EGF in the prediction of outcome in erlotinib treated non-small-cell lung cancer patients[J].Springerplus,2015,4:171.
[11]YANG ZM,DING XP,PEN L,et al.Analysis of CEA expression and EGFR mutation status in non-small cell lung cancers[J].Asian Pac J Cancer Prev,2014,15(8):3451-3455.
[12]ELLISON G,ZHU G,MOULIS A,et al.EGFR mutation testing in lung cancer:a review of available methods and their use for analysis of tumour tissue and cytology samples[J].J Clin Pathol,2013,66(2):79-89.
[13]WU YL,ZHOU C,LIAM CK,et al.First-line erlotinib versus gemcitabine/cisplatin in patients with advanced EGFR mutation-positive nonsmall-cell lung cancer:analyses from the phaseⅢ,randomized,open-label,ENSURE study[J].Ann Oncol,2015,26(9):1883-1889.
[14]HAALAND B,TAN PS,DE CASTRO G JR,et al.Meta-analysis of firstline therapies in advanced non-small-cell lung cancer harboring EGFR-activating mutations[J].J Thorac Oncol,2014,9(6):805-811.
[15]GOLDBERG SB,OXNARD GR,DIGUMARTHY S,et al.Chemotherapy with Erlotinib or chemotherapy alone in advanced non-small cell lung cancer with acquired resistance to EGFR tyrosine kinase inhibitors[J].Oncologist,2013,18(11):1214-1220.
[16]DELANEY C,FRANK S,HUANG RS.Pharmacogenomics of EGFR-targeted therapies in non-small cell lung cancer:EGFR and beyond[J].Chin J Cancer,2015,34(4):149-160.
[17]LIANG W,WU X,FANG W,et al.Network meta-analysis of erlotinib,gefitinib,afatinib and icotinib in patients with advanced non-smallcell lung cancer harboring EGFR mutations[J].PLoS One,2014,9(2):e85245.
[18]JIN B,ZHANG Y,ZHANG X,et al.Value of carcinoembryonic antigen levels in predicting the efficacy of EGFR-TKI in advanced non-small cell lung cancer harboring EGFR mutations[J].Zhonghua Yi Xue Za Zhi,2014,94(30):2327-2331.
[19]王进峰,龙浩.非小细胞肺癌表皮生长因子受体基因突变与癌胚抗原表达水平的关系[J].广东医学,2012,33(11):1589-1592.
[20]SHOJI F,YOSHINO I,YANO T,et al.Serum carcinoembryonic antigen level is associated with epidermal growth factor receptor mutations in recurrent lung adenocarcinomas[J].Cancer,2007,110(12):2793-2798.

