结直肠无蒂锯齿状腺瘤/息肉在白光内镜和窄带成像模式下的形态特征
田甜,崔静,胡桂明,赵治国,曹智博,李浩
(1.郑州大学第二附属医院 消化内科,河南 郑州 450000;2.郑州大学第二附属医院 病理科,河南 郑州 450000;3.河南大学附属郑州颐和医院 消化内科,河南 郑州 450000)
2010版WHO消化系统肿瘤分类中将锯齿状病变划分为:增生性息肉(hyperplastic polyp,HP)、无蒂锯齿状腺瘤/息肉(sessile serrated adenoma/polyp,SSA/P)和传统锯齿状腺瘤(traditional serrated adenoma,TSA)[1]。目前认为结直肠癌(colorectal cancer,CRC)发生发展途径包括:腺瘤-腺癌途径,Lynch syndrom突变途径,HP-锯齿状腺瘤(serrated adenoma,SA)-锯齿状肿瘤通路癌途径,后者是一种新型的CRC的发生途径,通过该途径发生的CRC约占30.0%~35.0%[2-3]。SSA/P呈平坦无蒂型,表面覆盖黄色黏液,清除黏液后,与周围黏膜色泽相同或红色,部分SSA/P内镜特征与HP相似,结肠镜检查时容易遗漏或混淆,切除不完整或随访不及时,可进展为锯齿状癌。加强对SSA/P镜下形态特征的认识,可以提高病变的早期检出率,便于治疗策略的制定和预后判断[4]。本研究拟从白光内镜(white light endoscopy,WLE)和窄带成像(narrow band imaging,NBI)模式下对SSA/P和HP形态特征进行观察,探讨NBI下SSA/P与HP的鉴别预测的方法。
1 资料与方法
1.1 一般资料
回顾性分析2014年1月-2017年3月郑州大学第二附属医院内镜室检出的具有完整临床和病理资料且诊断为SSA/P的病例,所有息肉经内镜下黏膜切除术(endoscopic mucosal resection,EMR)、内镜黏膜下剥离术(endoscopic submucosal dissection,ESD)或手术切除。排除临床或病理资料不完整、肠道准备不佳、图像不清晰及不能显示病变全貌的病例,排除合并溃疡性结肠炎、遗传性息肉综合征、锯齿状息肉病、混合型息肉病的病例。按上述标准纳入SSA/P 50枚,随机性按大小以1∶1比例匹配同期诊断为HP 50枚。50枚SSA/P来自41例患者(男23例,女18例,比例1.3∶1),平均年龄(58.4±8.3)岁,50枚HP来自43例患者(男26例,女17例,比例1.5∶1),平均年龄(55.5±7.5)岁,两组男女比例和平均年龄差异均无统计学意义(P>0.05);SSA/P位于右半结肠者多于HP(16枚 vs 14枚,P>0.05),但差异无统计学意义。SSA/P位于右半结肠者16枚,位于左半结肠及直肠者34枚,位于左半结肠及直肠的枚数多于右半结肠(以结肠脾曲为界将结肠分为右半结肠与左半结肠及直肠)。
1.2 器械与方法
1.2.1 肠道准备 分次口服舒泰清(成分为复方聚乙二醇电解质散),西甲基硅油祛泡。
1.2.2 器械 使用Olympus公司的CLV-260SL、CLV-290SL主机,CF-H260AI、CF-H260AZI、CFH290I结肠镜完成检查,使用NBI模式对病变进行观察并保存图像,标准单人操作。
1.2.3 诊断标准 ①SSA/P诊断标准参考2010年WHO消化系统肿瘤分类中的诊断标准[1]及相关文献中的标准[5-6]:锯齿状扩张腺腔、隐窝分布不规则、隐窝底部扩张、隐窝底部锯齿状结构、隐窝分支、隐窝底水平扩展、内翻生长、隐窝成熟不良、细胞无异型性且细胞增殖带异常。3个隐窝或连续2个隐窝具有至少2条特征性改变,病理诊断由1名病理医师完成;②结直肠肿瘤发育形态学分型根据2002年巴黎分型[7]:有蒂型:Ⅰp型;无蒂型:Ⅰs型;表浅隆起型:Ⅱa型;表浅平坦型:Ⅱb型;表浅凹陷型:Ⅱc型;侧边隆起型:LST型;③息肉腺管开口分型结合工藤分型[8]和KIMURA等[9]相关研究。
1.3 观察指标
参考SSA/P内镜特征相关文献[10],在WLE和NBI下对SSA/P和HP以下特征进行分析:部位、表面黏液、形态学分型、外形、边界、红色黏液帽、隐窝内黑点影、积云样表面、表面微血管网、腺管开口类型。所有内镜图片均由2名有经验的内镜医师(具有较熟练地黏膜细微结构及黏膜下微血管辨识能力)协商评估。
1.4 统计学方法
采用SPSS 20.0统计软件进行统计分析。正态分布的数据用均数±标准差(±s)表示,计量资料的比较采用t检验,计数资料的比较采用χ2检验,P<0.05认为差异有统计学意义。内镜下形态特征对SSA/P与HP的鉴别预测的价值采用灵敏度、特异度、阳性预测值、阴性预测值、准确性及优势比(odds ratio,O)描述。
2 结果
2.1 WLE下形态特征
SSA/P表面富于黏液者37枚,HP表面富于黏液者11枚,两组差异有统计学意义(P<0.05);SSA/P中内镜下呈Ⅰs型11枚,Ⅱa型21枚,Ⅱb型16枚,LST型2枚,HP中内镜下呈Ⅰs型17枚,Ⅱa型25枚,Ⅱb型8枚,两组差异无统计学意义(P>0.05)。见表1。
2.2 NBI模式下形态特征
SSA/P中表面有微血管网者多于HP(16枚 vs 7枚),差异有统计学意义(P<0.05),见图1;SSA/P中隐窝内有黑点影者多于HP(40枚 vs 11枚),差异有统计学意义(P<0.05),见图1~5;SSA/P中具有红色黏液帽者多于HP(32枚 vs 8枚),差异有统计学意义(P<0.05),见图1、4和6;SSA/P中边界不清者多于HP(27枚 vs 12枚),差异有统计学意义(P<0.05),见图5和6;SSA/P中形态不规则者多于HP(26枚vs 11 枚)差异有统计学意义(P<0.05),见图5和6;SSA/P中呈积云样表面者多于HP(26枚 vs 3枚),差异有统计学意义(P<0.05),见图6和7;SSA/P中腺管开口呈Ⅰ型者0枚,Ⅱ型15枚,Ⅱ-O型35枚,见图1~4,HP中腺管开口呈Ⅰ型者9枚,Ⅱ型39枚,见图8,Ⅱ-O型2枚,两组差异有统计学意义(P<0.05)。见表2和3。
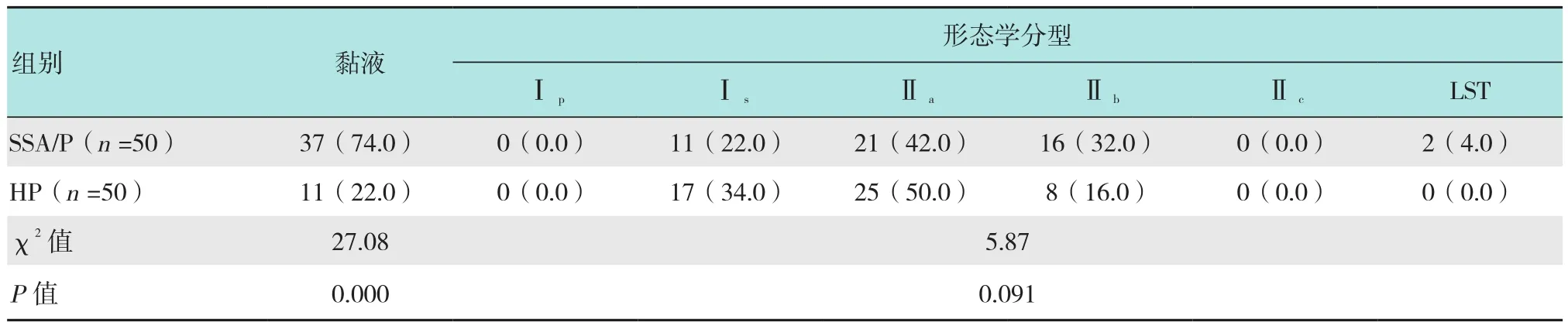
表1 SSA/P和HP在WLE下形态特征比较 枚(%)Table 1 Comparison of morphological features between SSA/P and HP under white light endoscopy n(%)
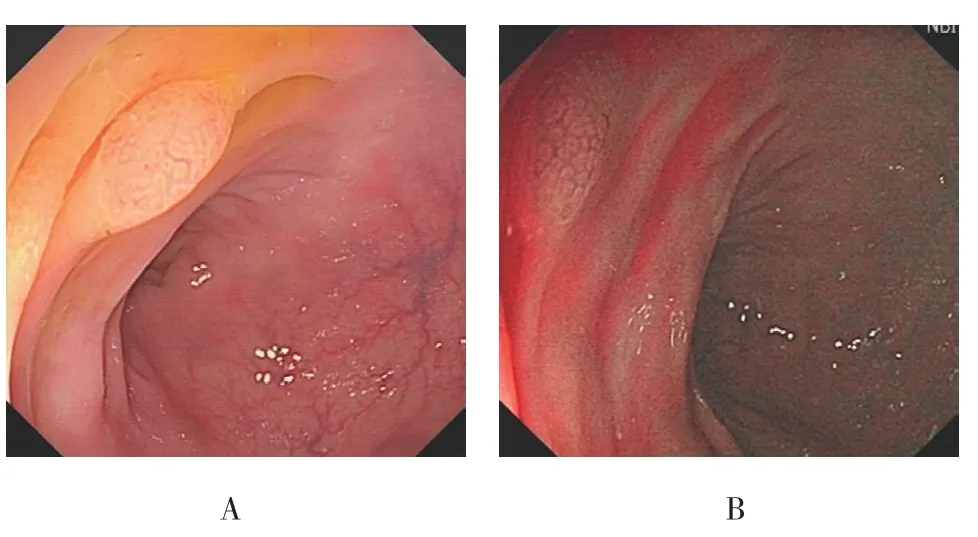
图1 乙状结肠SSA/P的内镜下形态特征Fig.1 Endoscopic morphological features of SSA/P located in the sigmoid colon
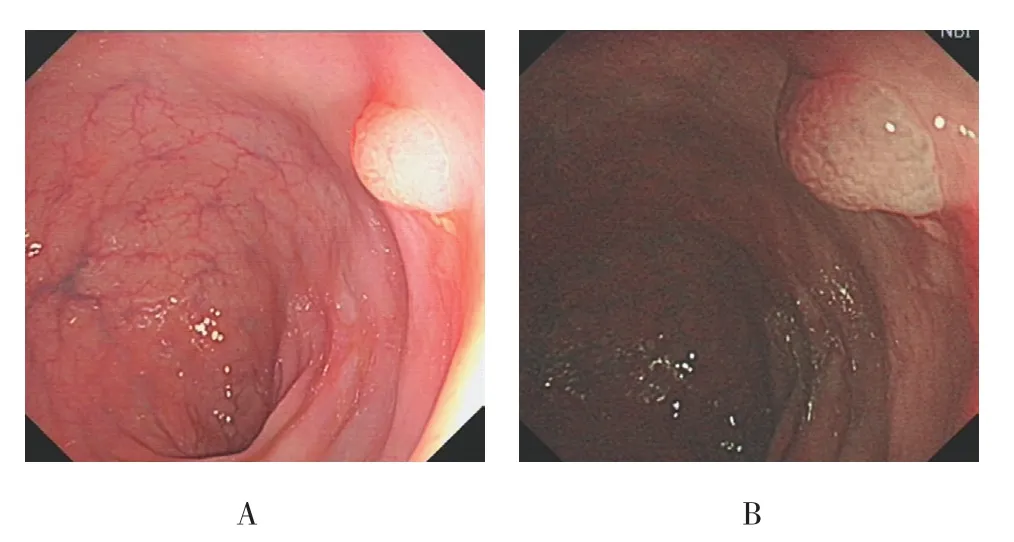
图2 乙状结肠形态规则的SSA/P的内镜下形态特征Fig.2 Endoscopic morphological features of SSA/P with regular morphology located in the sigmoid colon
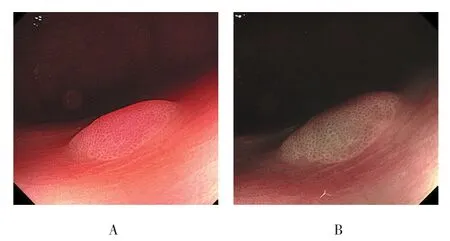
图3 直肠SSA/P的内镜下形态特征Fig.3 Endoscopic morphological features of SSA /P located in the rectum
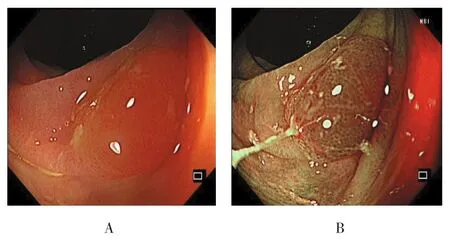
图4 横结肠SSA/P的内镜下形态特征Fig.4 Endoscopic morphological features of SSA /P located in transverse colon
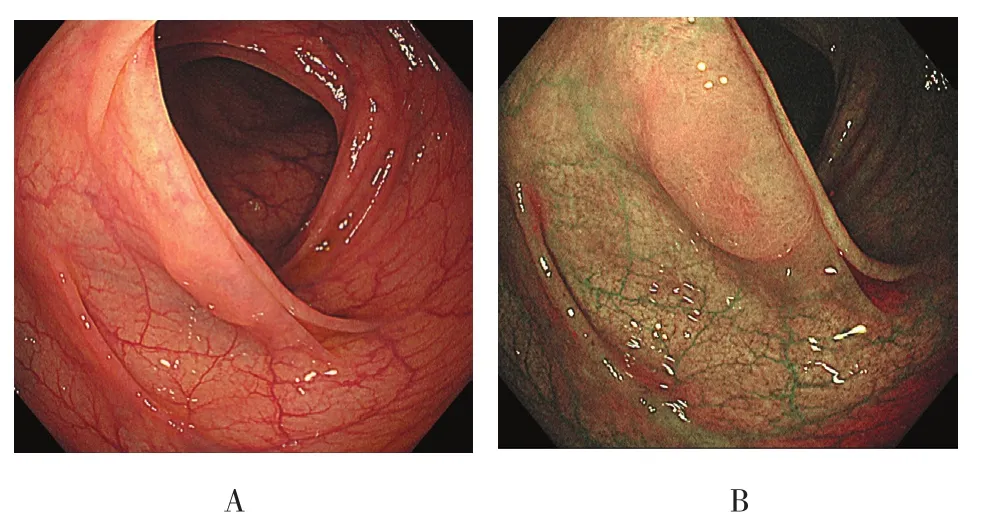
图5 横结肠形态不规则的SSA/P的内镜下形态特征Fig.5 Endoscopic morphological features of SSA/P with irregular shape located in transverse colon
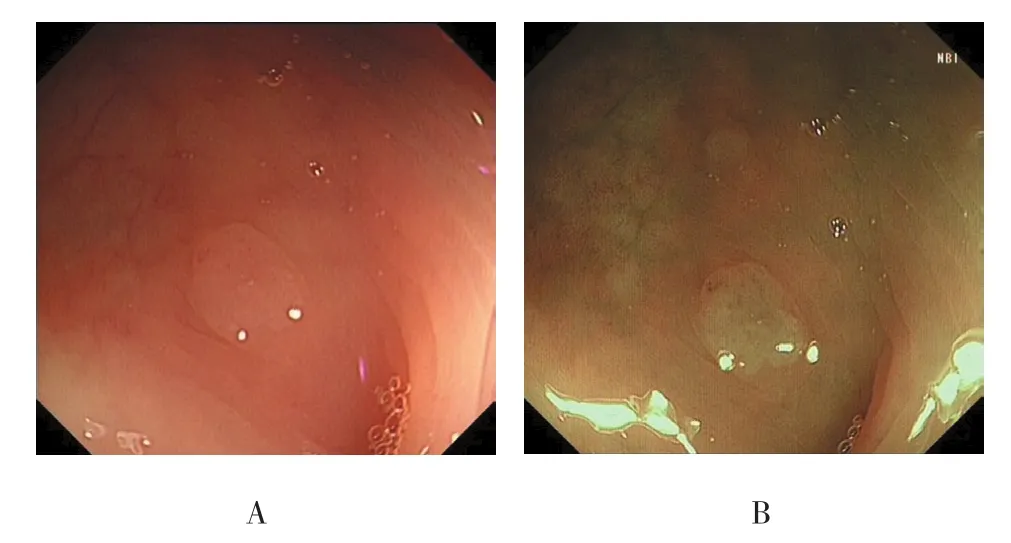
图6 乙状结肠形态不规则的SSA/P的内镜下形态特征Fig.6 Endoscopic morphological features of SSA/P with irregular shape located in the sigmoid colon
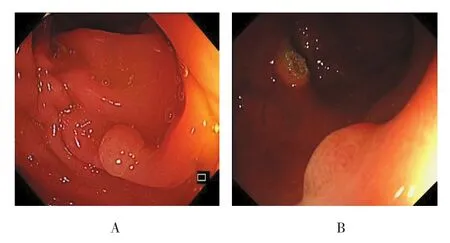
图7 白光内镜下SSA/P的形态特征Fig 7 Endoscopic morphological features of SSA /P under white light endoscope

图8 增生性息肉的内镜下形态特征Fig 8 Endoscopic morphological features of hyperplastic polyp
2.3 内镜下形态特征对SSA/P病理诊断的预测作用
2.4 联合3个内镜下形态特征对SSA/P进行诊断预测
联合隐窝内黑点影和Ⅱ-O型腺管开口与其余形态特征对SSA/P进行诊断预测:隐窝内黑点影+Ⅱ-O型开口+表面红色黏液帽的灵敏度、特异度、准确性分别为96.0%、66.7%和84.7%;隐窝内黑点影+Ⅱ-O型开口+积云样表面的灵敏度、特异度、准确性分别为88.9%、70.4%和81.9%;联合试验明显提高了边界模糊与形态不规则在诊断预测中的灵敏度,灵敏度、特异度、准确性分别为91.1%、59.3%、79.2%和88.9%、62.7%、79.2%。联合试验可提高诊断预测SSA/P的灵敏度和准确性,可使漏诊率降低。见表5。
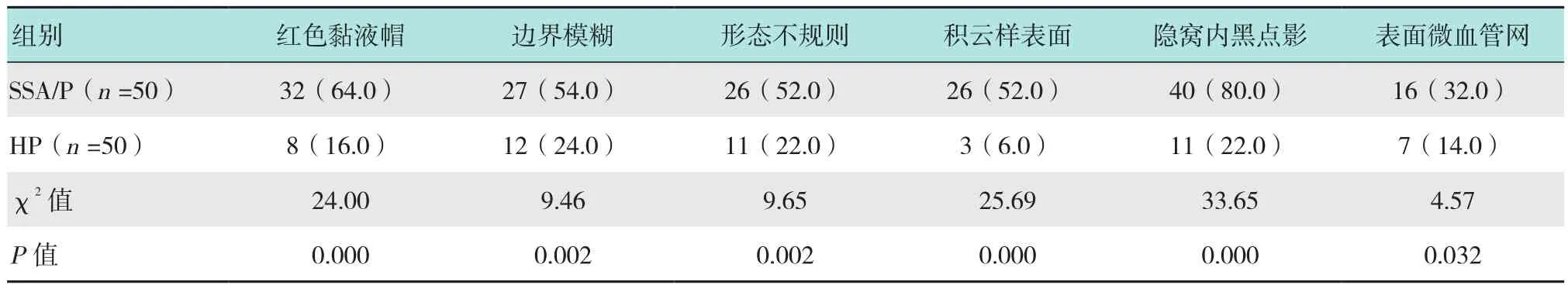
表2 SSA/P和HP在NBI下形态特征的比较 枚(%)Table 2 Comparison of morphological features between SSA/P and HP under narrow band imaging n(%)
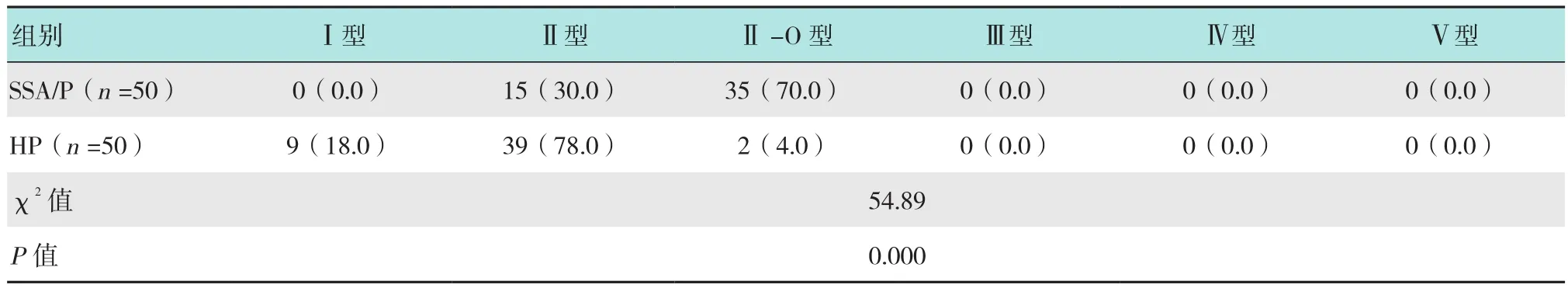
表3 SSA/P和HP的腺管开口类型比较 枚(%)Table 3 Comparison of the pit pattern between SSA/P and HP n(%)
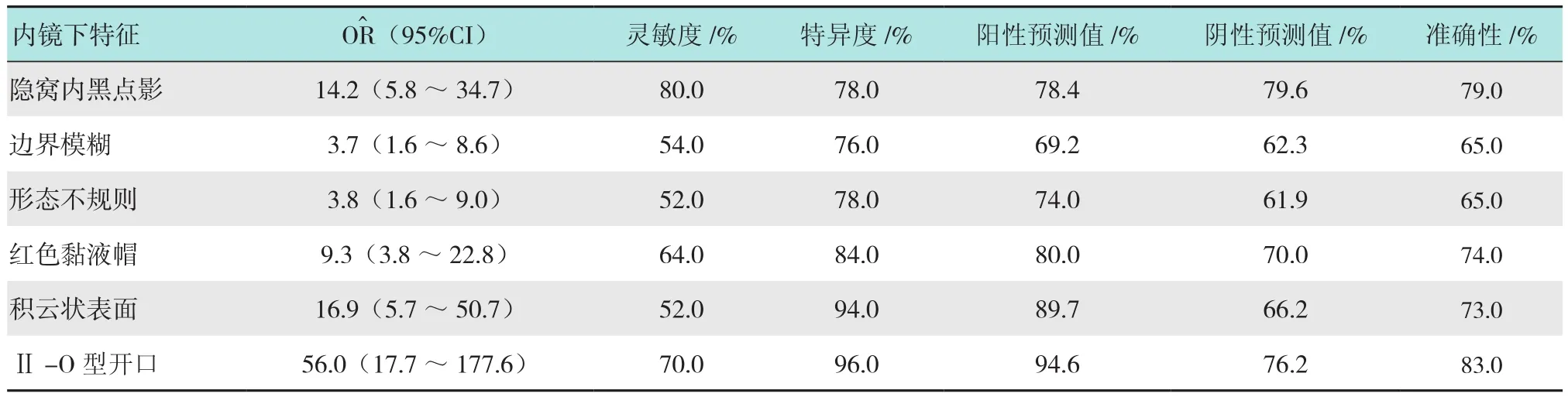
表4 内镜下形态特征对SSA/P病理诊断的预测作用Table 4 Predicted effect of endoscopic morphological features in SSA/P pathological diagnosis

表5 隐窝内黑点影和Ⅱ-O型腺管开口联合其他形态特征对SSA/P的诊断预测 %Table 5 Predicted diagnosis of SSA/P combining the black dots inside the crypts,Type Ⅱ-O pit pattern and others morphological features %
3 讨论
SSA/P常伴有BRFA基因的突变和CpG岛甲基化,是散发性微卫星不稳定性(microsatellite instability,MSI)癌及CpG岛甲基化的微卫星稳定性癌的前驱病变,与右半结肠癌的发生密切相关[11-12]。随着放大内镜及NBI技术的发展,研究开始关注SSA/P的内镜下特征。锯齿状病变中HP约占70.0%~90.0%,SSA/P约占15.0%~25.0%,TSA约占1.0%~2.0%。TSA少见、多有蒂、色红、分叶状、体积较SSA/P和HP大,易于鉴别,然而SSA/P与HP的内镜下鉴别特征仍然不明确。
本研究对SSA/P和HP的内镜下形态特征进行分析比较发现:SSA/P位于左半结肠和直肠的枚数多于右半结肠,与国外KAWASAKI等[13]的研究SSA/P多见于右半结肠的结果不一致,与国内张婉雯等[14]的报道一致。分析其原因,可能与以下因素有关:本研究样本量较少、国内内镜医生对右半结肠无蒂息肉的认识不足、检查时结肠镜在右半结肠退出过快、肠道准备不佳、扩张不充分及国内病理医生对SSA/P的诊断不足等因素相关。在WLE和NBI模式下SSA/P相比HP具有以下特点:表面光滑柔软、富于黏液、边界模糊、形态不规则、具有红色黏液帽、隐窝内黑点影、积云样表面、Ⅱ-O型腺管开口、偶见扩张微静脉。在SSA/P诊断的预测中:隐窝内黑点影(OR^:14.2;95%CI:5.8~34.7)的灵敏度、特异度、准确性分别是:80.0%、78.0%和79.0%,灵敏度相对较高,与HAZEWINKEL等[10]用高清白光内镜及NBI的研究结果58.0%、71.0%、65.0%相比,灵敏度、准确性均提高,特异度相似;Ⅱ-O型腺管开口(OR^:56.0;95%CI:17.7~177.6)的灵敏度、特异度、阳性预测值、阴性预测值、准确性分别是70.0%、96.0%、94.6%、76.2%和83.0%,特异度较高,与KIMURA等[9]的结果类似,与KAWASAKI等[13]用放大色素内镜研究的结果69.0%、87.5%、76.3%、82.9%和80.7%相比,特异度提高,但灵敏度、阳性预测值、阴性预测值、准确性均类似。KIMURA等[9]认为NBI下SSA/P隐窝内黑点影是扩张的隐窝,是腺管扩张的一种光学表现。本研究结合锯齿状息肉的组织学特征[5-6]发现隐窝内黑点包括但不等同于Ⅱ-O型腺管开口。Ⅱ-O型腺管开口在NBI下表现为大的黑点,Ⅱ-O型腺管开口在组织学上与SSA锯齿状畸形扩张的隐窝腺腔和黏液分泌增多直接相关,由于部分SSA/P隐窝的畸形扩张位于基底部,表层扩张不明显,Ⅱ-O型腺管开口在SSA/P的鉴别预测中有较高特异度为96.0%,而灵敏度不高仅70.0%;在HP中,微小泡型增生性息肉(microvesicular hyperplastic polyps,MVHP)组织学上表现为隐窝的上1/3锯齿状扩张,基底部狭窄,在NBI下可观察到息肉表面小而淡的黑点。因此,在研究中发现隐窝内黑点影在鉴别预测中灵敏度较高为80.0%,但特异度较低;研究发现边界模糊与形态不规则在鉴别预测中灵敏度、特异度、准确率分别是54.0%、76.0%、65.0%和52.0%、78.0%、65.0%,与HAZEWINKEL等[10]的研究结果78.0%、69.0%、74.0%和73.0%、65.0%、73.0%相比,灵敏度、准确性均较低,特异度类似。分析其原因:研究发现有一类SSA/P息肉,直径≤5 mm,表面光滑,富于黏液,隐窝内有黑点影,腺管开口呈Ⅱ-O型,但边界清楚,形态规则,在SSA/P中约占38.0%,普通结肠镜下与HP鉴别困难,需借助放大内镜、黏膜染色技术、NBI模式甚至组织病理学进行鉴别。JARAMILLO等[15]在研究中也提到此类SSA/P,在结肠镜检查时极易遗漏或误诊。
研究发现联合隐窝内黑点影和Ⅱ-O型腺管开口与其余内镜特征对SSA/P进行诊断预测,各组诊断预测的灵敏度明显提高,准确性也提高,推荐在结肠镜检查时可联合两者与其余形态特征对SSA/P和HP进行诊断鉴别,以达到内镜下筛检诊断SSA/P的目的。
研究证实NBI模式下SSA/P相比HP具有独特形态特征。在NBI下对SSA/P与HP表面特征进行观察,虽然可达到鉴别两者的目的,仍然需要前瞻性试验与实时结肠镜检查来验证这些形态特征对SSA/P的预测作用,来衡量这些形态特征在临床诊断中的价值。
[1]BOSMAN F T, CARNEIRO F, HRUBAN R H, et al. WHO classification of tumours of the digestive system[M]. International Agency for Research on Cancer, 2010: 1089.
[2]ERICHSEN R, BARON J A, HAMILTON-DUTOIT S J, et al.Increased risk of colorectal cancer development among patients with serrated polyps[J]. Gastroenterology, 2016, 150(4): 895-902.
[3]HAWKINS N J, BARIOL C, WARD R L. The serrated neoplasia pathway[J]. Pathology, 2002, 34(6): 548-555.
[4]AUST D E, BARETTON G B, Members of the Working Group GIPathology of the German Society of Pathology. Serrated polyps of the colon and rectum (hyperplastic polyps, sessile serrated adenomas, traditional serrated adenomas, and mixed polyps)-proposal for diagnostic criteria[J]. Virchows Archiv, 2010, 457(3):291-297.
[5]REX D K, AHNEN D J, BARON J A, et al. Serrated Lesions of the colorectum: review and recommendations from an expert panel[J].American Journal of Gastroenterology, 2012, 107(9): 1315-1329.
[6]SNOVER D C, JASS J R, FENOGLIO-PREISER C, et al. Serrated polyps of the large intestine: a morphologic and molecular review of an evolving concept[J]. American Journal of Clinical Pathology,2005, 124(3): 380-391.
[7]WORKSHOP P I. The Paris endoscopic classification of superficial neoplastic lesions: esophagus, stomach, and colon: November 30 to December 1, 2002[J]. Gastrointest Endosc, 2003, 58(6 Suppl):S3-S43.
[8]KUDO S, HIROTA S, NAKAJIMA T, et al. Colorectal tumours and pit pattern[J]. Journal of Clinical Pathology, 1994, 47(10): 880-885.
[9]KIMURA T, YAMAMOTO E, YAMANO H O, et al. A novel pit pattern identifies the precursor of colorectal cancer derived from sessile serrated adenoma[J]. American Journal of Gastroenterology,2012, 107(3): 460-469.
[10]HAZEWINKEL Y, LÓPEZCERÓN M, EAST J E, et al.Endoscopic features of sessile serrated adenomas: validation by international experts using high-resolution white light endoscopy and narrow-band imaging[J]. Gastrointestinal Endoscopy, 2013,77(6): 916-924.
[11]GOLDSTEIN N S. Small colonic microsatellite unstable adenocarcinomas and high-grade epithelial dysplasias in sessile serrated adenoma polypectomy specimens: a study of eight cases[J]. American Journal of Clinical Pathology, 2006, 125(1):132-145.
[12]CROCKETT S D, SNOVER D C, AHNEN D J, et al. Sessile serrated adenomas: an evidence-based guide to management[J].Clinical Gastroenterology & Hepatology, 2015, 13(1): 11-26.
[13]KAWASAKI K, KURAHARA K, YANAI S, et al. Colonoscopic features and malignant potential of sessile serrated adenomas:comparison with other serrated lesions and conventional adenomas[J]. Colorectal Disease, 2016, 18(8): 795-802.
[14]张婉雯, 任宝军, 童华生, 等. 71例结直肠锯齿状腺瘤内镜与病理学特征[J]. 中华胃肠外科杂志, 2006, 9(3): 250-252.
[14]ZHANG W W, REN B J, TONG H S, et al. Endoscopic and pathological features of 71 cases of colorectal serrated adenoma[J]. Chinese Journal of Gastrointestinal Surgery, 2006,9(3): 250-252. Chinese
[15]JARAMILLO E, WATANABE M, RUBIO C, et al. Small colorectal serrated adenomas: endoscopic findings [J]. Endoscopy,1997, 29(1): 1-3.

