大白菜基因组DNA快速提取方法的研究
王 涛,王超楠,张 红,温娟娟,张 斌
(1.天津师范大学 生命科学学院,天津 300387;2.天津科润蔬菜研究所,蔬菜种质创新国家重点实验室,天津市蔬菜遗传育种企业重点实验室,天津 300381)
植物基因组DNA的提取是重要的基础性技术,也是影响后续试验结果的关键步骤[1]。目前,常用的大白菜基因组DNA提取方法主要是CTAB法和SDS法[2],CTAB法中的CTAB能将破碎植物叶片细胞中的DNA溶解出来,再经氯仿-异戊醇抽提除去蛋白质,最后得到DNA。SDS法中的SDS在高温条件下能裂解植物细胞,使染色体离析、蛋白质变性,释放出DNA。这2种方法提取的DNA浓度高,且基因组DNA的完整性好,在植物分子育种研究上具有广泛的应用,但是其缺点也是很明显的,过程复杂,整个提取过程约3 h,效率低,无法满足快速检测的需要,而且所用到的有些试剂存在毒性,对人的身体健康会造成一定的危害[3]。随着分子标记技术在大白菜育种工作中的应用,经常需要对成千上万的大群体进行DNA提取,如果应用CTAB法或SDS法,则耗时长且工作量巨大。而分子标记辅助选择、纯度鉴定等工作中所需的DNA量不大[4],提取的DNA也不需要长时间保存。因此,寻找一种简单、快速的DNA提取方法非常必要。
碱裂解法是一种快速提取植物基因组DNA的新方法,在碱性环境中,样品的细胞膜和核膜被破坏[5],染色体DNA变性分开[5],然后加入Tris-HCl在DNA提取液中起到缓冲液的作用,使DNA去质子化,提高其溶解性[6]。这种方法提取的DNA量少、DNA保存时间短,但是操作过程简单,耗时短,能满足基本的试验需要[7]。目前文献报道的应用此种方法提取基因组DNA的有高粱[8]、水稻[9]、大豆[10]、玉米[11]、番茄[12]等,而碱裂解法在十字花科植物,如对大白菜基因组DNA提取中还未见相关的报道。本研究对碱裂解法进行了改进,并通过对几种大白菜基因组DNA提取方法的比较,在保证试验结果的可靠性和提高试验效率的基础上,旨在找到一种能够快速提取大白菜基因组DNA的方法。
1 材料和方法
1.1 试验材料
供试材料为抗根肿病的大白菜亲本G57和感根肿病的大白菜亲本G70,G70和G57杂交获得F1,F1与感病亲本G70回交构建BC1群体,所有试验材料均由天津科润蔬菜研究所提供。
2016年3月将试验的种子播种到育苗盘中,正常管理,育苗培养30 d后,待幼苗长到5~6片真叶时取样,采集叶片2~3片保存于-80 ℃,用于DNA提取。
1.2 试验方法
1.2.1 CTAB法[13]①取大白菜真叶0.2~0.3 g(1 cm×1 cm)叶片加入1.5 mL离心管中,加50 μL 2%的CTAB提取缓冲液,研磨,补至400 μL,65 ℃水浴40 min,每10 min拿出轻摇一次;②加入400 μL氯仿∶异戊醇(24∶1),轻摇5 min;③12 000 r/min离心5 min;④取上清200 μL至新的1.5 mL离心管,加入预冷的异丙醇200 μL,混匀,-20 ℃放置20 min,取出离心管,12 000 r/min,离心10 min;⑤弃上清,加入150 μL预冷乙醇,上下颠倒,洗净异丙醇,12 000 r/min,离心 5 min;⑥弃上清,室温下晾干2 h;⑦加蒸馏水100 μL溶解DNA,备用。
1.2.2 二步CTAB法[14]①取大白菜真叶0.2~0.3 g(1 cm×1 cm)叶片加入1.5 mL离心管中,加50 μL 2%的CTAB提取缓冲液,研磨,补至400 μL,65 ℃水浴40 min,每10 min拿出轻摇一次;②加入400 μL氯仿∶异戊醇(24∶1),轻摇5 min;③12 000 r/min,离心5 min;④取上清200 μL至新的离心管,备用。
1.2.3 碱裂解法Ⅰ ①取大白菜真叶0.2~0.3 g(1 cm×1 cm)叶片加入1.5 mL离心管中;②加100 μL 0.4 mol/L NaOH,研磨;③沸水浴1 min后,10 000 r/min,离心1 min;④取上清液10 μL至新的1.5 mL离心管,再加300 μL 0.1 mol/L Tris-HCl(pH值 8.0),混匀备用。
1.2.4 碱裂解法Ⅱ 共4步,其中步骤③,离心管10 000 r/min,离心1 min,其他3步同碱裂解法Ⅰ。
1.2.5 碱裂解法Ⅲ 共4步,其中步骤③中,不进行沸水浴和离心过程,其他3步同碱裂解法Ⅰ。
1.2.6 碱裂解法Ⅳ ①取大白菜真叶0.2~0.3 g(1 cm×1 cm)叶片加入1.5 mL离心管中;②加入200 μL 0.4 mol/L NaOH,研磨;③沸水浴1 min,直接作为PCR的模板,备用。以上每种方法重复3次。
1.3 提取的基因组DNA质量的检测
1%琼脂糖凝胶电泳检测DNA的提取质量(电泳缓冲液为1×TAE),GelRed染色,在凝胶成像仪上成像、观察。
1.4 PCR反应
取不同方法获得的DNA样本2 μL进行PCR扩增。
1.4.1 引物 分别为Bra019317、Bra019348、Bra019235-2和Bra019345-2。SSR标记为本项目开发的与本抗源抗根肿病基因连锁的分子标记,引物由华大基因公司合成。
1.4.2 PCR反应体系 20 μL,包括模板DNA 2 μL,Forward primer(10 μmol/L)1 μL,Reverse primer(10 μmol/L)1 μL,dNTPs(2.5 mmol/L each)2 μL,10×Buffer 2 μL,Taq酶(2.5 U/μL)0.2 μL,ddH2O补足20 μL。
1.4.3 PCR 反应程序 94 ℃预变性5 min;94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸30 s,35 个循环;72 ℃延伸5 min。
1.5 PCR产物检测分析
2%的琼脂糖凝胶电泳检测PCR产物的质量(电泳缓冲液为1×TAE),GelRed染色,在凝胶成像仪上成像、观察。8%非变性聚丙烯酰胺凝胶电泳检测条带多态性。
1.6 不同提取方法DNA保存时间和保存条件的比较
将提取到的DNA分别保存于4 ℃和-20 ℃下,并分别于第1,10,30,45,60天对基因组DNA进行PCR扩增,利用8%非变性聚丙烯酰胺凝胶电泳检测条带的清晰度,判断每种方法提取到DNA的保存时间和最佳的保存条件。
1.7 碱裂解法在抗根肿病基因分子标记辅助选择中的应用
选择最优的碱裂解法快速提取G57、G70、F1及BC1群体的DNA,用与抗根肿病基因连锁的标记Bra019345-2,对含抗病基因的单株进行筛选,以检验该方法在分子标记辅助选择中的应用效果。
2 结果与分析
2.1 提取基因组DNA质量的检测
将CTAB法、二步CTAB法和4种碱裂解法提取的基因组DNA进行琼脂糖凝胶电泳。由图1可知,只有CTAB法提取的DNA显示出特异性的电泳条带,其他5种方法未见到特异性的电泳条带,说明CTAB法提取基因组DNA的浓度高、质量好,其他方法提取的DNA可能浓度偏低。
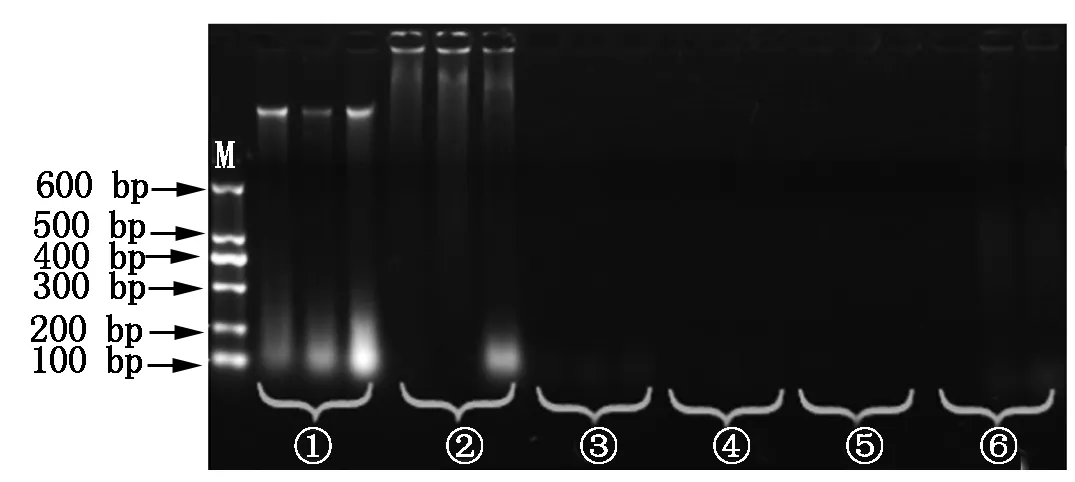
M.DNA MarkerⅠ;①~⑥.提取DNA的CTAB法、二步CTAB法、碱裂解法Ⅰ、碱裂解法Ⅱ、碱裂解法Ⅲ、碱裂解法Ⅳ。图2-4同。M.DNA MarkerⅠ;①-⑥.DNA from CTAB method,two-step CTAB method,alkaline lysis methodⅠ,alkaline lysis methodⅡ,alkaline lysis method Ⅲ,alkaline lysis method Ⅳ.The same as Fig.2-4.
2.2 不同方法提取的DNA为模板的PCR扩增效果的比较分析
分别以这6种方法提取的基因组DNA为模板,使用引物Bra019317和Bra019348进行PCR扩增,2%的琼脂糖凝胶电泳检测。
结果表明,二步CTAB法和碱裂解法Ⅳ提取的DNA为模板扩增不出特异性条带,而CTAB法和碱裂解法Ⅰ、Ⅱ和Ⅲ可以扩增出特异性条带,且条带清晰、明亮。说明CTAB法和碱裂解法Ⅰ、Ⅱ、Ⅲ提取的基因组DNA能够满足PCR反应的需要(图2)。

A.引物Bra019317;B.引物Bra019348。A.The primer Bra019317;B.The primer Bra019348.
为了进一步验证几种方法的准确性,利用8%的非变性聚丙烯酰胺凝胶电泳对PCR扩增产物进行检测。由图3可知,8%的非变性聚丙烯酰胺凝胶电泳检测和琼脂糖凝胶电泳检测结果一致,CTAB法和碱裂解法Ⅰ、Ⅱ、Ⅲ都可以看到清晰的条带,完全能够满足PCR扩增的需要(图3)。
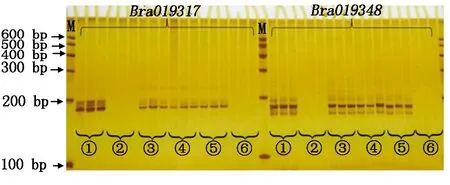
图3 8%非变性聚丙烯酰胺凝胶电泳检测结果Fig.3 The test results of 8% non-denaturing polyacrylamide gel electrophoresis
2.3 DNA保存时间和保存条件的比较
为了判断几种方法提取DNA的保存时间,以及保存温度对DNA保存时间的影响,第1 天时,把试验中6种方法提取到的DNA先用引物Bra019235-2进行PCR,然后对PCR产物进行聚丙烯酰胺凝胶电泳检测。再把6种方法提取到的DNA分别置于4 ℃和-20 ℃的条件下保存,分别于第10,30,45,60天对DNA用引物进行PCR,对PCR产物进行聚丙烯酰胺凝胶电泳检测,观察记录条带情况。结果如图4所示。
对试验结果进行分析可知,碱裂解法Ⅰ、Ⅱ和Ⅲ提取到的DNA在30 d检测时,4 ℃和-20 ℃条件下保存的效果都比较好,30~45 d碱裂解法Ⅰ、Ⅱ和Ⅲ提取到的DNA在4 ℃条件下开始有明显的降解,-20 ℃条件下的保存效果比4 ℃较好,但是DNA也略有降解,第60天检测时,2种保存条件下,碱裂解法Ⅰ、Ⅱ和Ⅲ提取到的DNA进行PCR,再进行聚丙烯酰胺凝胶电泳检测,已经检测不到条带。对CTAB法、碱裂解法Ⅰ、Ⅱ和Ⅲ提取DNA的保存时间进行比较,CTAB法提取的DNA保存时间最长,碱裂解法Ⅰ、Ⅱ和Ⅲ提取的DNA在30 d内PCR扩增的产物,可以通过聚丙烯酰胺凝胶电泳检测到清晰的特异性条带,并可满足进一步试验的需要。
2.4 碱裂解法在抗根肿病基因分子标记辅助选择中的应用
通过试验发现,碱裂解法Ⅲ不仅效率高,提取的DNA也能满足试验的需要。结合碱裂解法Ⅲ进行F1群体和BC1群体的基因型鉴定,鉴定F1群体的杂交率及分子标记辅助选择BC1群体中含抗病基因的单株。碱裂解法Ⅲ提取抗、感大白菜亲本、74株F1群体和74株BC1群体植株的基因组DNA,用与抗根肿病基因连锁的标记Bra019345-2进行PCR,聚丙烯酰胺凝胶电泳检测,所有的F1群体和BC1群体植株都检测到了清晰的条带(图5,6)。74株F1群体植株均表现为杂合条带;74株BC1群体植株中有33株表现为感病条带,41株表现为杂合抗病条带。说明碱裂解法Ⅲ完全能够满足大群体纯度鉴定及分子标记辅助选择中对基因组DNA质量的要求。
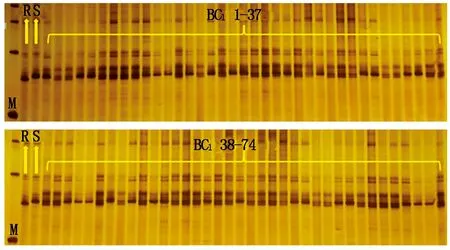
图6 BC1群体的8%非变性聚丙烯酰胺凝胶电泳检测结果(1~74)Fig.6 The test results of BC1 population of 8% non-denaturing polyacrylamide gel electrophoresis(1-74)
3 结论与讨论
本试验发现,以CTAB法和碱裂解法Ⅰ、Ⅱ、Ⅲ制备的基因组DNA作为模板的PCR扩增产物,都可以被检测到清晰的条带,而二步CTAB法和碱裂解法Ⅳ制备的基因组DNA作为模板的PCR扩增产物检测不到条带。CTAB法的提取时间较长,提取成本也较高[15]。相比较而言,能检测到条带的3种碱裂解法耗时短,操作简单,方便快速,实用性强,结合组织研磨仪可以高通量操作[16],而且成本低,只用到NaOH和Tris-HCl 2种常规试剂,试验方法大大的简化。尤其是碱裂解法Ⅲ,不需要沸水浴和离心,操作更为简便,效率最高,检测结果也好[17],是值得推荐的方法。
相比较碱裂解法Ⅳ,加了Tris-HCl的碱裂解法Ⅰ、Ⅱ和Ⅲ制备的DNA作为模板,PCR扩增产物可以检测到清晰的条带,说明使用碱裂解法提取大白菜基因组DNA时,Tris-HCl是必需的[18]。二步CTAB法成本低,耗时短,有文献报道这种方法提取的玉米基因组DNA通过琼脂糖凝胶电泳检测,DNA的完整性较好[14],但是在本试验中提取的大白菜基因组DNA通过琼脂糖凝胶电泳检测,没有检测到特异性条带,这可能和试验材料的不同有关。碱裂解法Ⅲ提取的基因组DNA在保存至30 d时,将基因组DNA作为模板的PCR扩增产物还能通过聚丙烯酰胺凝胶电泳检测到清晰的条带,说明这种方法保存时间较长,可以应用于大规模样本的分子标记筛选。
分子标记辅助选择育种,试验的对象都是一个大的群体[19-21]。传统的CTAB法提取基因组DNA的步骤繁琐,本试验寻找到的碱裂解法Ⅲ操作过程简单,耗时短,且保存时间较长,可以满足大白菜大批量快速检测的需要。
[1] 张晓祥, 王 玲, 寿路路. 一种快速提取小麦基因组DNA的改良CTAB方法[J]. 中国农学通报, 2012, 28(36): 46-49.
[2] 孟淑春, 张海英, 郑晓鹰, 等. 大白菜基因组DNA的提取及AFLP反应体系的建立[J]. 农业科学与技术:英文版, 2009, 10(3): 29-35.
[3] 吴则东, 王华忠, 倪洪涛. 不同碱裂解法快速提取甜菜大群体DNA的研究[J]. 中国糖料, 2013(3): 32-34.
[4] 陈平华, 王恒波, 许莉萍, 等. 碱裂解叶片两步快速制备PCR模板技术研究[J]. 热带作物学报, 2010, 31(3): 422-429.
[5] 郑 琪, 蒋 超, 黄璐琦, 等. 碱裂解法快速提取中药炒制品DNA的研究[J]. 中国中药杂志, 2014, 39(19): 3678-3683.
[6] 荣俊冬, 张迎辉, 郑志雷, 等. 不同提取缓冲液对三尖杉DNA提取质量的影响[J]. 广东林业科技, 2013, 29(5): 22-25.
[7] Wang H, Qi M, Cutler A J. A simple method of preparing plant samples for PCR[J]. Nucleic Acids Research, 1993, 21(17): 4153-4154.
[8] 郑 卓, 李 健, 圣忠华, 等. 高梁总DNA不同提取方法的比较[J]. 安徽农业科学, 2007, 35(36):11758-11759.
[9] 田 洁, 罗 科. 水稻总DNA的快速制备[J]. 应用与环境生物学报, 2004, 10(2): 143-145.
[10] 张 伟, 谢甫绨, 曹 萍, 等. 大豆叶片DNA提取方法的比较研究[J]. 大豆科学, 2007, 26(1): 60-65.
[11] 郭景伦, 赵久然, 王凤格. 适用于SSR分子标记的玉米单粒种子DNA快速提取新方法[J]. 玉米科学, 2005, 13(2): 16-17, 25.
[12] 孙利萍, 贾芝琪, 胡建斌, 等. 碱裂解法快速提取番茄DNA的研究[J]. 河南农业大学学报, 2012, 46(2): 136-138.
[13] 汤文开, 谭 新, 张 辉, 等. 一种快速简单高效提取植物DNA的方法[J]. 华中师范大学学报:自然科学版, 2007, 41(3): 447-449.
[14] 戴 军, 汪 海, 朱 莉, 等. 1种适用于转基因玉米PCR检测的DNA快速提取方法[J]. 安徽农业科学, 2014(12): 3494-3496.
[15] 梁玉琴, 李芳东, 傅建敏, 等. 柿属植物基因组DNA提取方法比较[J]. 中南林业科技大学学报, 2012, 32(4): 170-173.
[16] 李 委, 戴祖云, 夏伟伟, 等. 一种快速提取南瓜大群体基因组DNA的方法[J]. 中国蔬菜, 2017(9): 36-40.
[17] 王 希, 陈 丽, 赵春雷, 等. 不同方法对甜菜叶片基因组DNA提取效果比较与适用性探讨[J]. 中国糖料, 2015, 37(5): 3-6.
[18] Knox R E, Depauw R M, Clarke J M. A simple DNA preparation method for PCR amplifications in Marker-Assisted selection of wheat[J]. Journal of Integrative Agriculture, 2005, 4(7): 481-485.
[19] Bcy C, Das A, Virk P S, et al. Evaluation of 'quick and dirty' DNA extraction methods for marker-assisted selection in rice (OryzasativaL.)[J]. Plant Breeding, 2010, 126(1): 47-50.
[20] 周 晶, 曾庆涛, 刘铨义, 等. 一种适用于棉花种子的DNA快速提取方法[J]. 作物杂志, 2014(2): 31-33.
[21] 苏成付. 分子标记辅助选择育种发展策略[J]. 安徽农业科学, 2014(15): 4591-4592, 4598.

