土茯苓总黄酮抗单侧输尿管梗阻大鼠肾间质纤维化研究
蔡月琴 陈方明 方明笋 朱科燕 王德军
浙江中医药大学动物实验研究中心/比较医学研究所 杭州 310053
肾间质纤维化(renal interstitial fibrosis,RIF)是各种不同病因的慢性肾脏疾病进行性发展的共同途径,是终末期肾衰竭的共同病理表现,其主要病理特点为肾间质成纤维细胞增生和细胞外基质过度积聚[1-3]。目前临床上对RIF的治疗原则主要是针对基础疾病的治疗和减少导致肾功能恶化的因素,如合理降低血压、改善血糖、调整血脂等,这些只能有限地缓解病情发展。血管紧张素转化酶抑制剂(angiotensin converting enzyme inhibitors,ACEI)和血管紧张素Ⅱ受体拮抗剂(angiotensinⅡ receptor antagonist,ARB)是近年来临床应用较为广泛的药物。在大鼠RIF模型中,研究已证实ARB厄贝沙坦能够延缓RIF进展[4-5]。其他抗肾纤维化的治疗方法有抗转化生长因子-β1(transformation growth factor-β1,TGF-β1)抗体、环氧合酶抑制剂、秋水仙碱、中药及基因治疗等,但这些治疗方法都因为疗效不确切或者副作用明显,在临床上应用受到了限制[6]。因此,寻找更多的抗纤维化药物是目前肾脏病学的主要任务之一。
土茯苓是百合科植物光叶菝葜(Smilax glabra Roxb.)的干燥根茎,为一常用中药,首载于《本草纲目》,为清热除湿解毒之要药,在临床广泛应用于慢性肾脏疾病的治疗[7-8]。笔者前期研究发现,土茯苓具有改善糖尿病肾病大鼠肾脏病理变化、保护肾脏的作用[9-11]。本研究采用单侧输尿管结扎(unilateral ureteral obstruction,UUO)的方式建立大鼠RIF模型,观察从土茯苓提取物中分离纯化的土茯苓总黄酮(smilax glabra flavonoids,SGF)对大鼠肾功能、肾组织病理形态和TGF-β1表达水平的影响,明确SGF对大鼠RIF的干预作用,为深入研究中医药防治RIF的药理作用及相关机制提供实验依据。
1 材料与方法
1.1 实验动物 SPF级健康雄性SD大鼠60只,体质量160~180g,由上海斯莱克实验动物有限公司提供[许可证号:SCXK(沪)2012-0002]。饲养于浙江中医药大学动物实验研究中心屏障实验室 [许可证号:SYXK(浙)2013-0184],温度(22±2)℃,相对湿度 40%~60%。
1.2 药品与试剂 SGF由浙江省中医院制剂室提纯并测定含量,以蒸馏水溶解后分别调整浓度为3mg·mL-1、6mg·mL-1和 12mg·mL-1备用。厄贝沙坦购于赛诺菲制药有限公司(批号:2A336),以蒸馏水溶解稀释至 2mg·mL-1备用。肌酐(creatinine,CREA)、尿素氮
(blood urea nitrogen,BUN)、白蛋白(albumin,ALB)、总蛋白(total protein,TP)检测试剂盒购于南京建成生物科技公司(批号分别为171034/50001826、07128/00001355、022063/50002146、19018/00001413);TGF-β1抗体购自 Abcam 公司 (批号:GR1900395);Masson试剂盒购于南京贝索生物公司(批号:20151119)。
1.3 UUO大鼠模型建立及分组 大鼠以10%水合氯醛腹腔注射麻醉,剃毛刀去毛,75%乙醇消毒,选择腹正中线稍偏左切口,依次切开皮肤至腹腔,游离肾脏及输尿管,用组织钳托起左侧输尿管中段部位,止血钳夹闭,4-0丝线结扎左侧输尿管近肾盂段及远端,然后依次缝合皮肤,建立UUO大鼠模型。造模后所有大鼠均适应性饲养1周,依据体质量分为对照组、模型组、SGF低剂量组、SGF中剂量组、SGF高剂量组及厄贝沙坦组,每组10只。对照组手术方式同模型组,打开腹腔后游离输尿管但不结扎,即缝合皮肤。根据土茯苓的临床常用剂量换算出其有效剂量,再依据土茯苓有效剂量和前期SGF的细胞毒性试验确定SGF的有效剂量。SGF低剂量组大鼠采用3mg·mL-1SGF灌胃,灌胃剂量为15mg/(kg·d);中剂量组采用6mg·mL-1SGF灌胃,灌胃剂量为30mg/(kg·d);高剂量组采用12mg·mL-1SGF灌胃,灌胃剂量为60mg/(kg·d)。厄贝沙坦组大鼠灌胃剂量为10mg/(kg·d)。对照组和模型组分别以等量无菌饮用水灌胃。各组灌胃1次/d,连续2周。给药第2周末,将各组大鼠分别放入代谢笼,收集24h尿液并称体重;麻醉后心脏采血,分离血清待用。处死各组大鼠,取肾脏称重,并解剖左侧肾脏,用于病理学观察。
1.4 各组大鼠肾功能指标检测 全自动生化仪检测各组大鼠血清 ALB、BUN和血清肌酐(serum creatinine,Scr)的含量,24h 尿蛋白(urine total protein,U-TP)、尿尿素氮(urine urea nitrogen,UUN)、CREA 的含量,并计算肌酐清除率(creatinine clearance rate,Ccr)。Ccr(mL·min-1)=CREA(μmol·L-1)×每min尿量(mL·min-1)/Scr(μmol·L-1)。
1.5 各组大鼠肾组织病理学检查 将各组大鼠病变侧肾脏置于10%中性甲醛溶液中固定1~2d,蒸馏水冲洗,脱水,透明,浸蜡后,常规石蜡包埋切片,经二甲苯脱水,HE染色,200倍光学显微镜下观察肾组织病理学改变。
1.6 Masson染色分析各组大鼠肾组织纤维化程度各组大鼠病变侧肾组织石蜡切片脱蜡,蒸馏水冲洗,苏木素染液染核2min,Masson丽春红酸性复红染液染色5min,1%苯胺蓝染液染色5min,1%冰醋酸分化,二甲苯透明,200倍光学显微镜下观察。
1.7 免疫组化检测各组大鼠肾组织TGF-β1蛋白表达水平 大鼠肾组织石蜡切片置于60℃烤箱烘烤2h,脱蜡,修复液高压热修复,3%H2O2溶液阻断过氧化物酶,PBS溶液洗涤3次,滴加TGF-β1一抗,4℃孵育过夜,PBS溶液洗涤5次,滴加二抗,37℃孵育20 min,PBS溶液洗涤5次,二氨基联苯胺显色5min,苏木素复染、透明后封片,采用Carl Zeiss Imaging Systems对每张切片所要分析的部位拍摄3张照片(200倍),应用Image-proplus 6.0图像分析软件进行图像分析。TGF-β1阳性细胞经DAB显色呈棕黄色,计算阳性染色细胞的平均光密度表示TGF-β1蛋白相对表达量。
1.8 统计学方法 采用SPSS 11.0统计软件,计量资料均以±s表示,组间比较应用单因素方差分析(post hoc),以P<0.05为差异有统计学意义。
2 结果
2.1 各组大鼠肾功能指标的比较 模型组大鼠血清BUN、Scr含量均高于对照组,ALB含量低于对照组,差异有统计学意义(P<0.01)。SGF中剂量组和SGF高剂量组大鼠血清BUN、Scr含量均低于模型组(P<0.05或0.01),SGF低剂量组、厄贝沙坦组Scr含量低于模型组(P<0.05)。模型组大鼠尿液中U-TP、UUN、CREA含量均高于对照组(P<0.01),Ccr低于对照组(P<0.05);而SGF高剂量组、厄贝沙坦组大鼠尿液中U-TP、UUN、CREA 含量均显著低于模型组(P<0.05),SGF中剂量组U-TP、CREA含量均低于模型组,差异有统计学意义(P<0.05)。见表1、2。
表1 各组大鼠血清中ALB、BUN、Scr含量(±s,n=10)Tab.1 The level of ALB,BUN and Scr in rat serum(±s,n=10)
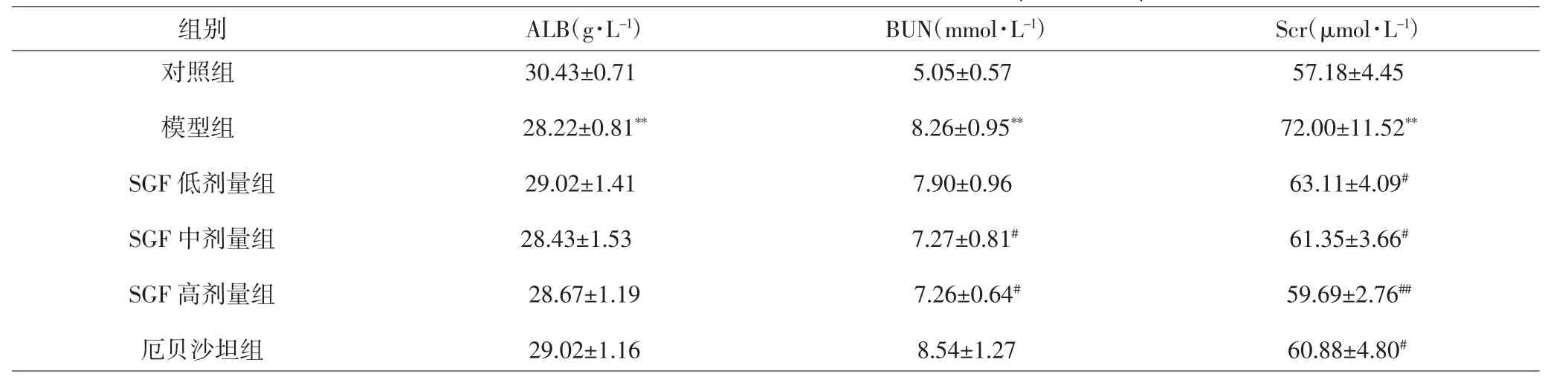
表1 各组大鼠血清中ALB、BUN、Scr含量(±s,n=10)Tab.1 The level of ALB,BUN and Scr in rat serum(±s,n=10)
注:与对照组比较,*P<0.05,**P<0.01;与模型组比较,#P<0.05,##P<0.01。Note:Compared with control group,*P<0.05,**P<0.01;compared with model group,#P<0.05,##P<0.01.
组别ALB(g·L-1)BUN(mmol·L-1)Scr(μmol·L-1)对照组模型组SGF低剂量组SGF中剂量组SGF高剂量组厄贝沙坦组30.43±0.71 28.22±0.81**29.02±1.41 28.43±1.53 28.67±1.19 29.02±1.16 5.05±0.57 8.26±0.95**7.90±0.96 7.27±0.81#7.26±0.64#8.54±1.27 57.18±4.45 72.00±11.52**63.11±4.09#61.35±3.66#59.69±2.76##60.88±4.80#
表2 各组大鼠尿液中U-TP、UUN、CREA和 Ccr含量(±s,n=10)Tab.2 The level of U-TP,UUN,CREA and Ccr in rat urine(±s,n=10)
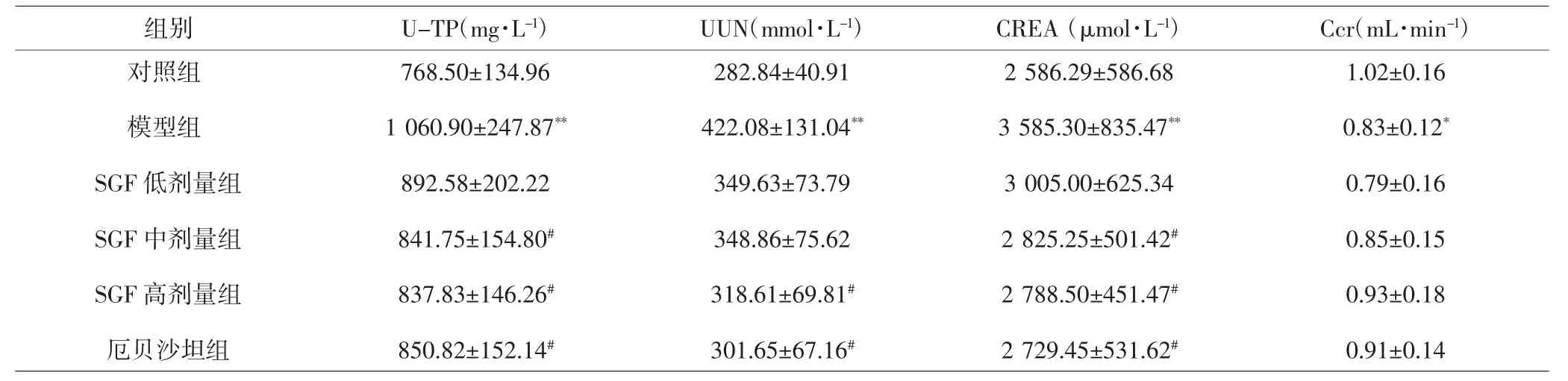
表2 各组大鼠尿液中U-TP、UUN、CREA和 Ccr含量(±s,n=10)Tab.2 The level of U-TP,UUN,CREA and Ccr in rat urine(±s,n=10)
注:与对照组比较,*P<0.05,**P<0.01;与模型组比较,#P<0.05。Note:Compared with control group,*P<0.05,**P<0.01;compared with model group,#P<0.05.
组别U-TP(mg·L-1)UUN(mmol·L-1)CREA(μmol·L-1)Ccr(mL·min-1)对照组模型组SGF低剂量组SGF中剂量组SGF高剂量组厄贝沙坦组768.50±134.96 1 060.90±247.87**892.58±202.22 841.75±154.80#837.83±146.26#850.82±152.14#282.84±40.91 422.08±131.04**349.63±73.79 348.86±75.62 318.61±69.81#301.65±67.16#2 586.29±586.68 3 585.30±835.47**3 005.00±625.34 2 825.25±501.42#2 788.50±451.47#2 729.45±531.62#1.02±0.16 0.83±0.12*0.79±0.16 0.85±0.15 0.93±0.18 0.91±0.14
2.2 各组大鼠肾组织病理形态的比较 对照组大鼠肾脏大小形态正常,颜色暗红,表面光滑,弹性好;模型组大鼠肾脏呈略带白色的灰红色,肾盂严重积水,肾实质萎缩变薄,光镜下观察可见多数的肾小管基底膜出现不规则改变,完整性丧失;SGF各剂量组和厄贝沙坦组大鼠肾脏在肿胀程度、肾实质萎缩、肾小管毁损等方面较模型组均有不同程度地改善。见图1。
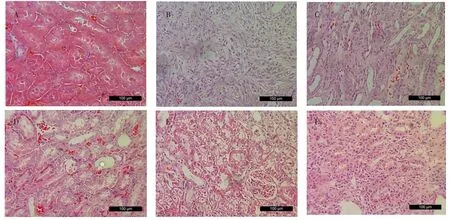
图1 各组大鼠肾组织病理形态的比较(HE染色,200×)Fig.1 Comparison of pathological morphology of renal tissue in each group(HE stain,200×)
2.3 各组大鼠肾组织纤维化情况的比较 Masson染色光镜下观察可见,对照组大鼠肾小管结构正常,肾小管上皮细胞排列整齐,肾小管间质无纤维化,无炎细胞浸润,模型组大鼠肾小管上皮细胞常见重度空泡和颗粒变性,细胞扁平,管腔扩张,大量炎细胞浸润,大量胶原纤维形成,肾间质重度纤维化;SGF各剂量组、厄贝沙坦组大鼠在炎细胞浸润、纤维组织增生、肾间质纤维化等方面较模型组均有不同程度改善。见图2。
2.4 各组大鼠肾组织TGF-β1蛋白表达水平的比较
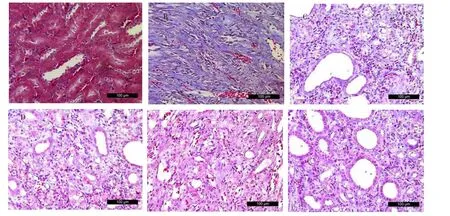
图2 各组大鼠肾组织纤维化情况的比较(Masson染色,200×)Fig.2Comparison ofrenal fibrosis in each group(Masson stain,200×)
TGF-β1蛋白在对照组大鼠的肾小管上皮细胞中无明显阳性表达;模型组大鼠的肾小管上皮细胞TGF-β1蛋白相对表达量高于对照组,差异有统计学意义(P<0.01);SGF 中、高剂量组、厄贝沙坦组大鼠肾小管上皮细胞中棕黄色颗粒均减少,TGF-β1蛋白相对表达量低于模型组,差异有统计学意义(P<0.05或 0.01)。见图3、表3。
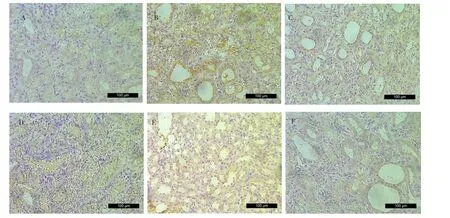
图3 各组大鼠肾组织TGF-β1表达水平的比较(免疫组化,200×)Fig.3Comparison ofTGF-β1expression in renal tissue in each group(immunohistochemical,200×)
表3 各组大鼠肾组织TGF-β1蛋白表达水平的比较(±s,n=30)Tab.3 Comparison of TGF-β1expression in renal tissue in each group(±s,n=30)

表3 各组大鼠肾组织TGF-β1蛋白表达水平的比较(±s,n=30)Tab.3 Comparison of TGF-β1expression in renal tissue in each group(±s,n=30)
注:与对照组比较,*P<0.05,**P<0.01;与模型组比较,#P<0.05,##P<0.01。Note:Compared with control group,*P<0.05,**P<0.01;compared with model group,#P<0.05,##P<0.01
组别平均光密度对照组模型组SGF低剂量组SGF中剂量组SGF高剂量组厄贝沙坦组0.0967±0.0186 0.1168±0.0165**0.1074±0.0120 0.1047±0.0097#0.1020±0.0094##0.1016±0.0127##
3 讨论
肾组织损伤后,损伤部位的细胞趋化因子会形成浓度梯度,为炎性细胞提供一个趋化信号,促使其向受损组织区域浸润,从而引起炎症的发生[12-13]。继而肾间质内巨噬细胞、单核细胞发生浸润,这些改变导致肾小管萎缩,肾实质被纤维组织取代,最终发生RIF[14]。结扎单侧输尿管导致输尿管梗阻,是经典的RIF动物模型的建立方式。本实验建立了大鼠RIF模型,生化检测提示UUO模型组大鼠血清BUN、Scr以及尿液中U-TP、UUN、CREA等含量均显著高于对照组,血清ALB含量则显著低于对照组,提示UUO大鼠的肾功能受损;肾组织HE染色和Masson染色镜下观察可见肾间质内大量单核细胞浸润,成纤维细胞聚集,肾小管结构严重毁损,管腔塌陷,大量炎细胞浸润,并出现较多的胶原纤维,提示梗阻肾发生广泛的肾小管上皮细胞坏死,肾间质广泛纤维化;免疫组化检测显示UUO大鼠肾小管上皮细胞中大量棕黄色颗粒表达,平均光密度高于对照组,表明TGF-β1蛋白表达水平上调。以上结果均证实大鼠RIF模型建立成功。
作为临床上常用的ARB,厄贝沙坦治疗RIF作用明确,在一定程度上能够延缓肾纤维化的进程[5]。笔者团队的前期研究中已证实土茯苓具有改善糖尿病肾病大鼠肾脏病理变化、保护肾脏的作用[9-11],继而通过大孔树脂技术从土茯苓提取物中分离纯化得到SGF。本研究发现,应用SGF和厄贝沙坦干预后,UUO大鼠血清中BUN、Scr以及尿液中U-TP、UUN、CREA的含量降低,表明SGF和厄贝沙坦均能改善UUO大鼠的肾功能指标。而且SGF各剂量组、厄贝沙坦组大鼠肾脏在肾实质萎缩、肾小管结构毁损、炎细胞浸润、纤维组织增生等方面较模型组均有不同程度地减轻,提示大鼠RIF得到明显改善。
既往研究证实,病理状态下TGF-β1是目前已知最强的促纤维化细胞因子,参与了RIF进程中所有的关键步骤[15-16]。本研究中以免疫组化检测了肾组织TGF-β1蛋白表达,结果提示SGF和厄贝沙坦能不同程度地抑制TGF-β1蛋白表达。推测SGF能阻断TGF-β1介导的肾损伤和纤维化过程,提示SGF改善RIF的作用可能通过下调TGF-β1表达来实现。
综上所述,SGF可明显改善UUO大鼠的肾功能,减轻肾脏病变,降低肾组织TGF-β1蛋白的表达,从而延缓肾小管损伤和纤维组织的增生。本研究为开发有效的抗RIF治疗药物提供了一定的理论依据。
[1] Takaori K,Nakamura J,Yamamoto S,et al.Severity and frequency ofproximaltubule injury determinesrenal prognosis[J].J Am Soc Nephrol,2016,27(8):2393-2406.
[2] Lu J,Shi J,Li M,et al.Activation of AMPK by metformin inhibits TGF-β-induced collagen production in mouse renal fibroblasts[J].Life Sci,2015,127:59-65.
[3] Yan Y,Ma L,Zhou X,et al.Src inhibition blocks renal interstitial fibroblast activation and ameliorates renal fibrosis[J].Kidney Int,2016,89(1):68-81.
[4] Tang L,Yi R,Yang B,et al.Valsartan inhibited HIF-1α pathway and attenuated renal interstitial fibrosis in streptozotocin-diabetic rats[J].Diabetes Res Clin Pract,2012,97(1):125-131.
[5] 孙时华,严富华,姜建军,等.红花黄色素对单侧输尿管梗阻大鼠模型肾间质纤维化的影响[J].中华中医药学刊,2010,28(4):891-893.SUN Shihua,YAN Fuhua,JIANG Jianjun,et al.Effect of safflor yellow injection on the renal interstitial fibrosis in unilateral ureteral obstructoin rats[J].Chinese Archives of Traditional Chinese Medicine,2010,28(4):891-893.
[6] Liu L,LiF G,Yang M,etal.Effectofproinflammatory interleukin-17A on epithelial cell phenotype inversion in HK-2 cells in vitro[J].Eur Cytokine Netw,2016,27(2):27-33.
[7] 张秋林.尿毒清胶囊对慢性肾功能衰竭患者肾纤维化指标的影响[J].广州中医药大学学报,2007,24(2):108-112.ZHANG Qiulin.Effect of niaoduqing capsule on kidney fibrosis parameters in chronic renal failure[J].Journal of Guangzhou University of Traditional Chinese Medicine,2007,24(2):108-112.
[8] 赵洪军,杨兴,胡沙沙.肾通丸对慢性肾脏病患者肾脏纤维化进程影响研究[J].辽宁中医药大学学报,2014,16(1):11-14.ZHAO Hongjun,YANG Xing,HU Shasha.Clinical study on effect of shentong pillon on renal fibrosis of patients with chronic kidney disease[J].Journal of Liaoning University of Traditional Chinese Medicine,2014,16(1):11-14.
[9] 王德军,寿旗扬,周为民,等.土茯苓对糖尿病肾病大鼠糖代谢及肾功能的影响[J].中华中医药学刊,2009,27(12):2262-2264.WANG Dejun,SHOU Qiyang,ZHOU Weimin,etal.Effect of Rhizoma Smilacis Glabrae on glucose metabolism and renal function in diabetic nephropathy rats[J].Chinese Archives of Traditional Chinese Medicine,2009,27(12):2262-2264.
[10]王德军,寿旗扬,陈方明,等.土茯苓对糖尿病肾病大鼠肾组织形态学及相关因子ET、NO、TGF-β1的影响[J].中国中医药科技,2010,17(4):320-322.WANG Dejun,SHOU Qiyang,CHEN Fangming,et al.Effect of Smilax glabra on morphology and related factors ET,NO and TGF-beta 1 in renal tissue of diabetic nephropathy rats[J].Journal of Chinese Medicine Science and Technology,2010,17(4):320-322.
[11]张利棕,寿旗扬,王德军,等.土茯苓对肾性高血压大鼠血液流变学和氧化应激的影响[J].浙江中医药大学学报,2012,36(7):803-808.ZHANG Lizong,SHOU Qiyang,WANG Dejun,etal.Effects of Smilax Glabra on hemorheology and oxidative stress in renovascular hypertensive rats[J].Journal of Zhejiang Chinese Medical University,2012,36(7):803-808.
[12]Cheng X,Zheng X,Song Y,et al.Apocynin attenuates renal fibrosis via inhibition of NOXs-ROS-ERK-myofibroblast accumulation in UUO rats[J].Free Radic Res,2016,50(8):840-852.
[13]Kim T W,Kim Y J,Seo C S,et al.Elsholtzia ciliata(Thunb.)Hylander attenuates renalinflammation and interstitial fibrosis via regulation of TGF-βand Smad3 expression on unilateral ureteral obstruction rat model[J].Phytomedicine,2016,23(4):331-339.
[14]Chen X,Wei S Y,Li J S,et al.Overexpression of heme oxygenase-1 prevents renal interstitial inflammation and fibrosis induced by unilateral ureter obstruction[J].PLoS One,2016,11(1):e0147084.
[15]Li L,Qi L,Liang Z,et al.Transforming growth factorβ1 inducesEMT by the transactivation ofepidermal growth factor signaling through HA/CD44 in lung and breast cancer cells[J].Int J Mol Med,2015,36(1):113-122.
[16]Du J,Hong S,Dong L,et al.Dynamic sialylation in transforming growth factor-β(TGF-β)-induced epithelial to mesenchymal transition[J].J Biol Chem,2015,290(19):12000-12013.

