影响颈动脉粥样硬化易损斑块对称性分布的危险因素分析
米东华,赵锡海,龚浠平,董可辉,赵性泉,王春雪,王伊龙,王拥军,刘丽萍
动脉粥样硬化是缺血性卒中发生的重要原因,约19%~35%的缺血性卒中是由颈动脉粥样硬化引发的[1],更有研究表明,约70%的致死性缺血性卒中由动脉粥样硬化斑块破裂导致,但其中2/3以上未发生责任血管的显著性狭窄[2],可见动脉斑块的稳定性与脑血管疾病发生的关系较动脉狭窄更为密切。对斑块的稳定性进行准确判断并采取干预措施能够有效降低缺血性卒中的发生风险。目前认为可以影响颈动脉粥样硬化易损斑块形成的因素包括年龄、糖尿病、高血压、吸烟、血脂异常等[3-4]。本研究的目的是为了寻找促进颈动脉易损斑块形成和对称性分布的危险因素,现将研究报道如下。
1 资料与方法
1.1 临床资料 前瞻性入选2015年1月-2016年12月首都医科大学附属北京天坛医院脑血管病中心收治的缺血性卒中患者作为研究对象。
纳入标准:①年龄≥18岁;②首次缺血性卒中患者;③发病时间≤1个月;④颈动脉超声显示颈动脉内膜中层厚度最大值≥15 mm;⑤入组时患者美国国立卫生研究院卒中量表(National Institutes of Health Stroke Scale,NIHSS)评分≤22分;⑥患者或其家属对本研究知情同意且签署同意书。
排除标准:①可疑心源性栓子(心房颤动、心脏瓣膜置换术后、可疑或确诊的心内膜炎);②患者有溶栓或者其他急诊介入治疗的指征;③颅内出血(脑实质内血肿、蛛网膜下腔出血、硬膜下或者硬膜外血肿)、肿瘤、感染;④仅存在单独的感觉症状(如麻木感),单独的视力改变,单独的头晕或者眩晕,基线颅脑计算机断层扫描(computed tomography,CT)或者磁共振成像(magnetic resonance imaging,MRI)没有急性梗死的证据;⑤一年之内计划行血管成形术或者手术治疗的患者;⑥由于血管成形术或手术治疗导致的神经功能缺损症状;⑦合并其他已知的严重威胁生命的疾病,预期寿命小于1年;⑧入组时正在接受实验性药物或者器械治疗;⑨有MRI检查禁忌证的患者;⑩研究医师认为该患者不适合本研究。本研究经天坛医院医学伦理委员会审核通过。
1.2 研究方法
1.2.1 磁共振检查 应用Philips公司Ingenia 3.0T医用MRI系统联合颈部相控阵表面线圈对入组患者进行颈部血管高分辨MRI扫描,患者取仰卧位,颈部自然伸直,以两侧下颌角为中心通过缚带固定相控阵表面线圈。采用3维时间飞跃(threedimensional time-of-flight,3D TOF)扫描患者双侧颈动脉,确认患者颈动脉分叉位置,在颈动脉分叉层面上下2 cm范围内行横轴位扫描,获得T1加权像(T1weighted imaging,T1WI)、T2加权像(T2weighted imaging,T2WI)和梯度回波序列(magnetization prepared rapid gradient echo,MP-RAGE)。所有入组患者图像均由清华大学生物医学影像中心进行专业判读,采取双人背靠背盲法判读,如果判读结果有异议,将会商确定。影像判读信息包括患者颈动脉斑块数量和分布、脂质坏死核心(lipd-rich necrotic core,LRNC)、斑块内出血(intra-plaque hemorrhage,IPH)、纤维帽厚度和纤维帽破裂(fibrous cap rupture,FCR)等情况。高危易损斑块定义为存在斑块内出血和(或)大的脂质坏死核存在(大的脂质坏死核定义为占斑块体积≥20%)[5]。
1.2.2 临床资料调查 收集患者临床资料,包括年龄、性别、身高、体重、血压、脉压、高血压史、糖尿病史、冠状动脉粥样硬化性心脏病史、目前吸烟史、入院时的NIHSS评分,计算患者体质指数(body mass index,BMI)。采集患者入院第二天空腹静脉血测定高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)、低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)、甘油三酯(triglyceride,TG)及总胆固醇(total cholesterol,TC)、超敏C反应蛋白、同型半胱氨酸等水平,并且记录患者入院后降压药物、降糖药物、他汀类以及抗血小板药物使用情况。
吸烟定义为一生中连续或累积吸烟6个月以上者,每天吸烟至少1支。目前吸烟定义为符合吸烟条件,在调查之前30 d内吸过烟。
1.3 统计学方法 采用SPSS 18.0软件进行数据统计分析,计量资料符合正态分布,用表示,不符合正态分布则用中位数和四分位数表示,计数资料用率表示。3组间计量资料比较采用单因素方差分析,计数资料采用卡方检验。将单因素分析中有统计学意义的变量代入二元Logistic回归方程,得到与颈动脉易损斑块不对称分布相关的危险因素。P<0.05表示差异具有显著性。
2 结果
2.1 一般资料 共入组81例患者,平均年龄(61.00±11.34)岁,男性60例,占74%。无易损斑块组40例,单侧易损斑块组25例,双侧易损斑块组16例。
2.2 颈动脉易损斑块形成危险因素单因素分析 单因素分析表明,无易损斑块组、单侧易损斑块组和双侧易损斑块组患者年龄、性别比例、糖尿病史、冠状动脉粥样硬化性心脏病病史以及HDL-C、LDL-C、TG、TC和入院时空腹血糖、NIHSS、超敏C反应蛋白、住院期间阿司匹林他汀类药物使用等因素比较,差异无显著性;3组高血压病史、目前吸烟史、BMI指数、收缩压等方面比较,差异具有显著性(表1)。
2.3 Logistic回归分析 以双侧均有易损斑块为因变量,将单因素分析得出的主要相关因素(高血压病史、目前吸烟史、BMI指数、收缩压)代入Logistic回归模型进行多因素回归分析,结果显示目前吸烟病史是双侧易损斑块发生的独立影响因素,比值比(odds ratio,OR)3.136,95%可信区间(con fidence interval,CI)1.122~8.766(表2)。
3 讨论
缺血性卒中具有较高的死亡率和致残率[6]。动脉粥样硬化是造成缺血性卒中的主要原因之一[7-8],而颈动脉粥样硬化可以反映全身动脉粥样硬化的病变程度。寻找颈动脉粥样硬化危险因素对缺血性卒中的防治具有重要临床意义。
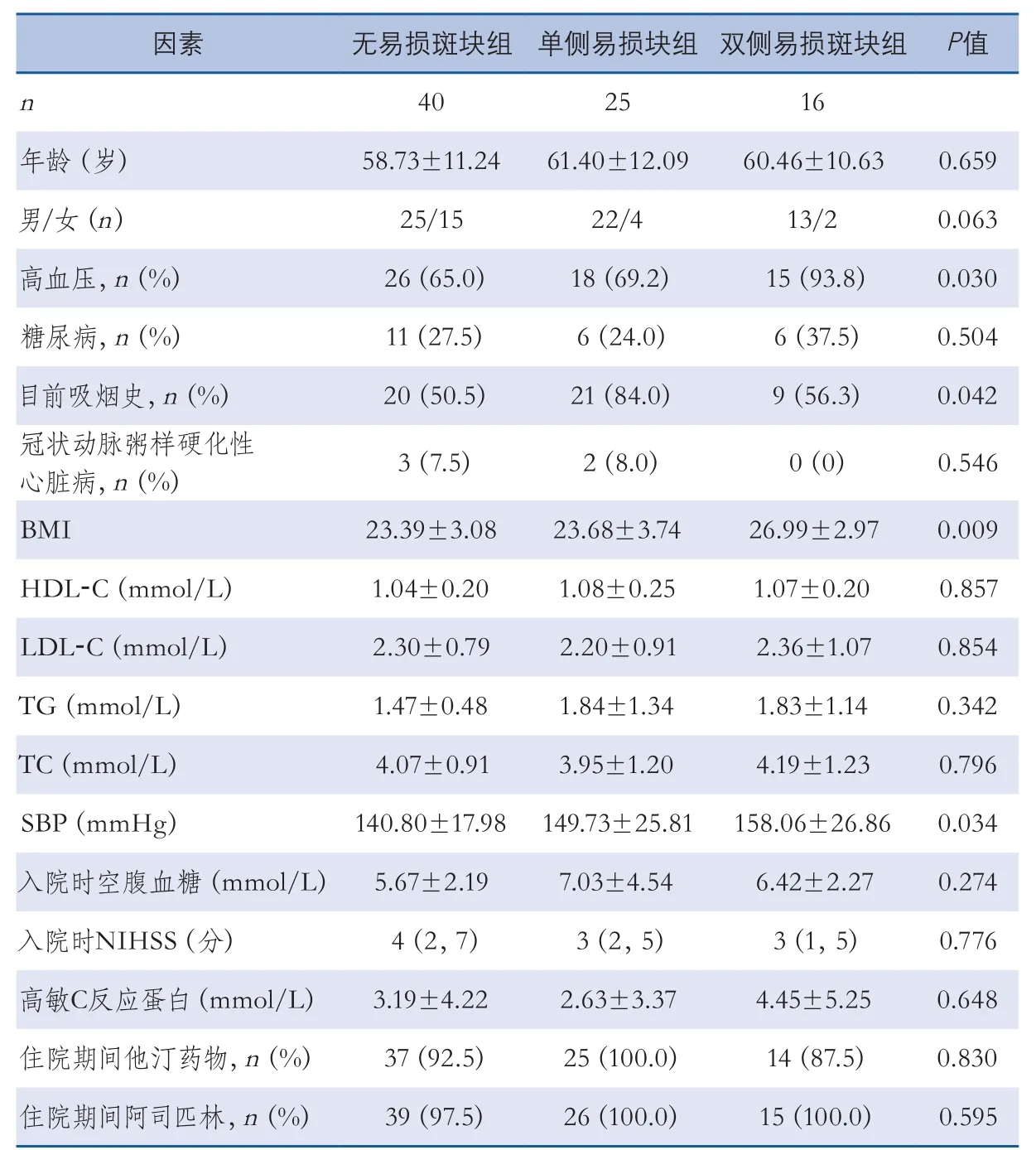
表1 颈动脉易损斑块形成危险因素单因素分析
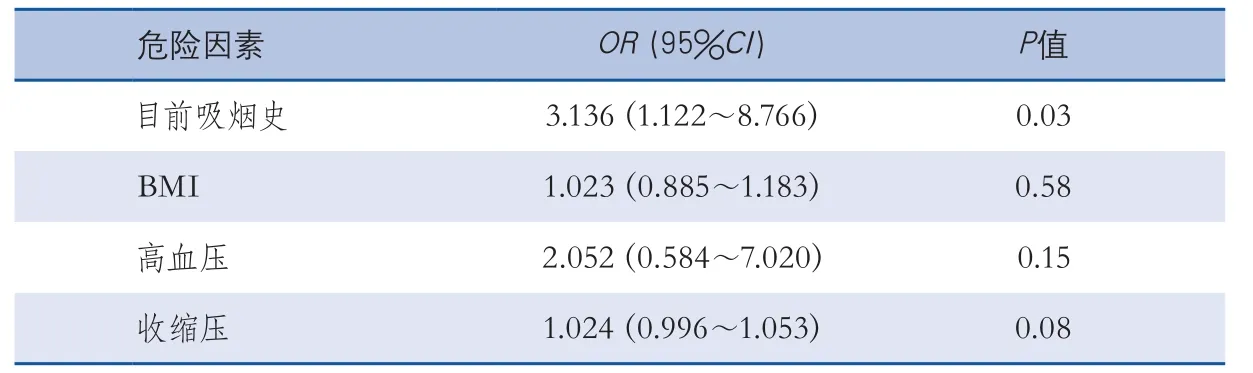
表2 颈动脉易损斑块形成多因素logistic回归分析
本研究单因素分析显示,无易损斑块组、单侧易损斑块组和双侧易损斑块组患者在高血压病史、目前吸烟病史、BMI、收缩压等方面比较,差异具有显著性。从表1可以看出,随着易损斑块的增多,高血压和目前吸烟病史的比例也逐渐增多,BMI指数和收缩压也逐渐增高。
高血压与动脉粥样硬化的发生具有密切的关系,高血压可以导致大动脉中层平滑肌细胞肥大、胞外基质胶原增加、血管内皮舒张功能失调、血管扩张能力减低等,随着高血压的进一步发展,大动脉血管可以发生内膜增厚、粥样斑块的发生和动脉管腔的狭窄。覃月秋等[9]利用颈动脉超声技术发现高血压早期,收缩压对血管内皮舒张功能影响最大,其次为舒张压和脉压。刘娜等[10]研究表明,高血压患者动脉压增大和颈动脉内膜中层厚度(carotid intima-media thickness,cIMT)增厚有关,动脉压是cIMT厚度的独立影响因素。还有研究者利用高分辨MRI对不同种族人群进行筛查,发现高血压是粥样硬化斑块内富含脂质核的危险因素,而富含脂质核的斑块被认为是易损斑块的特征之一[3]。
肥胖是目前普遍存在的社会问题,通常采用BMI进行衡量。国外学者的研究证明,高BMI与颈动脉内中膜的低回声表现相关[11],Masson等[12]则认为基于BMI的血管年龄可能是一个简单的工具,可以用来估计颈动脉粥样硬化斑块的存在。
本研究多因素分析中发现目前吸烟史是颈动脉易损斑块不对称分布的危险因素。吸烟一直被认为是动脉粥样硬化发生发展的促进因素。吸烟可以导致血小板活化、迁移至血管内皮下;血管内皮氧化应激反应以及C反应蛋白和氧化型LDL-C水平增高等。社区动脉粥样硬化风险(Atherosclerosis Risk in Communities,ARIC)研究发现被动吸烟也会导致cIMT的增厚[13]。Young Finns[14]研究发现父母吸烟导致子女在被动吸烟的环境中成长,子女到成人后颈动脉斑块发生率显著高于生活在非吸烟父母家庭的子女。
本研究样本量较小,在多因素分析中只有目前吸烟史得到了有统计学意义的结论。以后,在临床研究中将进行扩大样本量的进一步研究,希望得到更多危险因素对易损斑块影响的证据。
1 Chaturvedi S,Bruno A,Feasby T,et al. Carotid endarterectomy--an evidence-based review:Report of the therapeutics and technology assessment subcommittee of the american academy of neurology[J].Neurology,2005,65(6):794-801.
2 Fairhead JF,Mehta Z,Rothwell PM. Population-based study of delays in carotid imaging and surgery and the risk of recurrent stroke[J]. Neurology,2005,65(3):371-375.
3 Wasserman BA,Sharrett AR,Lai S,et al. Risk factor associations with the presence of a lipid core in carotid plaque of asymptomatic individuals using high-resolution mri:The multi-ethnic study of atherosclerosis (mesa)[J]. Stroke,2008,39(2):329-335.
4 Zhang Y,Bai L,Shi M,et al. Features and risk factors of carotid atherosclerosis in a population with high stroke incidence in China[J]. Oncotarget,2017,doi:10.18632/oncotarget. 15415.
5 Yuan C,Mitsumori LM,Beach KW,et al.Carotid atherosclerotic plaque:Noninvasive mr characterization and identi fication of vulnerable lesions[J]. Radiology,2001,221(2):285-299.
6 Kelly-Hayes M,Beiser A,Kase CS,et al. The in fl uence of gender and age on disability following ischemic stroke:The framingham study[J]. J Stroke Cerebrovasc Dis,2003,12(3):119-126.
7 李召晨,杜瑞艳,王洪娟,等. 颈动脉粥样硬化与急性脑梗死关系的研究[J]. 中国现代医学杂志,2013,6:89-93.
8 熊建群,余琛,李应华. 颈内动脉形态异常与缺血性脑血管病及颈动脉粥样硬化的关系[J]. 中华超声影像学杂志,2012,21(7):583-586.
9 Qin YQ,Chen AH,Tang XM. Echo-tracking technology for evaluating the impact of blood pressure on vascular endothelial function[J]. Nan fang yi ke da xue xue bao,2012,32(3):396-399.
10 刘娜,徐树军,陈业鹏,等. 老年高血压动态脉压与动脉粥样硬化性脑梗死的关系研究[J]. 中国血液流变学杂志,2014,24(1):51-53.
11 Lind L,Peters SA,den Ruijter HM,et al. Effect of rosuvastatin on the echolucency of the common carotid intima-media in low-risk individuals:The meteor trial[J]. J Am Soc Echocardiogr,2012,25(10):1120-1127.
12 Masson W,Siniawski D,Toledo G,et al. Estimation of the "vascular age" based on body mass index in a population in primary prevention. Association with subclinical carotid atherosclerosis[J]. Medicina clinica,2013,140(6):255-259.
13 Howard G,Burke GL,Szklo M,et al. Active and passive smoking are associated with increased carotid wall thickness. The atherosclerosis risk in communities study[J]. Arch Intern Med,1994,154(11):1277-1282.
14 West HW,Juonala M,Gall SL,et al. Exposure to parental smoking in childhood is associated with increased risk of carotid atherosclerotic plaque in adulthood:The cardiovascular risk in young finns study[J]. Circulation,2015,131(14):1239-1246.
【点睛】对缺血性卒中患者颈动脉粥样硬化斑块分布的危险因素进行多因素分析,结果显示目前吸烟史是其不对称分布的独立危险因素。

