H9N2亚型禽流感疫苗株的筛选
胡晓苗 , 张丹俊 , 戴 银 , 赵瑞宏 , 潘孝成 , 周学利 , 侯宏艳 , 沈学怀 , 朱传明
(安徽省农业科学院畜牧兽医研究所 , 安徽 合肥 230031)
在我国,H9N2亚型禽流感病毒疫苗大部分还在使用,一些早期的分离株,例如华南地区使用的Ck/GD/SS/1994疫苗株,山东地区使用的Ck/SD/6/96疫苗株以及华东地区使用的SH/F/98疫苗株。疫苗的大规模使用对禽流感的防控确实发挥了重要作用,然而疫苗免疫压力的存在却加速了AIV的变异[1-4]。安徽地区近些年间H9N2亚型禽流感的监测数据表明,当前流行的H9N2病毒在遗传进化和抗原性分析方面均发生了比较显著的变化,其中HA基因遗传进化分支已演变为以Y280亚系占绝对优势。此外,HA蛋白一些关键位点氨基酸残基、糖基化位点、受体结合位点也均有不同程度的突变,现有疫苗株的保护效果亟需进一步评价[5-6]。这提示我们,应该尽快筛选新的H9N2疫苗株用于研制新型疫苗,以应对已出现变异的H9N2亚型禽流感的防控。
1 材料与方法
1.1 试剂 禽流感抗H9亚型标准阳性血清及抗原,购自中国农业科学院哈尔滨兽医研究所。
1.2 毒株 经过HA基因遗传进化分析,选取12株近年来流行的H9亚型AIV,Dk/HK/Y280/97-like病毒亚系高度同源[5-6],均为本实验室分离鉴定、保存。
1.3 实验动物和鸡胚 SPF种蛋,购自山东省家禽研究所SPF种鸡场,在本实验室孵化至9-11日龄鸡胚使用;SPF鸡由上述鸡胚继续孵化至出雏,饲养于实验室动物房中至10日龄。
1.4 病毒增殖能力的测定 按照现行《中国兽药典》附录对近3年分离的12株H9亚型AIV接种鸡胚后收集的尿囊液的病毒含量进行测定。将尿囊液作10倍系列稀释,取10-7、10-8、10-93个稀释度,尿囊腔内接种于10日龄SPF鸡胚,测定各鸡胚尿囊液的凝集效价。根据尿囊液HA测定结果按Reed-Muench法计算鸡胚半数感染量(EID50)[7]。
1.5 病毒的纯化 选择HA效价较高(HA>29)的4株病毒,分别进行5轮有限稀释纯化(10-5-10-9),将纯化好的上述病毒尿囊液分别按10-5稀释后,接种9~11日龄SPF鸡胚(0.2 mL)15枚,置37 ℃孵化72 h,去除死亡胚,所有活胚4 ℃放置5 h。收集72 h后活胚的尿囊液,取血凝价大于9 log2的鸡胚尿囊液,分装成小份,置-80 ℃超低温冰箱保存备用。
1.6 免疫血清的制备 将纯化好的尿囊液按常规方法制备油乳剂灭活疫苗[8],颈部皮下接种6周龄SPF鸡,每次免疫0.3 mL/只,于首免后2周加强免疫1次,0.5 mL/只,于二免后21 d采血,分离血清,分别保存备用。
1.7 交叉HI试验 用制备的免疫血清与近年来流行代表毒株进行交叉HI试验[9-10],根据结果将筛选出的最优秀毒株按常规方法制备油乳剂灭活疫苗。
1.8 免疫攻毒保护试验 14日龄SPF鸡120只,分成三组,其中两组各40只分别经颈背侧皮下注射商品化F/98疫苗和候选株灭活疫苗,另一组40只为对照组。21 d采血后,若HI效价稳定,且在8以上,各试验组40只鸡用选定4个流行毒株(CK/AH/35/15,CK/AH/416/15、CK/AH/36/14、CK/AH/AJ3/15各1株)攻毒,每个毒株攻5只,滴鼻点眼,每只攻毒量约为2×106EID50。观察攻毒后鸡群健康状况,并于攻毒后第5天采集所有试验鸡的泄殖腔及咽拭子进行病毒分离。每个棉拭样品处理后接种10日龄SPF鸡胚2枚,每24 h照胚1次,观察120 h后,所有接种的鸡胚均进行鸡胚尿囊液HA效价测定。对病毒感染为阴性的鸡胚,盲传1代,再次测定HA效价。分析不同毒株灭活疫苗对不同毒株攻击的交叉保护情况。
2 结果
2.1 病毒增殖能力的测定 病毒HA效价检测结果显示,12株病毒的血凝效价从27-11不等。EID50的检测结果显示,12株病毒的EID50为108.00-109.00/100 μL,见表1。
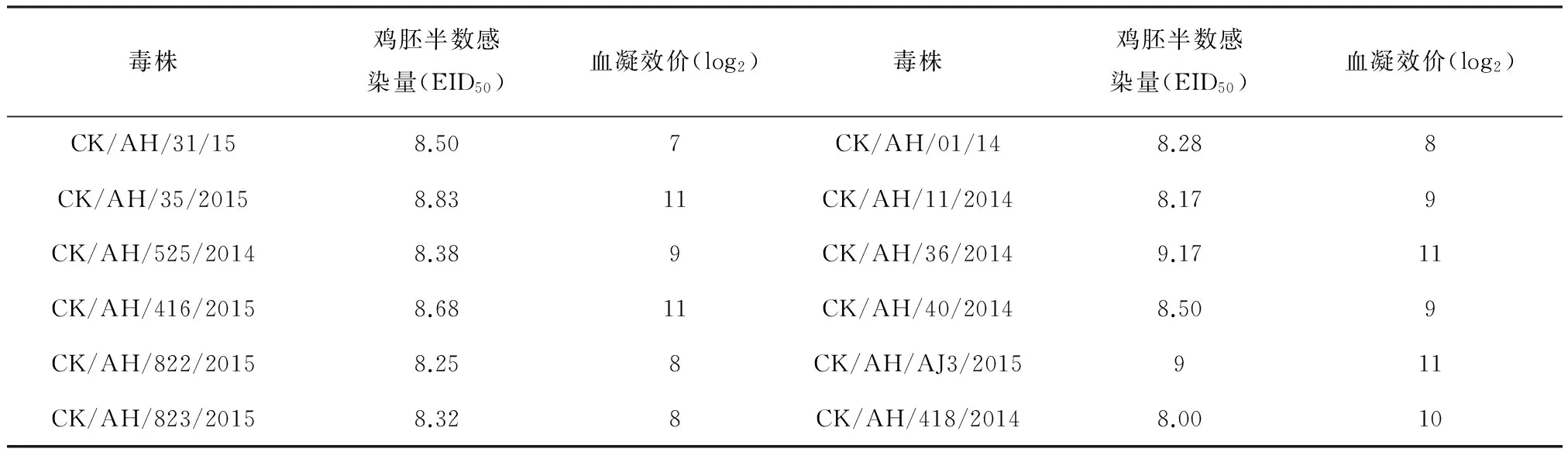
表1 H9N2亚型AIV分离株HA和EID50测定
2.2 病毒纯化结果 选择HA效价较高的4株病毒倍比稀释成10-5-10-9的稀释度,每个稀释度接种5枚SPF鸡胚,0.1 mL/枚,置35 ℃孵箱孵化96 h,弃去24 h内的死胚。然后分别收集尿囊液,测定其血凝价,取有血凝价的最高稀释度的鸡胚尿囊液继续做下一轮稀释纯化,连续纯化3轮,记录每一代纯化后的EID50,表2可知,纯化后的毒株EID50相差不大,证明原始病毒是比较纯的,达到预期效果。
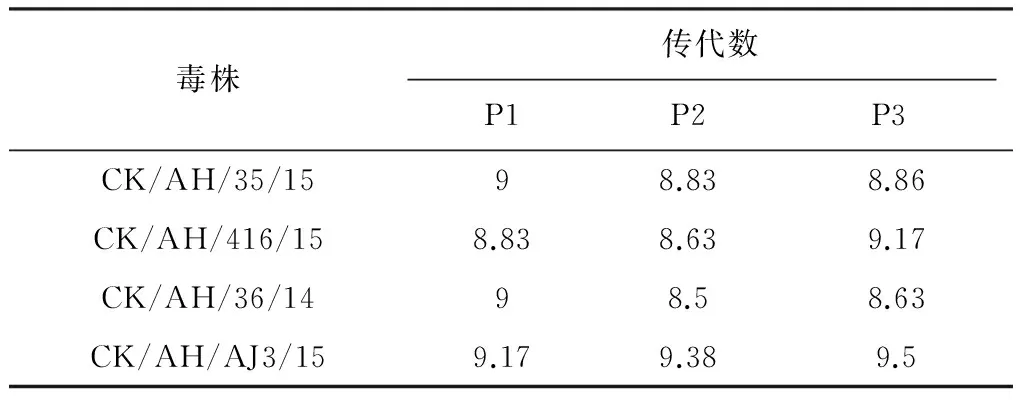
表2 H9N2 AIVs分离株EID50的测定结果
2.3 交叉HI试验结果 以4株毒株免疫SPF鸡后分离的血清与这4株毒株、F98株一起进行交叉血凝抑制试验。结果显示,CK/AH/AJ3/15毒株免疫后产生的抗体与5种检测抗原反应的血凝抑制价均值在9.70-10.60之间,而其他3株毒株免疫SPF鸡后,诱导机体产生的抗体不管是针对自身抗原还是其他抗原,平均抗体水平分布在7.10-9.70之间。说明CK/AH/AJ3/15株病毒具有很好的免疫原性,可作为疫苗候选株。
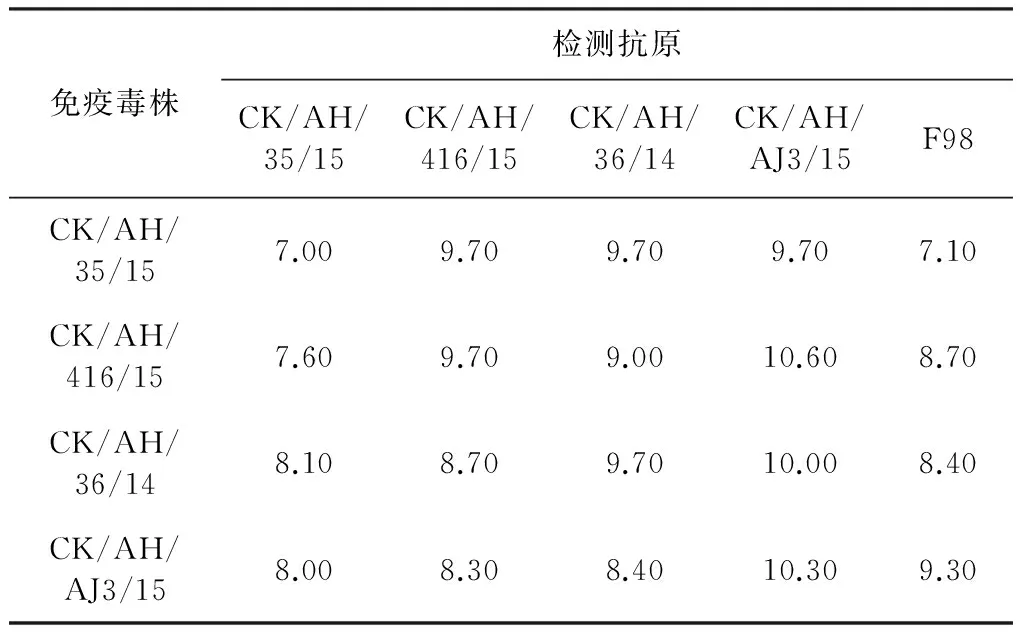
表3 H9N2亚型AIV分离株的交叉HI抗体效价测定
2.4 免疫攻毒保护试验 分别免疫CK/AH/AJ3/15毒株灭活苗和商品化F/98疫苗试验鸡各一组,第三组做对照,在抗体效价达到8 log2后,以106EID50的剂量经静脉注射进行4种毒株和F98株攻毒。从攻毒后的第2天开始,攻毒对照组的鸡出现了不同程度的发病症状,发病的程度从轻度的精神沉郁到羽毛凌乱不等,免疫组鸡在攻毒后整体精神状态良好。
攻毒后第5天采集所有鸡的泄殖腔和气管棉拭接种10日龄SPF胚,测定排毒情况,结果见表4。对照组除攻CK/AH/35/15毒株的小组有1只鸡泄殖腔不排毒,其余全部排毒,对照组结果有效。免疫候选株CK/AH/AJ3/15油苗组对4种病毒有很好的保护效果,除了攻CK/AH/416/15病毒的小组有1只鸡的泄殖腔排毒,气管不排毒,其他小组鸡都不排毒,总的保护率为97.5%。而免疫F/98疫苗除了攻CK/AH/36/14病毒小组鸡泄殖腔、气管都不
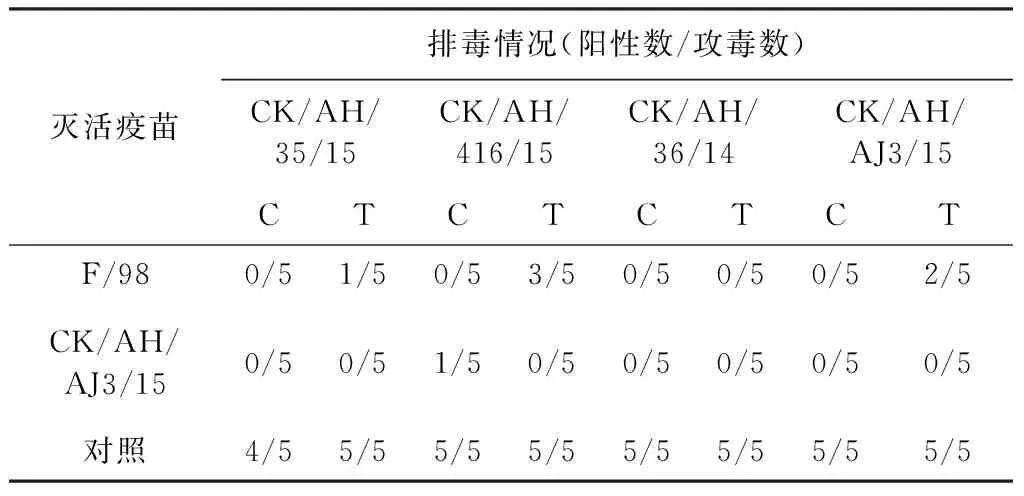
表4 交叉免疫攻毒保护结果
C:泄殖腔cloaca ; T:气管trachea
排毒外,攻其他病毒的小组都有鸡只排毒,F/98疫苗总的保护率为85%。可以很明显的看出,候选疫苗株比商品化F/98疫苗保护效果更好。
3 讨论
3.1 禽流感病毒具有频繁变异的特点,包括H9N2亚型病毒也不列外。变异频繁,当前流行的H9N2病毒在抗原性上发生了较大变化。而养殖生产上使用的H9N2疫苗Ck/SH/F/98等疫苗株至今已有10多年的历史,免疫保护效果不如从前,已不能满足养殖生产的需要。在这一背景下,开展禽流感H9N2亚型新疫苗的研制正当其时。本试验在对近年来流行的H9N2病毒遗传进化分析的基础上,通过对12株分离的H9N2禽流感病毒的免疫原性和部分生物学特性的测定,初步认为CK/AH/AJ3/15病毒株可以作为新型H9N2禽流感亚型疫苗研制候选株。
3.2 禽流感病毒是分节段的负链单股RNA病毒,在复制过程中很容易发生基因突变及基因重组, 因而决定了其易变的特点,这也是禽流感疫苗免疫保护率跟不上病毒变异的主要原因。疫苗的基因同源性和抗原性差异是影响疫苗免疫效果的关键因素。姜北宇[11]研究发现,4种不同毒株灭活疫苗的抗原液的HA价差异很大, 最高为9 log2, 最低为5 log2,但其病毒含量(EID50)基本相同,制备出的4种灭活疫苗所诱导产生的HI抗体效价也基本相同。这些观点提示我们,必须从病毒滴度、抗原性和交叉免疫保护作用等方面筛选疫苗候选株。
[1] Grund C, Abdelwhab el S M, Arafa A S,etal.Highly pathogenic avian influenza virus H5N1 from Egypt escapes vaccine-induced immunity but confers clinical protection against aheterologous clade 2.2.1 Egyptian isolate[J]. Vaccine, 2011,29:5 567-5 573.
[2] Kim J K, Kayali G, Walker D,etal.Puzzling inefficiency of H5N1 influenza vaccines in Egyptian poultry[J]. ProcNatl Acad Sci U S A, 2010,107:11 044-11 049.
[3] Connie Leung Y H, Luk G, Sia SF,etal.Experimental challenge of chicken vaccinated with commercially available H5 vaccines reveals loss of protection to some highly pathogenic avian influenza H5N1 strains circulating in Hong Kong/China[J]. Vaccine, 2013,31:3 536-3 542.
[4] Escorcia M, Vazquez L, Mendez S T,etal, Nava G M. Avian influenza: genetic evolution under vaccination pressure[J]. Virol J, 2008,5:15.
[5] 胡晓苗,胡顺林,陈鸿志,等.2011~2014年安徽省发病鸡群H9亚型禽流感病毒HA基因的遗传进化分析[J]. 中国动物传染病学报,2015,23(5): 21-26.
[6] 胡晓苗,戴银,沈学怀,等.2012年~2015年安徽部分地区发病家禽H9N2亚型禽流感流行情况分析[J]. 动物医学进展,2016, 37(3):127-130.
[7] 郭元吉,程晓雯.流行性感冒病毒及其实验技术[M].2版.北京:中国三峡出版社,1997:29-32.
[8] S.Edwards.OIE laboratory standards for avian influenza[J].Dev Biol (Basel),2006,124:159-62.
[9] 甘孟侯,于康震,徐百万,等.禽流感[M].2版.北京:中国农业出版社,2002:80-81.
[10] 杜念兴.兽医免疫学[M].2版.北京:中国农业出版社,1998:133-134.
[11] 姜北宇,章振华,李林,等.禽流感H9亚型流行毒株交叉免疫保护试验[J].动物医学进展,2009,30(8):29-33.

