华南虎源大肠杆菌耐药性与致病性研究
黄翠琴 , 杨守深 , 梁齐章 , 王正磊 , 杨小燕 , 吴德峰 , 尹会方
(1. 龙岩学院生命科学学院 , 福建 龙岩 364012 ; 2.福建省家畜传染病防治与生物技术重点实验室 , 福建 龙岩 364012 ;3.福建农林大学动物科学学院 , 福建 福州 350002)
华南虎是我国特有的虎亚种,目前野外几乎灭绝。梅花山中国虎园景区位于福建省龙岩市上杭县步云乡,是我国重要的华南虎拯救工程基地。由于华南虎在生态系统中具有重要的地位,因此,对华南虎致病菌及其耐药性的研究,对该物种的保护和繁育具有重要意义。大肠杆菌是一类广泛存在于自然界,能引起人和动物共同感染的重要人兽共患病,常常与其他病原菌混合感染,发病率和死亡率较高,给养殖业带来严重的经济损失。
目前对该地区虎源大肠杆菌耐药性和致病性缺乏相应的参考资料,因此,本研究通过无菌采集龙岩梅花山虎园老虎的粪便,进行大肠杆菌的分离鉴定、药敏试验、动物毒力试验以及毒力基因检测。通过研究获得其致病性及耐药情况,为龙岩梅花山地区虎源致病性大肠杆菌病的防控和临床合理用药提供科学依据。
1 材料与方法
1.1 试验材料 2015年采集龙岩梅花山华南虎园4只健康母虎新鲜粪便分离大肠杆菌,经分离纯化得到的4株大肠杆菌,本次取样母虎未使用任何药物。试验小鼠,购自上海斯莱克实验动物有限公司;麦康凯培养基、LB肉汤、MH肉汤、MH琼脂和伊红美蓝琼脂,均购自广州环凯微生物科技有限公司;药敏纸片,购自杭州天和微生物试剂有限公司。
1.2 细菌分离鉴定 采用无菌棉签采集母虎的新鲜粪便,接种于LB肉汤培养基,并置于37 ℃的恒温摇床(200 r/min)培养箱中培养3~6 h。用接种环取少量培养液均匀划线接种于麦康凯培养基中,37 ℃的恒温培养16~24 h。挑选疑似菌落进一步纯化,并通过革兰染色后镜检和16S rRNA(F:5′-AGAGTTTGATCTGGCTCAG-3′,R:5′-GGTTACCTTGTTACGACTT-3′)[1]。
1.3 药敏试验 大肠杆菌的药物敏感性测定按照CLSI(2010)推荐方法执行[2]。大肠杆菌ATCC 25922作为药敏质控菌。
1.4 动物试验 试验小鼠10只,随机分为试验组A、B、C、D和对照组E,每组2只。试验组腹腔接种LB菌液,每只0.5 mL;对照组腹腔接种相同剂量的空白LB液体培养基,隔离饲养。观察发病及死亡情况。
1.5 毒力基因的检测 采用水煮法提取细菌基因组DNA作为PCR模板,分别对8种毒力基因进行PCR检测。8对引物毒力基因引物序列及目的片段长度参考文献报道[3],见表1。

表1 毒力基因引物序列及片段长度
F:上游引物; R:下游引物
2 结果与分析
2.1 细菌分离和鉴定 从龙岩梅花山虎园中采集4份母虎粪便,经分离纯化得到的4株大肠杆菌。细菌在麦康凯培养基中,呈粉色、圆形、边缘整齐、表面光滑、半透明、小凸起;在伊红美蓝培养基中,菌落中心呈黑色,有金属光泽。革兰染色结果镜检观察可见两端顿圆、呈短杆状、红色的革兰阴性菌。经16S rRNA 鉴定,可得到目的条带,确定分离株菌为大肠杆菌。
2.2 药敏试验结果 根据纸片法抗菌药物敏感试验方法,其结果见表2。分离株对复方新诺明的耐药率最高为100%;对多西环素和阿莫西林/克拉维酸耐药率均为75%;对恩诺沙星和左氧氟沙星的耐药率为50%。对庆大霉素的敏感性最好;对头孢呋辛和头孢噻呋敏感性下降。
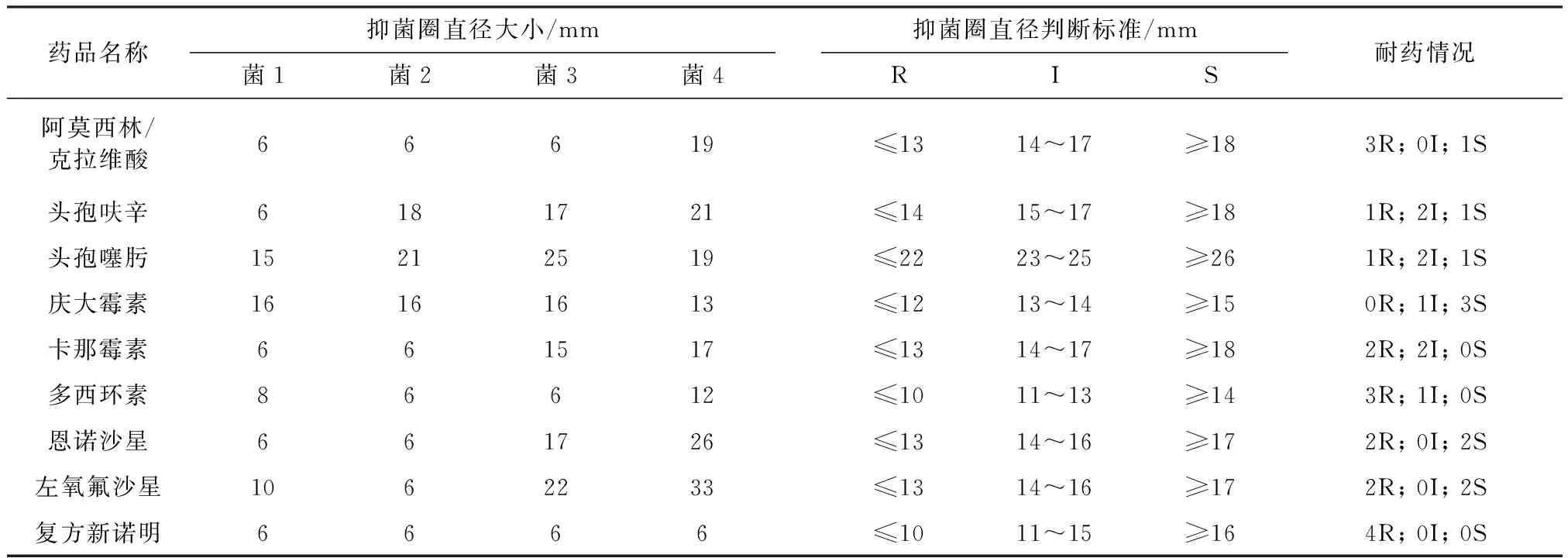
表2 药敏试验结果
R:耐药 ; I:中介 ; S:敏感
2.3 动物实验结果 在接种后3 h之内,试验组D中1只小鼠死亡,剖检无明显病理变化。12 h之内,试验组A和B各有1只小鼠死亡,剖检可见心包淤血,肝脏肿大,小肠有红棕色水样稀粪(见中插彩版图1)。其余小鼠反应迟钝,食欲减退,精神沉郁。24 h之内C组未发生小鼠死亡。对照组小鼠始终正常。
2.4 毒力基因检测结果 对分离株的8种毒力基因进行PCR检测,测结果见表3。所有菌株均携带有2个以上的毒力基因,其中1株菌携带有高达6个毒力基因。毒力基因aatA的检出率最高为100%;irp2检出率次之为75%;papC、iucD、vat、iss检出率均为50%;毒力基因tsh和cva/cvi未检出。
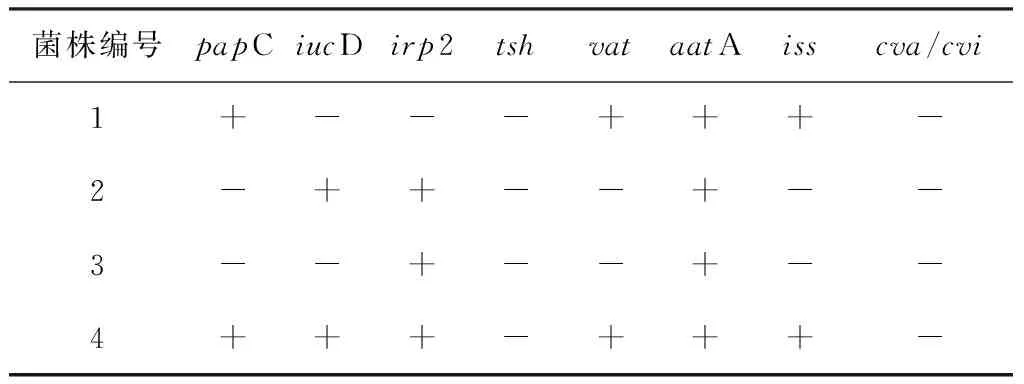
表3 大肠杆菌毒力基因检测结果
3 讨论
野生动物的耐药性相对研究较少,有文献表明,圈养虎源大肠杆菌同样表现出较强的耐药性,如对哈尔滨市东北虎林园虎源大肠杆菌,对氨苄西林耐药率为100 %,四环素和复方新诺明的耐药率均高于80%[4];有时不仅耐药率高,其相应耐药基因携带率也高,如30株虎大肠杆菌对氯霉素的耐药率为85%,对氟苯尼考的耐药率为78%,其耐药基因cmlA检出率高达70%[5]。龙岩梅花山虎园华南虎主要是圈养管理,本研究中所检大肠杆菌对受试的抗菌药物呈多重耐药性,并且对复方新诺明100% 耐药。耐药性的产生为临床有效治疗带来了极大的困难,因此,确定致病性大肠杆菌的耐药谱,寻找最佳疗效的药物成为科学防治大肠杆菌病的必要措施。
为确认分离株是否为致病菌,本研究结合动物实验和PCR方法对其致病性进行检测。虽然大肠杆菌的致病性主要集中在某些特定的血清型[6],但是有研究表明,血清型相同,菌株间携带毒力相关基因存在差异[7]。因此有必要对毒力因子携带情况进行研究,其中与大肠杆菌感染有关的毒力因子主要有粘附素和毒素。本试验除了做动物实验外,还对其毒力基因进行检测。分离株在12 h~48 h内致小鼠死亡,均含有8种毒力基因中的2种及2种以上。接4号大肠杆菌小鼠死亡时间最快,携带有6种毒力基因,致病性最高。1号和2号大肠杆菌分别携带有4种和3种毒力因子,其致病性高于3号菌株。结合本次的动物实验,毒力基因携带情况可以反映出其致病力的高低。谢和平等研究表明,虎源大肠杆菌同时携带irp2、iucD和iss基因,其毒力较强在36 h内攻毒小鼠的死亡率高达100%[1]。在本试验中以上3种毒力基因均有检测,其中irp2检出率最高(3/4),iucD和iss检出率相同(2/2),毒力基因的携带率较高。
通过本次对虎源大肠杆菌的耐药性和致病性的研究,尽管样本数不大,但是发现了圈养虎肠道中携带的大肠杆菌表现出较强的耐药性,并且显示出明显的致病性。因此,圈养虎携带病原菌的耐药性和致病性应引起广大科研工作者的重视。
[1] 谢和平,朱庆艳,陈武,等. 华南虎源大肠杆菌的快速鉴定及致病特性的初步研究[J]. 野生动物,2012(03):109-112.
[2] Clinical and Laboratory Standards Institute. Performance Standards for Antimicrobial Susceptibility Testing: Twentieth Informational Supplement M100-S20. CLSI Wayne P A[J]. USA, 2010.
[3] 张宇曦,韩先干,左佳坤,等. 禽致病性大肠杆菌脂多糖核心型分布与毒力基因的相关性分析[J]. 微生物学通报,2015,42(08):1 619-1 625.
[4] 薛原,李凤勇,孙静,等. 虎源大肠杆菌耐药性的检测与分析[J]. 经济动物学报,2013,16(01):31-34.
[5] 薛原,王晓菲,陈建飞. 圈养虎源大肠杆菌中氯霉素类药物耐药基因的调查[J]. 经济动物学报,2016,19(01):33-35.
[6] Frydendahl K. Prevalence of serogroups and virulence genes in Escherichia coli associated with postweaning diarrhoea and edema disease in pigs and a comparison of diagnostic approaches[J]. Vet Microbiol,2002,85(2):169-182.
[7] 王秀梅,蒋红霞,廖晓萍,等. 猪源致病性大肠杆菌的血清型、毒力基因及抗菌药耐药性的调查[J]. 中国农业科学,2010,43(19):4 109-4 115.

