纤维素酶法提取黄秋葵多糖的工艺优化
孟 楠 樊振江 高雪丽
1(漯河食品职业学院,河南漯河462000)2(许昌学院,河南许昌461000)
黄秋葵(Okra,Hibiscus esculentus L.)别名羊角豆,为锦葵科秋葵属,是一年生药食同源植物,其果实可供食用,富含多种营养素,如蛋白质、多糖、不饱和脂肪酸、维生素、矿物质等。近年来,国内外学者对秋葵已有研究,表明经常食用秋葵可提高人体免疫力、增强体质,是一种营养价值高、开发前景好的草本植物。
黄秋葵果实中富含多种营养素,营养价值和药用保健功能极高,具有广泛的应用前景。有研究表明,每100 g秋葵果实中约含蛋白质22.98 g,维生素C44 mg,磷65 mg,维生素B10.2 mg,维生素E 1.03 mg,镁 29 mg,维生素B20.2 mg,维生素PP 1.0 mg,铁 0.8 mg,脂肪 9.4 g,钾 95 mg,黄酮2.56 g,钙 45 mg。
现代药理学研究表明,秋葵具有多种生物活性成分,具有很高的药用价值。秋葵果实中特有的黏性物质可助消化,能有效治疗胃炎、保护肝脏和提高人体体质,其黏液亦可当做脂肪替代物使用,在巧克力和饼干制作中均有应用。此外,秋葵多糖还具有增稠、乳化等功效。Zheng Wei等对黄秋葵花中多糖成分进行了分离纯化,结果表明水溶性多糖组分可以有效抑制癌细胞增殖,且还有一定免疫调节功能,为进一步深入研究和应用秋葵多糖提供了依据。因此,秋葵多糖在食品行业具有良好的开发潜力和应用前景。
本文以黄秋葵果实为研究对象,采用纤维素酶法提取秋葵多糖,研究反应时间、反应温度、酶浓度、底物浓度对多糖提取率的影响,并在单因素试验的基础上,采用正交试验对黄秋葵果实多糖的提取工艺条件进行优化,旨在为秋葵多糖的工业化提取和利用提供理论依据。
1 材料与方法
1.1 主要材料
黄秋葵,购自河南省漯河市丹尼斯超市。
1.2 仪器
UV-2550紫外分光光度计,日本岛津;DZF-6090真空干燥箱,上海精宏实验设备有限公司;电热恒温水浴锅,北京长风仪器仪表公司;RE-2000E型旋转蒸发器,天津凯易达仪器有限公司;奥立龙pH计868型,上海热电仪器公司;SHZ(Ⅲ)循环水式真空泵和电热套,巩义市予华仪器有限责任公司。
1.3 试验方法
1.3.1 提取工艺流程
秋葵→挑选清洗→打浆→酶法提取→减压浓缩→真空冷冻干燥→粗多糖
1.3.2 工艺要点
a)原料选择:要求秋葵新鲜,无虫蛀、无霉变。
b)打浆:以一定的料水比进行打浆,破碎秋葵,使提取更充分。
c)酶法提取:在不同提取温度、提取时间、酶浓度、底物浓度条件下进行提取秋葵多糖。
d)减压浓缩:将浸提液过滤,在真空度-0.06 MPa~0.08 MPa条件下进行浓缩至膏状。
e)真空冷冻干燥:真空冷冻干燥制备粗多糖。
1.3.3 秋葵多糖得率
秋葵多糖得率=提取物中多糖含量(g)/秋葵原料多糖含量(g)。
2 结果与分析
2.1 葡萄糖标准曲线的建立
采用苯酚-硫酸法测定秋葵多糖含量。分别配制质量浓度为 0.01 mg/mL、0.02 mg/mL、0.03 mg/mL、0.04 mg/mL、0.05 mg/mL、0.06 mg/mL、0.07 mg/mL、0.08 mg/mL的萄萄糖标准溶液,在490 nm处测其吸光度值。以葡萄糖标准溶液质量浓度为横坐标,吸光度为纵坐标绘制标准曲线,见图1。回归方程为 y=9.768 9x-0.066 7(R2=0.994 6)。
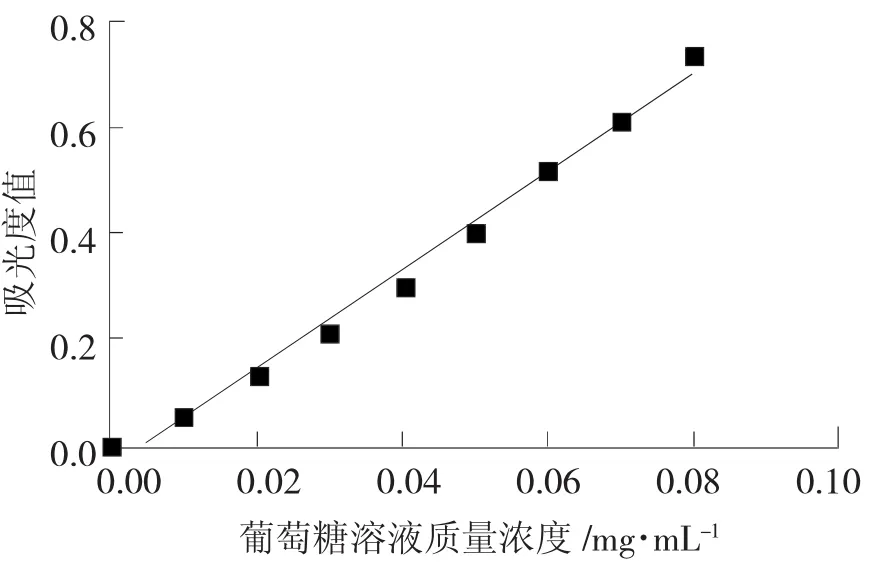
图1 葡萄糖标准曲线
2.2 酶解反应的单因素试验
根据前期研究,本试验以中性纤维素酶为处理手段,分别研究提取时间、提取温度、酶浓度、底物浓度等因素对秋葵多糖得率的影响。
2.2.1 提取时间对秋葵多糖得率的影响
在固定的条件下,即底物浓度为10%(g/g)、酶浓度为0.3%(g/g)、提取温度为50℃及pH为6.0时,提取时间分别取0.5 h、1.0 h、1.5 h、2.0 h、2.5 h进行试验,其试验结果见图2。
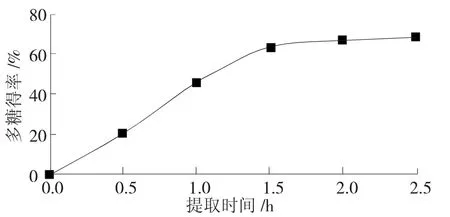
图2 提取时间对秋葵多糖得率的影响
从图2中可以看出,随着提取时间的延长,得率曲线趋于平稳,增加不明显。这可能是由于试验初始,酶浓度比较大,活性较高,能快速分解秋葵纤维组织,使秋葵多糖释放;随着时间的延长,酶不断被消耗,活性降低,反应接近停滞。考虑到经济实用性,确定适宜的反应时间为2 h。
2.2.2 提取温度对秋葵多糖得率的影响
在固定的条件下,即底物浓度为10%、酶浓度为0.3%、提取时间为1.5 h及pH为6.0时,分别选择提取温度为30℃、40℃、50℃、60℃、70℃进行试验,试验结果如图3所示。
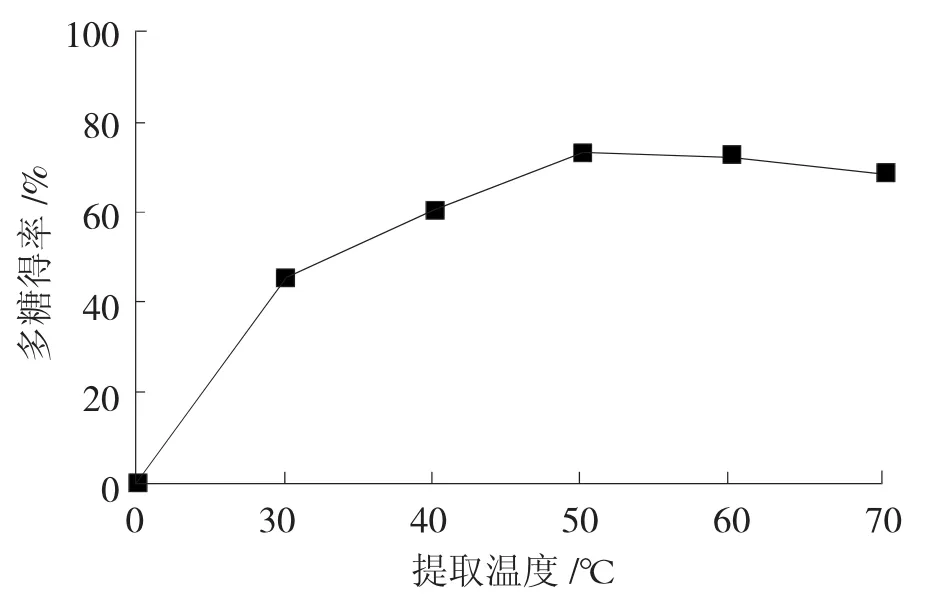
图3 提取温度对秋葵多糖得率的影响
由图3可知,在一定的作用时间里,当提取温度小于50℃时,秋葵多糖得率随着反应温度的增加而升高;当提取温度超过50℃时,秋葵多糖得率随着提取温度的增加而降低。这是因为在纤维素酶酶解过程中,温度对酶解反应效率的影响包括两个方面,即酶催化反应速度及酶的稳定性。在酶的最适温度以下,随着温度的升高,反应物的能量和分子间有效接触的频率增加,因而反应速度加快;超过最适温度,酶分子的空间结构由于能量的增加而发生改变,导致酶活性减弱或丧失,从而影响催化效果。由此,在温度50℃~60℃范围内,秋葵多糖具有较高的得率,可作为下一步正交优化试验的温度可选范围。
2.2.3 酶浓度对秋葵多糖得率的影响
在固定的条件下,即底物浓度为10%、提取温度为50℃、提取时间为1.5 h及pH为6.0时,分别选择纤维素酶酶浓度为0.1%、0.2%、0.3%、0.4%、0.5%进行试验,研究其对秋葵多糖得率的影响,结果如图4所示。
由图4可知,随着酶浓度的增加,秋葵多糖得率也逐渐增大。当酶浓度超过0.4%时,秋葵多糖的得率增加不明显,因此,确定酶的适宜浓度为0.4%。
2.2.4 底物浓度秋葵多糖得率的影响
在固定的条件下,即酶浓度为0.3%、提取温度为50℃、提取时间为1.5 h及pH为6.0时,分别选择底物浓度为5%、10%、15%、20%、25%进行试验,研究其对秋葵多糖得率的影响,结果如图5所示。
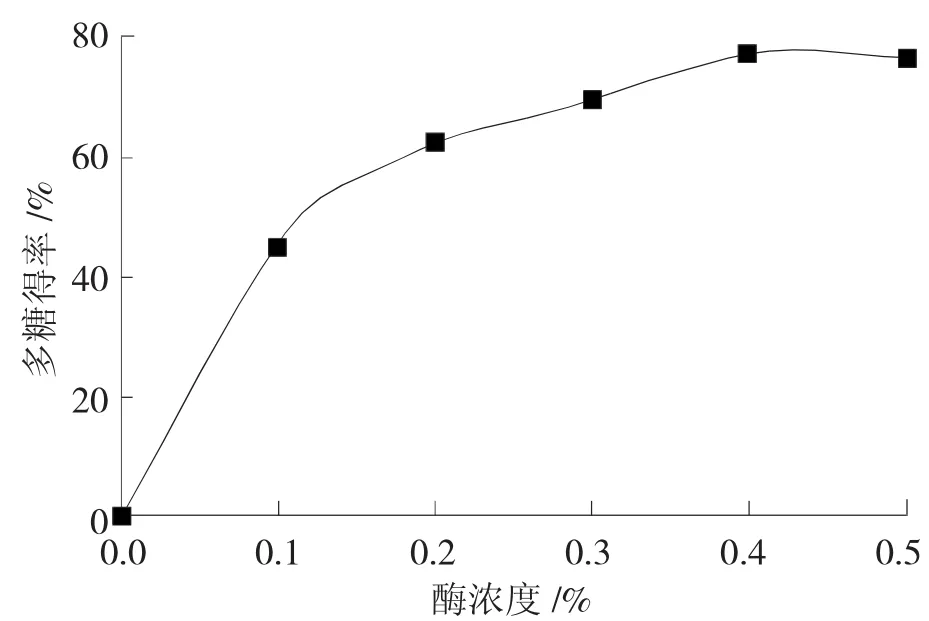
图4 酶浓度对秋葵多糖得率的影响
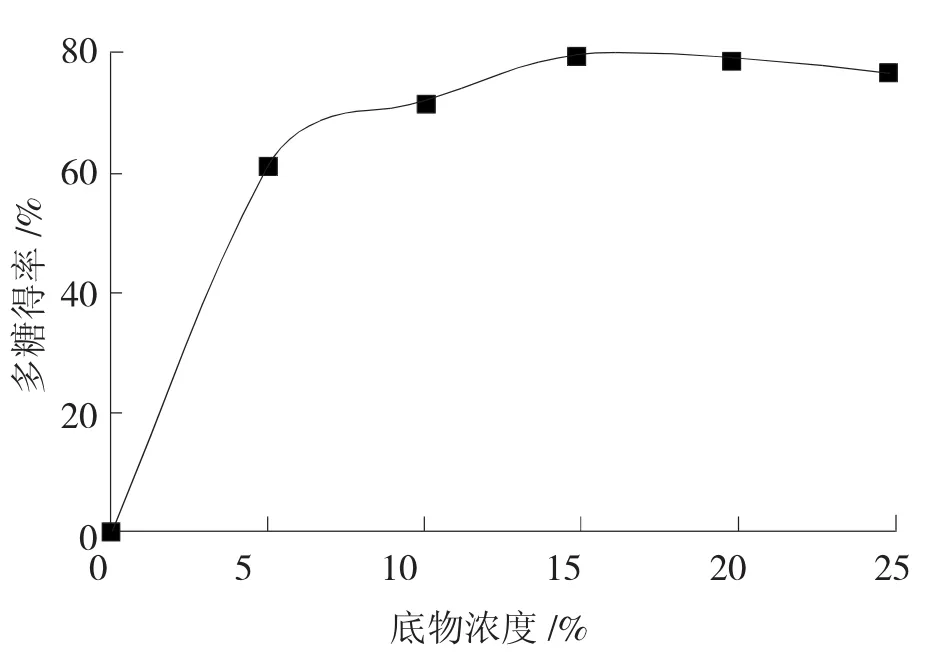
图5 底物浓度对秋葵多糖得率的影响
由图5可以看出,随着底物浓度的增加,秋葵多糖得率都逐渐增大,主要是因为底物浓度增加,反应速率增加。但当底物浓度超过达到一定值时,反应速率显著减小。
2.3 酶解反应的优化试验
由单因素试验可以得出酶解反应适宜作用条件:底物浓度为10%、酶浓度为0.4%、提取时间为1.5 h、提取温度为50℃及pH为6.0。为进一步得到酶解的较优条件,再进行L16(45)正交试验,因素水平设计见表1,正交试验结果见下页表2。
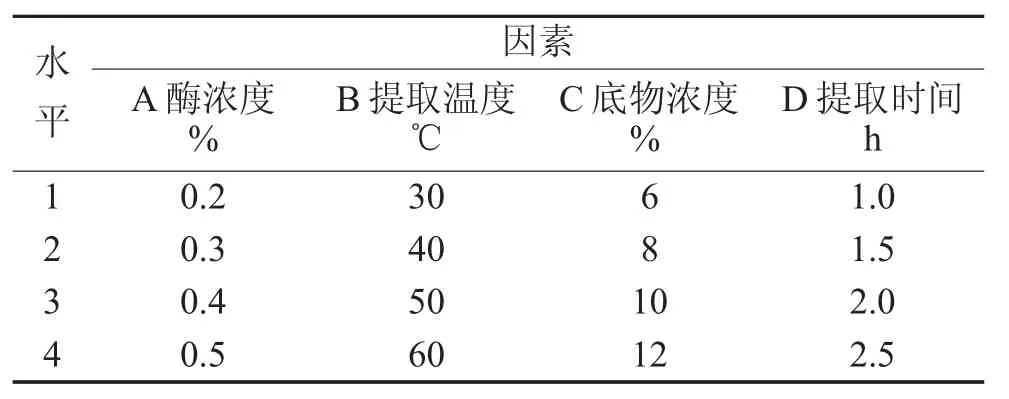
表1 因素水平设计表
由极差分析可知,各因素对秋葵多糖得率的影响大小顺序为:A>C>D>B,即酶浓度>底物浓度>提取时间>提取温度,最优组合为A4B4C3D3,即酶浓度为0.5%,提取时间为2.0 h,提取温度为60℃,底物浓度为10%。正交试验方差分析结果见表3。
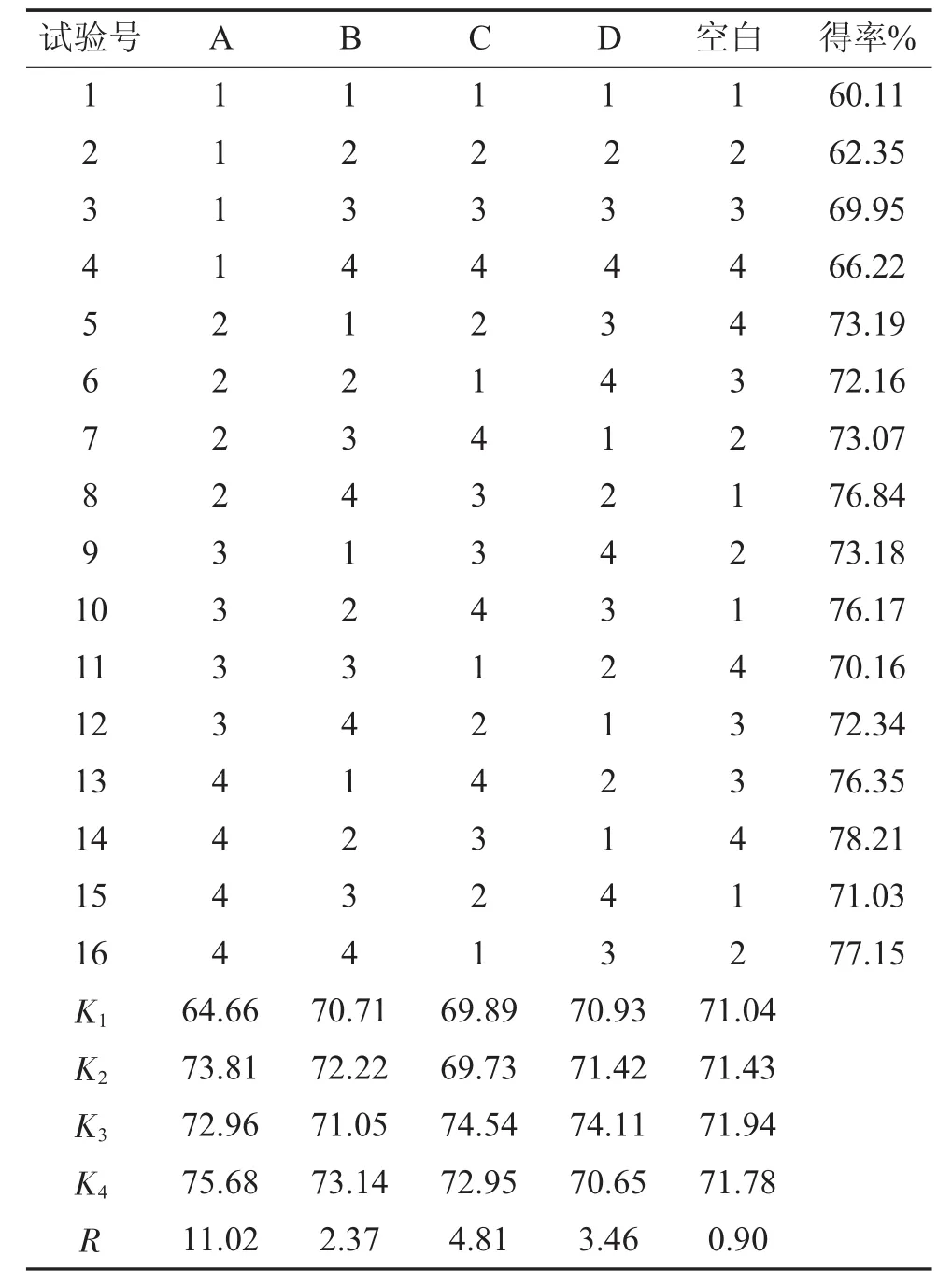
表2 正交试验结果
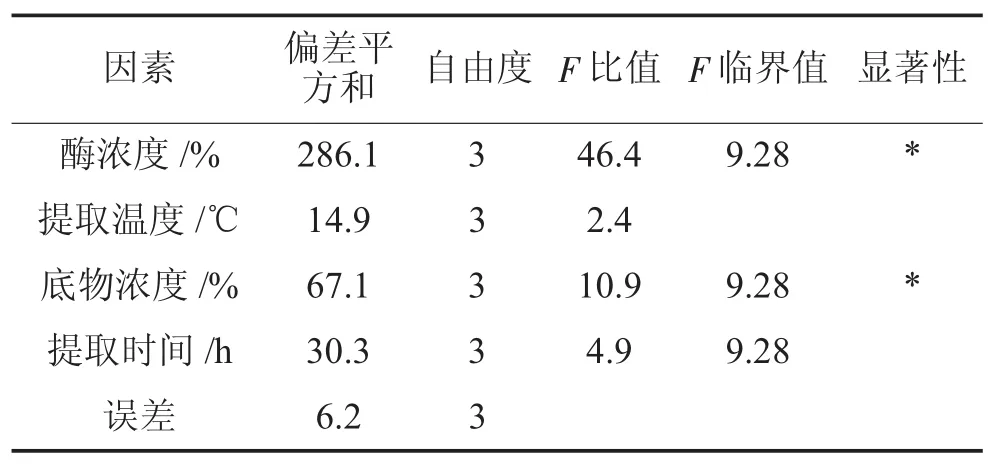
表3 方差分析结果
由表3方差分析结果可知,在显著水平P=0.05时,酶浓度、底物浓度两因素都显著,由方差分析得出影响因素大小顺序为酶浓度、底物浓度、提取时间、提取温度,这和极差分析结果一致。
经验证试验,正交优化出的条件为:酶浓度0.5%,提取时间2.0 h,提取温度60℃,底物浓度10%,此工艺条件下秋葵多糖得率为81.06%。
3 结论
通过单因素试验和正交试验发现,影响秋葵多糖得率的4个因素的主次顺序为:酶浓度>底物浓度>提取时间>提取温度,最优组合为A4B4C3D3,即酶浓度为0.5%,提取时间为2.0 h,提取温度为60℃,底物浓度为10%。经验证试验测得在最佳条件下秋葵多糖得率为81.06%。采用纤维素酶法提取秋葵多糖,具有高效、易操作,对环境污染小等优势。
[1]刘晓霞.黄秋葵花果胶类多糖的提取工艺及其性质的研究[D].杭州:浙江大学,2014.
[2]ALBA K,RITZOULIS C,GEORGIADlS N,et a1.Okra extracts as emulsifiers for acidic emulsions[J].Food research international,2013,54(2):1 730-1 737.
[3]任丹丹.黄秋葵多糖提取纯化及其体外结合胆酸能力和抑制肿瘤活性分析[D].广州:华南理工大学,2011.
[4]王宏.黄秋葵降血脂的功能与作用机理研究[D].广州:华南理工大学,2013.
[5]宋思圆,苏平,王丽娟,等.响应面试验优化超声提取黄秋葵花果胶多糖工艺及其体外抗氧化活性[J].食品科学,2017,38(2):283-289.
[6]SHEU S C,LAI M H.Composition analysis and immuno-modulatory effect of okra belmoschus esculentus L 1 extract[J].Food chemistry,2012,134(4):1 906-1 911.
[7]SAVELLO PA,MARTINSF, HULL W.Nutrition composition of okra seed meals [J].Joumals of agricultural and food chemistry,1980,28(6):1 163-1 166.
[8]ALBA K,LAWS A P,KONTOGIORGOS V.Lsolation and characterization of acetylated LM.pectins extracted from okra pods[J].Food hydrocolloids,2015,43:726-735.
[9]赵焕焕.黄秋葵多糖提取纯化及体外抗氧化活性的探讨[D].郑州:郑州大学,2012.
[10]张首玉,周婧琦,李少华,等.秋葵多糖与α-淀粉酶的相互作用及光谱学分析[J]食品工业科技,2015,36(4):101-104.
[11]SABHOOA PK,SRIVASTAVAB AP.Physical properties of okra seed [J].Biosystems engineering,2002,83(4):44l-448.
[12]SENGICLLAMPAM N,SAGIS LM,VRIES RD,et,al.Phy-sicochemical properties of pectins from okra(Abelmoschus esculentus(L.)Moench)[J].Food hydrocouoids,2010,24(1):35-41.
[13]DOYMAZ I.Drying characteristics and kinetics of okra[J].Journal of food engineering,2005,69(3):275-279.

