SIRT在肠屏障中作用的研究进展
陈 杰,万剑华,吴当彦,夏 亮
(南昌大学第一附属医院 消化内科, 江西 南昌 330006)
短篇综述
SIRT在肠屏障中作用的研究进展
陈 杰,万剑华,吴当彦,夏 亮*
(南昌大学第一附属医院 消化内科, 江西 南昌 330006)
沉默信息调节子(SIRT)是一组保守的NAD+依赖的蛋白去乙酰化酶,参与调控细胞的基因稳定、代谢、衰老和凋亡等过程。研究表明,SIRT对肠屏障具有保护作用,其通过参与调节炎性因子的释放、肠上皮细胞间紧密连接蛋白的表达、改变肠道潘氏细胞和杯状细胞的数量等影响肠屏障的结构与功能。
SIRT;组蛋白去乙酰化酶;肠屏障
肠屏障包括机械屏障、化学屏障、免疫屏障和微生物屏障,其中机械屏障最为重要,其结构基础为完整的肠黏膜膜上皮细胞以及上皮细胞间的紧密连接。正常情况下肠黏膜上皮细胞不断更新,保证了肠上皮的完整性。然而,失血性休克、严重创伤、烧伤等可致肠黏膜缺血缺氧、大量炎性因子释放,导致肠黏膜屏障的破坏,通透性增加,使细菌和毒素易位,引起系统性炎性反应和多器官功能障碍[1]。沉默信息调节子(silent information regulator,SIRT)是一组存在于细菌和哺乳动物细胞内高保守的烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide,NAD+)依赖的蛋白去乙酰化酶。目前已知SIRT在细胞中的基因稳定、基因沉默、代谢及细胞寿命起重要作用[2],而SIRT在肠屏障中的保护作用亦引起了研究者们的关注,已发现SIRT1、SIRT3和SIRT6对肠屏障具有保护作用。
1 SIRT的简介
在哺乳动物中,共有7个与Sir2(silence information regulator 2)同源的NAD+依赖的蛋白去乙酰化酶,统称为Sir2相关酶类,在哺乳动物鉴定的与Sir2同源的一个蛋白家族统一称为Sirtuin蛋白,简称SIRT,其在哺乳动物中共有7种,分别命名为SIRT1~7[2]。SIRT成员在结构上都含有一个长约275氨基酸的核心区域,包括NAD+结合区域和催化结构域。以人类为例,SIRT由一个能量传感器家族构成,能够在细胞内NAD+比例增加时以NAD+依赖的方式介导脱乙酰化(图 1)或 O-ADP-核糖基化[3],继而引起相应的细胞结构和功能的改变。到目前为止,普遍认为SIRT通过与各种底物结合参与基因修复、细胞代谢、细胞能量平衡和细胞的寿命调节。SIRT在损伤修复中的作用大多涉及心、脑、肾和肝,近年来,SIRT对肠上皮屏障的作用引起研究者的关注。研究发现,SIRT参与调节炎性因子的释放、上皮细胞间紧密连接蛋白的表达、肠上皮细胞基因的稳定性及改变肠道潘氏细胞和杯状细胞的数量影响肠上皮的结构和功能。
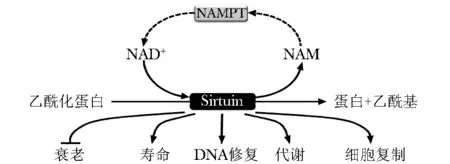
图1 SIRT的去乙酰化
2 SIRT1与肠上皮屏障
SIRT1与酵母Sir2同源性最好,具高度保守性,是目前研究和报道最多的SIRT。其作用底物繁多,包括叉头转录因子(FOXO)、核转录因子NF-kB、转录因子AP- 1、肿瘤抑制因子p53和DNA损伤修复因子Ku70等[2]。
在肠道方面,SIRT1报道较多。在葡聚糖硫酸钠诱发的小鼠结肠炎模型中,白藜芦醇(resveratrol)作为SIRT1激动剂可以降低血清IL- 6、TNF-α和IL- 1β等炎性因子表达,减轻炎性反应对肠黏膜造成的损伤[4]; 严重失血性休克引起的小肠缺血再灌注损伤,SIRT1表达水平下降,而白藜芦醇可以有效减少失血性休克引起的小肠损伤[5];低氧及TNF-α处理条件下肠上皮SIRT1和紧密链接蛋白表达降低,而白藜芦醇的预处理则可缓解这一作用,提示低氧及TNF-α处理条件下可通过SIRT1调控肠上皮细胞间紧密连接蛋白的表达及分布来影响肠上皮屏障功能[6]。可见SIRT1表达的上调对肠上皮具有保护作用。
SIRT1具有维持基因稳定、调节细胞代谢与寿命、参与炎性反应氧化应激反应的作用,这些作用在在肠屏障中也有体现。炎性反应需要消耗还原H,故有NAD+/NADH比例的改变,而SIRT发挥功能又直接依赖NAD+,进一步说明了SIRT与炎性反应的关联性。此外研究发现SIRT1是一个重要的中枢免疫耐受调节因子[7],提示了SIRT1与免疫反应的关联性。人们所熟悉的NF-κB介导的炎性反应通路在急性胰腺时激活,其下游系列炎性因子TNF-α、IL- 1及IL- 6等的激活可引起肠道功能紊乱,而SIRT1可以抑制NF-κB起到抗感染作用[8],可见白藜芦醇引起的效应刚好和胰腺炎引起的炎性反应介质的效应相反。但是,对于胰腺炎的患者激动SIRT1能否降低炎性因子对肠黏膜的损害还没有相关报道。不巧的是,部分研究发现sirt1基因的缺失可以增加小鼠肠道杯状细胞和潘氏细胞的数量从而增强肠道抗菌能力[9],此外抑制SIRT1可以提高败血症小鼠的免疫力并改善预后[10]。事实上,这与SIRT1对肠上皮屏障的保护作用并不矛盾,因为免疫细胞的耐受和炎性介质的释放在不同的病理情况下对机体的作用不同,SIRT1抑制免疫细胞的活性和炎性介质的释放在某些病理情况下对机体是有保护作用的。可见,SIRT1保护肠上皮屏障的作用需进一步研究并阐明机制,以指导临床用药和治疗。
3 SIRT3与肠上皮屏障
SIRT3是第1个被定位于哺乳动物细胞线粒体的SIRT,其在富含线粒体的组织如肌肉、肝、肾和心脏中高表达。其作用底物有长链乙酰辅酶A脱氢酶(LCAD)、线粒体羟基- 3-甲基戊二酰辅酶A合成酶2(HMGCS2)、异柠檬酸脱氢酶(Idh2)、p53及PGC- 1α等[2]。SIRT3与线粒体代谢、ATP合成、脂肪酸的有氧氧化、基因完整性保护密切相关。
SIRT3在肠道方面报道较少。有报道称,沉默sirt3后,肠上皮系Caco.2细胞低氧诱导因子- 1α(HIF- 1α)的蛋白表达明显升高,与此同时连接蛋白ZO- 1、occludin及claudin- 1的表达降低[11]。这提示在肠上皮细胞低氧时SIRT3的表达可以调控HIF- 1α的表达降低肠屏障的损伤。此外还发现,白藜芦醇也作用于SIRT3-SOD2(超氧化物歧化酶- 2)信号通路,调节线粒体功能减少出血性休克引起的小肠损伤[12]。
SIRT3主要存在于线粒体,涉及呼吸链ATP的产生、脂肪酸的氧化和抗氧化应激。肠上皮细胞快速的更新没有线粒体的能量供应是无法完成的,这也暗示了SIRT3对肠上皮细胞的重要性。已经有很多研究表明SIRT3有利于损伤的修复:小鼠实验中发现,急性肾损伤伴随着SIRT3的明显下调和线粒体损失,而增加SIRT3的表达有利于急性肾损伤小鼠的恢复[13];咖啡酸通过SIRT3依赖的呼吸链调节功能减少大鼠肝脏的缺血再灌注损伤[14]等。有研究发现,在细菌脂多糖引起的败血症大鼠实验中发现,增加SIRT3的表达具有维持血管完整性和保护微血管的功能[15]。临床上因重症急性胰腺炎导致肠源性感染的患者和该实验的模型有点类似,然而目前还没有报告涉及SIRT3在肠源性感染中对肠上皮屏障的作用如何。可见,SIRT3在肠道这一块仍值得进一步研究。
4 SIRT6与肠上皮屏障
SIRT6 是异常染色质相关核蛋白,高表达于大脑和骨骼肌,其作用底物有NF-κB、ADP-核糖基DNA聚合酶β和多聚腺苷二磷酸核糖聚合酶1(PARP1)等[2]。SIRT6不但具有去乙酞化酶活性,还有强大的ADP-核糖基转移酶活性,在DNA修复、维持基因组稳定性具有重要作用[2]。
在肠道方面,SIRT6报道极少。有研究发现,sirt6敲除的小鼠寿命明显缩短,常于出生后4周死亡[16]。值得注意的是,在小鼠死后的组织病理研究中发现,死亡小鼠有明显的结肠炎表现,主要特征为结肠上皮细胞的大量坏死和脱落。
近来有研究表明,结肠炎发展过程中伴随着SIRT6表达的显著减少,肠上皮细胞特异性敲除sirt6,显著增加了小鼠对DSS诱导实验性结肠炎的易感性;进一步的实验发现,在回肠和结肠内,SIRT6的表达仅次于胸腺和脑组织,明显高于其他部位[17]。强烈提示SIRT6与结肠炎密切相关。在机体其他器官炎性反应中,SIRT6可以通过增加叉头转录因子FOXO3α依赖的抗氧化作用对抗心肌缺血和再灌注损伤[18];提高SIRT6的表达可抵抗高脂饮食诱发的肝脏慢性炎性反应与肝纤维化[19];可见SIRT6具有对抗炎性反应的作用。事实上SIRT6与SIRT1相似之处在于,同样可以抑制NF-κB起到抗感染作用[20],从上看来,研究SIRT6在炎性反应性肠病治疗中的作用远不限于目前的研究,进一步研究SIRT6在炎性反应性肠病的发病、诊断和治疗中所扮演的角色将有助于解决炎性反应性肠病治疗中所遇到的难题。
5 小结与展望
有研究表明SIRT激动剂白藜芦醇可抑制肠道胰岛素样生长因子- 1受体(IGF- 1R)的激动从而抑制肠道成纤维细胞胶原蛋白的合成[21],提示白藜芦醇可减少肠壁的纤维化的作用。这种药表现出对肠屏障损伤修复特别是慢性损伤修复的重要临床价值。SIRT6与炎性反应性肠病密切相关,很可能是治疗结肠炎的一个重要靶点。SIRT1和SIRT3均可通过抑制NF-κB通路减少炎性因子的产生,但是目前还没有研究涉及肠上皮SIRT的高表达是否有助于抑制急性胰腺炎炎性因子的释放从而减轻肠黏膜的损伤,这也许是未来治疗胰腺炎的新思路。因此,进一步研究SIRT对肠上皮屏障的影响,不仅可能提供更多有关细胞生命过程调控的信息,还可为临床疾病的发生发展、诊断及治疗提供依据。
[1] Jakubczyk M, Rozowicz A, Spychalska K,etal. Analysis of occurrence of bacteraemia with pathogens from gastrointestinal tract in patients fed parenterally and enterally in the intensive care unit[J]. Prz Gastroenterol,2016,11:127- 130.
[2] 时小燕,杜丽敏. Sirtuin家族成员及其生物学特性[J]. 国际药学研究杂志,2011,38:349- 355.
[3] Sacconnay L, Carrupt PA, Nurisso A. Human sirtuins: structures and flexibility[J]. J Struct Biol,2016,196:534- 542.
[4] Singh UP, Singh NP, Singh B,etal. Resveratrol (trans- 3,5,4’-trihydroxystilbene) induces silent mating type information regulation- 1 and down-regulates nuclear transcription factor-kappaB activation to abrogate dextran sulfate sodium-induced colitis[J]. J Pharmacol Exp Ther,2010,332:829- 839.
[5] Zeng Z, Chen Z, Xu S,etal. Polydatin alleviates small intestine injury during hemorrhagic shock as a SIRT1 activator[J]. Oxid Med Cell Longev,2015,2015:1- 12.
[6] 马远航,许超,王文生,等.沉默信息调节因子1对缺氧条件下肠上皮屏障功能的保护作用及机制[J].中华胃肠外科杂志,2014,17:602- 606.
[7] Chuprin A, Avin A, Goldfarb Y,etal. The deacetylase Sirt1 is an essential regulator of Aire-mediated induction of central immunological tolerance[J]. Nat Immunol,2015,16:737- 745.
[8] Shen J, Fang J, Hao J,etal. SIRT1 inhibits the catabolic effect of IL- 1 beta through TLR2/SIRT1/NF-kappaB pathway in human degenerative nucleus pulposus cells[J]. Pain Physician,2016,19:E215-E226.
[9] Lo SG, Ryu D, Mouchiroud L,etal. Loss of Sirt1 function improves intestinal anti-bacterial defense and protects from colitis-induced colorectal cancer[J]. PLoS One,2014,9:1- 10.
[10] Vachharajani VT, Liu T, Brown CM,etal. SIRT1 inhibition during the hypoinflammatory phenotype of sepsis enhances immunity and improves outcome[J]. J Leukoc Biol,2014,96:785- 796.
[11] 逯顶松. 去乙酰化酶Sirt3对肠上皮屏障功能的作用研究[D]. 第三军医大学,2014,2014:1- 56.
[12] Zeng Z, Yang Y, Dai X,etal. Polydatin ameliorates injury to the small intestine induced by hemorrhagic shock via SIRT3 activation- mediated mitochondrial protection[J]. Expert Opin Ther Targets,2016,20:645- 652.
[13] Perico L, Morigi M, Benigni A. Mitochondrial Sirtuin 3 and renal diseases[J]. Nephron,2016,134:14- 19.
[14] Mu HN, Li Q, Pan CS,etal. Caffeic acid attenuates rat liver reperfusion injury through sirtuin 3-dependent regulation of mitochondrial respiratory chain[J]. Free Radic Biol Med,2015,85:237- 249.
[15] Zeng H, He X, Tuo QH,etal. LPS causes pericyte loss and microvascular dysfunction via disruption of Sirt3/angiopoietins/Tie- 2 and HIF- 2alpha/Notch3 pathways[J]. Sci Rep,2016,6:1- 13.
[16] Mostoslavsky R, Chua KF, Lombard DB,etal. Genomic instability and aging-like phenotype in the absence of mammalian SIRT6[J]. Cell,2006,124:315- 329.
[17] 刘芳宜. SIRT6在溃疡性结肠炎发病机制中的作用研究[D]. 北京协和医学院,2015.
[18] Wang XX, Wang XL, Tong MM,etal. SIRT6 protects cardiomyocytes against ischemia/reperfusion injury by augmenting FoxO3alpha-dependent antioxidant defense mechanisms[J]. Basic Res Cardiol,2016,111:1- 13.
[19] Xiao C, Wang RH, Lahusen TJ,etal. Progression of chronic liver inflammation and fibrosis driven by activation of c-JUN signaling in Sirt6 mutant mice[J]. J Biol Chem,2012,287:41903- 41913.
[20] Chen Y, Sun T, Wu J,etal. Icariin intervenes in cardiac inflammaging through upregulation of SIRT6 enzyme activity and inhibition of the NF-kappa B pathway[J]. Biomed Res Int,2015,2015:1- 12.
[21] Li P, Liang ML, Zhu Y,etal. Resveratrol inhibits collagen I synthesis by suppressing IGF- 1R activation in intestinal fibroblasts[J]. World J Gastroenterol,2014,20:4648- 4661.
Research progress on the role of SIRT in intestinal barrier
CHEN Jie, WAN Jian-hua, WU Dang-yan, XIA Liang*
(Dept. of Gastroenterology, the First Affiliated Hospital of Nanchang University, Nanchang 330006,China)
SIRT is a family of highly conserved nicotine adenine dinucleotide(NAD+)-dependent protein deacetylase which regulates several processes including cell gene stability, metabolism, aging and apoptosis. Studies have shown that SIRT has protective effects on intestinal barrier, which influences the structure and function of intestinal barrier by controlling the release of inflammatory cytokines, regulating the expression of tight junction protein in intestinal epithelial, and changing the number of Paneth and goblet cells in the intestine.
SIRT; protein deacetylase; intestinal barrier
2016- 10- 31
2017- 01- 18
*通信作者(correspondingauthor):liangx96180@126.com
1001-6325(2018)01-0103-04
R34
A

