miR- 202通过抑制PGC1β表达促进3T3-L1前脂肪细胞分化
伍 迪,凌宏艳,曹 参,何剑琴,杨丝丝,张恺芳,奉水东
(南华大学 1.生理学教研室;2. 附属第二医院 内分泌科;3.社会医学与卫生事业管理学教研室, 湖南 衡阳 421001)
研究论文
miR- 202通过抑制PGC1β表达促进3T3-L1前脂肪细胞分化
伍 迪1#,凌宏艳1#,曹 参2,何剑琴1,杨丝丝1,张恺芳1,奉水东3*
(南华大学 1.生理学教研室;2. 附属第二医院 内分泌科;3.社会医学与卫生事业管理学教研室, 湖南 衡阳 421001)
目的观察miR- 202对3T3-L1前脂肪细胞分化的影响及可能的机制。方法通过慢病毒感染构建稳定表达AMO-miR- 202和乱序对照miRNA细胞系,随后诱导分化。至分化的第9天,油红O染色观察细胞内脂滴的情况;RT-PCR检测过氧化物酶体激活增殖受体γ2(PPARγ2)和aP2的基因表达;Western blot检测PPARγ2、aP2和miR- 202靶基因PPARγ辅助活化因子1β(PGC1β)蛋白表达。结果经293T细胞慢病毒包装AMO-miR- 202、乱序对照miRNA,荧光显微镜下可见约80%~90%荧光细胞;将上述2组病毒液分别感染3T3-L1前脂肪细胞后,可见约70%~80%荧光细胞。AMO-miR- 202组细胞内脂滴及PPARγ2和aP2的mRNA表达显著低于乱序对照组和对照组(P<0.05)。与乱序对照组和对照组相比,AMO-miR- 202组PGC1β蛋白表达显著增加(P<0.05),PPARγ2和aP2蛋白表达显著降低(P<0.01),而乱序对照组和脂肪细胞组上述指标无明显差异。结论miR- 202可能通过抑制PGC1β、提高PPARγ2和aP2的表达促进3T3-L1前脂肪细胞分化。
miR- 202;3T3-L1前脂肪细胞;脂肪细胞分化;PGC1β
肥胖发病率不断增加且呈年轻化趋势,并导致2型糖尿病、高血压和动脉粥样硬化等疾病,严重危害人类健康[1]。在整体水平,能量摄入大于消耗会导致肥胖;在细胞水平,肥胖是因脂肪细胞的数目增多及体积增大所致;深入研究脂肪细胞分化的调控机制有助于预防肥胖的发生。
微小RNA分子(miRNA)是一种内源性的非编码单链小分子RNA,能在转录后水平负性调节基因的表达[2- 3]。研究表明,某些miRNAs参与细胞增殖、分化和凋亡等生理和病理过程[4],且被证实参与脂肪细胞分化的调节,如,miR- 143通过多效生长因子促进3T3-L1脂肪细胞分化[5];miR- 17- 92簇通过负性调节肿瘤抑制蛋白Rb2/p130促进3T3-L1细胞分化[6];miR- 375通过抑制ERK1/2的磷酸化水平来促进3T3-L1脂肪细胞分化[7];miR- 27a和miR- 27b抑制3T3-L1脂肪细胞分化,但miR- 202是否影响脂肪细胞分化,尚不清楚。
1 材料与方法
1.1 材料
3T3-L1前脂肪细胞系和293T细胞系(上海中科院细胞库);大肠杆菌菌株(TaKaRa公司);DMEM培养基、胰蛋白酶和胎牛血清(FBS)(Gibco公司),分化诱导剂1-甲基-3-异丁基黄嘌呤(1-methyl-3-isobuthylxanthine,IBMX)、油红O染色试剂(Sigma公司)。反义miRNA寡核苷酸-miR- 202(AMO-miR- 202,anti-miRNA oligonucleotide-miR- 202)及乱序对照物、慢病毒包装质粒(Gene copoeia公司);PCR扩增试剂盒(北京天为时代公司);羊抗小鼠aP2(apetala2)多克隆抗体、羊抗小鼠氧化物酶体激活增殖受体γ2(peroxisome proliferator-activeted receptor γ2,PPARγ2)多克隆抗体和兔抗小鼠PPARγ辅助活化因子1β(peroxisome proliferator-activeted receptor γ coactivator 1β,PGC1β)多克隆抗体(Santa Cruze公司);PPARγ2和aP2引物由在线软件primer5设计,上海生工生物工程公司合成,Pubmed验证。
1.2 方法
1.2.1 细胞培养:将3T3-L1和293T细胞置于含10%胎牛血清的DMEM培养基中,于37 ℃和5% CO2培养箱静置培养。当细胞汇合度达80%以上时,可进行1∶2传代或冻存细胞。
1.2.2 慢病毒包装:将293T细胞接种于细胞培养皿,37 ℃、5% CO2培养箱内培养,待细胞汇合达 70%~80%时用于转染。在2个新EP管里加入50 μL基础DMEM培养基(无FBS和P/S),加入10.5 μg DNA,在其中一个EP管里加入50 μL基础DMEM培养基及21 μL脂质体,混匀,室温下孵育5 min。将两个EP管溶液混匀,室温下孵育15 min。在混合液中加入1 mL新鲜DMEM培养基(含FBS和P/S),混匀,加入293T细胞和3 mL新鲜DMEM培养基,混匀。孵育2 h,加入4 mL新鲜DMEM。孵育10 h弃去培养基,向培养皿里加入10~14 mL新鲜DMEM。孵育48~72 h后,收集培养液于离心管中,1 500 r/min离心20 min。将含AMO-miR- 202和乱序对照质粒的病毒分装500~1 000 μL EP管,保存在-80 ℃。
1.2.3 慢病毒液感染3T3-L1前脂肪细胞:将3T3-L1前脂肪细胞于6孔板中培养至20%~30%汇合度时,在EP管里分别加入含AMO-miR- 202、乱序对照miRNA的病毒液、新鲜DMEM(含FBS、P/S)和Polybrene(病毒液:DMEM=1∶1~4∶1,Polybrene为总体积的1∶2 000),混匀。移去6孔板中原有DMEM,并加入EP管中混合物,混匀。孵育12 h后,加入1 mL新鲜DMEM。在第24 h,加入1~1.5 mL新鲜DMEM。在36~48 h,将6孔板中原有培养液弃去,换成新鲜DMEM。孵育至72 h,在荧光显微镜下观察绿色荧光的强度进行转染效率的判断。
1.2.4 油红O染色:分别将上述3组诱导分化至第9天的细胞,PBS洗涤3次(每次5 min),加入60%异丙醇室温下固定15 min,随后加入油红O染色液,染色10 min后蒸馏水冲洗3次,每次1 min。染色后显微镜下观察拍照,分析3T3-L1前脂肪细胞分化率。
1.2.5 RT-PCR检测PPARγ2和aP2的mRNA表达:实验结束时,用Trizol处理细胞,按照说明书提取RNA、反转录合成cDNA,进行PCR扩增。PPARγ2上游引物:5′-CCTTGCTGTGGGGATGTCTC-3′,下游引物:5′-GCCACCTCTTTGCTCTGCTC-3′(319 bp);aP2上游引物:5′-AACACCGAGATTTCCTTCAA-3′,下游引物:5′-TCACGCCTTTCATAACACAT-3′(193 bp);β-actin上游引物:5′-TTCTACAATGAGCTGCGTGTG GC-3′,下游引物:5′-CTCATAGCTCTTCTCCAGGG AGGA-3′(457 bp)。PCR反应条件为:95 ℃ 5 min;94 ℃ 1 min;58 ℃ 30 s;72 ℃ 30 s(35个循环);72 ℃ 7 min。反应结束后,各取产物5 μL,1.2%琼脂糖凝胶电泳(60~80 v,60~90 min),用全自动凝胶分析系统吸光度扫描分析,结果用3个样本的平均相对单位表示。分析各组目的产物及β-actin吸光度值,以二者比值代表目的产物表达量。
1.2.6 miR- 202靶基因预测:通过以下3个生物学预测网站(TargetScan:http://www.TargetScan.org;miRanda:http://www. miRanda.org;miRBase:http://microna.sanger.ac.uk)寻找miR- 202靶基因。
1.2.7 Western blot检测脂肪细胞PGC1β(peroxisome proliferaters activated receptor-γ-coactivator-1)、aP2和PPARγ2蛋白的表达:提取各组细胞蛋白进行蛋白定量后,取蛋白样品30 μg进行电泳, 转膜和封闭、加入抗PPARγ2、aP2和PGC1β抗体孵育,洗涤后加入辣根过氧化酶标记的二抗,孵育,充分洗涤后与ECL化学发光试剂反应,曝光后扫描,用图像分析软件进行吸光度值分析。
1.3 统计学分析
2 结果
2.1 构建稳定表达AMO-miR- 202和乱序对照miRNA细胞系
2.1.1 慢病毒包装:AMO-miR- 202组和乱序对照组6孔板中的293T细胞,经慢病毒包装过程,在第48~72 h,80%~90%细胞可见荧光,说明慢病毒包装效率高(图1)。
2.1.2 慢病毒液成功感染3T3-L1前脂肪细胞:在第72 h,70%~80%细胞可见荧光,说明病毒感染细胞效率高,成功构建稳定表达AMO-miR- 202、乱序对照miRNA的3T3-L1前脂肪细胞系(图2)。
2.2 miR- 202对3T3-L1前脂肪细胞分化的影响
诱导分化第9天,3组细胞均被油红O染成亮红色,可见较大脂滴,呈典型的脂肪细胞表型,但AMO-miR- 202组红色细胞脂滴明显少于其他2组。
miR- 202对PPARγ2和aP2的mRNA表达影响: 经RT-PCR实验发现:AMO-miR- 202组PPARγ2、aP2的表达显著低于乱序对照组和正常脂肪细胞组(图3)。

A.morphology of the cell from AMO-miR- 202 group with microscope; B.morphology of the cell from AMO-miR- 202 group with fluorescence microscope; C.morphology of the cell from random group with microscope; D.morphology of the cell from random group with fluorescence microscope
图1293T细胞慢病毒包装效率分析
Fig1Analysisof293Tcellslentiviruspackageefficiency(×100)

A.morphology of the cell from AMO-miR- 202 group with microscope; B.morphology of the cell from AMO-miR- 202 group with fluorescence microscope; C.morphology of the cell from random group with microscope; D.morphology of the cell from random group with fluorescence microscope
图2病毒感染3T3-L1前脂肪细胞效率分析
Fig2Analysisoflentivirusinfectedwith3T3-L1preadipocytes(×40)
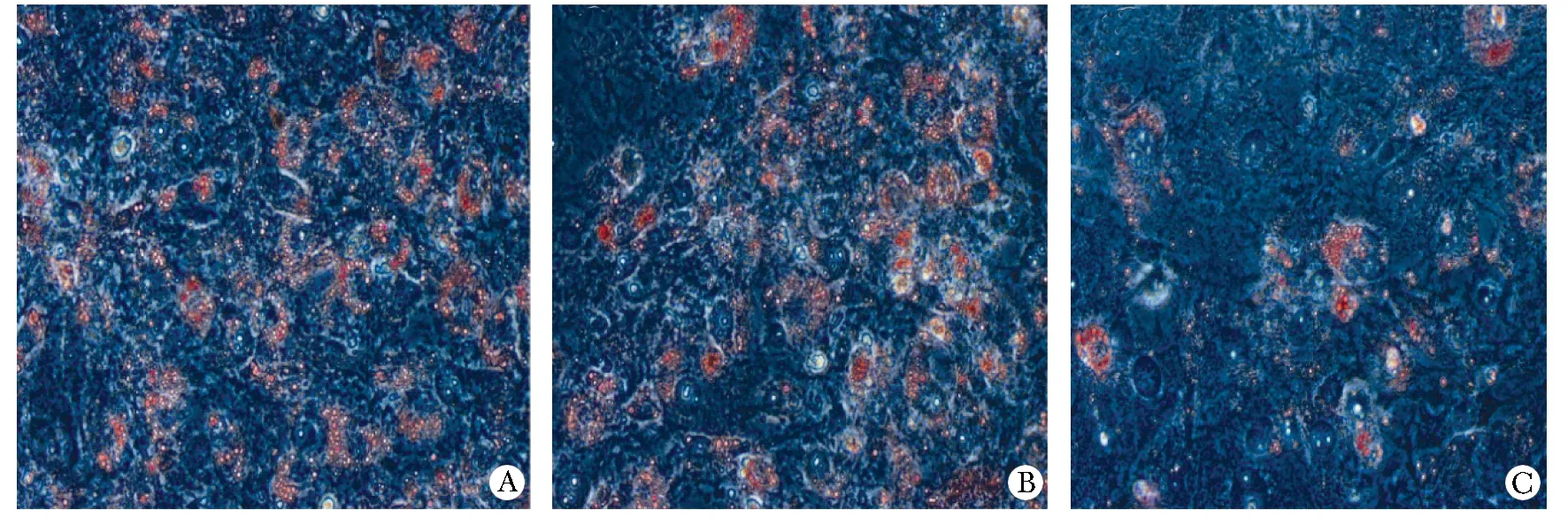
图3 油红O观察miRNA对脂肪细胞内脂滴的影响Fig 3 miRNA influnce droplets in adipocyte cells by Oil Red O staning(×200)
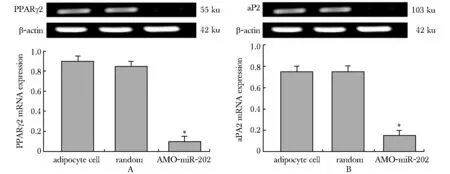
A.mRNA expression of PPARγ2;B.mRNA expression of aP2;*P<0.05 compared with adipocyte cell group图4 miRNA- 202对3T3-L1脂肪细胞PPARγ2和aP2 mRNA表达的影响Fig 4 miRNA- 202 influence PPARγ2 and aP2 mRNA expression of 3T3-L1 preadipocyte cell(±s,n=3)
2.3 miR- 202靶基因预测
综合多个生物信息学预测网站和软件预测结果,寻找miRNA- 202靶基因,取至少两个软件预测到的基因作为靶基因,结果表明PGC1β可能是其靶基因(图4)。
2.4 miR- 202可促进3T3-L1前脂肪细胞分化
与乱序对照组和正常脂肪细胞组相比,AMO-miR- 202组PGC1β蛋白表达显著增加,PPARγ2和aP2蛋白表达显著下降(图5)。

图5 多种靶基因预测软件预测miR- 202潜在靶基因PGC1βFig 5 Biological prediction site to predict the target gene PGC1β of miR- 202

A.expression of PGC1β detected by Western blot; B.expression of PPARγ2 detected by Western blot; C.expression of aP2 detected by Western blot;*P<0.05,**P<0.01 compared with adipocyte cell group

3 讨论
脂肪细胞分化是决定脂肪细胞体积和数目的关键,目前该方面的研究主要侧重于某些药物,对内源性调控基因研究较少。3T3-L1前脂肪细胞是一种具有脂肪细胞分化潜力的细胞系。本实验选择3T3-L1前脂肪细胞系作为脂肪细胞诱导分化模型,并观察内源性miRNA对脂肪细胞分化调控作用。
在前期研究中,发现3T3-L1前脂肪细胞分化过程中miR- 202表达上调,故本实验设计miR- 202的反义核苷酸抑制其表达,观察miR- 202对脂肪细胞分化的影响。将已转染AMO-miRNA- 202和乱序对照序列的3T3-L1前脂肪细胞诱导分化,油红O染色发现细胞被染成亮红色,呈典型脂肪细胞表型,且AMO-miRNA- 202组经油红O染成亮红色脂滴细胞明显少于其他2组;通过RT-PCR检测PPARγ2和aP2的mRNA表达,发现AMO-miR- 202能显著抑制PPARγ2和aP2的mRNA表达水平,提示miR- 202促进3T3-L1前脂肪细胞分化。
为进一步探讨miR- 202促进3T3-L1前脂肪细胞分化的机制,通过软件预测PGC1β可能是miR- 202的靶基因。PGC1β是新发现的与能量代谢关系最密切的一个转录辅助活化因子,主要表达于棕色脂肪组织、骨骼肌和肝脏,参与脂肪细胞分化、糖脂代谢和能量平衡[8],研究表明PGC1β参与了3T3-L1细胞系分化过程[9]。AMO-miR- 202可显著增加PGC1β蛋白表达,降低PPARγ2和aP2蛋白表达,提示 miR- 202可能是通过抑制PGC1β表达,提高aP2和PPARγ2蛋白表达来促进3T3-L1脂肪细胞分化。
[1] Su WL, Kleinhanz RR, Schadt EE. Characterizing the role of miRNAs within gene regulatory networks using integrative genomics techniques[J]. Mol Syst Biol, 2011,7:490- 502.
[2] Mateescu B, Batista L, Cardon M,etal. miR- 141 and miR- 200a act on ovarian tumorigenesis by controlling oxidative stress response[J]. Nat Med, 2011,17: 1627- 1635.
[3] Kovacs B, Lumayag S, Cowan C,etal. microRNAs in early diabetic retinopathy in streptozotocin-induced diabetic rats. Invest[J]. Ophthalmol Visual Sci, 2011, 52:4402- 4409.
[4] Kang M, Yan LM, Li YM,etal.Inhibitory effect of microRNA- 24 on fatty acidbinding protein expression on 3T3-L1 adipocyte differentiation[J]. Genet Mol Res, 2013,12: 5267- 5277.
[5] Yi C, Xie WD, Li F,etal. MiR- 143 enhances adipogenic differentiation of 3T3-L1 cells through targeting the coding region of mouse pleiotrophin[J]. FEBS Lett, 2011,585: 3303- 3309.
[6] Brier AB 1, Loft A 1, Madsen JG,etal.The KDM5 family is required for activation of pro-proliferative cell cycle gene during adipocyte differentiation[J].Nucleic Acids Res, 2017,45:1743- 1759.
[7] Ling HY, Wen GB, Feng SD,etal. MicroRNA- 375 promotes 3T3-L1 adipocyte differentiation through modulation of extracellular signal-regulated kinase signalling[J]. Clin Exp Pharmacol Physiol, 2011,38: 239- 246.
[8] 吉红, 卢荣华, 常志光, 等. 转录辅助活化因子PGC- 1家族的生物学特性及功能[J]. 中国生物化学与分子生物学报, 2010,26:596- 603.
[9] 袁韫聪,朱庆.PGC- 1β基因调控肉鸡腹脂沉积与鸡前体脂肪细胞脂质沉积的分子机制研究[J].四川农业大学学报,2015,12:93- 112.
miR- 202 promotes the differentiation of 3T3-L1 preadipocyteviainhibiting PGC1β expression
WU Di1#, LING Hong-yan1#, CAO Cen2, HE Jian-qin1, YANG Si-si1, ZHANG Kai-fang1, FENG Shui-dong3*
(1. Dept. of Physiology; 2.Dept. of Endocrinology,the Second Hospital of University of South China;3.Dept. of Social Medicine and Health Service Management,University of South China,Hengyang 421001,China)
ObjectiveTo explore the effect and molecular mechanism of miR- 202 on the differentiation of 3T3-L1 preadipocyte.MethodsThrough lentivirus infected with 3T3-L1 preadipocytes, we set up the AMO-miR- 202 group and the random control group, then, these cells were induced to differentiate, nine days later, differentiation was assessed by Oil Red O staining and we examined the mRNA expression of PPARγ2 and aP2 by RT-PCR method.We examined the mRNA expression of PPARγ2,aP2 and PGC1β by Western blot method.ResultsAfter packaging lentivirus with AMO-miR- 202 and random sequence control miRNA through cell line 293T, 80%-90% cells with fluorescence were found under fluorescence microscope; After these two lentivirus respectively infected with 3T3-L1 preadipocytes, About 70%-80% cells with fluorescence were found under fluorescence microscope.Oil Red O staining test showed that these cells with Oil Red O stained bright red fat droplets of AMO-miR- 202 group and PPARγ2 and aP2 mRNA expression in the AMO-miR- 202 group significantly lower than control groups (P<0.05).Western blot assay showed that the protein expression of PGC1β in the AMO-miRNA- 202 group was significantly increased(P<0.05), but the expression of aP2 and PPARγ2 was significantly decreased (P<0.01). However, the random control group and the adipocyte group had no significant effect on the above indexes.ConclusionsmiR- 202 can promote the differentiation of 3T3-L1 preadipocyte by inhibiting the protein expression of PGC1β and improving the protein expression of PPARγ2 and aP2.
miR- 202;3T3-L1 preadipocyte;adipocyte differentiation;PGC1β
2016- 12- 05
2017- 05- 05
教育部留学归国基金[教外司留(2014)1685];湖南教育厅基金(16C1411);衡阳市科技局基金(2016KJ64)
*通信作者(correspondingauthor):shuidong_f@hotmail.com
#对本文有相同贡献
1001-6325(2018)01-0063-06
R335+.9
A

