慢性阻塞性肺疾病大鼠肺组织中肺表面活性物质蛋白-C表达下降
张 伟,王煜霞,朱认真,姬明丽
(新乡医学院 基础医学院,河南 新乡 453003)
研究论文
慢性阻塞性肺疾病大鼠肺组织中肺表面活性物质蛋白-C表达下降
张 伟,王煜霞,朱认真,姬明丽*
(新乡医学院 基础医学院,河南 新乡 453003)
目的探讨肺表面活性物质蛋白-C(SP-C)在慢性阻塞性肺疾病(COPD)大鼠肺组织中的作用。方法将大鼠随机分为对照组、香烟烟雾暴露组、脂多糖组和COPD组,每组10只。测定各组大鼠的PaO2和PaCO2的水平;透射电镜观察肺组织的细胞微观结构;ELISA检测支气管肺泡灌洗液(BALF)和肺组织SP-C蛋白;RT-qPCR检测肺组织SP-C mRNA的表达。结果与其他组相比,COPD大鼠的PaO2最低,而PaCO2最高;肺泡Ⅱ型上皮细胞表面微绒毛明显减少(P<0.01);BALF和肺组织中SP-C蛋白表达下降(P<0.01);肺组织中的SP-C mRNA表达下降(P<0.01)。结论SP-C在COPD大鼠肺组织中表达下调,这种下调可能引起肺通气和肺换气功能障碍。
慢性阻塞性肺疾病;表面活性物质蛋白-C;呼吸功能
慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD),其发生与慢性气道炎性反应增强有关,是以持续进行性气流受限为特征的呼吸系统疾病,患者可表现为咳嗽、咳痰、喘息及滞痰等[1- 2]。炎性反应、吸入气中的颗粒物质及有害成分是已经明确的危险因素,目前研究较多的是香烟烟雾和炎性刺激在慢阻肺发病机制中的作用[3- 4]。肺表面活性物质(pulmonary surfactant,PS)由约90%磷脂和约10%蛋白质组成,位于肺泡上皮细胞表面[5]。PS可降低肺泡表面张力、抑制炎性反应、结合和破坏气道上的微生物,通过肺泡巨噬细胞以及与内源性和外源性分子结合增加吞噬作用[5]。肺表面活性物质蛋白C(surfactant protein C,SP-C)是肺表面活性蛋白之一,对髓磷脂合成和表面活性物质形成不可缺少,在肺表面活性物质的功能发挥起着关键作用[6]。因此,本研究采用香烟烟雾暴露及脂多糖气管内滴注方法构建的COPD模型为实验对象,探讨SP-C改变对呼吸功能的影响及机制,以期为慢阻肺的临床防治提供可行的思路与依据。
1 材料与方法
1.1 材料
香烟为红旗渠牌过滤嘴香烟(每支含焦油量12 mg、尼古丁0.9 mg、CO 15 mg,由河南中烟工业有限公司出品);LPS(Sigma公司);4%水合氯醛(上海芸强化工有限公司);SP-C酶联检测试剂盒(北京中杉金桥生物技术有限公司);Trizol、SuperScript Ⅲ反转录试剂盒(Invitrogen公司);SYBR Green Real-time PCR Master Mix试剂盒(TaKaRa公司);引物合成由上海生工生物工程公司完成。
1.2 方法
1.2.1 实验动物及分组:CV(conventional,CV)级SD大鼠40只 [郑州大学实验动物中心;合格证号:Scxk(豫)2010- 0002] 随机分为4组,对照组;香烟烟雾暴露组(烟雾组):每日烟雾暴露2次,每次30 min,持续暴露28 d;脂多糖组:第1和第14天以1 mg/kg的剂量气管内滴注脂多糖;慢性阻塞性肺疾病模型大鼠组(慢阻肺组):每日烟雾暴露2次,每次30 min,持续28 d,在第1和第14天气管内滴注脂多糖,每次滴注剂量1 mg/kg。第29天,收集动脉血3 mL、支气管肺泡灌洗液5 mL及取出右肺下叶肺组织。
1.2.2 超微结构观察: 肺组织常规制片,置于透射电镜下观察肺泡上皮细胞的变化。
1.2.3 检测PaO2和PaCO2:用M248全自动血气分析仪测大鼠动脉血PaO2和PaCO2值。
1.2.4 ELISA检测肺组织和肺泡灌洗液中SP-C含量:按照相应试剂盒要求操作,样品均做复孔,以DG5031酶联免疫检测仪检测450 nm吸光度值并计算相应蛋白质浓度。
1.2.5 实时荧光定量PCR法检测肺组织SP-C mRNA的表达:以总RNA为模板,利用SuperScript Ⅲ reverse transcriptase合成cDNA,RT-qPCR按照SYBR Green Real-time PCR Master Mix试剂盒的说明操作。SP-C上游引物序列为5′-GAAACTCAGAA ACGCCTCG-3′,下游引物序列为5′-CCCAGAAGAA TCAGAATCGG-3′, 长度285 bp;内参β-actin的上游引物序列为 5′-CGTTGACATCCGTAAAGACCTC-3′,下游引物序列为5′-TAGGAGCCAGGGCAGTAATCT-3′,扩增片段长度为110 bp。采用的RT-qPCR程序如下:95 ℃ 5 min进行预变性;95 ℃ 10 s,60 ℃ 15 s,72 ℃ 20 s,进行40个循环。反应在ABI 7300荧光定量PCR仪上进行,设cDNA样品3次重复。利用2-△△Ct相对定量法计算相对表达量。
1.3 统计学分析
2 结果
2.1 大鼠肺泡Ⅱ型上皮细胞的超微结构
慢阻肺组大鼠的肺泡Ⅱ型上皮细胞表面微绒毛明显减少、板层小体空泡化、线粒体可见肿胀或伴有嵴缺如。烟雾组大鼠的肺泡Ⅱ型上皮细胞表面微绒毛减少、部分板层小体有空泡现象,线粒体形态基本正常、线粒体嵴可见肿胀断裂。脂多糖组大鼠Ⅱ型上皮细胞表面微绒毛基本正常、板层小体未见空泡现象,线粒体形态基本正常、线粒体嵴可见肿胀。对照组大鼠肺泡Ⅱ型上皮细胞板层小体结构和线粒体结构未见异常,细胞完整、表面微绒毛正常(图1)。
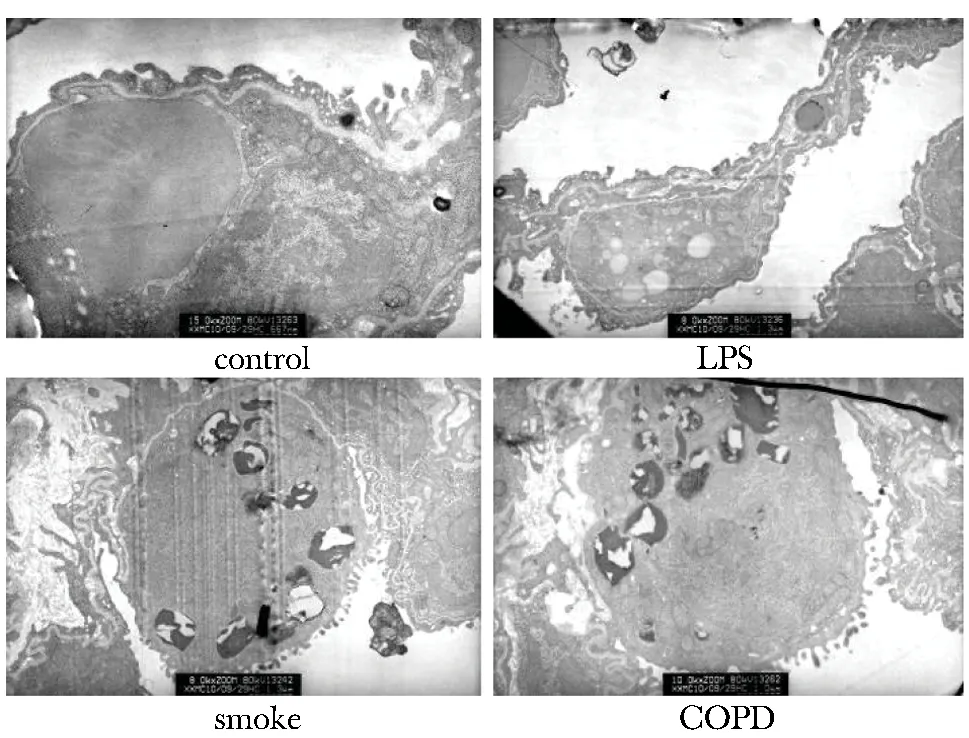
图1 大鼠肺组织细胞透射电镜超微结构Fig 1 Ultrastructure of lung tissues (transmission electron microscopy, ×7000)
2.2 大鼠PaO2和PaCO2
COPD组、烟雾组和脂多糖组大鼠PaO2均低于对照组大鼠,而3个实验组大鼠的PaCO2均高于对照组。COPD组大鼠PaO2低于烟雾组和脂多糖组(P<0.01)(图2)。COPD组大鼠PaCO2与烟雾组和脂多糖组相比,明显升高(P<0.01)(图2)。
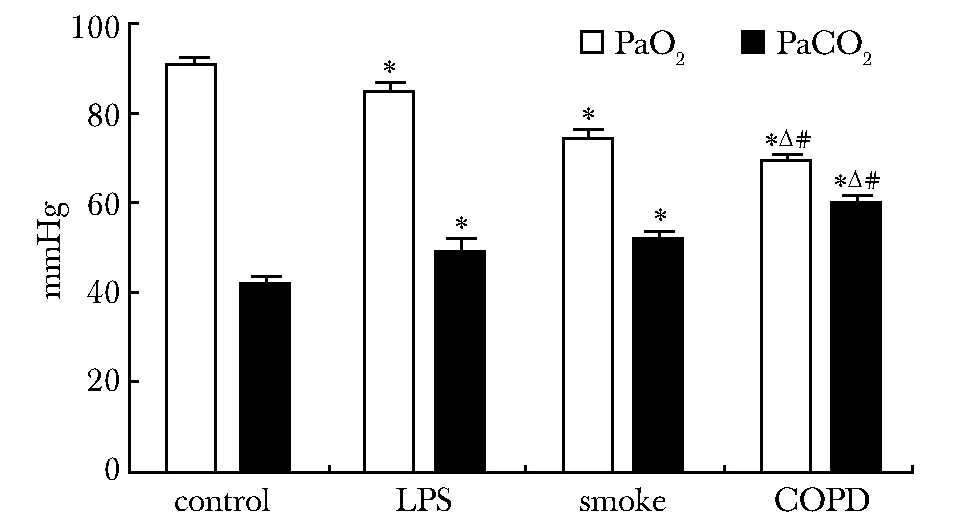
*P<0.01 compared with control; △P<0.01 compared with LPS;#P<0.01 compared with smoke图2 大鼠PaO2和PaCO2的各组比较Fig 2 Comparison of PaO2 and PaCO2
2.3 大鼠支气管肺泡灌洗液和肺组织中SP-C含量
COPD、烟雾组和脂多糖组大鼠BALF和肺组织中SP-C的含量均低于对照组(P<0.01),而COPD组大鼠BALF和肺组织中SP-C的含量又低于烟雾组与脂多糖组(P<0.01)(图3)。
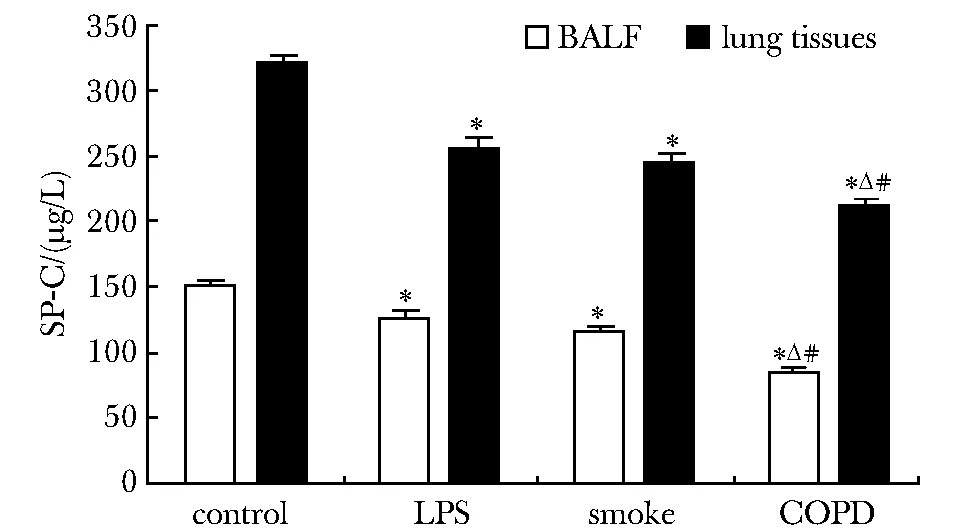
*P<0.01 compared with control; △P<0.01 compared with LPS;#P<0.01 compared with smoke图3 大鼠支气管肺泡灌洗液和肺组织中SP-C含量Fig 3 Content of SP-C in BALF and lung tissues
2.4 大鼠肺组织SP-C mRNA水平
与对照组相比,3个实验组大鼠肺组织中SP-C mRNA的表达水平均下调(P<0.01)。在所有实验组中,COPD组中SP-C的表达量最低,低于烟雾组和脂多糖组(P<0.01)(图4)。

*P<0.01 compared with control; △P<0.01 compared with LPS;#P<0.01 compared with smoke图4 大鼠肺组织中的SP-C mRNA水平比较Fig 4 Change of SP-C mRNA expression in lung
3 讨论
吸烟是引起COPD的主要致病因素。香烟烟雾中含有的丙烯醛等成分会导致呼吸道的防御及净化功能的降低,大大增加呼吸道对细菌的易感性,从而导致支气管及肺的损伤[7]。LPS通过内毒素途径激活巨噬细胞等相关细胞,导致肺内中性粒细胞的产生,触发炎性反应[8]。因此,用熏香烟加气管内注入内毒素的方法建立大鼠COPD模型,探讨SP-C蛋白在慢阻肺病程中的作用。
SP-C蛋白是表面活性物质的重要组成成分,主要功能是维持肺泡表面脂类物质活性,降低肺泡表面张力,维持肺泡顺应性,维持肺泡通气功能[5,9]。生理条件下,SP-C使气血交换加速并促进Ⅱ型肺泡上皮细胞对磷脂的摄取转化。病理条件下,可以减弱血浆蛋白对PS的抑制作用、减轻水肿液对PS的抑制作用、减轻病理因素对肺泡顺应性的损伤作用、稳定呼吸膜的生理活性和功能[10- 12]。在本研究中,慢阻肺组大鼠无论是在支气管肺泡灌洗液中还是肺组织中,SP-C含量是3个实验组中最低的,与之对应的是在各组大鼠肺组织SP-C mRNA水平的比较结果同样显示COPD组的水平最低,这与在COPD组大鼠Ⅱ型肺泡上皮细胞超微结构损伤最严重的结果一致。Ⅱ型肺泡上皮细胞结构的破坏会引起肺泡完整性的破坏和顺应性下降。SP-C表达下降使表面活性物质磷脂层不稳定。肺泡表面形成的气相-液相交换界面不稳定,不利于气血交换,并使肺换气功能下降及肺泡通气量减少。
综上所述,COPD大鼠Ⅱ型肺泡上皮细胞结构损伤,使得SP-C表达下降,导致肺泡表面活性物质减少和肺泡气血交换膜损伤引起肺泡顺应性下降肺泡通气量减少肺通气功能障碍及气血交换障碍肺换气功能障碍等。因此,本研究认为SP-C表达下降是COPD大鼠肺通气和肺换气功能障碍的重要原因之一,也是导致COPD大鼠中低PaO2和高PaCO2的直接原因。
[1] 周新,白春学.慢性阻塞性肺疾病的预防与治疗[M]. 北京:人民卫生出版社, 2009:1- 5.
[2] 张莉, 李金田, 刘永琦, 等. 慢性阻塞性肺疾病大鼠模型病变特点的研究[J]. 四川动物, 2010, 29: 285- 287.
[3] Wedzicha JA, Banerji D, Chapman KR,etal. Indacaterol-glycopyrronium versus salmeterol-fluticasone for COPD [J]. New Eng J Med, 2016, 374: 2222- 2234.
[4] Criner GJ, Bourbeau J, Diekemper RL,etal. Prevention of acute exacerbations of COPD: american college of chest physicians and canadian thoracic society guideline [J].Chest, 2015, 147:894- 942.
[5] Wert SE, Whitsett JA, Nogee LM. genetic disorders of surfactant dysfunction [J]. Pediatr Dev Pathol, 2009, 12:253- 274.
[6] 韩笑, 尹晓娟. 肺表面活性物质蛋白C研究新认识[J]. 中国儿童保健杂志, 2015, 23: 49- 51.
[7] Wright JL, Churg A. A model of tobacco smoke-induced airflow obstruction in the guinea pig [J]. Chest, 2002, 121:188S- 191S.
[8] Vernooy JH, Dentener MA, van Suylen RJ,etal. Long-term intratracheal lipopolysaccharide exposure in mice results in chronic lung inflammation and persistent pathology [J]. Am J Resp Cell Mol, 2012, 26:152- 159.
[9] Roldan N, Goormaghtigh E, Pérezgil J,etal. Palmitoylation as a key factor to modulate SP-C-lipid interactions in lung surfactant membrane multilayers[J]. BBA-Biomembranes, 2014, 1848:184- 191.
[10] Degiulio JV, Kaufman CD, Dean DA. The SP-C promoter facilitates alveolar type Ⅱ epithelial cell-specific plasmid nuclear import and gene expression [J]. Gene Therapy, 2010, 17: 541- 549.
[11] Sato A, Ikegami M. SP-B and SP-C containing new synthetic surfactant for treatment of extremely immature lamb lung [J]. PLoS One, 2012, 7:e39392. doi: 10.1371/journal.pone.0039392.
[12] Deng FT, Ouyang WX, Ge LF,etal. Expression of lung surfactant proteins SP-B and SP-C and their modulating factors in fetal lung of FGR rats [J]. J Huazhong U Sci-Med, 2015, 35:122- 128.
Decreased expression of surfactant protein C in lung tissue of chronic obstructive pulmonary disease rats
ZHANG Wei, WANG Yu-xia, ZHU Ren-zhen, JI Ming-li*
(School of Basic Medical Sciences, Xinxiang Medical University,Xinxiang 453003, China)
ObjectiveTo study the role of surfactant protein C (SP-C) in rat lung of chronic obstructive pulmonary disease (COPD).MethodsForty healthy conventional Sprague-Dawley (SD) rats were randomly divided into four groups, normal control group (control group), smoke exposure group (smoking group), lipopolysaccharide group (LPS group), smoke exposure + Lipopolysaccharide group (COPD group). The arterial partial pressure oxygen (PaO2) and arterial partial pressure of carbon dioxide pathological (PaCO2) were detected. The ultrastructure of lung tissue was observed by transmission electron microscope. Enzyme-linked immuno sorbent assay (ELISA) were performed to determine protein expression of SP-C in lung and bronchoalveolar lavage fluid (BALF). RT-qPCR were performed to determine mRNA expression of SP-C in lung.ResultsCompared with control group, smoking group and LPS group, the PaO2of COPD group was obviously lower, the PaCO2of COPD group was obviously higher; the ultrastructure and histological analysis of lung tissues showed chronic inflammatory injury; Compared with control group, the expression of SP-C protein in was reduced, as well as SP-C mRNA expression.ConclusionsThe expression of SP-C in lung of rats COPD model is down-regulated. SP-C may be involved in COPD.
chronic obstructive pulmonary disease; surfactant protein C; respiratory function
2016- 11- 08
2017- 03- 27
河南省科技厅基础与前沿技术研究计划(132300410160);河南省科技厅科技攻关研究计划(162102310121);新乡医学院高学历人才启动基金(505001)
*通信作者(correspondingauthor):teachermingliji@163.com
1001-6325(2018)01-0047-04
R994.6
A

