RCAN1在恶性肿瘤中的研究进展
江 莹 综述 刘宝刚 审校
RCAN1在恶性肿瘤中的研究进展
江 莹 综述 刘宝刚 审校
钙调神经磷酸酶调节蛋白(Regulator of calcineurin 1,RCAN1)作为与钙调神经磷酸酶(Calcineurin,CaN)发生相互作用的内源性蛋白,在许多恶性肿瘤细胞中广泛表达,如小细胞肺癌、甲状腺癌、白血病、肝癌、恶性胶质细胞瘤、子宫内膜腺癌等。近年来研究显示,当RCAN1呈高表达状态时,可以通过多种途径来抑制肿瘤的增殖、分化、侵袭和转移,从而抑制肿瘤的进展。这些研究结果对患者的生存期和预后评估有着重要的指导作用,并对恶性肿瘤的治疗和干预奠定了一定的理论基础。
RCAN1;恶性肿瘤;进展
早在20世纪90年代,人们最开始发现钙调神经磷酸酶调节蛋白(Regulator of calcineurin 1,RCAN1)的长期过量表达与唐氏综合征(Down′s syndrome,DS)的发病有关,并且它是导致DS患者智力障碍的原因之一[1-2]。随着不断的研究发现,RCAN1还与许多其他疾病的发生发展相关,例如,在阿尔茨海默病患者的脑组织中RCAN1的表达是过量的[3];而过表达的RCAN1却可以防止心肌细胞的肥大[4],也会减少胰岛素的分泌[5]。然而,近年来RCAN1与恶性肿瘤的关系成为研究热点,它作为与钙调神经磷酸酶(Calcineurin,CaN)相互作用的内源性蛋白[6],已被证实可以通过抑制CaN-NFAT通路、调节NF-κB活性及VEGF的旁分泌等多种途径来影响恶性肿瘤的增殖、分化、侵袭和转移[7-8]。因此,RCAN1已被视为抗肿瘤的靶基因[9]。本文将对RCAN1在多种恶性肿瘤中的研究进展进行综述。
1 RCAN1的组成
RCAN1蛋白是由RCAN1基因编码的CaN的调节子。RCAN1基因最早是由Fuentes等人在21号染色体21q22.1-22.2区域所发现[1],其基因包括7个外显子和6个内含子,前四个外显子可被选择性剪切,生成不同的mRNA转录产物(图1),其中由外显子1和外显子4编码的转录产物占大部分[7]。RCAN1-1有两个潜在的翻译起始点,可翻译产生两种不同的RCAN1-1蛋白;在外显子4临近5的区域存在一个特殊结构,它可以作为一个启动子,选择性受CaN的应答,转录生成RCAN1-4蛋白[7]。到目前为止,在人类中我们发现RCAN1蛋白家族由三个蛋白组成,分别是RCAN1/MCIP1、ZAKI-4/RCAN1L1/MCIP2以及RCAN1L2/MCIP3,并且它们都能与CaN结合[10]。
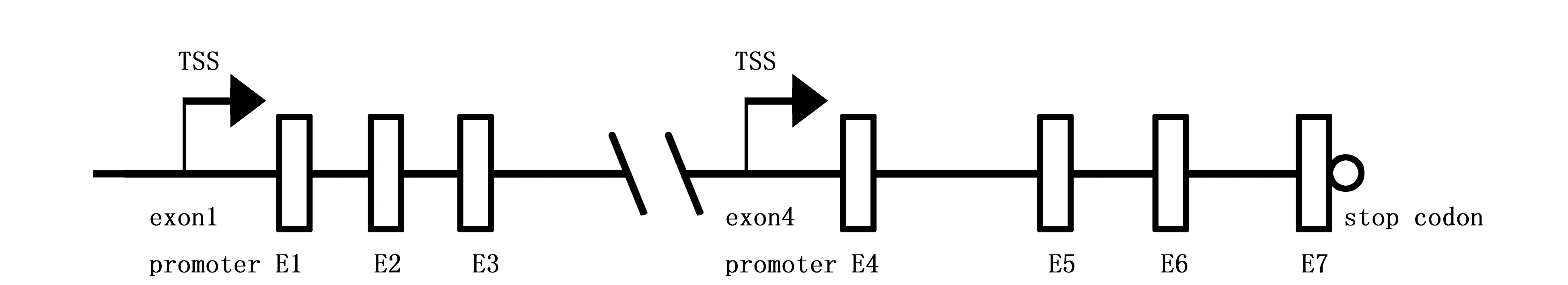
图1 RCAN1基因的基本构成Figure 1 The basic structure of RCAN1
2 RCAN1与肿瘤的研究
2.1 RCAN1与小细胞肺癌
小细胞肺癌(Small cell lung cancer,SCLC)具有早期广泛转移和快速耐药的特点,因此它是一种预后不良的侵袭性肿瘤[11]。其中肺癌发生骨转移概率约占30%~40%[12],而发生骨转移后将对SCLC的治疗增加很大的难度。Miki等[13]发现将人小细胞肺癌骨转移细胞系SBC-5细胞和SBC-3细胞分别通过静脉注射到NK细胞严重缺陷的小鼠体内,结果显示注射了SBC-5细胞的小鼠发生了骨转移,而注射了SBC-3细胞的小鼠没有发生骨转移。Ma等[6]证实SBC-3细胞中RCAN1的表达水平明显高于SBC-5细胞,而SBC-3细胞中的CaN活性显著低于SBC-5细胞,RCAN1表达与CaN活性呈负相关。经免疫组化染色发现,与没有发生骨转移的SCLC组织相比,发生骨转移的SCLC组织中钙调神经磷酸酶的同工酶(CaN Aα)表达水平显著升高。因此CaN被视为一种促癌蛋白,在小细胞肺癌发生骨转移的过程中起促进作用,而RCAN1的过表达则可以抑制骨转移的发生。
2.2 RCAN1与甲状腺癌
曾有报道证实甲状腺癌的生长和转移与RCAN1-4有关。研究发现,应用转移抑制因子(Kiss1基因产物)来处理肿瘤细胞,通过Kiss1转移抑制途径上调RCAN1-4,将会导致RCAN1-4的表达水平显著升高,而RCAN1-4表达程度的高低会直接影响其抑制肿瘤细胞活动性的能力[14]。另有研究者通过建立敲除RCAN1-4基因的皮下异种移植瘤模型实验证实,RCAN1-4基因的缺失会促进肿瘤生长。此外,由微阵列分析显示,NFE2L3是RCAN1-4下游的关键效应元件,其过表达将成为RCAN1-4介导的肿瘤生长和侵袭的独立危险因素。而在TCGA癌症基因样本库中,NFE2L3在甲状腺癌及其远处转移组织中的表达水平均较正常组织高。为了研究NFE2L3在体外异种移植瘤中表达是否上调,应用免疫组化法将异种移植瘤和肺转移组织切片用NFE2L3抗体染色,结果发现体内外数据一致,即NFE2L3的表达随着RCAN1-4的降低而呈现增加的趋势。由此可见,RCAN1-4是一种甲状腺癌生长和转移的抑制因子[15]。
2.3 RCAN1与白血病
在人类白血病等血液系统肿瘤中可通过多种机制实现典型和非经典的NF-κB活化[16-17]。NF-κB的组成性活化通常来自NF-κB基因的重排和突变或者对信号通路中上游基因进行编码[18-19]。被激活的NF-κB会抗白血病细胞凋亡,有人发现高表达的RCAN1能与NF-κB的抑制因子IκBα发生相互作用,并减少IκBα在第42位络氨酸的磷酸化,从而导致NF-κB的失活,NF-κB信号传导被抑制后可有效地控制白血病的进展[8,20]。在Kazuaki等[21]的研究中发现,在对糖皮质激素(Glucocorticoid,GC)敏感的白血病细胞系Nalm-6中,选用仅在GC敏感型细胞中被上调的两个基因FKBP5和RCAN1,并将其通过同源重组破坏,结果显示FKBP5的破坏对GC诱导的细胞凋亡具有深包质边缘化影响,而RCAN1的破坏则导致了细胞对GC的显著抗性。此外,RCAN1的过表达还可使细胞对地塞米松的敏感性增加。这些研究表明RCAN1的过表达不仅抑制了白血病的进展,而且是应用糖皮质激素来诱导淋巴细胞凋亡的重要介质。
2.4 RCAN1与肝癌
Jin等[22]通过Affymetrix HG-U133 Plus 2.0阵列比较了14例肝细胞癌(Hepatocellular carcinoma,HCC)患者的癌组织与癌旁组织中RCAN1基因表达情况,并且收集了108例HCC患者的癌组织和癌旁组织进行实时定量荧光PCR检测和免疫组化分析,两个实验结果均显示与癌旁组织相比,HCC组织中RCAN1-4水平显着降低,低水平的RCAN1-4与肿瘤分期、分化程度、肿瘤体积以及血管浸润呈显著正相关。Kaplan-Meier生存分析显示,低表达RCAN1-4的HCC患者比高表达RCAN1-4的患者生存时间更短,并且更容易复发。在体外实验中,过表达的RCAN1-4可以通过抑制NFAT1中的CaN活性和核移位来显著降低肿瘤的增殖、转移及侵袭活性[23]。在动物模型中,高表达RCAN1-4的HCC细胞与对照组相比形成的异种移植肿瘤病灶相对较小,肿瘤血管生成较少,远处转移的机率也明显降低[24]。
2.5 RCAN1与恶性神经胶质瘤
神经胶质瘤是中枢神经系统中最常见的肿瘤[25],WHO根据其恶性程度分为四级(Ⅰ~Ⅳ)[26-27]。在治疗上,尽管可以联合手术、化疗和放疗等方法,但其预后仍不尽人意[28-29]。近年来已有研究表明RCAN1可作为经典的NF-κB信号通路中的抑制剂来抑制神经胶质瘤的生长[30]。Chen等[31]的一系列研究进一步证实,神经胶质瘤组织中NF-κB的表达比癌旁组织中显著增加,NF-κB信号通路中涉及的相关蛋白表达水平也明显升高。为了探究胶质瘤中增加的NF-κB信号传导与RCAN1表达的关系,使胶质瘤细胞系U251和T98G分别感染表达RCAN1或阴性对照的慢病毒,经72 h后进行MTT比色法和集落形成实验,结果显示,与阴性对照相比,RCAN1的过表达显著降低了细胞活力(P<0.05),并且降低了集落形成效率(P<0.05)。将感染了表达RCAN1的慢病毒的胶质瘤细胞进行TUNEL染色后进一步发现,RCAN1的过表达是通过诱导细胞凋亡,而不是阻止细胞周期来抑制细胞活力的。潜在的机制为过表达的RCAN1可以抑制NF-κB蛋白的核移位以及NF-κB的转录活性,从而影响NF-κB信号通路的活性。
2.6 RCAN1与子宫内膜腺癌
增加PGF2α-FP受体信号转导,能够促进子宫内膜腺癌的血管生成和微环境的调节,从而加速肿瘤生长[32-33]。在分化差的子宫内膜腺癌中IL-11的表达活跃,并经实验证明IL-11的表达和释放是通过PGF2α-FP受体激活Gq-PKC-calcium-CaN-NFAT信号通路进行调控的。那么,RCAN1作为CaN-NFAT信号传导通路中的抑制因子,其在子宫内膜腺癌中的作用是值得探究的。应用RT-PCR和Western印迹法对稳定转染FP受体的高分化子宫内膜腺癌细胞中的IL-11分泌进行定量分析,结果表明,与对照组相比,在过表达RCAN1-4的FPS细胞中,由PGF2α-FP受体介导的IL-11mRNA的表达水平和蛋白质的分泌均显著降低。由此可见,RCAN1-4是子宫内膜腺癌中IL-11表达的负调节因子。在此基础上进一步对RCAN1-4进行定量RT-PCR分析得知,与正常增殖期子宫内膜相比,高分化腺癌中的RCAN1-4表达水平较低分化者明显升高,并且与肿瘤分级呈负相关[34]。
3 小结与展望
近年来,RCAN1已被公认为肿瘤相关因子,并成为肿瘤界的关注焦点之一。RCAN1对多种恶性肿瘤的进展起到调控作用,其表达水平升高将会抑制肿瘤的增殖、分化、侵袭和转移,从而有效抑制恶性肿瘤的进展。这充分说明RCAN1已经成为抗肿瘤治疗的新靶点。但就目前来说,我们仅在有限的几种肿瘤中对其进行研究,而且大多研究仍处于体外动物实验阶段,作用机制也尚未完全明确,因此我们需要进一步研究RCAN1在其他肿瘤中所起到的作用、机制及临床意义。相信在不久的将来,我们会发现更多的功能和机理,这将对肿瘤的全面研究、治疗以及评估预后提供科学依据有着不可忽视的临床意义。待相关药物研究成熟后,必然将对恶性肿瘤的治疗指明新的方向。
1 Fuentes JJ,Pritchard MA,Planas AM,et al.A new human gene from the down syndrome critical region encodes a proline-rich protein highly expressed in fetal brain and,heart[J].Hum Mol Genet,1995,4(10):1935.
2 Patel A,Yamashita N,Ascao M,et al.RCAN1 links impaired neurotrophin trafficking to aberrant development of the sympathetic nervous system in down syndrome[J].Nat Commun,2015,6:10119.
3 Wong H,Levenga J,Cain P,et al.RCAN1 overexpression promotes age-dependent mitochondrial dysregulation related to neurodegeneration in Alzheimer′s disease[J].Acta Neuropathol,2015,130(6):829-843.
4 Torac E,Gaman L,Atanasiu V.The regulator of calcineurin(RCAN1)an important factor involved in atherosclerosis and cardiovascular diseases development[J].J Med Life,2014,7(4):481-487.
5 Peiris H,Raghupathi R,Jessup CF,et al.Increased expression of the glucose-responsive gene,RCAN1,causes hypoinsulinemia,β-cell dysfunction,and diabetes[J].Endocrinology,2012,153(11):5212-5221.
6 Ma N,Shen W,Pang H,et al.The effect of RCAN1 on the biological behaviors of small cell lung cancer[J].Tumour Biol,2017,39(6):1010428317700405.
7 马宁强,陈连宏,张贺龙,等.内源性CaN蛋白抑制剂RCAN1在肿瘤中的作用[J].现代肿瘤医学,2011,19(9):1866-1869.
8 Lu M,Zheng L,Han B,et al.Rest regulates dyrk1a transcription in a negative feedback loop[J].J Biol Chem,2011,286(12):10755-10763.
9 Xing L,Salas M,Zhang H,et al.Creation and characterization of BAC-transgenic mice with physiological overexpression of epitope-tagged RCAN1,(DSCR1)[J].Mammalian Genome,2013,24(1/2):30-43.
10 Kim SS,Jang SA,Su RS.CREB-mediated Bcl-2 expression contributes to RCAN1 protection from hydrogen peroxide-induced neuronal death[J].J Cell Biochem,2013,114(5):1115-1123.
11 Taromi S,Kayser G,Catusse J,et al.CXCR4 antagonists suppress small cell lung cancer progression[J].Oncotarget,2016,7(51):85185.
12 Pang H,Ma N,Jiao M,et al.The biological effects of dickkopf1 on small cell lung cancer cells and bone metastasis[J].Oncol Res,2017,25(1):35-42.
13 Miki T,Yano S,Hanibuchi M,et al.Bone metastasis model with multiorgan dissemination of human small-cell lung cancer(SBC-5)cells in natural killer cell-depleted SCID mice[J].Oncol Res,2000,12(5):209-217.
14 Stathatos N,Bourdeau I,Espinosa AV,et al.KiSS-1/G protein-coupled receptor 54 metastasis suppressor pathway increases myocyte-enriched calcineurin interacting protein 1 expression and chronically inhibits calcineurin activity[J].J Clin Endocrinol Metab,2005,90(9):5432-5440.
15 Wang C,Saji M,Justiniano SE,et al.RCAN1-4 is a thyroid cancer growth and metastasis suppressor[J].JCI Insight,2017,2(5):e90651.
16 Santos NRD,Ghezzo MN,Silva RCD,et al.NF-κB in T-cell acute lymphoblastic leukemia:oncogenic functions in leukemic and in microenvironmental cells[J].Cancers(Basel),2010,2(4):1838-1860.
17 Safa M,Tavasoli B,Manafi R,et al.Indole-3-carbinol suppresses NF-κB activity and stimulates the p53 pathway in pre-B acute lymphoblastic leukemia cells.[J].Tumour Biol,2015,36(5):3919-3930.
18 Savva CG,Totokotsopoulos S,Nicolaou KC,et al.Selective activation of TNFR1 and NF-κB inhibition by a novel biyouyanagin analogue promotes apoptosis in acute leukemia cells[J].BMC Cancer,2016,16(1):279.
19 Savl H,Akkoyunlu RU,Çine N,et al.Deregulated levels of the NF-κB1,NF-κB2,and rel genes in ukrainian patients with leukemia and lymphoma in the post-chernobyl period[J].Turk J Haematol,2016,33(1):8-14.
20 Bosman MC,Schuringa JJ,Vellenga E.Constitutive NF-κB activation in AML:Causes and treatment strategies.[J].Crit Rev Oncol Hematol,2016,98:35-44.
21 Kazuaki N,Yujiro I,Toshiyuki M.RCAN1 is an important mediator of glucocorticoid-induced apoptosis in human leukiemic cells[J].PLoS One,2012,7(11):e49926.
22 Jin H,Wang C,Jin G,et al.Regulator of calcineurin 1 Gene isoform 4,downregulated in hepatocellular carcinoma,prevents proliferation,migration,and invasive activity of cancer cells and growth of orthotopic tumors by inhibiting nuclear translocation of NFAT1[J].Gastroenterology,2017[Epub ahead of print].
23 Zucman-Rossi J,Villanueva A,Nault JC,et al.Genetic landscape and biomarkers of hepatocellular carcinoma[J].Gastroenterology,2015,149(5):1226-1239.
24 Kawahara T,Kashiwagi E,Ide H,et al.Cyclosporine A and tacrolimus inhibit bladder cancer growth through down-regulation of NFATc1[J].Oncotarget,2015,6(3):1582.
25 Kepes JJ,Rubinstein LJ.Malignant gliomas with heavily lipidized(foamy)tumor cells:a report of three cases with immunoperoxidase study.[J].Cancer,2015,47(10):2451-2459.
26 Vaccaro V,Fabi A,Vidiri A,et al.Activity and safety of bevacizumab plus fotemustine for recurrent malignant gliomas.[J].Biomed Res Int,2014,2014(1):351252.
27 Tabatabaei P,Visse E,Bergström P,et al.Radiotherapy induces an immediate inflammatory reaction in malignant glioma:a clinical microdialysis study[J].J Neurooncol,2017,131(1):83-92.
28 Muroski ME,Morshed RA,Cheng Y,et al.Controlled payload release by magnetic field triggered neural stem cell destruction for malignant glioma treatment[J].PLoS One,2016,11(1):e0145129.
29 Mccowage GB,Friedman HS,Moghrabi A,et al.Activity of high‐dose cyclophosphamide in the treatment of childhood malignant gliomas[J].Med Pediatr Oncol,2015,30(2):75-80.
30 Yili W,Weihong S.Regulation of RCAN1 translation and its role in oxidative stress-induced apoptosis[J].FASEB J,2013,27(1):208.
31 Chen X,Hu Y,Wang S,et al.The regulator of calcineurin 1(RCAN1)inhibits nuclear factor kappaB signaling pathway and suppresses human malignant glioma cells growth[J].Oncotarget,2017,8(7):12003-12012.
32 Genot JY,Krulik M,Poisson M,et al.Two cases of acute leukemia following treatment of malignant glioma[J].Cancer,2015,52(2):222-226.
33 Byron SA,Loch DC,Pollock PM.Fibroblast growth factor receptor inhibition synergizes with Paclitaxel and Doxorubicin in endometrial cancer cells[J].Int J Gynecol Cancer,2012,22(9):1517-1526.
34 Sales KJ,Grant V,Cook IH,et al.Interleukin-11 in endometrial adenocarcinoma is regulated by prostaglandin F2alpha-F-prostanoid receptor interaction via the calcium-calcineurin-nuclear factor of activated T cells pathway and negatively regulated by the regulator of calcineurin-1[J].Am J Pathol,2010,176(1):435-445.
ResearchprogressofRCAN1inmalignanttumor
JIANGYing,LIUBaogang
Harbin Medical University Cancer Hospital,Harbin 150081,China
Regulation of calcineurin 1(RCAN1),as an endogenous protein that interacts with calcineurin(CaN),widely expresses in many malignant tumor cells,such as small cell lung cancer,thyroid cancer,leukemia,liver cancer,malignant glioma,endometrial adenocarcinoma and so on.In recent years,many studies have been shown that when RCAN1 is highly expressed,it can inhibit tumor proliferation,differentiation,invasion and metastasis by a variety of ways,thereby inhibiting tumor progression.These findings play an important role in the survival and prognosis of patients,and provide a theoretical basis for the treatment and intervention of malignant tumors.
RCAN1;Tumors;Progression
哈尔滨医科大学附属肿瘤医院(哈尔滨 150081)
江莹,女,(1990-),硕士研究生,从事肿瘤内科综合治疗的研究。
刘宝刚,E-mail:liubaogang1962@sina.com
R73
A
10.11904/j.issn.1002-3070.2017.06.015
(收稿:2017-08-03)

