功能磁共振成像在胶质瘤精确诊断中的研究
王 巍 孙 鹏 刘妍姝 李露露 刘志兰 张原理 张毓婧
·临床应用·
功能磁共振成像在胶质瘤精确诊断中的研究
王 巍 孙 鹏 刘妍姝 李露露 刘志兰 张原理 张毓婧
目的应用多种功能磁共振成像对胶质瘤进行评估,术前对脑胶质瘤进行较精准的诊断。方法收集35例经病理诊断证实的胶质瘤患者,均行常规磁共振成像(Magnetic resonance imaging,MRI)及功能MRI检查,对体素内不相干运动扩散加权成像(Intravoxel incoherent motion diffusion weighted imaging,IVIM-DWI)中快速扩散系数(D*)、慢扩散系数(D)、灌注分数(f)和分布扩散系数(DDC)的值进行统计学分析。结果高级别胶质瘤患者病灶侧IVIM的D、D*、DDC值较对侧正常脑白质增高(D:0.71±0.05×10-3mm2/svs.0.14±0.03×10-3mm2/s;D*:0.06±0.04 mm2/svs.0.03±0.02 mm2/s;DDC:1.29±0.33×10-3mm2/svs.0.43±0.14×10-3mm2/s)、f值较对侧正常脑白质降低(f:0.41±0.11vs.0.51±0.05),差异均具有统计学意义(P<0.05)。结论多种磁共振功能成像序列协同分析胶质瘤,可以避免肿瘤的异质性,显著提高了磁共振检查对高级别脑胶质瘤实性部分的识别能力及精确性。
胶质瘤;磁共振成像;体素内不相干运动;三维增强梯度回波T2*血管成像序列;动脉自旋标记灌注成像
胶质瘤是中枢神经系统最常见的原发性肿瘤,2007版WHO标准将其分为Ⅰ~Ⅳ级,其异质性与浸润性生长的特点导致胶质瘤的病理分级与真实级别之间存在一定的差异,也导致患者术后治疗方案的差异,这或许是相同级别胶质瘤患者术后生存期存在差异的重要原因[1-2]。因此精确的胶质瘤术前诊断及分级是决定治疗策略的基础,并能够帮助临床制订合理的治疗计划及判断患者的预后[3-4]。磁共振成像(Magnetic resonance imaging,MRI)因其组织分辨率高、多序列成像及多参数成像的优点,现已成为胶质瘤术前诊断的首选方法。随着MRI的发展,功能MRI在胶质瘤分级及诊断中的应用逐渐增多。本文将应用磁共振功能成像中的动脉自旋标记灌注成像(Arterial spin labeling,ASL)、三维增强梯度回波T2*血管成像序列(Enhanced gradient echo T2 star weighted angiography,ESWAN)、体素内不相干运动扩散加权成像(Intravoxel incoherent motion diffusion weighted imaging,IVIM-DWI)综合对胶质瘤的精确诊断进行评估。
1 对象与方法
1.1 研究对象
收集2014年1月—2016年2月在哈尔滨医科大学附属第一医院神经外科住院的35位胶质瘤患者,进行常规MRI和功能MRI检查,并建立了以下纳入标准:(1)首次发病,未进行治疗;(2)术后经病理诊断证实为胶质瘤;(3)图像无伪影。共入组28位病人,其中男性14人,女性14人;年龄29~71岁,平均为50岁;低级别胶质瘤患者6人,高级别胶质瘤患者22人。本研究经过本院伦理委员会批准及所有患者同意并签署知情同意书。
1.2 图像参数
使用3T GEMRI(GE Singa EXCITE MRI)、标准8通道头颅相控矩阵线圈。
1.2.1 常规MRI T1WI、T2WI、T2FLAIR均进行轴位扫描;使用T1WI序列进行轴位、矢状位、冠状位增强扫描,增强剂用Gd-DTPA,以0.1 mmol/kg注射。
1.2.2 IVIM 利用标准弥散加权自旋回波平面回波成像,TR:4500 ms,TE:113.8 ms,FOV:22 cm×22 cm,层厚4 mm,层数10,采用12个b值(0,10,20,50,100,200,400,800,1200,1600,2400,3000),在三个矢量方向同时施加,采集次数也随着b值增大而增大(b<200采集次数是2,b>200采集次数是4)。IVIM图像在增强后并且隔一段时间再进行扫描,总扫描时间是7分26秒。
1.2.3 3D-pCASL TR:4522 ms,TE:9.8 ms,TI:1525.0 ms,FOV:22 cm×22 cm,层厚4 mm,层数30,NEX=3,扫描时间4 min 22 s。
1.2.4 ESWAN 回波数为8,首个回波TE:4.0 ms,回波间隔约5.1~5.2 ms,TR:4000 ms,翻转角为20°,NEX=0.7,层厚1 mm,层数124,FOV:24 cm×24 cm,扫描时间7 min 32 s。
1.3 图像处理
在GE ADW4.5工作站Functool软件上进行后处理。
1.3.1 对ESWAN进行处理,并在MinIP上显示颅内静脉及出血灶,根据瘤内磁敏感信号强度(ITSS)数目将其分级如下:(1)零级,无ITSS;(2)一级,1~5个点状、线条状ITSS;(3)二级,6~10个点状、线条状ITSS;(4)三级,11个及以上点状、线条状ITSS。
1.3.2 根据ESWAN、ASL及T1WI增强图像,由两个经验丰富的神经放射学医生协商分别在肿瘤及对侧正常白质部取2个ROIs,得出rCBF、D、D*、DDC、f值,ROIs面积为27~35 mm2,在肿瘤的实质部分选取ROIs并尽量避开肿瘤坏死、囊变、出血等区域;其中rCBF=肿瘤实性区最大CBF/对侧半卵圆中心正常脑组织的CBF。
1.4 统计学分析
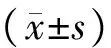
2 结果
2.1 3D-pCASL结果
rCBF值在高级别胶质瘤中的分布范围为1.85 mL/min/100 g~18.32 mL/min/100 g,低级别胶质瘤的rCBF值分布范围为1.77 mL/min/100 g~14.06 mL/min/100 g,由此可见rCBF值在高和低级别胶质瘤中的分布跨度较大,并且范围有交叉,不具有可比性。
2.2 ESWAN的结果
高、低级别胶质瘤组根据TISS数目进行分级,可以发现高级别胶质瘤组的ITSS偏大,但在零级也有分布;低级别胶质瘤组的ITSS在三级也有分布,所以ESWAN的结果不足以区分两组胶质瘤患者(表1)。
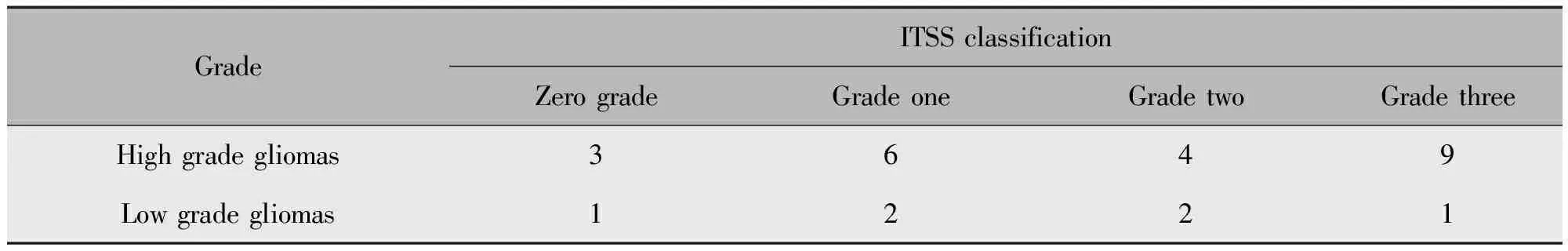
表1 高级别和低级别胶质瘤组ESWAN相位图的ITSS级别分布Table 1 ESWAN functional imaging post-processing phase map minimum intensity projection in high and low grade gliomas distribution based on the ITSS classification
2.3 IVIM结果
在高级别胶质瘤组,病灶侧IVIM各参数值与对侧正常脑白质IVIM各参数值比较均具有统计学意义(P<0.05)。在低级别胶质瘤组,IVIM各参数中,只有D值相较于高级别胶质瘤组的D值偏大(0.48±0.05×10-3mm2/svs.0.14±0.03×10-3mm2/s),但因低级别胶质瘤组入组例数较少未进行统计分析(表2)。
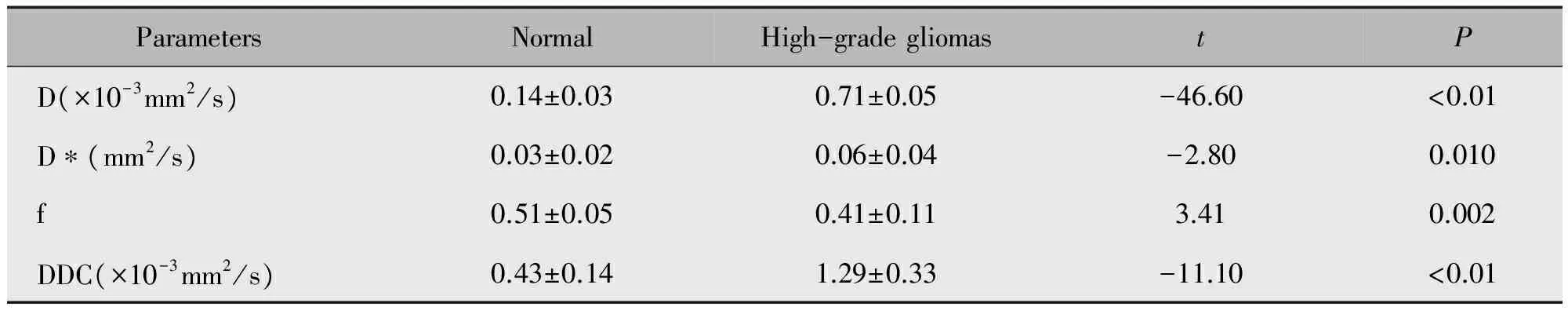
表2 高级别胶质瘤病人病灶侧和对侧正常脑白质IVIM各参数的比较Table 2 Parameters description of IVIM in patients with high-grade gliomas and the contralateral normal brain tissues
3 讨论
常规磁共振成像在区分高、低级别胶质瘤时不够精确,其灵敏度介于55%~83%之间[5]。因此,多种磁共振功能成像方法被应用于脑胶质瘤的精确诊断,这些方法能观察胶质瘤的微观结构信息,如DWI能显示细胞密度[6],但是传统DWI受许多因素的影响,因此IVIM-DWI被提出并应用于胶质瘤诊断分级[7-8]。由于灌注加权成像中非侵入检查方法ASL结果与DCEMRI相似,故被用于胶质瘤分级[9-12]。因为瘤内血管增殖及微出血随着星形细胞肿瘤恶性程度的升高而显著出现,所以我们用ESWAN显示瘤内小血管及微出血灶以根据ITSS数目对其进行分级。单一的功能MRI方法不能够完整的展现出脑肿瘤的结构、功能及分子方面的信息。先前也已有磁共振功能成像在胶质瘤术前分级评估的研究并取得了一些成果,但是由于各种磁共振功能成像技术都有其特殊倾向及不足之处,因此目前大多学者开始认为将多种技术有效结合才是目前精确诊断胶质瘤的趋势[13]。本研究采用3D-pCASL、ESWAN、IVIM多种磁共振功能成像序列对脑胶质瘤的组织信息进行评估。
本研究rCBF值在高和低级别胶质瘤中的分布跨度较大,并且范围有交叉,可能是不同级别肿瘤的增生血管存在一定的差异,在Furtner等[14]的研究也显示了广泛的灌注值在高低级别组中有重叠的灌注范围,这和本研究有一定的相似性。研究者认为出血灶的形成会对IVIM各参数值的测定有一定的影响,高级别胶质瘤通常存在大量血管及出血区域,该区域内富含大量脱氧血红蛋白,在SWI图像上会将其明显呈现出来[15]。ESWAN拥有SWI的特点,可以很好的显示肿瘤内的出血灶及小血管影;使用ESWAN结合ASL以尽量避免出血对IVIM测定的影响,此外,也能以此在血供异常高的区域划定测量区域,更精确的检测IVIM的在高级别胶质瘤的数值。
在对IVIM的D、D*、f、DDC值进行统计分析时,本研究发现高级别胶质瘤组的D、D*、f、DDC值与对侧正常脑组织相比都具有统计学意义。表观弥散系数(ADC)会受肿瘤细胞和血管的影响,在胶质瘤的诊断时受限,D值能消除灌注的影响,或许能更真实的反映出弥散系数[16],本研究中肿瘤实质的D值均高于对侧正常脑白质,这与Castillo等[17]的研究一致。本研究采用13个b值,范围跨度也较大,由于对IVIM所选用b值个数、范围大小没有一个确切的定义,研究结果也不尽相同,因此b值的个数和范围还需进一步的研究。低级别胶质瘤组IVIM的D值为0.48±0.05×10-3mm2/s,与高级别胶质瘤组0.14±0.03×10-3mm2/s相比数值偏大,但因低级别胶质瘤组入组例数较少,未进行统计分析,在接下来的研究中应提高样本量并针对两组不同级别胶质瘤的IVIM各参数进行统计分析。
本研究存在不足之处,首先,入组病例数不足,没有对低级别胶质瘤进行分析,下一步的研究应扩大样本量,完成对低级别胶质瘤组的统计分析并进一步探讨IVIM对不同级别胶质瘤及不同胶质瘤亚型诊断的精确性。其次,本研究采用的是ASL序列、ESWAN序列及T1WI增强图像确定肿瘤实质部分,是否符合病理切片的位置,还需要进一步的证实。因为单独采用某种磁共振功能成像对胶质瘤诊断及分级评估仍存在缺陷,故多种磁共振功能成像联合应用势必是未来的趋势。
综上所述,本研究采用多种磁共振功能成像序列协同分析胶质瘤,可以避免肿瘤的异质性,显著提高了磁共振检查对高级别脑胶质瘤实性部分的识别能力及精确性。
1 Mangla R,Ginat DT,Kamalian S,et al.Correlation between progression free survival and dynamic susceptibility contrast MRI perfusion in WHO grade III glioma subtypes[J].J Neurooncol,2014,116(2):325-331.
2 Hu YC,Yan LF,Wu L,et al.Intravoxel incoherent motion diffusion-weighted MR imaging of gliomas:efficacy in preoperative grading[J].Sci Rep,2014,4:7208.
3 Lin Y,Li J,Zhang Z,et al.Comparison of intravoxel incoherent motion diffusion-weighted MR imaging and arterial spin labeling MR imaging in gliomas[J].Biomed Res lnt,2015,2015:234-245.
4 Bai Y,Lin Y,Zhang W,et al.Noninvasive amide proton transfer magnetic resonance imaging in evaluating the grading and cellularity of gliomas[J].Oncotarget,2017,8(4):5834-5842.
5 Law M,Yang S,Wang H,et al.Glioma grading:sensitivity,specificity,and predictive values of perfusion MR imaging and proton MR spectroscopic imaging compared with conventional MR imaging[J].AJNR Am J Neuroradiol,2003,24(10):1989-1998.
6 Shen N,Zhao L,Jiang J,et al.Intravoxel incoherent motion diffusion-weighted imaging analysis of diffusion and microperfusion in grading gliomas and comparison with arterial spin labeling for evaluation of tumor perfusion[J].J Magn Reson Imaging,2016,44(3):620.
7 Le BD,Breton E,Lallemand D,et al.Separation of diffusion and perfusion in intravoxel incoherent motion MR imaging.[J].Radiology,1988,168(2):497-505.
8 Le BD,Breton E,Lallemand D,et al.MR imaging of intravoxel incoherent motions:application to diffusion and perfusion in neurologic disorders.[J].Radiology,1986,161(2):401-407.
9 Kim HS,Kim SY.A prospective study on the added value of pulsed arterial spin-labeling and apparent diffusion coefficients in the grading of gliomas.[J].AJNR Am J Neuroradiol,2007,28(9):1693-1699.
10 李锐,刘晋红,王玉林,等.三维动脉自旋标记与磁共振动态对比增强成像参数在胶质瘤术前分级中的对照研究[J].肿瘤影像学,2016,25(3):217-222.
11 Wong AM,Feng X Yan MS,et al.Comparison of three-dimensional pseudo-continuous arterial spin labeling perfusion imaging with gradient-echo and spin-echo dynamic susceptibility contrast MRI[J].J Magn Reson Imaging,2014,39(2):427-433.
12 Järnum H,Steffensen EG,Knutsson L,et al.Perfusion MRI of brain tumours:a comparative study of pseudo-continuous arterial spin labelling and dynamic susceptibility contrast imaging[J].Neuroradiology,2010,52(4):307-317.
13 Caulo M,Panara V,Tortora D,et al.Data-driven grading of brain gliomas:a multiparametric MR imaging study[J].Radiology,2014,272(2):494-503.
14 Furtner J,Bender B,Braun C,et al.Prognostic value of blood flow measurements using arterial spin labeling in gliomas[J].PLoS One,2014,9(6):e99616.
15 Di Ieva A,Matula C,Grizzi F,et al.Fractal analysis of the susceptibility weighted imaging patterns in malignant brain tumors during antiangiogenic treatment:technical report on four cases serially imaged by 7 T magnetic resonance during a period of four weeks[J].World Neuro Surg,2012,77(5/6):785.
16 Bai Y,Lin Y,Tian J,et al.Grading of gliomas by using monoexponential,biexponential,and stretched exponential diffusion-weighted MR imaging and diffusion kurtosis MR imaging[J].Radiology,2016,278(2):496-504.
17 Castillo M,Smith JK,Kwock L,et al.Apparent diffusion coefficients in the evaluation of high-grade cerebral gliomas[J].AJNR Am J Neuroradiol,2001,22(1):60-64.
Functionalmagneticresonanceimagingintheaccuratediagnosisofgliomas
WANGWei,SUNPeng,LIUYanshu,LILulu,LIUZhilan,ZHANGYuanli,ZHANGYujing
Department of MRI,The First Affiliated Hospital of Harbin Medical University,Harbin 150001,China
ObjectiveThe aim of this study was to evaluate the glioma using the variety of functional magnetic resonance imaging(fMRI),and to perform a more accurate preoperative diagnosis of gliomas.MethodsThirty-five patients with gliomas confirmed by pathology were examined by magnetic resonance imaging(MRI)and functional MRI.Rapid diffusion coefficient(D*),Slow diffusion coefficient(D),perfusion fraction(f)and distribution diffusion coefficient(DDC)in the intravoxel incoherent motion diffusion weighted imaging(IVIM-DWI)were analyzed statistically.ResultsThe mean values of D*,D,f and DDC in the IVIM sequence of the patients with high-grade of gliomas were statistically significant when compared to the IVIM values of the contralateral normal brain tissues(P<0.05).ConclusionA variety of magnetic resonance functional imaging sequences are used to analyze gliomas,which can avoid tumor heterogeneity and improve the recognition ability and accuracy of magnetic resonance imaging in high grade gliomas.
Gliomas;Magnetic resonance imaging;Intravoxel incoherent motion;Enhanced gradient echo T2 star weighted angiography;Arterial spin labeling.
黑龙江省教育厅科学技术研究项目(12531244)
哈尔滨医科大学附属第一医院磁共振室(哈尔滨 150001)
王巍,女,(1972-),博士,主任医师,从事磁共振在中枢神经系统的研究。
王巍,E-mail:1391082196@qq.com
R445.2
A
10.11904/j.issn.1002-3070.2017.06.008
(收稿:2017-05-07)

