东北红豆杉枝叶总黄酮超声波辅助提取及其抗氧化活性
姜 萍,陈华芳,黄海斌,包新业,徐 岚
( 南京林业大学 化学工程学院;江苏省高校农林生物质化学与利用国家重点实验室培育建设点,江苏 南京 210037 )
东北红豆杉枝叶总黄酮超声波辅助提取及其抗氧化活性
姜 萍,陈华芳,黄海斌,包新业,徐 岚
( 南京林业大学 化学工程学院;江苏省高校农林生物质化学与利用国家重点实验室培育建设点,江苏 南京 210037 )
以东北红豆杉枝叶为原料,采用超声波辅助法提取红豆杉中总黄酮,在单因素试验基础上采用响应面法优化了提取工艺条件。结果表明:在乙醇体积分数60%,提取温度64 ℃,提取时间60 min,液料比14 ∶1(mL∶g),超声波功率168 W的最佳工艺条件下提取1次,总黄酮得率可达4.48%(提取率为69.14%)。东北红豆杉总黄酮粗提物经不同溶剂萃取后,在质量浓度0.01~0.20g/L范围内,不同萃取物的抗氧化能力与质量浓度均呈良好量效关系。乙酸乙酯萃取物具有较强的1,1-二苯基-2-苦肼基自由基(DPPH·)清除能力,其半数抑制质量浓度(IC50)值0.018 g/L,与Vc(0.012 g/L)相近。乙酸乙酯萃取物经大孔树脂AB-8纯化后得到16个组分,各组分的总黄酮含量与其DPPH·清除能力具有良好的相关性,相关系数(R)为 0.958 1,显著性水平P<0.000 1。
东北红豆杉;响应面优化;总黄酮;抗氧化活性
红豆杉在全世界有12种,主要分布在北半球,中国有4种和1变种,即中国红豆杉、东北红豆杉、云南红豆杉、南方红豆杉和西藏红豆杉[1]。红豆杉素有“植物黄金”之称[2],是国家一级保护珍稀植物。红豆杉中紫杉醇独特的抗癌作用和显著疗效被发现后[3-5],关于红豆杉中有效成分的研究受到了世界各国的广泛关注。紫杉醇在红豆杉中的含量极低[6],提取紫杉醇后会产生大量的废渣,废渣中还含有生物活性较强的多糖类和黄酮类化合物,对红豆杉枝叶中黄酮类化合物的研究有利于保护红豆杉资源,提高其利用率。近年来,大量的研究表明,黄酮类化合物具有抗氧化、抗衰老、清除自由基等作用[7],因此广泛应用于医药、食品、日用化学品以及保健品等领域。目前,已有较多从红豆杉中提取紫杉醇的研究报道[8],但对红豆杉中黄酮类化合物[9]的提取工艺优化及其抗氧化活性的报道较少。中国的红豆杉资源约占世界一半以上,研究红豆杉中的各种有效成分对红豆杉资源的综合利用具有重要意义。本研究利用超声波辅助提取东北红豆杉枝叶中的黄酮类化合物,在单因素试验的基础上采用响应面法优化提取工艺,并以不同溶剂对粗提物进行萃取,利用大孔吸附树脂分离纯化,探讨了不同纯化组分对1,1-二苯基-2-苦肼基自由基(DPPH·)的清除能力,以期为红豆杉资源的综合利用提供理论数据。
1 实 验
1.1原料、试剂与仪器
东北红豆杉(TaxuscuspidataSieb. et Zucc.)枝叶,由荣成健康集团有限公司提供,自然风干后粉碎成粒径≤0.425 mm,含水率为6.33%,备用。
1,1-二苯基-2-苦肼基(DPPH)、芦丁标准品,Sigma Aldrich公司;AB-8大孔吸附树脂,蚌埠市辽源新材料有限公司;乙醇、亚硝酸钠、硝酸铝、氢氧化纳、石油醚、二氯甲烷、乙酸乙酯和正丁醇,均为分析纯。
UV-2450紫外可见分光光度仪,日本SHIMADZU公司;AC5200DTD超声波清洗机,南京安秀仪器设备有限公司。
1.2红豆杉枝叶总黄酮的提取
1.2.1原料中总黄酮含量的测定 准确称取已粉碎的原料10.00 g装入索式抽提器中,用60%乙醇为溶剂连续抽提12 h,测定原料的总黄酮含量,进行2次平行实验。
1.2.2单因素试验 准确称取已粉碎的原料3.00 g,装入100 mL锥形瓶中,加入不同体积分数的乙醇溶剂,在不同的超声波功率、提取时间、提取温度和液料比条件下,进行超声波辅助提取,提取1次,过滤,定容至50 mL,测定总黄酮的含量,每个单因素进行3次平行实验。
1.2.3响应面优化 在单因素试验的基础上,选择对总黄酮得率影响较大的因素,应用Design-Expert 8.0.6.1软件,依据Box-Behnken 试验原理,设计4因素3水平响应面试验,确定超声波辅助提取红豆杉枝叶总黄酮的最佳工艺参数。
1.2.4总黄酮得率的测定
1.2.4.1标准曲线的绘制 采用NaNO2-Al(NO3)3比色法[10],称取105 ℃干燥至质量恒定的 20 mg芦丁标准品,置于50 mL容量瓶中,用60%乙醇溶液溶解并定容,配制成质量浓度0.4 g/L的芦丁标准溶液。准确移取芦丁标准溶液0、0.2、0.4、0.6、0.8、1.0、1.2和1.4 mL,置于10 mL容量瓶中,各加入一定量的60%乙醇溶液补充至2 mL;加入5%的NaNO2溶液0.5 mL,摇匀,放置6 min,加入10% 的 Al(NO3)3溶液0.5 mL,摇匀,放置6 min,加入4%的NaOH溶液4 mL,用60%乙醇溶液定容至刻度,摇匀,放置15 min。以相应试剂为空白对照,在波长510 nm处测定其吸光度。以吸光度(A)为纵坐标,芦丁质量浓度(C)为横坐标绘制标准曲线,得到回归方程为A=2.701 4C-0.051 8,相关系数R2=0.999 8, 线性范围为0~0.056 g/L。
1.2.4.2得率的计算 将1.2节提取得到的提取液稀释一定倍数,取稀释液1 mL,按1.2.4.1节方法测定吸光度,根据标准曲线按式(1)计算总黄酮得率。
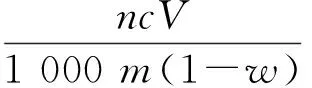
(1)
式中:Y—总黄酮得率,%;c—总黄酮质量浓度,mg/L;V—待测提取溶液的总体积,mL;m—原料的质量,g;w—原料含水率,%;n—稀释倍数。
1.3红豆杉枝叶总黄酮的萃取与纯化
1.3.1不同溶剂萃取 将红豆杉枝叶提取物溶液分别用石油醚、乙酸乙酯、二氯甲烷和正丁醇依次萃取,萃取液再经减压浓缩、冷冻干燥后得到5种萃取物。每种萃取物再分别配成质量浓度为0.01、0.02、0.04、0.08、0.12、0.16和0.20 g/L乙醇溶液,备用。
1.3.2分级纯化 取5 g生物活性较好的萃取物样品,采用AB-8大孔吸附树脂柱进行分离,分别用水,10%、20%、30%、40%和50% 乙醇依次梯度洗脱,流速为6 mL/min,收集流出液100 mL/瓶,将收集的溶液进行编号。将组分相同的流出液进行富集合并,减压浓缩、冷冻干燥得到16个组分(Fr.1~ Fr.16),将各组分配成质量浓度50 mg/L的样品溶液,备用。
1.4总黄酮抗氧化活性的测定
1.4.1DPPH溶液的配制 精确称取20 mg的DPPH试剂,用无水乙醇溶解,定容成500 mL,配置成0.1 mmol/L的DPPH溶液。
1.4.2抗氧化活性的测定 分别移取不同浓度的红豆杉枝叶样品溶液各1.0 mL于10 mL离心管中,加入3.0 mL的0.1 mmol/L DPPH乙醇溶液,室温下避光反应30 min,无水乙醇作为空白,在517 nm波长处测定其吸光度,每个样品需做3个平行实验。同时以维生素C(Vc)作为抗氧化活性测定的对照组。按式(2)计算DPPH自由基(DPPH·)的清除率[11-13]。
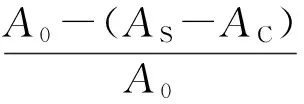
(2)
式中:I—清除率,%;A0—1.0 mL无水乙醇+3.0 mLDPPH溶液的吸光度;AS—1.0 mL样品溶液+3.0 mL DPPH溶液的吸光度;AC—1.0 mL样品溶液+3.0 mL无水乙醇的吸光度。
2 结果与分析
2.1不同条件对总黄酮提取得率的影响
2.1.1乙醇体积分数 在提取温度50 ℃,提取时间50 min,液料比14 ∶1(mL∶g,下同),超声波功率144 W的条件下,提取1次,考察乙醇体积分数对总黄酮得率的影响,结果见图1(a)。由图1(a)可知,随着乙醇体积分数的增大,总黄酮得率逐渐增大;当乙醇体积分数为70%时,总黄酮得率达到最大为3.98%,提取率为61.42%(原料中总黄酮的质量分数为6.48%);在相同的条件下,以水为溶剂提取总黄酮得率为3.16%;当乙醇体积分数大于70%时,总黄酮得率开始下降。这可能是因为乙醇体积分数逐渐增大会增加溶剂的渗透能力,使黄酮类物质逐渐溶出,但随着乙醇体积分数的继续增大,提取液中脂溶性物质含量逐渐增大,进而导致得率下降[14]。因此,初步确定以体积分数70%的乙醇为东北红豆杉枝叶中总黄酮提取溶剂。
2.1.2提取温度 选择70%乙醇为提取溶剂,在提取时间50 min,液料比14 ∶1,超声波功率144 W的条件下,分别在不同温度下提取1次,考察提取温度对总黄酮得率的影响,结果见图1(b)。由图1(b)可知,随着提取温度的升高,总黄酮得率逐渐增加;当提取温度为60 ℃时,总黄酮得率达到最大值,为4.16%(提取率为64.20%);当提取温度超过60 ℃,总黄酮得率开始逐渐下降。这可能是因为随着温度的升高,加快了红豆杉枝叶中黄酮类物质的溶出速率,但随着提取温度的继续增大,当超过60 ℃时,黄酮类物质会发生分解,破坏其结构[14],并且会使其他杂质更多的溶出,使得总黄酮得率降低。因此,初步确定红豆杉枝叶中总黄酮较佳提取温度为60 ℃。
2.1.3提取时间 选择70%乙醇为提取溶剂,在提取温度60 ℃,液料比14 ∶1,超声波功率144 W的条件下,选择不同的提取时间,提取1次,考察提取时间对总黄酮得率的影响,结果见图1(c)。由图1(c)可以看出,在30~60 min内,随着提取时间的延长,总黄酮得率逐渐增大,当超过60 min时,总黄酮得率略微下降,这可能是因为超声波处理时间过长可能会对黄酮类化合物的结构产生破坏,使得总黄酮得率降低。因此,初步确定红豆杉枝叶总黄酮最佳提取时间为60 min。
2.1.4液料比 选择70%乙醇为提取溶剂,在提取温度60 ℃,提取时间60 min,超声波功率144 W的条件下,选择不同的液料比提取1次,考察液料比对总黄酮得率的影响,结果见图1(d)。由图1(d)可知,随着液料比的增加,红豆杉枝叶总黄酮得率先增大后减小,当液料比14∶1时,总黄酮得率达到最大值,为4.35%(提取率为67.13%)。这可能是由于随着溶剂量的逐步增加,物料和溶剂的接触面积变大,进而使得黄酮类物质的溶出量变大,提高了总黄酮得率;但随着溶剂量达到一定值时,溶剂已经将物料充分包裹,再继续加大溶剂量,对总黄酮得率的提高不但没有促进作用,而且可能导致其他杂质也被提取出来[15],影响总黄酮得率,并且溶剂量大也会增加提取成本。因此,初步确定红豆杉枝叶总黄酮提取的较佳液料比为14∶1(mL∶g)。
2.1.5超声波功率 选择70%乙醇为提取溶剂,在提取温度60 ℃,提取时间60 min,液料比14∶1,选择不同的超声波功率提取1次,考察超声波功率对总黄酮得率的影响,结果见图1(e)。
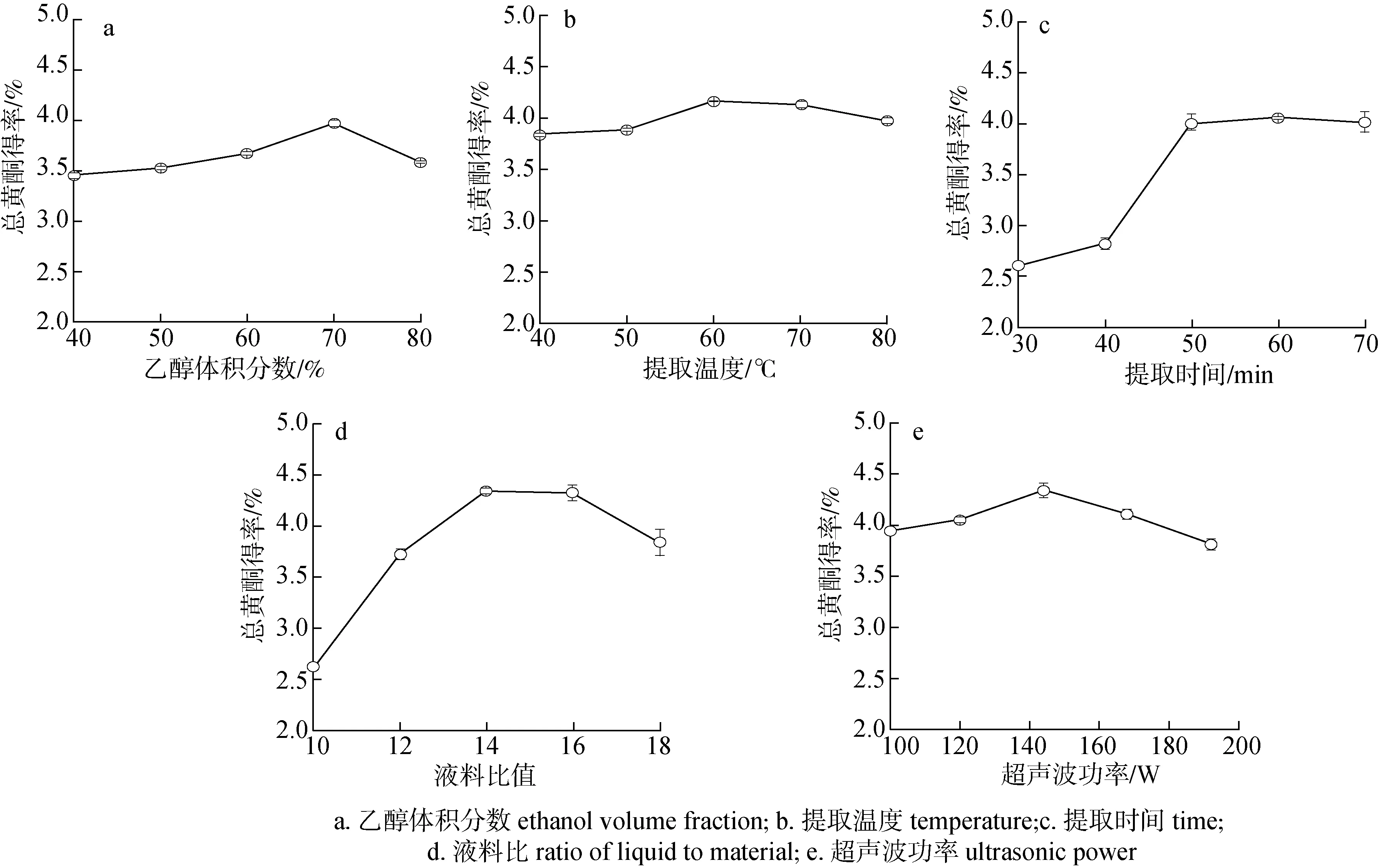
图 1 不同条件对总黄酮得率的影响Fig. 1 Effect of different conditions on total flavonoid yield
由图1(e)可知,随着超声波功率的增大,总黄酮得率先增大后减小,当超声波功率为144 W时,总黄酮得率达到最大,为4.34%(提取率为66.98%)。这可能是因为超声波的机械效应和空化效应会破坏植物细胞壁和细胞膜,使黄酮类物质溶出。超声波功率越大,越能有效破坏植物细胞壁,使黄酮类化合物充分溶出[16],但超声波功率继续加大,分子运动加剧,会导致黄酮类化合物发生降解和其他杂质溶出。因此,初步确定较佳超声波功率为144 W。
2.2响应面法优化提取工艺分析
2.2.1响应面试验设计及结果 依据Box-Behnken 模型进行试验设计[17],结合单因素试验结果,选取乙醇体积分数(X1),提取温度(X2),液料比(X3),超声波功率(X4)4个因素,运用Design-Expert 8.0.6.1软件进行设计,通过响应面法对试验数据进行分析,得到试验方案及结果见表1。
对表1 结果进行多元线性回归拟合,得到的二次多项回归方程如下:

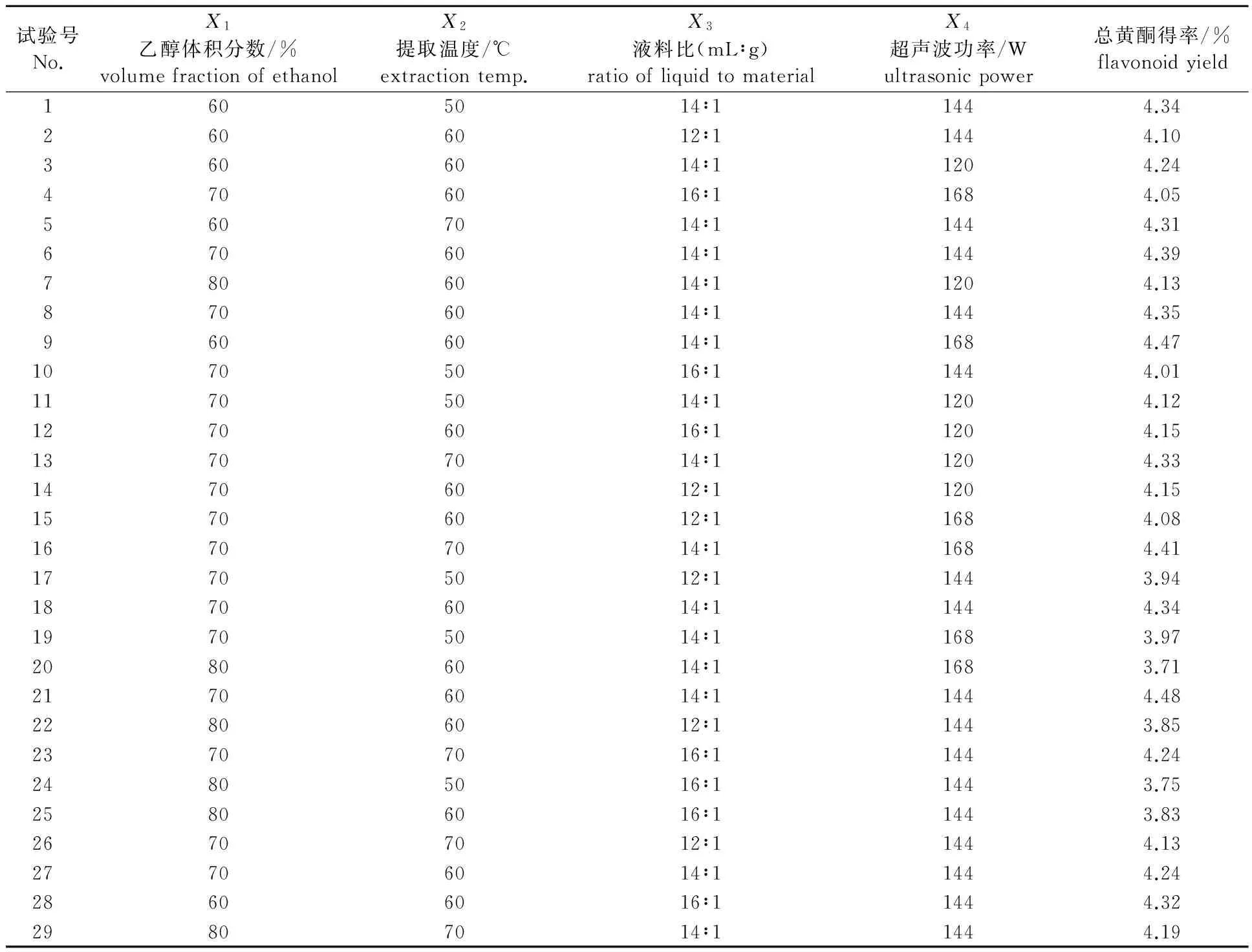
表 1 响应面试验设计及结果Table 1 Experimental design and results of response surface analysis
2.2.2响应面试验结果分析 为了说明回归方程的有效性及各因素对东北红豆杉枝叶总黄酮得率的影响程度,对上述回归模型进行方差分析,结果见表2。
表 2 总黄酮得率响应面方差分析结果Table 2 Variance analysis for extraction yield of total flavonoids
由表2可以看出,模型失拟项p=0.932 6>0.05,不显著,模型的p<0.000 1,回归方程极显著,R2=0.955 2>0.9,说明该模型拟合良好[18],能较好地描述各因素与响应值之间的关系,所以,可以利用此回归方程确定东北红豆杉枝叶中总黄酮的最佳提取工艺。
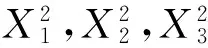
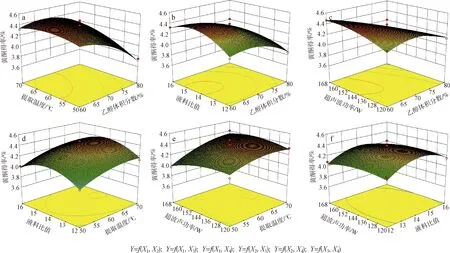
图 2 两因素交互作用对总黄酮得率影响的响应曲面图Fig. 2 Response surface plots of operating parameters on total flavonoids yield
为了检测试验结果是否与真实情况相一致,对得到的最佳工艺条件进行了5次验证性实验,得到东北红豆杉枝叶总黄酮得率实际值分别为4.39%、4.45%、4.57%、4.53%和4.48%,平均值为4.48%(提取率69.14%),与响应面软件分析得出的理论值仅相差0.01%,且测定结果稳定,重复性好,说明响应面优化结果可靠。
2.3总黄酮的抗氧化活性
2.3.1不同萃取物的DPPH·清除能力 DPPH·是一种以氮为中心的稳定自由基,其溶于乙醇显紫色,在517 nm处有特征吸收峰。当DPPH·溶液中加入自由基清除剂时,孤对电子配对使吸收消失或减弱,吸光度变小,因此,可用于分析清除自由基能力的强弱。由图3可以看出,Vc的半数抑制质量浓度(IC50)值为0.012 g/L,说明作为对照样Vc有很强的抗氧化能力;红豆杉枝叶不同溶剂萃取物在0.01~0.20 g/L范围内抗氧化能力与萃取物的浓度均呈现良好的量效关系,其不同溶剂萃取物抗氧化能力强弱顺序是乙酸乙酯萃取物>正丁醇萃取物>二氯甲烷萃取物>石油醚萃取物>水萃取物。乙酸乙酯萃取物IC50值达0.018 g/L,其自由基清除能力略小于Vc,说明乙酸乙酯萃取物有较强的抗氧化能力。
2.3.2不同纯化组分的DPPH·清除能力 采用AB-8大孔吸附树脂柱对红豆杉枝叶乙酸乙酯萃取物分离富集得到16个组分,并对进行了DPPH·清除率试验,总黄酮含量与DPPH·清除率相关性可见图4。

图3不同溶剂萃取物对DPPH·的清除率图4总黄酮含量与DPPH·清除率相关性
Fig.3RelationshipbetweendifferentsolventextractsandDPPH·scavengingrateFig.4ThecorrelationbetweentotalflavonoidcontentandDPPH·scavengingrate
由图4可知,红豆杉枝叶乙酸乙酯萃取物分离组分的总黄酮质量分数与DPPH·自由基清除能力有很好的相关性,抗氧化活性与总黄酮质量分数间的相关系数(R)=0.958 1,显著性水平P<0.000 1。说明分离组分中总黄酮含量越高,其相应的DPPH·清除能力越强,因此具有较强的抗氧化能力。
3 结 论
3.1以东北红豆杉枝叶为原料,采用超声波辅助提取红豆杉总黄酮,通过单因素试验和响应面中心组合设计对提取工艺参数进行优化,得到最佳工艺条件为:乙醇体积分数60%,提取温度64 ℃,提取时间60 min,液料比14∶1(mL∶g),超声波功率168 W。在此条件下提取1次的总黄酮得率为4.48%(提取率为69.14%)。
3.2通过对比不同萃取物的DPPH·清除率可知,红豆杉枝叶乙酸乙酯萃取物具有良好的抗氧化能力,其IC50值达0.018 g/L,与Vc(0.012 g/L)相近。在质量浓度0.01~0.20 g/L范围内,红豆杉枝叶不同萃取物的抗氧化能力与质量浓度均呈良好量效关系。
3.3采用AB-8大孔吸附树脂从东北红豆杉枝叶乙酸乙酯萃取物中富集得到16个分离组分,分离组分的总黄酮质量分数与其DPPH·清除率具有很好的相关性,相关系数(R)为0.958 1,显著性水平p<0.000 1。
[1]高兴兴. 南方红豆杉叶三种黄酮糖苷的分离和结构鉴定[D]. 杭州:浙江大学硕士学位论文,2014.
GAO X X. Separation and identification of three kinds of flavonoid glycosides fromTaxuschinensisvarmaireileaves[D]. Hangzhou:Master Degree Thesis of Zhejiang University,2014.
[2]冯宁,刘志明. “植物黄金”—红豆杉[J]. 陕西林业,2007(1):32.
FENF N,LIU Z M. Plant gold:Taxuschinensis[J]. Forestry of Shaanxi,2007(1):32.
[3]LI C F,HUO C H,ZHANG M L,et al. Chemistry of Chinese yew,Taxuschinensisvar.mairei[J]. Biochemical Systematics and Ecology,2008,36(4):266-282.
[4]LIN Z Z,HSU C,CHANG Y C,et al. Outcome of advanced nonsmall cell lung cancer patients receiving gemcitabine and weekly paclitaxel as first-line treatment[J]. Lung Cancer,2008,60(2):215-221.
[5]TAMAR S,JOSEPH M,RINAT M,et al. Combined weekly carboplatin and paclitaxel as primary treatment of advanced epithelial ovarian carcinoma[J]. Gynecologic Oncology,2009,114(2):215-218.
[6]李立华,张国升. 安徽皖南红豆杉中紫杉醇和多糖的提取与含量测定[J]. 中医药临床杂志,2010,22(5):465-466.
LI L H,ZHANG G S. Extraction and determination of taxol and polysaccharides fromTaxuschinensisin southern Anhui province[J]. Clinical Journal of Traditional Chinese Medicine,2010,22(5):465-466.
[7]DUBEY S K,BATRAL A. Hepatoprotective activity fromethanol fraction ofThujaoccidentalisLinn[J]. Asian Journal of Research in Chemistry,2008,1(1):32-35.
[8]彭天浩,王燕. 红豆杉中提取紫杉醇研究进展[J]. 农产品加工,2013(6):57-62.
PENG T H,WANG Y. The research of extraction progress of taxol fromTaxusChinensis[J]. Academic Periodical of Farm Products Processing,2013(6):57-62.
[9]高昕. 东北红豆杉枝叶中总黄酮类成分富集工艺研究[D]. 哈尔滨:黑龙江中医药大学硕士学位论文,2005.
GAO X. Studies on the purifying techniques of flavonoids in the twigs and leaves ofTaxuscuspidate[D]. Harbin:Master Degree Thesis of Heilongjiang University of Chinese Medicine,2005.
[10]韩志萍,崔海燕,张志琪. 响应曲面法优化甜杏仁皮总黄酮提取工艺[J]. 安徽农业科学,2015,43(28):278-281,284.
HAN Z P,CUI H Y,ZHANG Z Q. Optimizing the extraction of total flavonoids from sweetApricotkernelskin using response surface methodology[J]. Journal of Anhui Agricultural Sciences,2015,43(28):278-281,284.
[11]KHIZAR H,ZHANG X M. Liberation and separation of phenolic compounds from citrus mandarin peels by microwave heating and its effect on antioxidant activity[J]. Separation and Purification Technology,2010,73:371-376.
[12]LAURA G,DANIELE F,ANAHI B,et al. Antioxidant activity of citrus paradisi seeds glyceric extract[J]. Fitoterapia,2004,75:221-224.
[13]ROSA A,TUBEROSO C I G,ATZERI A,et al. Antioxidant profile of strawberry tree honey and its marker homogentisic acid in several models of oxidative stress[J]. Food Chemistry,2011,129:1045-1053.
[14]卢赛赛,许凤,王鸿飞,等. 杨梅叶中总黄酮提取及其抗氧化能力研究[J]. 果树学报,2015,32(3):460-468.
LU S S,XU F,WANG H F,et al. Extraction and antioxidant activities of total flavonoids fromMyricarubraleaves[J]. Journal of Fruit Science,2015,32(3):460-468.
[15]杜艳,李荣,姜子涛. 白苏叶黄酮的微波辅助提取及其纯化的研究[J]. 食品工业科技,2016,37(6):280-286.
DU Y,LI R,JIANG Z T. Study on microwave-assisted extraction and purification of flavonoids fromPerillafrutescensleaves[J]. Science and Technology of Food Industry,2016,37(6):280-286.
[16]张泽生,董晓朦,王田心,等. 黄秋葵中多酚和黄酮提取工艺的研究[J]. 中国食品添加剂,2017(1):91-99.
ZHANG Z S,DONG X M,WANG T X,et al. Study on extraction of polyphenols and flavonoids from okra[J]. China Food Additives,2017(1):91-99.
[17]侯学敏,李林霞,张直峰,等. 响应面法优化薄荷叶总黄酮提取工艺及抗氧化活性[J]. 食品科学,2013,34(6):124-128.
HOU X M,LI L X,ZHANG Z F,et al. Total flavonoids fromMenthahaplocalyxBriq. leaves:Optimization of extraction process by response surface methodology and antioxidant activity[J]. Food Science,2013,34(6):124-128.
[18]邹建国,刘飞,刘燕燕,等. 响应面法优化微波辅助提取枳壳中总黄酮工艺[J]. 食品科学,2012,33(2):24-28.
ZHOU J G,LIU F,LIU Y Y,et al. Optimization of microwave-assisted extraction of total flavonoids fromFructusaurantiiImmaturus by response surface methodology[J]. Food Science,2012,33(2):24-28.
[19]吴晖,赖富饶,胡筱波. 响应面分析法优化油菜花粉多糖提取工艺的研究[J]. 食品与机械,2007,23(5):66-70.
WU H,LAI F R,HU X B. Optimization of the extraction technology of water-soluble polysaccharides form rape pollen by responsive surfaces analysis[J]. Food and Machinery,2007,23(5):66-70.
Ultrasonic-assisted Extraction of Total Flavonoids from Branchesand Leaves of Taxus cuspidata Sieb. et Zucc.and Its Antioxidant Activity
JIANG Ping, CHEN Huafang, HUANG Haibin, BAO Xinye, XU Lan
(College of Chemical Engineering,Nanjing Forestry University;Jiangsu Provincial Key Lab. for the Chemistry and Utilization of Agro-forest Biomass,Nanjing 210037, China)
The total flavonoids from branches and leaves ofTaxuscuspidatawere extracted by using the method of ultrasonic assisted extraction. The interaction effects between the factors were analyzed and the optimal extraction process conditions of the total flavonoids were optimized by the response surface method. The results showed that the optimal extraction conditions were as follows: the volume fraction of ethanol was 60%, the extraction temperature was 64 ℃, the extraction time was 60 min, the ratio of liquid to material was 14 ∶1 (mL∶g), the ultrasonic power was 168 W, the maximum extraction yield of total flavonoids was up to 4.48%(extraction rate 69.14%). After the ethanol crude extract from branches and leaves ofTaxuscuspidatawas extracted by different solvents, the antioxidant activity of extract had good dose-effect relationship with the mass concentration of 0.01-0.20g/L.The ethyl acetate extract had strong DPPH radical scavenging ability, and its IC50value was 0.018 g/L, similar to the IC50value of Vc(0.012 g/L). 16 fractions contained the total flavonoids were obtained from the ethyl acetate extract separated by macroporous resin AB-8. The total flavonoids content in 16 separated fractions had good correlation with their DPPH radical scavenging ability. The correlation coefficientRwas 0.958 1, and the significantP<0.000 1.
TaxuscuspidataSieb. et Zucc.; response surface optimization; total flavonoids; antioxidant activity
10.3969/j.issn.0253-2417.2017.06.017
2017- 08- 17
国家重点研发计划项目(2017YFD0601306);江苏高校品牌专业建设工程资助项目(无编号)
姜 萍(1969— ),女, 黑龙江伊春人,副教授,主要从事天然产物化学与应用研究;E-mailpingj_chem@njfu.edu.cn。

JIANG Ping
TQ35
A
0253-2417(2017)00- 0125- 08
姜萍,陈华芳,黄海斌,等.东北红豆杉枝叶总黄酮超声波辅助提取及其抗氧化活性[J].林产化学与工业,2017,37(6):125- 132.

