植物多糖中单糖组成分析技术的研究进展
郭元亨,张利军,曹丽丽,陈金金,刘伯言,赵庆生,赵 兵,*
(1.中国科学院过程工程研究所,生化工程国家重点实验室,生物炼制工程研究部,北京 100190;2.中国科学院大学,北京 100049)
植物多糖中单糖组成分析技术的研究进展
郭元亨1,2,张利军1,2,曹丽丽1,陈金金1,刘伯言1,2,赵庆生1,赵 兵1,*
(1.中国科学院过程工程研究所,生化工程国家重点实验室,生物炼制工程研究部,北京 100190;2.中国科学院大学,北京 100049)
植物多糖是重要的药用和食用资源。在植物多糖的研究中,单糖组成分析是基础性和关键性的环节。单糖组成分析包括植物多糖的降解、单糖的相互分离及检测等环节。本文围绕近年来植物多糖研究,综述了植物多糖降解技术和单糖化学修饰及分离检测技术,为植物多糖的研究提供理论参考。
植物多糖;单糖组成;定量分析
在1993年美国召开的第一届国际糖类工作年会上,会议主席称“Glycobiology”(糖生物学)是生物学领域的最后一个重大前沿。2001年,Science杂志以“Cinderella’s coach is ready”为题专门出版了“糖化学和糖生物学”专辑,介绍了糖类的最新研究成果和前景展望[1]。以此为标志,人类对糖类的研究进入快速通道。从原来将糖类视为生物体中维持细胞组织结构和提供能量来源的物质,逐渐转移到研究糖类多方面的、复杂的生理生化功能。随着研究的深入,越来越多的人意识到多糖研究的重要性和学科前沿性。近十多年来,大量研究结果表明,许多植物多糖具有多种生物活性和生理功能,包括免疫调节[2-3]、抗肿瘤[4-6]、抗氧化[7-9]、抗疲劳[10]、抗炎[11-12]、控制血糖[13]和代谢胆固醇[14]、降血脂[15]以及肝功能保护[16]等,而且对机体几乎无毒副作用,具有高效低毒的特点。据不完全统计,目前全球至少有数10 种多糖已进入到抗肿瘤、抗艾滋病及糖尿病治疗等临床实验阶段,并且已有多种多糖药物成功应用于临床,如香菇多糖、人参多糖以及猪苓多糖。
在植物多糖的结构特征、理化性质及其构效关系的研究中,单糖组成是最基本的研究对象。另外,随着越来越多的多糖类药品、食品和保健品出现在市面上,这些产品的质量控制也显得愈加紧迫,甚至一些原料药材的质量控制也需要借助其中糖类的指纹图谱来控制。因此对植物多糖中的单糖组成分析逐渐成为一个非常重要的环节。
在分析植物多糖的单糖组成过程中,最基本的环节包括多糖水解为单糖、单糖之间相互分离、单糖的化学修饰以及对逐个分离的单糖进行检测分析。几乎所有对植物多糖的单糖组成分析的研究都是围绕上述环节展开。因此,本文将围绕上述环节,对近年来单糖组成分析领域中取得的进展及存在的问题逐一分析综述。
1 植物多糖降解
降解多糖大分子的方法有多种,包括电磁辐射、超声波[17-19]、酶催化[20-21]、碱催化、酸催化等。
1.1 电磁辐射降解
目前报道用于降解多糖的辐射多指γ射线,主要通过γ光子断裂糖苷键或者γ射线产生的自由基断裂糖苷键[22-23],但辐射通常很难将多糖完全降解成单糖;因此目前在单糖组成分析中还未见使用辐射手段进行多糖链降解的报道。
1.2 超声波降解
超声波在介质中传播时,介质质点作疏密振动,当质点之间的瞬时距离超过临界距离之后,介质结构的完整性遭到破毁,形成空穴。空穴破碎产生局部性的高温高压,为自由基产生提供了条件,而自由基可以攻击大分子导致长链断裂[19];另一方面,超声波产生的激烈而快速变化的机械运动,可导致多糖长链分子断裂。但超声波和辐射一样,很难将多糖分子彻底降解为单糖分子;因此单糖组成分析中,尚未有使用超声波进行多糖降解的报道。
1.3 酶催化降解
糖苷酶可以有效降低糖苷键的活化能,提高多糖降解的反应速率。糖苷酶可以分为2 类:一类是外切糖苷酶,这类酶只能从多糖链的非还原末端逐个切下单糖,对糖基的组成和糖苷键的类型有专一性要求;另一类是内切糖苷酶,这类酶水解糖链内部的糖苷键,释放糖链片段[24]。Zha Shenghua等[25]在提取玛咖多糖时,就使用了酶催化法,其可促进纤维素断裂,加速玛咖中可溶性多糖的溶出。但酶催化法降解植物多糖有诸多不利因素:1)酶对底物的专一性要求较高,因此在实际应用中往往很难找到与底物相吻合的酶制剂;2)虽然目前已经发现的糖苷酶有多种,但绝大多数在生物体内,实现规模化生产的很少,因此合适的酶来源非常有限;3)如果酶不是固定在某种载体上,而是以游离的形态加入,则酶催化水解完成后,水解液中酶的去除也是一个新增问题。因此,目前酶解法应用于水解多糖受到一定限制。
1.4 碱催化降解
碱也可以催化多糖的水解,根据有机化学反应机理,碱催化水解反应只能从糖链的还原末端逐个脱下单糖,而不能从非还原末端或者链中间的糖苷键上进行[26],因此水解速率较慢。另外,碱催化过程常伴随着产物结构的变化[27];因此目前碱催化降解尚无法满足植物多糖中单糖组成分析研究的需要。
1.5 酸催化降解
在分析多糖中单糖组成时,需要快速、完全、彻底地对多糖进行水解,以保证较高的单糖回收率。多糖的水解是糖苷键断裂的过程,糖苷键的酸水解实质上是使糖苷键O原子质子化,从而将糖苷键打开的过程。而酸性条件提供了大量H+,有利于糖苷键O原子的质子化进程。糖苷键O原子质子化后,随后糖苷键断裂,苷元脱离,碳正离子溶剂化,最后脱去质子形成单糖[28]。与碱水解不同,酸催化水解可发生在糖链中,也可发生在糖链的还原端或者非还原端;因此反应速率快,水解产物发生结构变化的机率较小。所以在多糖的单糖组成分析中,酸催化降解是目前的主流技术。
早期催化多糖水解多采用不同体积比的盐酸和硫酸混合液[29]。但这两种酸水解操作相当复杂,此外,水解完成后,还需要将水解样品的pH值调成中性后再进行检测[30];另一方面,硫酸水解多糖完成后,最终需要以碳酸钡中和调整pH值,且硫酸钡沉淀过程中往往会吸附一部分的单糖,使其回收率降低,影响样品检测的准确性。近年来有关多糖水解的报道更多采用三氟乙酸或氢氟酸[30-31],但氢氟酸易腐蚀玻璃容器,且多糖水解过程需要加热,相比三氟乙酸,氢氟酸在受热时更易挥发,因此在多糖水解过程中三氟乙酸更为常用。Harazono等[30]研究表明,氨基糖在使用三氟乙酸水解的过程中,会出现一定程度的破毁。由于糖苷键对水解的敏感性不同以及解聚成单糖的难易程度不同,因此目前还无一种通用的技术可使中性以及氨基糖完全水解而不使其出现降解。植物多糖中氨基糖相对较少,因而多采用三氟乙酸催化水解。
2 单糖的化学修饰技术
单糖分子本身缺少发色基团,因此一定程度上限制了单糖的分析检测。为在单糖分析过程中获得较高的检测灵敏度,人们逐渐将注意力转移到单糖分子的化学修饰上。目前,已有多种结构修饰技术被报道可用于修饰单糖分子,包括3-甲基硅烷修饰技术[32]、α-萘胺衍生化技术[33-34]、糖腈乙酸酯衍生化法[35]、1-苯基-3-甲基-5-吡唑啉酮(1-phenyl-3-methyl-5-pyrazolone,PMP)衍生化法[36]、1-(4-异丙基)苯基-3-甲基-5-吡唑啉酮(1-(4-isopropyl) phenyl-3-methyl-5-pyrazolone,PPMP)修饰法[37]、乙酸酐修饰法[38]、2-氨基吖啶酮(2-amino acridone,AMAC)修饰法[39]、苯并吖啶酮-5-乙酰肼(benzoacridinone-5-acetyl hydrazine,BAAH)衍生化法[40]和邻苯氨基苯甲酸衍生化法[41]。在上述修饰技术中,由于PMP是一种可以在温和的条件下与糖反应的通用化学修饰试剂,无需酸催化剂,且产物无唾液酸的异构,因此多数单糖检测使用PMP做为修饰物。虽然PMP修饰的单糖最初只用于高效液相色谱(high performance liquid chromatography,HPLC)检测[42],但后来成功地应用于毛细管电泳[43]、毛细管区带电泳[44]、胶束电动色谱[45]和离子交换毛细管电动色谱[46]等检测技术中。
然而,上述化学修饰技术均存在不足,即果糖无法修饰,而果糖是天然产物多糖,尤其是植物多糖组成中非常常见且含量较高的一种单糖。另外,甘露醇和山梨醇也无法使用上述常见的修饰试剂修饰,这就极大地降低了化学修饰法在检测天然产物多糖,尤其是植物多糖中的可信度。后面将以PMP修饰葡萄糖为例逐一分析单糖修饰的机理,以及果糖、甘露醇及山梨醇等不能被修饰的机理。

图1 碱性介质中PMP转变为亲核试剂的机理Fig. 1 Mechanism of PMP conversion to pro-nuclear agent in alkaline medium
如图1所示,PMP分子结构中,2-位的氮原子和羰基氧原子有较强的电负性。由于在碱性介质中,缺少如H+一类的正电荷去中和2-位的氮原子和羰基氧原子上的电负性,因此,这两个基团的电负性诱导吡唑环上电子转移。4-位碳原子上电子云密度减小,最终造成氢键断裂,氢以正离子的形式离开吡唑环,与OH-结合形成一个水分子,而PMP则形成一个以4-位碳为活性中心的亲核试剂。
单糖是以环状结构在碱性溶液中与亲核试剂发生反应的[37,47-48]。在溶液中,单糖主要以环状形式存在,且单糖半缩醛在碱性介质中更稳定,在酸中不稳定[49],这也佐证了上述研究的观点。但上述研究的观点很难解释同为环状结构的果糖为何不能被修饰试剂修饰。根据有机化学的相关理论,单糖分子虽然以环状结构为主,但在溶液(或在生物体)中,很多化学反应是通过链形结构完成的,链式结构尽管比例很小,但在理论和有机合成应用中都十分重要[49]。因此可以推断,单糖是以链状结构与PMP发生修饰反应的。单糖中的羰基是一个具有极性的官能团,由于氧原子的电负性比碳原子的大,因此氧带有负电性,而碳带有正电性,亲核试剂容易进攻带正电的碳原子,导致羟基的π键异裂,而形成两个δ键,这个过程就是羰基的亲核加成[50]。其反应历程如图2所示。
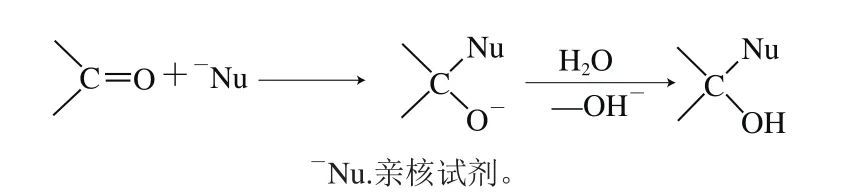
图2 羰基发生亲核反应的历程Fig. 2 Reaction mechanism of nucleophilic substitution of carbonyl group
由此可以看出,PMP亲核试剂易与羰基反应,而不易与羟基反应。甘露醇和山梨醇分子结构中不含羰基,因此PMP不能修饰甘露醇和山梨醇。在常见的单糖分子中,果糖是酮糖,就羰基的活泼程度而言,由于空间位阻和电子效应,酮糖活泼程度远低于醛糖,因此果糖也不能被PMP修饰。
综上所述,PMP修饰单糖的过程如图3所示。首先,在碱性条件下,PMP转变为亲核试剂后,PMP吡唑环的4-位碳原子与极少数以开链形式存在的醛糖在其1-位碳原子上发生亲核反应,然后失去一个水分子,同时,醛糖1-位碳原子和PMP的4-位碳原子之间形成双键,产生单分子PMP修饰的糖。此后,另一个处于亲核状态的PMP分子的4-位碳原子攻击上一个PMP吡唑环与单糖1-位碳之间新形成的双键。最终,2 个PMP分子和1 个醛糖分子形成双PMP衍生单糖;另一方面,以环状半缩醛形式存在的醛糖和以开链形式存在的醛糖之间存在着相互转化的平衡,开链醛糖随着亲核反应的减少,以环状半缩醛形式存在的醛糖转化成链状结构的醛糖,继续与PMP发生亲核反应,直到所有单糖均被PMP修饰。
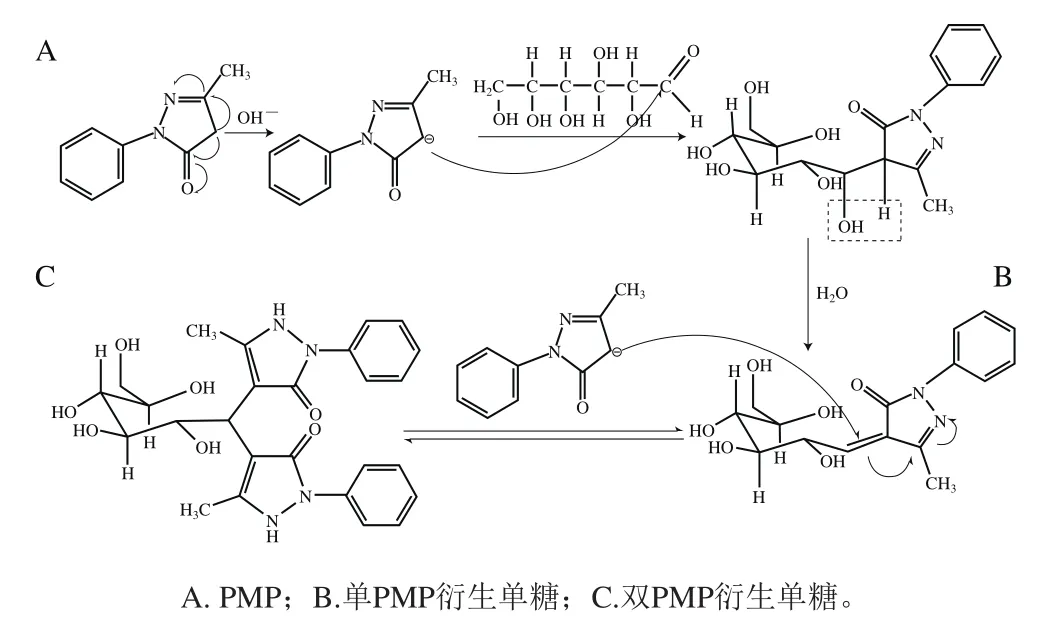
图3 PMP在碱性介质中衍生化修饰L-葡萄糖的机理Fig. 3 Mechanism of PMP Derivatization reaction of L-glucose in an alkaline medium
Wu Xiaodan[48]和Zhang Ping[37]等的研究中描述,在双PMP衍生糖中,PMP吡唑环上的双键是在2-位和3-位碳原子之间。而Guan等[47]的研究则认为,在双PMP衍生糖中,PMP吡唑环上的双键应该是3-位和4-位碳原子之间。如图3所示,单PMP衍生单糖中,吡唑环上2-、3-位之间的双键与新形成的双键共轭,后一个PMP分子的4-位碳原子攻击单PMP衍生单糖中吡唑环与单糖1-位碳之间形成的双键的同时,单PMP衍生物中吡唑环上2-位氮原子由于电负性强发生溶剂分解反应,获得一个氢原子,而3-位和4-位碳之间形成双键。综上所述,双PMP衍生糖中,PMP吡唑环上的双键应该在3-位和4-位碳原子之间,而不是2-位和3-位碳原子之间。
PMP衍生法是当前最为普遍的单糖修饰技术,但PMP修饰的单糖稳定性较差,尤其是在低浓度时,稳定性更差,且PMP在弱极性溶剂中的溶解性不高;因此有报道使用PPMP代替PMP作为修饰试剂,在溶解性方面取得了不错的效果[37]。尽管BAAH[40]、PPMP[37]、乙酸酐[38]、AMAC[39]等修饰试剂及α-萘胺衍生化法[33-34]、糖腈乙酸酯衍生化[35]等方法均有报道修饰单糖分子用于单糖的检测,但类似PMP,这些修饰方法也无法突破酮糖和多元醇等常见的单糖及衍生物无法被修饰的限制,因此在植物多糖的单糖组成分析中难以取得可信的结果。
3 单糖的分离检测技术
3.1 毛细管电泳技术
多糖的毛细管电泳(capillary electrophoresis,CE)技术是带电粒子在电场力的驱动下,在毛细管中按其淌度或分配系数不同进行高效、快速分离的电泳技术[51],具有样品用量少、时间短、灵敏度高、分离效果明显的特点。CE常用于糖蛋白裂解产生的单糖和寡糖[52]以及既带电荷又有紫外吸收的糖胺聚糖[53]的测定,对分离带电荷糖类具有独特优势[54]。由于植物多糖水解产生的单糖在水溶液中解离能力极差,只有在强碱条件下才能带上电荷;因此经常使用含硼砂的缓冲液让单糖在较低pH值条件下带上足够的负电荷。不同的单糖在相同介质条件下与硼砂的络合物有效淌度之间存在差异,这种差异可以被CE技术分辨。
3.2 气相色谱技术
气相色谱(gas chromatography,GC)测定目标样品的单糖组成具有灵敏度高、结果可靠等优点,同时适用于样品含量较低(如10-8或10-9)的多糖组分分析[55-56]。GC技术被用于灵芝多糖[57]、锁阳多糖[58]、猴头菇多糖[59]、稻壳多糖[60]等多种多糖中单糖组成和连接方式的研究中。但GC分离度有限,难以一次性分开很多种单糖,因此如果组成植物多糖的单糖种类较多,GC往往难以逐一分开,且GC出峰的峰面积重现性不佳;因此常需要添加内标物以辅助单糖含量的定量分析,这增加了操作的繁琐程度。
3.3 HPLC技术
在常用的分离设备中,HPLC稳定性好,色谱柱类型较多,技术相对成熟,可供选择的色谱柱和操作方法较多,不需要加内标物。HPLC的峰面积稳定性最好,可操作性最强,因此越来越多的单糖分离使用HPLC技术[32]。
多糖水解为单糖分子以后,可以不经过任何化学修饰,直接通过合适的LC柱使单糖相互分离,最终由检测器检出。由于不经过化学修饰,这种方法操作简单。但单糖由于自身缺少发色基团,因此对检测器的要求较为苛刻,经常只能使用示差检测器(refractive index detector,RID)或者蒸发光散射检测器(evaporative light scattering detector,ELSD)。同时检测器的特殊性又限制了分离手段,例如使用RID或ELSD时,要求流动相必须保持不变,这就意味着单糖分离环节中不能使用梯度洗脱,而梯度洗脱是分离过程中非常重要且常用的技术。等梯度洗脱常导致部分单糖之间难以相互分离、峰形相互重叠。例如HPLC(色谱柱为HPX-87H)是一种常用的单糖检测技术[61-62],但此技术在分析单糖过程中,半乳糖、木糖、果糖及甘露糖的出峰时间相同,难以相互分离。而植物多糖结构复杂、组成的单糖种类较多,因此单独使用LC技术难以准确检测全部单糖。
如前文所述,虽然单糖的化学修饰技术已经发展了20多年,但目前仍无法突破酮糖和多元醇等常见单糖难以修饰的限制。因此,在植物多糖的单糖组成分析中,单独使用此类技术难以取得可信的结果。
由于修饰检测技术和直接检测技术均难以全面检测植物多糖中的所有单糖。Guo Yuanheng等[63]在研究中发现,在用离子交换柱(如HPX-87H)分离单糖并以RID作检测器检测时,如果几种单糖的出峰时间重叠,则不同单糖的浓度与出峰总面积之间存在着加和效应。例如,鼠李糖和甘露醇的出峰时间重合,将1 mol/L的鼠李糖和1 mol/L的甘露醇溶液混合,其出峰面积与1 mol/L的鼠李糖或1 mol/L的甘露醇十分接近。依此特性,该组研究人员将PMP修饰法和离子交换色谱直接检测法结合起来,用于肉苁蓉多糖中单糖组分分析。其思路是先用PMP修饰所有的酮糖并通过HPLC法测定其含量,然后根据这些酮糖的含量以及各种单糖在离子交换色谱RID检测法中的标准曲线,推算出单糖在色谱图中所对应的峰面积,最后以样品中叠加峰的总面积减去计算所得的醛糖的峰面积,得到果糖及甘露醇的虚拟峰面积,根据这些虚拟峰面积和标准曲线计算出果糖和甘露醇的含量。此法虽然操作繁杂,但在现有的技术条件下,能较快、较准确地得到植物中尽可能多的单糖组成信息,不失为一种实用性较强的单糖分析途径。
3.4 质谱技术
质谱(mass spectrum,MS)技术是一种可以详细解析化合物结构特征的分析手段,待测样品在离子源中电离成不同荷质比(z/m)的离子,再利用电场和磁场的双重作用,使离子发生速度色散,将各离子分别聚焦,从而得到MS图。MS与LC或GC技术联用,是糖类化合物分离表征的有效工具,可用于不同类型糖类化合物的定性和定量分析[64-68]。Boldizsar等[69]利用GC-MS技术分析了香芹果实和叶子中的黄酮类化合物酶解后产生的糖和糖醇。You Chao等[70]利用GC-MS技术同步分析了雪样中痕量的左旋葡萄糖、甘露聚糖和半乳聚糖。Acanski等[71]利用GC-MS技术分析了不同类型面粉中糖的组成,包括戊糖、己糖和双糖。HPLC-MS技术也可以用于糖的分析。Qian Weiliang等[72]等使用HPLC-MS分析了蜂胶样品中糖的组成。Xu Xianbing等[73]在电喷雾探针的尖端加入鞘液,有效提高了单糖和二糖的电离效率,提高了LC-MS分析的灵敏度。
组成多糖化合物的单糖结构中存在大量异构体(例如D型和L型)、异头构型(α构型和β构型),另外,单糖残基的连接位置也各有差异。这种高度复杂的结构降低了常规方法对糖类化合物结构分析的准确性。MS技术通常无法区分对映异构体,因此,被认为是“手性失明”技术。在MS分析技术中,非对映异构体通常产生相似的一级谱图,而对映异构体产生相似的二级谱图;因此对MS技术和检测方法的改进十分必要。Nagy等[74]报道了对24 种己醛糖和2-己酮糖异构体的识别和绝对构型检测,包括葡萄糖、古洛糖、阿洛糖、阿卓糖、半乳糖、艾杜糖、塔罗糖、甘露糖、果糖、阿洛酮糖、山梨糖和塔格糖的D型和L型对映异构体,通过使用特定的固定配体动力学组合,产生足够明显的能量差异,实现对24 种己糖的手性识别,据报道该技术可以用于准确表征未知来源的任意单糖。MS技术虽然有其自身的优势,但其设备费用昂贵、操作相对繁琐,使用受到一定程度的限制。
4 结 语
单糖组成的分析未来在植物药物、植物活性多糖甚至中药材原料的鉴定等领域将会扮演重要的角色。本文详述了植物多糖的单糖组成分析过程中,水解、分离、检测等各环节的技术发展的最新进展。在植物多糖的水解环节中,目前主流的技术是酸水解,但随着生物技术和酶工程的发展,利用酶的多样性和高度特异性,未来有可能从自然界中分离得到甚至人为改造或设计出各种适宜的多糖水解酶,这些酶可以切断某些特定序列的多糖片段,或者打开某些特定构型糖苷键(α构型和β构型),或者从特定的位置(如1-位、6-位、4-位或者3-位,目前类似的酶如1,4-糖苷酶或1,6-糖苷酶)断开多糖的支链,根据所得信息推断糖链结构,将会使多糖中单糖组成和连接方式的分析更为方便。随着酶生物制备和酶固定化技术的发展,未来有可能大幅降低酶的成本和提高酶重复使用的次数,从而有可能实现以温和高效的酶水解方式取代现有的酸水解技术。在单糖相互分离环节,分离技术快速发展,有望在未来开发出一款不需要对单糖进行修饰,就能一次性分离所有常见单糖的色谱技术,以替代现有的修饰法检测技术,从而大大简化单糖的分析检测。
[1] HURTLEY S, SERVICE R, SZUROMI P. Cinderella’s coach is ready[J]. Science, 2001, 291: 2337.
[2] YAO Y, ZHU Y Y, REN G X. Immunoregulatory activities of polysaccharides from mung bean[J]. Carbohydrate Polymers, 2016,139: 61-66. DOI:10.1016/j.carbpol.2015.12.001.
[3] LUO Q, SUN Q, WU L S, et al. Structural characterization of an immunoregulatory polysaccharide from the fruiting bodies of Lepista sordida[J]. Carbohydrate Polymers, 2012, 88(3): 820-824.DOI:10.1016/j.carbpol.2011.12.043.
[4] HAN H P, XIE H C. A study on the extraction and purif i cation process of lily polysaccharide and its anti-tumor effect[J]. African Journal of Traditional, Complementary, and Alternative Medicines, 2013, 10(6):485-489. DOI:10.4314/ajtcam.v10i6.16.
[5] SUN Y, SUN T W, WANG F, et al. A polysaccharide from the fungi of Huaier exhibits anti-tumor potential and immunomodulatory effects[J]. Carbohydrate Polymers, 2013, 92(1): 577-582.DOI:10.1016/j.carbpol.2012.09.006.
[6] ZHU Z Y, LIU X C, FANG X N, et al. Structural characterization and anti-tumor activity of polysaccharide produced by Hirsutella sinensis[J]. International Journal of Biological Macromolecules, 2016,82: 959-966. DOI:10.1016/j.ijbiomac.2015.10.075.
[7] ZHANG C H, YU Y, LIANG Y Z, et al. Purif i cation, partial characterization and antioxidant activity of polysaccharides from Glycyrrhiza uralensis[J].International Journal of Biological Macromolecules, 2015, 79: 681-686.DOI:10.1016/j.ijbiomac.2015.05.060.
[8] ZHENG C P, DONG Q, CHEN H J, et al. Structural characterization of a polysaccharide from Chrysanthemum morifolium fl owers and its antioxidant activity[J]. Carbohydrate Polymers, 2015, 130: 113-121.DOI:10.1016/j.carbpol.2015.05.004.
[9] JIANG J Y, KONG F S, LI N S, et al. Purification, structural characterization and in vitro antioxidant activity of a novel polysaccharide from Boshuzhi[J]. Carbohydrate Polymers, 2016, 147:365-371. DOI:10.1016/j.carbpol.2016.04.001.
[10] LI Y X, YANG Z H, LIN Y, et al. Antifatigue effects of ethanol extracts and polysaccharides isolated from Abelmoschus esculentus[J]. Pharmacognosy Magazine, 2016, 12(47): 219-224. DOI:10.4103/0973-1296.186341.
[11] LIAO C H, GUO S J, LIN J Y. Characterisation of the chemical composition and in vitro anti-inflammation assessment of a novel lotus(Nelumbo nucifera Gaertn) plumule polysaccharide[J]. Food Chemistry,2011, 125(3): 930-935. DOI:10.1016/j.foodchem.2010.09.082.
[12] BATISTA J A, DIAS E G N, BRITO T V, et al. Polysaccharide isolated from Agardhiella ramosissima: chemical structure and antiinflammation activity[J]. Carbohydrate Polymers, 2014, 99: 59-67.DOI:10.1016/j.carbpol.2013.08.071.
[13] DENG Y T, LIN-SHIAU S Y, SHYUR L F, et al. Pu-erh tea polysaccharides decrease blood sugar by inhibition of alphaglucosidase activity in vitro and in mice[J]. Food & Function, 2015,6(5): 1539-1546. DOI:10.1039/c4fo01025f.
[14] LI X H, LI Y, CHENG Z Y, et al. The Effects of Phellinus linteus polysaccharide extracts on cholesterol efflux in oxidized low-density lipoprotein-loaded THP-1 macrophages[J]. Journal of Investigative Medicine, 2015, 63(5): 752-757. DOI:10.1097/Jim.0000000000000201.
[15] KOLSI R B, BEN GARA A, CHAABEN R, et al. Anti-obesity and lipid lowering effects of Cymodocea nodosa sulphated polysaccharide on high cholesterol-fed-rats[J]. Archives of Physiology and Biochemistry,2015, 121(5): 210-217. DOI:10.3109/13813455.2015.1105266.
[16] ZHANG K F, GAO Y, ZHONG M L, et al. Hepatoprotective effects of Dicliptera chinensis polysaccharides on dimethylnitrosamineinduced hepatic fibrosis rats and its underlying mechanism[J].Journal of Ethnopharmacology, 2016, 179: 38-44. DOI:10.1016/j.jep.2015.12.053.
[17] 马海乐, 周存山, 郑悦, 等. 超声降解条斑紫菜多糖的反应动力学[J]. 化工学报, 2007, 58(3): 660-664. DOI:10.3321/j.issn:0438-1157.2007.03.021.
[18] 任瑞, 马海乐, 刘斌, 等. 超声降解香菇多糖及其体外抗氧化活性的研究[J]. 安徽农业科学, 2008, 36(17): 7061-7062; 7065.DOI:10.3969/j.issn.0517-6611.2008.17.005.
[19] 李坚斌, 李琳, 李冰, 等. 超声降解多糖研究进展[J]. 食品工业科技,2006, 29(9): 181-184. DOI:10.3969/j.issn.1002-0306.2006.09.058.
[20] 游丽君, 刘钧发, 冯梦莹, 等. 酶法水解金针菇多糖及其产物特性分析[J]. 现代食品科技, 2013, 29(7): 1486-1490.
[21] 陈文, 王楠, 张民. 燕麦多糖的纤维素酶降解及理化性质分析[J]. 中国食品添加剂, 2014(2): 159-163. DOI:10.3969/j.issn.1006-2513.2014.02.022.
[22] XU Z L, SUN Y M, YANG Y H, et al. Effect of γ-irradiation on some physiochemical properties of konjac glucomannan[J]. Carbohydrate Polymers, 2007, 70(4): 444-450. DOI:10.1016/j.carbpol.2007.05.011.
[23] 龚志华, 陈美丽, 肖文军. 辐照降解茯苓多糖效应研究[J]. 分析测试学报, 2010, 29(10): 1011-1016. DOI:10.3969/j.issn.1004-4957.2010.10.005.
[24] 王镜岩, 朱圣庚, 徐长法. 生物化学[M]. 3版. 北京: 高等教育出版社,2002: 73-74.
[25] ZHA Shenghua, ZHAO Qingsheng, CHEN Jinjin, et al. Extraction,purification and antioxidant activities of the polysaccharides from maca (Lepidium meyenii)[J]. Carbohydrate Polymers, 2014, 111: 584-587. DOI:10.1016/j.carbpol.2014.05.017.
[26] 吴继洲, 孔令仪. 天然药物化学[M]. 北京: 中国医药科技出版社,2008: 219-220.
[27] TOKITA Y, OKAMOTO A. Hydrolytic degradation of hyaluronicacid[J]. Polymer Degradation and Stability, 1995, 48(2): 269-273.DOI:10.1016/0141-3910(95)00041-J.
[28] 杨世林, 热娜·卡斯木. 天然药物化学[M]. 北京: 科学出版社, 2010:126-132.
[29] ZHANG X D, AMELUNG W. Gas chromatographic determination of muramic acid, glucosamine, mannosamine, and galactosamine in soils[J]. Soil Biology and Biochemistry, 1996, 28(9): 1201-1206.DOI:10.1016/0038-0717(96)00117-4.
[30] HARAZONO A, KOBAYASHI T, KAWASAKI N, et al. A comparative study of monosaccharide composition analysis as a carbohydrate test for biopharmaceuticals[J]. Biologicals, 2011, 39(3):171-180. DOI:10.1016/j.biologicals.2011.04.002.
[31] CHEN F T A, DOBASHI T S, EVANGELISTA R A. Quantitative analysis of sugar constituents of glycoproteins by capillary electrophoresis[J]. Glycobiology, 1998, 8(11): 1045-1052.DOI:10.1093/glycob/8.11.1045.
[32] BECKER M, ZWECKMAIR T, FORNECK A, et al. Evaluation of different derivatisation approaches for gas chromatographic-mass spectrometric analysis of carbohydrates in complex matrices of biological and synthetic origin[J]. Journal of Chromatography A, 2013,1281: 115-126. DOI:10.1016/j.chroma.2013.01.053.
[33] 付昆, 叶强. 高效毛细管电泳法分析附子多糖中单糖组分[J]. 中国药业, 2014, 23(13): 17-19.
[34] YU W J, JIANG T F, WANG Y H, et al. Determination of the monosaccharide composition of polysaccharides from rhizomaphragmitis and pollen typhae by capillary zone electrophoresis[J]. Transactions of Oceanology and Limnology,2010(2): 162-168.
[35] 范嘉龙, 马丽苹, 叶红, 等. 苦丁冬青苦丁茶多糖的单糖组成分析[J].食品科学, 2013, 34(11): 72-76. DOI:10.7506/spkx1002-6630-201311017.
[36] CHEN J Y, YANG F F, GUO H Z, et al. Optimized hydrolysis and analysis of Radix Asparagi polysaccharide monosaccharide composition by capillary zone electrophoresis[J]. Journal of Separation Science, 2015, 38(13): 2327-2331. DOI:10.1002/jssc.201500120.
[37] ZHANG Ping, WANG Zhongfu, XIE Mingming, et al. Detection of carbohydrates using a pre-column derivatization reagent 1-(4-isopropyl) phenyl-3-methyl-5-pyrazolone by high-performance liquid chromatography coupled with electrospray ionization mass spectrometry[J]. Journal of Chromatography B-Analytical Technologies in the Biomedical and Life Sciences, 2010, 878(15/16):1135-1144. DOI:10.1016/j.jchromb.2010.03.027.
[38] FAN J L, WU Z W, ZHAO T H, et al. Characterization, antioxidant and hepatoprotective activities of polysaccharides from Ilex latifolia Thunb[J]. Carbohydrate Polymers, 2014, 101: 990-997. DOI:10.1016/j.carbpol.2013.10.037.
[39] LI G Y, LI L Y, XUE C H, et al. Prof i ling pneumococcal type 3-derived oligosaccharides by high resolution liquid chromatography-tandem mass spectrometry[J]. Journal of Chromatography A, 2015, 1397:43-51. DOI:10.1016/j.chroma.2015.04.009.
[40] ZHANG S J, LI C L, ZHOU G Y, et al. Determination of the carbohydrates from Notopterygium forbesii Boiss by HPLC with fluorescence detection[J]. Carbohydrate Polymers, 2013, 97(2):794-799. DOI:10.1016/j.carbpol.2013.05.041.
[41] ALWAEL H, CONNOLLY D, PAULL B. Liquid chromatographic profiling of monosaccharide concentrations in complex cell-culture media and fermentation broths[J]. Analytical Methods, 2011, 3(1):62-69. DOI:10.1039/c0ay00516a.
[42] SHEN X D, PERREAULT H. Characterization of carbohydrates using a combination of derivatization, high-performance liquid chromatography and mass spectrometry[J]. Journal of Chromatography A, 1998, 811(1/2): 47-59. DOI:10.1016/S0021-9673(98)00238-6.
[43] SUZUKI S, TANAKA R, TAKADA K, et al. Analysis of sialo-N-glycans in glycoproteins as 1-phenyl-3-methyl-5-pyrazolone derivatives by capillary electrophoresis[J]. Journal of Chromatography A, 2001, 910(2): 319-329. DOI:10.1016/S0021-9673(00)01228-0.
[44] HONDA S, SUZUKI S, NOSE A, et al. Capillary zone electrophoresis of reducing mono- and oligo-saccharides as the borate complexes of their 3-methyl-1-phenyl-2-pyrazolin-5-one derivatives[J].Carbohydrate Research, 1991, 215(1): 193-198. DOI:10.1016/0008-6215(91)84018-A.
[45] JANINI G M, ISSAQ H J. Micellar electrokinetic capillary chromatography-basic considerations and current trends[J].Journal of Liquid Chromatography, 1992, 15(6/7): 927-960.DOI:10.1080/10826079208018846.
[46] HONDA S, TOGASHI K, UEGAKI K, et al. Enhancement of the zone electrophoretic separation of 1-phenyl-3-methyl-5-pyrazolone derivatives of aldoses as borate complexes by concerted ioninteraction electrokinetic chromatography with Polybrene[J]. Journal of Chromatography A, 1998, 805(1/2): 277-284. DOI:10.1016/S0021-9673(98)00015-6.
[47] GUAN J, LI S P. Discrimination of polysaccharides from traditional Chinese medicines using saccharide mapping: enzymatic digestion followed by chromatographic analysis[J]. Journal of Pharmaceutical and Biomedical Analysis, 2010, 51(3): 590-598. DOI:10.1016/j.jpba.2009.09.026.
[48] WU Xiaodan, JIANG Wei, LU Jiajia, et al. Analysis of the monosaccharide composition of water-soluble polysaccharides from Sargassum fusiforme by high performance liquid chromatography/electrospray ionisation mass spectrometry[J]. Food Chemistry, 2014,145: 976-983. DOI:10.1016/j.foodchem.2013.09.019.
[49] 邢其毅, 裴伟伟, 徐瑞秋, 等. 基础有机化学[M]. 3版. 北京: 高等教育出版社, 2005: 939.
[50] 刑其毅, 裴伟伟, 徐瑞秋, 等. 基础有机化学[M]. 3版. 北京: 高等教育出版社, 2005: 507.
[51] 林炳承.毛细管电泳导论[M]. 北京: 科学出版社, 1996: 1-4.
[52] 牟世芬, 李宗利. 阴离子交换分离-脉冲安培检测分析糖类化合物的进展[J]. 色谱, 1995, 13(5): 320-324.
[53] 毛秀丽, 林炳承. 糖类的毛细管电泳及芯片毛细管电泳[J]. 色谱,2001, 19(4): 309-312. DOI:10.3321/j.issn:1000-8713.2001.04.006.
[54] 陈伟才, 冯津津, 秦庆军, 等. 糖蛋白寡糖及单糖色谱分析的研究进展[J]. 天津药学, 2000, 24 (4): 13-15.
[55] KANG E K, LEE B M, HWANG H A, et al. Analysis of mono-sugars obtained by acid hydrolysis of algae-based polysaccharides[J]. Journal of Industrial and Engineering Chemistry, 2012, 18(4): 1366-1369.DOI:10.1016/j.jiec.2012.01.037.
[56] SONG X L, NAVARRO S L, DIEP P, et al. Comparison and validation of 2 analytical methods for measurement of urinary sucrose and fructose excretion[J]. Nutrition Research, 2013, 33(9): 696-703.DOI:10.1016/j.nutres.2013.05.017.
[57] YI P, LI N S, ZHANG D Z, et al. Structural characterization and antioxidant activity of a heteropolysaccharide from Ganoderma capense[J]. Carbohydrate Polymers, 2015, 121: 183-189.DOI:10.1016/j.carbpol.2014.11.034.
[58] WANG F X, WANG W, HUANG Y L, et al. Characterization of a novel polysaccharide purif i ed from a herb of Cynomorium songaricum Rupr.[J]. Food Hydrocolloids, 2015, 47: 79-86. DOI:10.1016/j.foodhyd.2015.01.006.
[59] LIU X K, WANG L, ZHANG C M, et al. Structure characterization and antitumor activity of a polysaccharide from the alkaline extract of king oyster mushroom[J]. Carbohydrate Polymers, 2015, 118: 101-106. DOI:10.1016/j.carbpol.2014.10.058.
[60] YANG L C, HSIEH C C, LIN W C. Characterization and immunomodulatory activity of rice hull polysaccharides[J].Carbohydrate Polymers, 2015, 124: 150-156. DOI:10.1016/j.carbpol.2015.02.025.
[61] SHALABY M A, ISBELL H S, ELKHADEM H S. Oxidation of monosaccharides with oxygen in alkaline-solution-separation,identif i cation and estimation of the aldonic acids produced by liquidchromatography[J]. Journal of Carbohydrate Chemistry, 1995, 14(3):429-437. DOI:10.1080/07328309508002082.
[62] 赵庆生. 芦笋废弃资源的生物炼制[D]. 北京: 中国科学院, 2012: 81.
[63] GUO Yuanheng, CAO Lili, ZHAO Qingsheng, et al. Preliminary characterizations, antioxidant and hepatoprotective activity of polysaccharide from Cistanche deserticola[J]. International Journal of Biological Macromolecules, 2016, 93: 673-685. DOI:10.1016/j.ijbiomac.2016.09.039.
[64] LEIJDEKKERS A G M, SANDERS M G, SCHOLS H A, et al.Characterizing plant cell wall derived oligosaccharides using hydrophilic interaction chromatography with mass spectrometry detection[J]. Journal of Chromatography A, 2011, 1218(51): 9227-9235. DOI:10.1016/j.chroma.2011.10.068.
[65] SUN Y J, YANG B Y, WU Y M, et al. Structural characterization and antioxidant activities of κ-carrageenan oligosaccharides degraded by different methods[J]. Food Chemistry, 2015, 178: 311-318.DOI:10.1016/j.foodchem.2015.01.105.
[66] REMOROZA C, CORD-LANDWEHR S, LEIJDEKKERS A G M, et al. Combined HILIC-ELSD/ESI-MSnenables the separation, identification and quantification of sugar beet pectin derived oligomers[J]. Carbohydrate Polymers, 2012, 90(1): 41-48.DOI:10.1016/j.carbpol.2012.04.058.
[67] JIMÉNEZ-SÉNCHEZ C, LOZANO-SÁNCHEZ J, MARTI N, et al.Characterization of polyphenols, sugars, and other polar compounds in persimmon juices produced under different technologies and their assessment in terms of compositional variations[J]. Food Chemistry,2015, 182: 282-291. DOI:10.1016/j.foodchem.2015.03.008.
[68] SALAS D, BORRULL F, FONTANALS N, et al. Hydrophilic interaction liquid chromatography coupled to high-resolution mass spectrometry to determine artificial sweeteners in environmental waters[J]. Analytical and Bioanalytical Chemistry, 2015, 407(15):4277-4285. DOI:10.1007/s00216-014-8330-6.
[69] BOLDIZSAR I, FUZFAI Z, MOLNAR-PERL I. Characterization of the endogenous enzymatic hydrolyses of Petroselinum crispum glycosides: determined by chromatography upon their sugar and fl avonoid products[J]. Journal of Chromatography A, 2013, 1293: 100-106. DOI:10.1016/j.chroma.2013.03.037.
[70] YOU Chao, YAO Tandong, GAO Shaopeng, et al. Simultaneous determination of levoglucosan, mannosan and galactosan at trace levels in snow samples by GC/MS[J]. Chromatographia, 2014,77(13/14): 969-974. DOI:10.1007/s10337-014-2702-0.
[71] ACANSKI M M, VUJIC D N. Comparing sugar components of cereal and pseudocereal fl our by GC-MS analysis[J]. Food Chemistry, 2014,145: 743-748. DOI:10.1016/j.foodchem.2013.08.138.
[72] QIAN Weiliang, KHAN Z, WATSON D G, et al. Analysis of sugars in bee pollen and propolis by ligand exchange chromatography in combination with pulsed amperometric detection and mass spectrometry[J]. Journal of Food Composition and Analysis, 2008,21(1): 78-83. DOI:10.1016/j.jfca.2007.07.001.
[73] XU Xianbing, LIU Dingbo, GUO Xiaoming, et al. Improvement of sugar analysis sensitivity using anion-exchange chromatographyelectrospray ionization mass spectrometry with sheath liquid interface[J]. Journal of Chromatography A, 2014, 1366: 65-72.DOI:10.1016/j.chroma.2014.09.019.
[74] NAGY G, POHL N L B. Complete hexose isomer identif i cation with mass spectrometry[J]. Journal of the American Society for Mass Spectrometry, 2015, 26(4): 677-685. DOI:10.1007/s13361-014-1072-z.
Recent Advances in Analytical Techniques for Monosaccharide Composition of Plant Polysaccharides
GUO Yuanheng1,2, ZHANG Lijun1,2, CAO Lili1, CHEN Jinjin1, LIU Boyan1,2, ZHAO Qingsheng1, ZHAO Bing1,*
(1. Division of Bioref i nery Engineering, State Key Laboratory of Biochemical Engineering, Institute of Process Engineering, Chinese Academy of Sciences, Beijing 100190, China; 2. University of Chinese Academy of Sciences, Beijing 100049, China)
Plant polysaccharides are important medicinal and food resources. Quantitative analysis of the monosaccharide composition of plant polysaccharides plays a fundamental role in the investigation of polysaccharide structures and characteristics. The analytical process includes the degradation of plant polysaccharides, and the separation and detection of monosaccharides. This article reviews recent research on the degradation of plant polysaccharides and the chemical modif i cation, separation and detection of the resulting monosaccharides, which will provide a theoretical basis for further study of plant polysaccharides.
plant polysaccharides; monosaccharide composition; quantitative analysis
10.7506/spkx1002-6630-201801049
TS207.3
A
1002-6630(2018)01-0326-07
郭元亨, 张利军, 曹丽丽, 等. 植物多糖中单糖组成分析技术的研究进展[J]. 食品科学, 2018, 39(1): 326-332.
DOI:10.7506/spkx1002-6630-201801049. http://www.spkx.net.cn
GUO Yuanheng, ZHANG Lijun, CAO Lili, et al. Recent advances in analytical techniques for monosaccharide composition of plant polysaccharides[J]. Food Science, 2018, 39(1): 326-332. (in Chinese with English abstract)
10.7506/spkx1002-6630-201801049. http://www.spkx.net.cn
2016-10-06
阿拉善肉苁蓉产业化关键技术研究及应用项目(中科)(KFA2013-189);国家自然科学基金青年科学基金项目(21506220)
郭元亨(1984—),男,博士,研究方向为高端药用植物资源的生化炼制。E-mail:guoyuanheng@163.com
*通信作者简介:赵兵(1984—),男,研究员,博士,研究方向为植物资源开发利用及植物细胞工程。E-mail:bzhao@home.ipe.ac.cn

