百里醌对阪崎克罗诺肠杆菌的抑制作用
石 超,孙慧慧,孙 正,郭 都,张文婷,孙 怡,陈怡飞,夏效东*
(西北农林科技大学食品科学与工程学院,陕西 杨凌 712100)
百里醌对阪崎克罗诺肠杆菌的抑制作用
石 超,孙慧慧,孙 正,郭 都,张文婷,孙 怡,陈怡飞,夏效东*
(西北农林科技大学食品科学与工程学院,陕西 杨凌 712100)
为探究百里醌对阪崎克罗诺肠杆菌的抑制作用及可能的抑制机理,检测了百里醌对阪崎克罗诺肠杆菌的最小抑菌浓度(minimal inhibitory concentrations,MIC)及对其生长动力学模型的影响,并测定百里醌处理后阪崎肠杆菌胞内ATP浓度、胞内pH值、膜电位、细胞膜完整性的变化,最后利用场发射扫描电子显微镜观察细胞形态的改变。结果表明:百里醌对阪崎克罗诺肠杆菌的MIC为0.3~0.6 mg/mL;百里醌使阪崎克罗诺肠杆菌的生长迟滞期延长,最大生长速率减小;百里醌影响了阪崎克罗诺肠杆菌细胞膜的通透性,表现为:质量浓度为MIC和2×MIC的百里醌使细胞内ATP浓度由6.52 μmol/L分别降低为0.27 μmol/L和0.17 μmol/L,胞内pH值分别由5.69降低为5.22和4.99,细胞膜完整菌体比例分别降低至80%和22%,引起细胞膜膜电位超极化;场发射扫描电子显微镜观测表明百里醌使阪崎克罗诺肠杆菌细胞膜褶皱,菌体干瘪。综上所述,百里醌是通过影响细胞膜通透性和改变细胞形态抑制阪崎克罗诺肠杆菌。这些结果表明百里醌有潜力作为控制阪崎克罗诺肠杆菌的天然抑菌剂应用于食品中。
阪崎克罗诺肠杆菌;百里醌;细胞膜;膜电位
阪崎克罗诺肠杆菌(Cronobacter sakazakii)是一种革兰氏阴性、杆状、无芽孢、兼性厌氧、周生鞭毛的食源性条件致病菌[1],它能造成新生儿脑膜炎、菌血症、坏死性小肠结肠炎等多种疾病,致死率高达50%以上[2]。免疫力低下的成年人(主要是老人)食用被阪崎克罗诺肠杆菌污染的食物也能导致骨髓炎、脓毒症、脚溃疡等多种疾病的发生。目前在临床治疗中多使用抗生素治疗阪崎克罗诺肠杆菌感染,虽可以使患者康复,但是常常伴随有严重的神经系统后遗症和发育障碍等症状[3]。鉴于阪崎克罗诺肠杆菌的巨大潜在危害,2 0 0 2年食品微生物标准委员会(I n t e r n a t i o n a l Commissionon Microbiological Specifications for Foods,ICMSF)把阪崎肠杆菌描述为“对特定人群造成严重危害,危及生命或引起长期慢性实质性后遗症的细菌”[4]。
预防和控制食源性致病菌对于各国的公共健康卫生具有重要的意义。为抑制和杀灭食品中的病原微生物,食品加工生产过程中通常以添加天然合成防腐剂来保证食品安全、延长食品货架期。然而由于合成的物质往往具有潜在的毒性,近年来部分研究者将目光集中到植物来源,尤其是水果、蔬菜和中草药等的活性物质上[5]。消费者在消费过程中也倾向于选择“零添加”或低含量防腐剂的产品[6]。植物源活性物质以其消费者接受度高及来源范围广被认为是合成防腐剂的最佳替代品[7]。
百里醌(thymoquinone,TQ),是黑种草(Nigella sativa)中的主要成分,占黑种草油含量的28%~57%[8]。黑种草,又称为黑小茴香,是一种毛莨科一年生草本芳香植物[9],被用作香料、食品添加剂在食品生产中广为应用,同时它也被作为药物用来治疗哮喘、腹泻、头痛、鼻塞、背部疼痛、高血压和胃肠道问题[9-10],目前黑种草已被美国食品药品监督管理局确认为公认安全的食品成分(GRAS 182.10)。研究表明,百里醌具有多种生物活性作用,包括抗肿瘤、抗炎、抑菌、抗氧化等[8,11-12]。
尽管百里醌已被报道对多种微生物有抑制效果,但其对阪崎克罗诺肠杆菌的抑制作用及机理鲜有研究。鉴于此,本实验旨在探讨百里醌对阪崎克罗诺肠杆菌的抑菌效果,并通过检测其对细菌生长动力学模型、胞内ATP、胞内pH值、膜电位、细胞膜完整性及细胞形态的影响探讨其可能的抑菌机理。
1 材料与方法
1.1 菌株与试剂
阪崎克罗诺肠杆菌(Cronobacter sakazakii)ATCC 29544、ATCC 29004、ATCC 12868和ATCC BAA-894购于美国模式菌株收集中心;阪崎克罗诺肠杆菌分离菌株12-2、14-15、18-7、18-8和18-13由西北农林科技大学食品科学与工程学院食品微生物研究团队分离自市售婴幼儿乳粉及米粉。
百里醌(色谱级,纯度≥9 8%)、荧光探针DiBAC4(3)及cFDA-SE 美国Sigma公司;胰蛋白胨大豆琼脂(tryptone soya agar,TSA)、胰蛋白胨大豆肉汤(tryptone soya broth,TSB)培养基 北京陆桥技术有限公司;ATP检测试剂盒 上海碧云天生物技术公司;LIVE/DEAD®BacLightTM细菌活性检测试剂盒 美国赛默飞世尔科技公司;其他所用有机溶剂均为国产分析纯。
1.2 仪器与设备
InfiniteTMM200 PRO多功能酶标仪 瑞士Tecan公司;SmartSpecTMPlus分光光度计 美国Bio-Rad公司;5804R低温冷冻离心机 德国Eppendorf公司;S-4800场发射扫描电子显微镜 日本Hitachi公司;微生物全自动生长曲线分析仪 芬兰Bioscreen公司;SCIENTZ-IID超声波裂解仪 宁波新芝生物科技股份有限公司。
1.3 方法
1.3.1 菌种活化
将冻存于-80 ℃的阪崎克罗诺肠杆菌采用划线法在TSA平板上活化,挑取单菌落接种于30 mL TSB培养基中,将其置于37 ℃培养18 h使细菌处于对数生长后期,培养后的菌液经5 000×g离心15 min,去除上清液,用磷酸盐缓冲液(phosphate buffered saline,PBS)洗涤菌体沉淀,反复洗涤3 次后,用一定量的PBS悬浮菌体沉淀,测定并调整菌悬液的OD600nm为0.5,使菌液浓度约为108CFU/mL。
1.3.2 最小抑菌浓度测定
最小抑菌浓度(minimal inhibitory concentrations,MIC)的测定采用琼脂稀释法[13]。将冷却至45 ℃的TSA培养基加入24 孔培养板中,向其中加入百里醌并进行稀释,使百里醌质量浓度为0.80、0.60、0.40、0.30、0.20、0.10、0.05 mg/mL,充分吹打混匀,培养基在室温下放置至凝固。吸取2 μL菌悬液(1.3.1节方法制备)接种至24 孔板各孔中央。将24 孔板放置于37 ℃培养箱中培养24 h后观测结果,其中可抑制阪崎克罗诺肠杆菌出现增长的最低质量浓度即为百里醌的MIC。实验以不含有百里醌的培养基作为阴性对照,含有1 mg/mL氨苄西林的培养基为阳性对照。
1.3.3 百里醌对阪崎克罗诺肠杆菌生长动力学模型影响的测定
按照1.3.1节中的方法制备ATCC 29544菌悬液,调整菌悬液OD600nm为0.5并稀释100 倍,使菌悬液浓度约为106CFU/mL。向96 孔培养板中每孔加入125 µL的菌悬液和125 µL不同质量浓度的百里醌溶液(TSB培养基配制),使百里醌的最终质量浓度为2×MIC、MIC、1/2×MIC、1/4×MIC、1/8×MIC、1/16×MIC和1/32×MIC,背景空白对照组添加250 µL TSB培养基,样品对照组添加125 µL菌悬液及125 µL TSB培养基。设置微生物全自动生长曲线分析仪培养温度为37 ℃并每隔1 h检测600 nm波长处的OD值。
以培养时间为横坐标,菌悬液OD600nm值为纵坐标,绘制生长曲线。选取修正Gompertz模型(式(1~3))拟合其生长状况,并表征菌株的生长参数。利用SPSS软件中的非线性回归方法拟合A、B、µ、λ、M和µmax等参数值,以相关系数R2作为评估因子模型的拟合度。
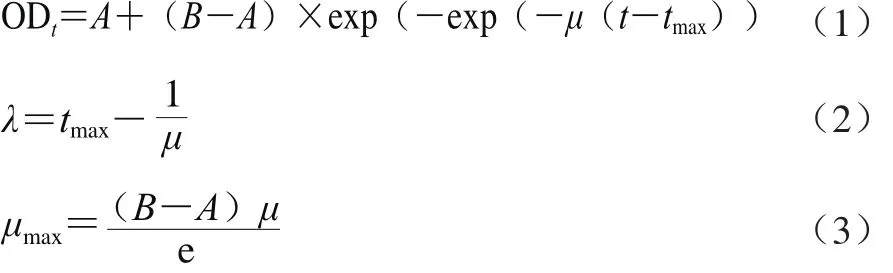
式中:ODt为在t时菌液的OD600nm值;t为培养时间/h;B为最大菌液浓度时的OD600nm值;A为初始菌液浓度时的OD600nm值;tmax为菌株达到指数期所用时间/h;µ为指数期的相对生长速率/h-1;λ为迟滞期/h;µmax为最大生长速率/h-1。
1.3.4 百里醌对阪崎克罗诺肠杆菌胞内ATP的影响
按照1.3.1节方法制备菌悬液,用PBS调整菌悬液的OD600nm为0.5。样品实验组中添加菌悬液及百里醌溶液(0、MIC和2×MIC),背景空白对照组添加PBS及百里醌溶液,将样品置于37 ℃培养箱中培养30 min。随后裂解超声,具体方法如下:将样品冰浴,逐个超声,每超声3 s停顿5~7 s,一轮超声10 次,超声4 轮;超声时,探头置于液面下约1 cm处,同时与离心管底部保持一定距离。每个样品超声结束后立即将离心管于100 ℃温度下处理2~3 min使样品中ATP酶灭活。将样品离心取上清液,根据ATP检测试剂盒说明书进行实验,使用多功能酶标仪测定样品上清液的荧光强度。同时,使用ATP检测裂解液将ATP标准溶液稀释成0.01、0.10、1.00、10.00 µmol/L的4 个浓度梯度,绘制荧光强度与ATP浓度间的标准曲线,并根据标准曲线计算样品中ATP的浓度。
1.3.5 百里醌对阪崎克罗诺肠杆菌肠杆菌胞内pH值的影响
菌液制备同1.3.1节,将培养后的菌液4 ℃、5 000×g离心5 min,去除上清液,并用磷酸钾缓冲液洗涤一次,调整菌悬液的OD600nm为0.5。用4-羟乙基哌嗪乙磺酸缓冲液洗涤菌体2 次,加入磷酸钾缓冲液重悬浮,加入cFDA-SE荧光探针使其终浓度为3 µmol/L(37 ℃培养箱中孵育20 min),随后用磷酸钾缓冲液洗涤一次,重新悬浮,加入葡萄糖使其终浓度为10 µmol/L(37 ℃培养箱中孵育30 min),最后用磷酸钾缓冲液洗涤菌体2 次并重悬浮菌体。实验使用磷酸钾缓冲液配制百里醌溶液,实验组将百里醌溶液添加至菌悬液中,使百里醌质量浓度分别为0、MIC和2×MIC,背景空白对照组为磷酸钾缓冲液配制的百里醌溶液,样品于37 ℃培养箱中培养20 min。
为构建标准曲线,使用50 mmol/L甘氨酸、50 mmol/L氯化钾、50 mmol/L柠檬酸、50 mmol/L磷酸二氢钠溶液配制pH值为3、4、5、6、7、8、9、10的缓冲液,用氢氧化钠、盐酸溶液调节pH值。标准曲线组每孔加入200 µL上述缓冲液、30 µL菌液、10 µL尼日利亚菌素(10 µmol/L)和10 µL缬氨霉素(10 µmol/L)。使用多功能酶标仪测定发射波长520 nm,激发波长分别为490、440 nm时的荧光强度,绘制490 nm和440 nm时荧光强度的比值与pH值间的线性关系,并根据标准曲线计算样品组胞内pH值。
1.3.6 百里醌对阪崎克罗诺肠杆菌膜电位的影响
细菌膜电位的测定参照Sanchez等[14]的方法,菌液制备同1.3.1节,以PBS洗涤菌体2 次并调整菌悬液OD600nm为0.5。将125 µL菌悬液加入黑色96 孔酶标板中,置于37 ℃培养箱中培养30 min。随后向每孔中加入细胞膜电位荧光探针DiBAC4(3)(1 µmol/L),并再次37 ℃孵育30 min。然后将125 µL百里醌溶液加入黑色酶标板各孔中,使百里醌的质量浓度分别为0、MIC和2×MIC。百里醌作用5 min后使用多功能酶标仪检测荧光强度,激发、发射波长分别为492、515 nm。激发和发射缝隙宽度分别为3、5 nm。通过计算百里醌作用组与对照组的相对荧光强度(处理组检测所得荧光强度减去对照组检测所得荧光强度),分析细菌膜电位的变化。若细胞内荧光强度增加,即膜电位增加,表示细胞去极化;反之,细胞内荧光强度降低,即膜电位降低,表示细胞超极化[24]。
1.3.7 百里醌对阪崎克罗诺肠杆菌细胞膜完整性的影响
参照Shi Chao等[15]的方法,使用LIVE/DEAD®BacLightTM细菌活性检测试剂盒检测百里醌对阪崎克罗诺肠杆菌细胞膜完整性的影响。具体方法如下:菌液制备同1.3.1节,将菌液4 ℃、10 000×g离心15 min,使用0.85% NaCl溶液洗涤菌体2 次,随后加入2 mL 0.85% NaCl溶液。将重悬菌悬液分别取1 mL加入到20 mL 0.85% NaCl溶液(活菌组)和70%异丙醇溶液(死菌组)中,于25 ℃培养箱中培养1 h。使用0.85% NaCl溶液洗脱2~3 次后将两组样品调整至OD600nm为0.5(两组误差不超过0.01)。添加百里醌于0.85% NaCl溶液处理的菌液中,使百里醌质量浓度为0、MIC和2×MIC,并在37 ℃孵育30 min后,离心去掉上清液,加入相同体积的0.85% NaCl溶液重悬。
以不同体积活菌组菌悬液和死菌组菌悬液配制不同活菌比例(0%、10%、50%、90%、100%)的菌悬液,在黑色96 孔酶标板中设置样品空白对照孔(0.85% NaCl溶液)、样品孔和标准曲线孔,并向所有孔内加入相同体积2×SYTO/PI染料,充分吹打混匀。将96 孔酶标板置于25 ℃条件下培养5~10 min。使用多功能酶标仪检测荧光强度,SYTO染料的激发及发射波长分别为485、542 nm,PI染料的激发及发射波长分别为485、610 nm。
1.3.8 百里醌对阪崎克罗诺肠杆菌细胞形态的影响
场发射扫描电子显微镜对阪崎克罗诺肠杆菌细胞形态的观测参照Li Guanghui等[16]的方法,具体如下:按1.3.1节方法制备菌悬液,将添加不同质量浓度百里醌(0、MIC和2×MIC)的菌液(OD600nm为0.5)置于37 ℃培养箱中培养,分别在2 h和4 h取出样品。随后,使用PBS洗涤菌体2 次,并将菌体重新悬浮于2.5%戊二醛-PBS中固定(4 ℃)。12 h后依次使用PBS、无菌水洗涤菌体,并将菌体置于1%锇酸中固定5 h,随后使用不同体积分数(30%、50%、70%、80%、90%和100%)的乙醇梯度脱水,每次10 min。将样品滴加至专用盖玻片并贴附于场发射扫描电子显微镜载物台,样品抽真空脱水2 h后镀金,使用场发射扫描电子显微镜观测细菌细胞形态。
1.4 数据统计分析
2 结果与分析
2.1 百里醌对阪崎克罗诺肠杆菌的MIC
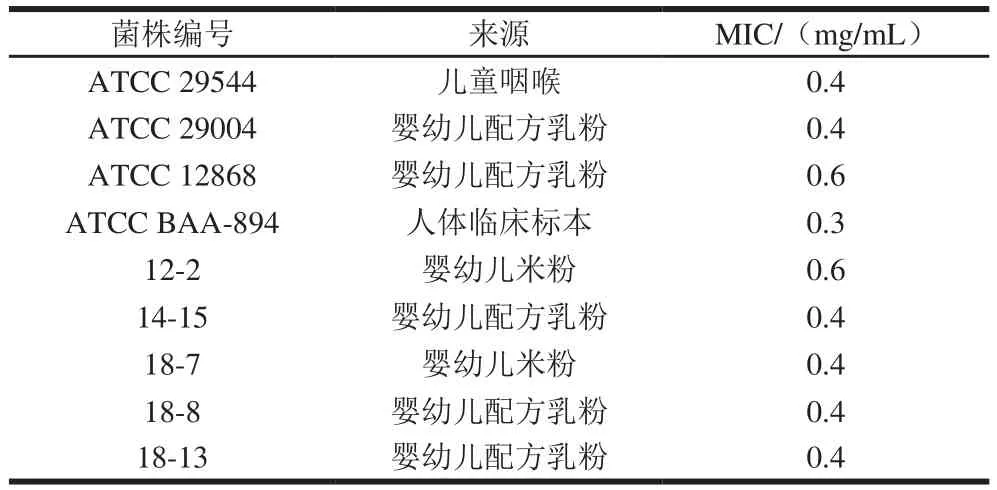
表1 百里醌对阪崎克罗诺肠杆菌的MICTable 1 Minimum inhibitory concentrations of thymoquinone against C. sakazakii
百里醌对9 株食品或临床来源的阪崎克罗诺肠杆菌有良好的抑制效果。由表1可知,百里醌对阪崎克罗诺肠杆菌ATCC 29544、ATCC 29004的MIC为0.4 mg/mL,对4 种食品来源的分离菌(14-15、18-7、18-8、18-13)的MIC也为0.4 mg/mL。百里醌对ATCC 12868及分离菌12-2的MIC为0.6 mg/mL,对ATCC BAA-894的MIC为0.3 mg/mL。为了进一步探讨百里醌对阪崎克罗诺肠杆菌的抑菌机理,选择ATCC 29544进行后续的实验。国内外一些研究也报道了植物源抑菌剂对阪崎克罗诺肠杆菌有抑制效果,如香芹酚和百里酚[17]、辛酸、柠檬酸、香草醛[18]、反式-肉桂醛[18]、蓝莓花青素和野生蓝莓汁[19],对比其他的植物源抑菌剂,百里醌对阪崎克罗诺肠杆菌具有较强的抑菌效果。
2.2 百里醌对阪崎克罗诺肠杆菌生长动力学模型的影响
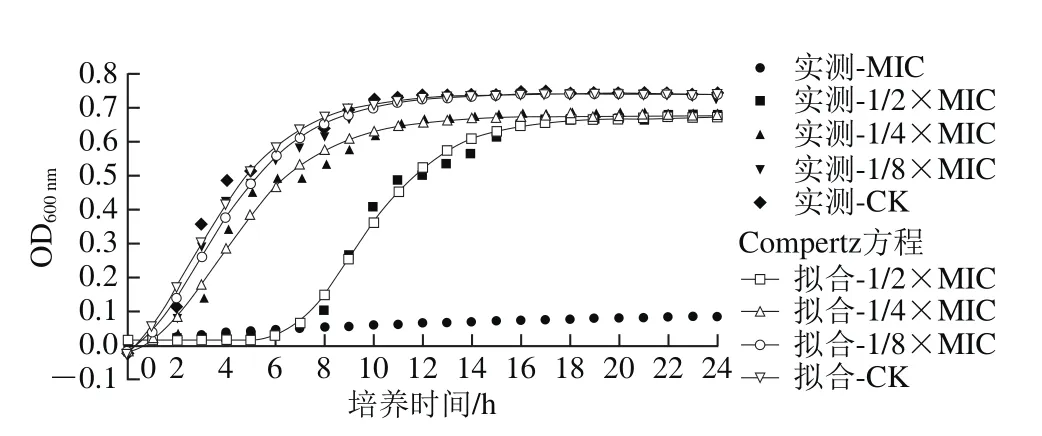
图1 百里醌对阪崎克罗诺肠杆菌ATCC 29544生长曲线的影响Fig. 1 Growth curves of C. sakazakii ATCC 29544 cultured in TSB with various concentrations of thymoquinone
阪崎克罗诺肠杆菌在含有不同质量浓度百里醌的TSB中的生长曲线如图1所示,应用修正Gompertz方程拟合ATCC 29544的生长曲线,各拟合方程的R2均大于0.98,表明此方程能够较好地拟合菌株的生长状况。由图1可以看出,在TSB培养液中,质量浓度为MIC的百里醌几乎完全抑制阪崎克罗诺肠杆菌的生长。当百里醌质量浓度为1/2×MIC时,阪崎克罗诺肠杆菌在6 h内几乎没有生长,生长17 h达到细菌数量的最大值。
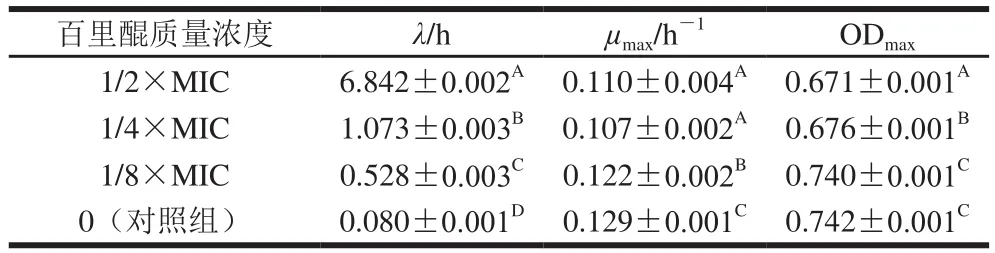
表2 阪崎克罗诺肠杆菌在含有不同质量浓度百里醌的TSB中的生长动力学参数(n=6)Table 2 Kinetic parameters of C. sakazakii cells during growth in TSB with different concentrations of thymoquinone (n= 6)
菌株的生长参数如表2所示,百里醌使阪崎克罗诺肠杆菌在TSB中生长迟滞期增长,最大生长速率减小,并呈现浓度依赖效应。
2.3 百里醌对阪崎克罗诺肠杆菌胞内ATP浓度的影响
萤火虫荧光素酶催化荧光素产生荧光时需要ATP提供能量,并当萤火虫荧光素酶和荧光素都过量时,在一定的浓度范围内荧光的产生和ATP的浓度成正比,据此首先构建标准曲线,得到ATP浓度与相对荧光强度之间呈现良好的线性关系(y=21 365x+2 381;R2=0.999)。
由图2可知,百里醌对阪崎克罗诺肠杆菌胞内ATP含量有极显著的降低作用(P<0.01),并呈现浓度依赖效应。未经百里醌处理的对照组胞内ATP浓度为6.52 μmol/L,经质量浓度为MIC的百里醌处理的实验组胞内ATP浓度降为0.27 μmol/L,经质量浓度为2×MIC的百里醌处理的实验组降为0.17 μmol/L。ATP是细胞内能量代谢、酶反应和信号调节的基础,对细胞生长、分裂和存活等细胞功能有着关键作用[20]。本实验中百里醌使阪崎肠杆菌胞内ATP显著降低,从而影响细菌存活。Li Guanghui等[16]也有类似的发现,绿原酸处理金黄色葡萄球菌细胞使细菌胞内ATP浓度降低。胞内ATP浓度的降低可以归因于细菌自身水解速率增加[14],以及细胞膜通透性的损伤,使胞内ATP流出[20]。
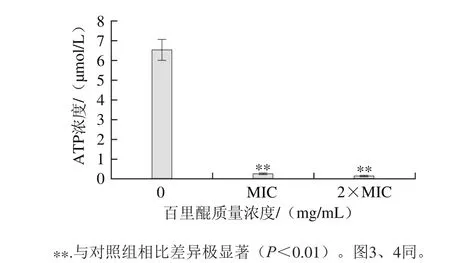
图2 百里醌对阪崎克罗诺肠杆菌ATCC 29544胞内ATP浓度的影响Fig. 2 Effect of thymoquinone on intracellular ATP production in C. sakazakii ATCC 29544
2.4 百里醌对阪崎克罗诺肠杆菌胞内pH值的影响
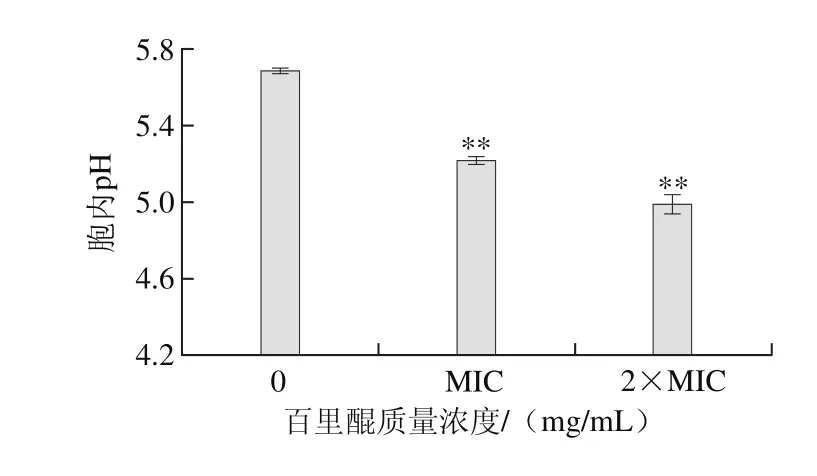
图3 百里醌对阪崎克罗诺肠杆菌ATCC 29544胞内pH值的影响Fig. 3 Effect of thymoquinone on intracellular pH of C. sakazakii ATCC 29544
由图3可知,百里醌对阪崎克罗诺肠杆菌胞内pH值有极显著的影响(P<0.01)。未经百里醌处理的阪崎肠杆菌胞内pH值为5.69±0.01,经质量浓度为MIC的百里醌处理后,阪崎肠杆菌胞内pH值降低为5.22±0.02,经质量浓度为2×MIC的百里醌处理后,阪崎肠杆菌胞内pH值降低为4.99±0.05。
细菌pH值对于细胞内的DNA的转录与合成、酶活性及蛋白质合成等有非常重要的影响[21]。Turgis等[22]研究表明了芥末精油使大肠杆菌O157:H7胞内pH值从6.23降低为5.20,使鼠伤寒沙门氏菌胞内pH值从6.59降至5.44,胞内pH值的改变意味着细胞膜的损伤[14]。
2.5 百里醌对阪崎克罗诺肠杆菌细胞膜电位的影响
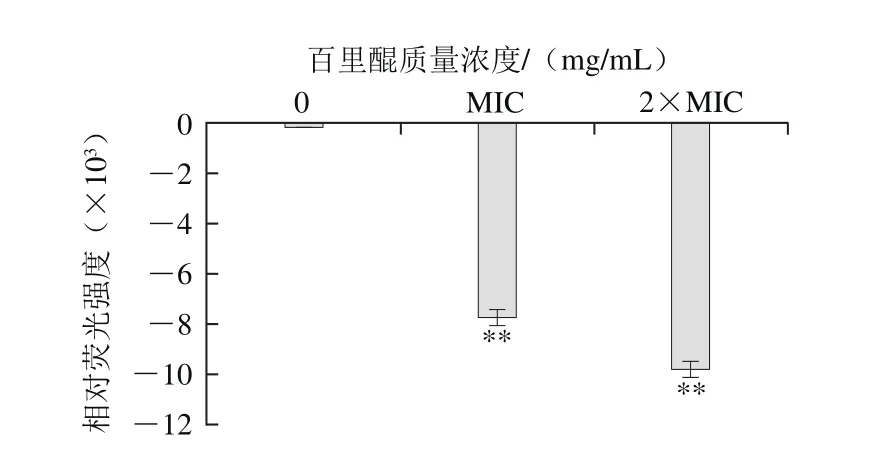
图4 百里醌对阪崎克罗诺肠杆菌ATCC 29544细胞膜电位的影响Fig. 4 Effect of thymoquinone on membrane potentials of C. sakazakii ATCC 29544
由图4可知,经百里醌处理的阪崎克罗诺肠杆菌细胞膜出现超级化(负相对荧光强度),并且经质量浓度为2×MIC百里醌处理比质量浓度MIC的处理后超级化现象更加明显。静息膜电位是活细胞的重要参数之一,与抑菌物质杀灭细菌作用密切相关[23]。实验所使用的阴离子荧光染料DiBAC4(3)是一种细胞膜电位敏感的亲脂性阴离子荧光染料,可以指示细胞膜电位的变化[18]。DiBAC4(3)本身无荧光,当进人细胞与胞浆内的蛋白质结合后才发出荧光,DiBAC4(3)进入细胞,细胞内荧光强度增加,即膜电位增加表示细胞去极化;反之,细胞内荧光强度降低即膜电位降低表示细胞超极化[24]。
通过实验可以得出,百里醌引起阪崎肠杆菌细胞膜超极化,这与紫苏、白蒿和金合欢提取物引起细菌细胞膜的超极化现象一致[14]。研究表明,出现超极化和去极化现象的原因为:pH值的改变及抑菌物质影响细菌细胞膜上离子的运动,特别是K+,从而影响胞体的自动调节[25]。
2.6 百里醌对阪崎克罗诺肠杆菌细胞膜完整性的影响

表3 不同质量浓度百里醌处理对阪崎克罗诺肠杆菌ATCC 29544细胞膜荧光强度的影响Table 3 Fluorescence of C. sakazakii ATCC 29544 treated with various concentrations of thymoquinone
绿色荧光强度与细胞膜完整细胞百分比呈现良好的线性关系,线性拟合方程为y=32 769x+10 632(R2=0.99)。由表3可知,与对照组相比,经百里醌处理的阪崎克罗诺肠杆菌细胞膜完整性极显著下降(P<0.01)。未经百里醌处理的对照组细胞膜完整菌体比例为96%,仅经过质量浓度为MIC的百里醌处理15 min后,细胞膜完整菌体比例下降至80%。经质量浓度为2×MIC百里醌处理后,细胞膜完整的细菌比例仅为22%。Campos等[26]也得到相似结论,添加不同浓度的没食子酸能够显著降低希氏乳杆菌的细胞膜完整性。Cherrat等[27]证明最小抑菌浓度的月桂精油能够在细菌适宜生长的温度下损伤大肠杆菌及单增李斯特菌细胞膜。
2.7 百里醌对阪崎克罗诺肠杆菌细胞形态的影响
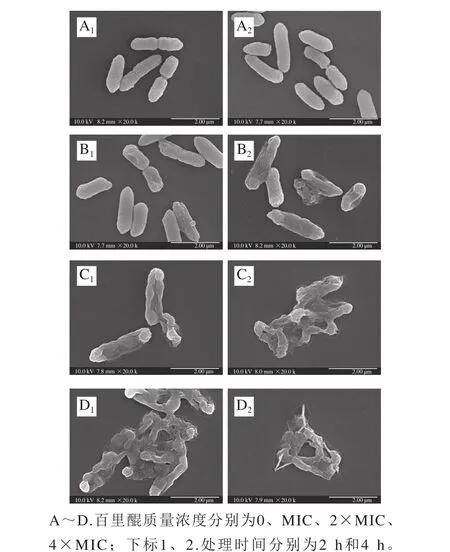
图5 场发射扫描电子显微镜观测百里醌对阪崎克罗诺肠杆菌ATCC 29544细胞形态的影响(20 000×)Fig. 5 Field emission scanning electron electron microscopic observation of the effect of thymoquinone on morphology of C. sakazakii ATCC 29544 (20 000 ×)
由图5可知,未经百里醌处理和经由百里醌处理的细菌细胞形态存在明显差异。未经百里醌处理的阪崎克罗诺肠杆菌表面光滑、饱满,具有典型的革兰氏阴性杆菌的形态,并且细胞能够生长和分裂(图5A1、A2)。但经过百里醌处理后,阪崎肠杆菌表面褶皱,菌体干瘪。经4×MIC的百里醌处理后,阪崎肠杆菌菌体出现大面积塌陷,丧失了其固有形态(图5D1、D2)。阪崎克罗诺肠杆菌细胞的受损程度和受损的比例随着百里醌质量浓度的增加而升高。
植物源活性物质对其他多种病原菌细胞形态的改变也有类似报道。di Pasqua等[28]发现丁子香酚能够破坏大肠杆菌O157:H7的细胞膜,导致细胞内容物流出。然而其他天然物质(香芹酚、肉桂醛、柠檬烯和百里酚)仅能导致外膜形态的改变。Rhayour等[29]发现丁香精油对于不同病原菌细胞形态的作用不同。作用大肠杆菌后,细胞膜表面出现孔洞,但对于枯草芽孢杆菌,菌体仅出现变形。在本实验中,百里醌使菌体细胞表面塌陷但并没有造成细胞膜破裂、瓦解。这说明百里醌是通过与细胞膜表面特定位点结合然后渗透到靶位点并影响其目标分子[30]。
3 结 论
本研究以百里醌为研究对象,以阪崎克罗诺肠杆菌为作用主体,探究百里醌对阪崎克罗诺肠杆菌的抑菌作用及可能的抑菌机理。利用琼脂稀释法测定了百里醌对9 株阪崎克罗诺肠杆菌的MIC为0.3~0.6 mg/mL。测定百里醌对阪崎克罗诺肠杆菌生长曲线的影响,并利用修正Gompertz模型拟合其生长状况,表征菌株的生长参数。结果表明百里醌使阪崎克罗诺肠杆菌生长迟滞期显著增长,最大生长速率显著减小。接着探索了百里醌对阪崎克罗诺肠杆菌细胞膜通透性的影响:利用萤火虫荧光素酶检测百里醌对胞内ATP的影响,利用cFDA-SE荧光探针检测百里醌对胞内pH值的影响,利用DiBAC4(3)荧光探针检测百里醌对细胞膜电位的影响,利用LIVE/DEAD®BacLightTM细菌活性检测试剂盒检测百里醌对阪崎克罗诺肠杆菌细胞膜完整性的影响。结果表明百里醌影响了阪崎克罗诺肠杆菌细胞膜的通透性,表现为:质量浓度为MIC和2×MIC的百里醌使细胞内ATP浓度由6.52 μmol/L分别降低为0.27 μmol/L和0.17 μmol/L,胞内pH值由5.69分别降低为5.22和4.99,细胞膜完整菌体比例分别降低至80%和22%,引起细胞膜膜电位超极化。最后通过场发射扫描电子显微镜观测百里醌对阪崎克罗诺肠杆菌细胞形态的影响,结果表明百里醌作用使细胞膜皱缩,细胞干瘪,部分菌体丧失了原有的细胞形态。上述结果表明:百里醌对阪崎克罗诺肠杆菌有着良好的抑制效果,是通过影响细胞膜的通透性及引起细胞功能紊乱来实现其抑菌作用。研究结果为百里醌作为天然抑菌剂在食品中发挥其控制阪崎克罗诺肠杆菌的作用提供了理论依据。然而,百里醌对于食品感官品质的影响及食品成分对于百里醌抑菌作用的干扰需要在实际应用前进一步探讨。
[1] 任立松, 陈卓, 马龙, 等. 阪崎肠杆菌新疆分离株侵袭乳鼠器官特征研究[J]. 新疆医科大学学报, 2010, 33(6): 614-616. DOI:10.3969/j.issn.1009-5551.2010.06.007.
[2] 刘咪, 杨保伟, 夏效东, 等. 阪崎克罗诺肠杆菌致病性机理研究进展[J]. 食品科学, 2014, 35(9): 329-333. DOI:10.7506/spkx1002-6630-201409064.
[3] 李秀桂. 阪崎肠杆菌污染婴幼儿食品流行病学特征研究进展[J]. 大众科技, 2009(9): 137-139. DOI:10.3969/j.issn.1008-1151.2009.09.068.
[4] IVERSEN C, FORSYTHE S. Risk prof i le of Enterobacter sakazakii,an emergent pathogen associated with infant milk formula[J]. Trends in Food Science & Technology, 2003, 14(11): 443-454. DOI:10.1016/S0924-2244(03)00155-9.
[5] CUSHNIE T P, LAMB A J. Recent advances in understanding the antibacterial properties of flavonoids[J]. International Journal of Antimicrobial Agents, 2011, 38(2): 99-107. DOI:10.1016/j.ijantimicag.2011.02.014.
[6] GYAWALI R, IBRAHIM S A. Natural products as antimicrobial agents[J]. Food Control, 2014, 46: 412-429. DOI:10.1016/j.foodcont.2014.05.047.
[7] TAJKARIMI M M, IBRAHIM S A, CLIVER D O. Antimicrobial herb and spice compounds in food[J]. Food Control, 2010, 21(9):1199-1218. DOI:10.1016/j.foodcont.2010.02.003.
[8] GALI-MUHTASIB H, ROESSNER A, SCHNEIDER-STOCK R.Thymoquinone: a promising anti-cancer drug from natural sources[J].International Journal of Biochemistry and Cell Biology, 2006, 38(8):1249-1253. DOI:10.1016/j.biocel.2005.10.009.
[9] RAGHEB A, ATTIA A, ELDIN W S, et al. The protective effect of thymoquinone, an anti-oxidant and anti-inflammatory agent, against renal injury: a review[J]. Saudi Journal of Kidney Diseases and Transplantation, 2009, 20(5): 741-752.
[10] ALI B H, BLUNDEN G. Pharmacological and toxicological properties of Nigella sativa[J]. Phytotherapy Research, 2003, 17(4): 299-305.DOI:10.1002/Ptr.1309.
[11] BADARY O A, AL-SHABANAH O A, NAGI M N, et al. Acute and subchronic toxicity of thymoquinone in mice[J]. Drug Development Research, 1998, 44(2/3): 56-61. DOI:10.1002/(Sici)1098-2299(199806/07)44:2/3<56::Aid-Ddr2>3.0.Co;2-9.
[12] HARZALLAH H J, KOUIDHI B, FLAMINI G, et al. Chemical composition, antimicrobial potential against cariogenic bacteria and cytotoxic activity of Tunisian Nigella sativa essential oil and thymoquinone[J]. Food Chemistry, 2011, 129(4): 1469-1474.DOI:10.1016/j.foodchem.2011.05.117.
[13] FRANKOVA A, MAROUNEK M, MOZROVA V, et al. Antibacterial activities of plant-derived compounds and essential oils toward Cronobacter sakazakii and Cronobacter malonaticus[J]. Foodborne Pathogens and Disease, 2014, 11(10): 795-797. DOI:10.1089/fpd.2014.1737.
[14] SANCHEZ E, GARCIA S, HEREDIA N. Extracts of edible and medicinal plants damage membranes of Vibrio cholerae[J]. Applied and Environmental Microbiology, 2010, 76(20): 6888-6894.DOI:10.1128/Aem.03052-09.
[15] SHI Chao, ZHANG Xiaorong, SUN Yi, et al. Antimicrobial activity of ferulic acid against Cronobacter sakazakii and possible mechanism of action[J]. Foodborne Pathogens and Disease, 2016, 13(4): 196-204.DOI:10.1089/fpd.2015.1992.
[16] LI Guanghui, WANG Xin, XU Yunfeng, et al. Antimicrobial effect and mode of action of chlorogenic acid on Staphylococcus aureus[J].European Food Research and Technology, 2014, 238(4): 589-596.DOI:10.1007/s00217-013-2140-5.
[17] LEE S Y, JIN H H. Inhibitory activity of natural antimicrobial compounds alone or in combination with nisin against Enterobacter sakazakii[J]. Letters in Applied Microbiology, 2008, 47(4): 315-321.DOI:10.1111/j.1472-765X.2008.02432.x.
[18] JANG H I, RHEE M S. Inhibitory effect of caprylic acid and mild heat on Cronobacter spp. (Enterobacter sakazakii) in reconstituted infant formula and determination of injury by flow cytometry[J].International Journal of Food Microbiology, 2009, 133(1/2): 113-120.DOI:10.1016/j.ijfoodmicro.2009.05.009.
[19] JOSHI S S, HOWELL A B, D’SOUZA D H. Cronobacter sakazakii reduction by blueberry proanthocyanidins[J]. Food Microbiology,2014, 39: 127-131. DOI:10.1016/j.fm.2013.11.002.
[20] MEMPIN R, TRAN H, CHEN C, et al. Release of extracellular ATP by bacteria during growth[J]. BMC Microbiology, 2013, 13: 1-13.DOI:10.1186/1471-2180-13-301.
[21] BREEUWER P, DROCOURT J, ROMBOUTS F M, et al. A novel method for continuous determination of the intracellular pH in bacteria with the internally conjugated fl uorescent probe 5 (and 6-)-carboxyfluorescein succinimidyl ester[J]. Applied Environmental Microbiology, 1996, 62(1): 178-183.
[22] TURGIS M, HAN J, CAILLET S, et al. Antimicrobial activity of mustard essential oil against Escherichia coli O157:H7 and Salmonella typhi[J]. Food Control, 2009, 20(12): 1073-1079. DOI:10.1016/j.foodcont.2009.02.001.
[23] MATES S M, EISENBERG E S, MANDEL L J, et al. Membrane potential and gentamicin uptake in Staphylococcus aureus[J].Proceedings of the National Academy of Sciences, 1982, 79(21):6693-6697.
[24] WHITEAKER K L, GOPALAKRISHNAN S M, GROEBE D, et al.Validation of FLIPR membrane potential dye for high throughput screening of potassium channel modulators[J]. Journal of Biomolecular Screening, 2001, 6(5): 305-312. DOI:10.1089/108705701753200518.
[25] BOT C, PRODAN C. Probing the membrane potential of living cells by dielectric spectroscopy[J]. European Biophysics Journal with Biophysics Letters, 2009, 38(8): 1049-1059. DOI:10.1007/s00249-009-0507-0.
[26] CAMPOS F M, COUTO J A, FIGUEIREDO A R, et al. Cell membrane damage induced by phenolic acids on wine lactic acid bacteria[J]. International Journal of Food Microbiology, 2009, 135(2):144-151. DOI:10.1016/j.ijfoodmicro.2009.07.031.
[27] CHERRAT L, DUMAS E, BAKKALI M, et al. Effect of essential oils on cell viability, membrane integrity and membrane fl uidity of Listeria innocua and Escherichia coli[J]. Journal of Essential Oil Bearing Plants, 2016, 19(1): 155-166. DOI:10.1080/0972060X.2015.1029986.
[28] DI PASQUA R, BETTS G, HOSKINS N, et al. Membrane toxicity of antimicrobial compounds from essential oils[J]. Journal of Agricultural and Food Chemistry, 2007, 55(12): 4863-4870. DOI:10.1021/Jf0636465.
[29] RHAYOUR K, BOUCHIKHI T, TANTAOUI-ELARAKI A, et al.The mechanism of bactericidal action of oregano and clove essential oils and of their phenolic major components on Escherichia coli and Bacillus subtilis[J]. Journal of Essential Oil Research, 2003, 15(5):356-362.
[30] BAJPAI V K, SHARMA A, BAEK K H. Antibacterial mode of action of Cudrania tricuspidata fruit essential oil, affecting membrane permeability and surface characteristics of food-borne pathogens[J]. Food Control, 2013, 32(2): 582-590. DOI:10.1016/j.foodcont.2013.01.032.
Antimicrobial Activity of Thymoquinone against Cronobacter sakazakii
SHI Chao, SUN Huihui, SUN Zheng, GUO Du, ZHANG Wenting, SUN Yi, CHEN Yifei, XIA Xiaodong*
(College of Food Science and Engineering, Northwest A & F University, Yangling 712100, China)
The objective of the present study was to evaluate the effectiveness of thymoquinone (TQ) against Cronobacter sakazakii strains. The minimum inhibitory concentration (MIC) of TQ against C. sakazakii and its effect on microbial growth kinetics were determined. Changes in intracellular ATP concentration, intracellular pH (pHin), membrane potential and membrane integrity were measured to elucidate the possible antimicrobial mechanism. Cell morphology changes were also observed under a fi eld emission scanning electron microscope. The results showed that the MICs of TQ against C. sakazakii strains ranged from 0.3 to 0.6 mg/mL, and TQ exposure resulted in a longer lag phase and lower specif i c growth rate compared to the control. TQ affected the cell membrane permeability of C. sakazakii, as evidenced by a reduction in intracellular ATP concentration from 6.52 to 0.27 and 0.17 μmol/L and a decrease in pHinfrom 5.69 to 5.22 and 4.99 at MIC and 2 × MIC, respectively. TQ at both tested concentrations caused 80% and 22% reduction in cell integrity, respectively. In addition, cells treated with TQ showed hyperpolarized cell membrane. Field emission scanning electron microscopy illustrated that C. sakazakii cells exposed to TQ exhibited a more wrinkled surface compared with the smooth surface of untreated cells. In conclusion, TQ exerts its antimicrobial action partly by causing excessive permeability of the cell membrane and changing cell morphology. These fi ndings suggest that TQ has potential application in controlling C. sakazakii in foods.
Cronobacter sakazakii; thymoquinone; cell membrane; membrane potential
10.7506/spkx1002-6630-201801009
Q939.9
A
1002-6630(2018)01-0058-07
石超, 孙慧慧, 孙正, 等. 百里醌对阪崎克罗诺肠杆菌的抑制作用[J]. 食品科学, 2018, 39(1): 58-64.
10.7506/spkx1002-6630-201801009. http://www.spkx.net.cn
SHI Chao, SUN Huihui, SUN Zheng, et al. Antimicrobial activity of thymoquinone against Cronobacter sakazakii[J]. Food Science,2018, 39(1): 58-64. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201801009. http://www.spkx.net.cn
2016-09-04
“十二五”国家科技支撑计划项目(2015BAD16B08);中央高校基本科研业务费专项资金项目(2452017146)
石超(1989—),女,讲师,博士,研究方向为天然活性物质的抗菌功能。E-mail:meilixinong@126.com
*通信作者简介:夏效东(1981—),男,教授,博士,研究方向为天然活性物质的营养及抗菌功能。E-mail:foodscixiaodong@yahoo.com

