硫辛酸对阪崎克罗诺杆菌感染能力的抑制作用
郭 都,赵宇阳,王瑞霞,王 硕,夏效东,石 超
(西北农林科技大学食品科学与工程学院,陕西 杨凌 712100)
阪崎克罗诺杆菌(Cronobacter sakazakii)是一种新兴的食源性致病菌,直至2008年才被科学定义和分类[1]。阪崎克罗诺杆菌是一种革兰氏阴性、无芽孢、周身鞭毛的条件性致病菌[2]。该菌广泛分布于奶粉、水果以及蔬菜等食品中,流行病学研究表明婴幼儿奶粉是其可能的传播途径[3]。它可导致新生儿或早产儿出现危及生命的脑膜炎、菌血症以及坏死性小肠结肠炎等疾病,致死率高达80%[4]。即使此类由阪崎克罗诺杆菌感染引起的相关疾病被治愈,患者仍存在患有神经性发育迟缓、脑积水、四肢瘫痪等严重后遗症的风险[5]。因此,预防及控制阪崎克罗诺杆菌的感染对于保障婴幼儿健康具有重要意义。
使用抗生素是治疗和预防致病菌感染常见的方法,然而随着耐药菌株的出现,一些抗生素对这些菌株不再有效[6]。近年来,将植物源活性物质用于控制由致病菌引起的感染成为研究热点[7]。硫辛酸是一种天然的抗氧化剂,它能够螯合金属、消除活性物质从而修复细胞的氧化损伤。最初,硫辛酸被认为是一种维生素,广泛存在于菠菜、西兰花、番茄、豌豆、豆芽以及米糠中,其在人体血清中质量浓度约为16 mg/L[8-9]。研究表明硫辛酸对于糖尿病、肝损伤、动脉粥样硬化等疾病有一定的治疗潜力,已被一些国家作为膳食补充剂用于防治上述疾病[10]。研究表明,硫辛酸可通过改变阪崎克罗诺杆菌胞内pH值、降低胞外ATP、使细胞膜电位发生去极化从而抑制阪崎克罗诺杆菌[9]。此外,Kubra等[11]发现4 mmol/L硫辛酸对铜绿假单胞菌PAO1生物被膜形成的抑制率为28%。然而,硫辛酸对于其他细菌的抑制效果和机理鲜有报道。本实验旨在探究硫辛酸对于阪崎克罗诺杆菌体外感染能力的抑制作用。
基于以上研究背景,本实验通过评价硫辛酸对阪崎克罗诺杆菌运动能力、生物被膜形成能力、黏附及侵入肠上皮细胞能力以及在巨噬细胞中存活及增殖能力的影响,共同探究硫辛酸对阪崎克罗诺杆菌感染能力的抑制作用,以期为硫辛酸作为膳食补充剂预防或控制由阪崎克罗诺杆菌引起的相关食源性疾病提供理论依据。
1 材料与方法
1.1 菌株、材料与试剂
阪崎克罗诺杆菌ATCC 29544、29004和12868购于美国模式培养物集存库。阪崎克罗诺杆菌分离菌株6-16、15-7和18-11由西北农林科技大学食品科学与工程学院食品微生物安全实验室从婴幼儿奶粉及米粉中分离得到[12]。人克隆结肠腺癌上皮细胞(Caco-2)、小鼠巨噬细胞(RAW 264.7)购于武汉大学细胞保藏中心。
硫辛酸(纯度≥98%) 成都曼斯特生物科技有限公司;胰蛋白胨大豆琼脂(tryptone soya agar,TSA)、胰蛋白胨大豆肉汤(tryptone soya broth,TSB)培养基北京陆桥技术有限公司;Dulbecco’s modified Eagle’s medium(DMEM)细胞培养液 美国Gibco公司;胎牛血清(fetal bovine serum,FBS) 以色列Biological Industries公司;庆大霉素 美国Sigma公司;二甲基亚砜(dimethyl sulfoxide,DMSO)(纯度≥99.5%)天津市科密欧化学试剂有限公司;其他所用试剂均为国产分析纯。
1.2 仪器与设备
微生物全自动生长曲线分析仪 芬兰Bioscreen公司;5 8 0 4 R 低温冷冻离心机 德国E p p e n d o r f公司;HF90 CO2恒温培养箱 上海力申科技仪器有限公司;GHX-9050B-2细菌恒温培养箱 上海福玛实验设备有限公司;Model 680酶标仪 美国Bio-Rad公司。
1.3 方法
1.3.1 菌株活化及菌液制备
将冻存于-80 ℃冰箱的阪崎克罗诺杆菌平板划线于TSA培养基上并置于37 ℃恒温培养箱培养12 h进行活化。随后挑取单菌落接种于TSB培养基中,将接种了阪崎克罗诺杆菌的培养液置于37 ℃恒温摇床中培养12 h(130 r/min)。将培养后的菌悬液4 ℃、5 000×g离心5 min,去除上清液,随后使用pH 7.2磷酸盐缓冲液(phosphate buffered saline,PBS)洗涤2 次。最后用PBS重新悬浮菌体沉淀,并调整菌悬液在600 nm波长处的光密度值(OD600nm)为0.50±0.05,使菌液浓度约为108CFU/mL,备用。
1.3.2 硫辛酸对阪崎克罗诺杆菌最小抑菌浓度的测定
硫辛酸对阪崎克罗诺杆菌最小抑菌浓度(minimum inhibitory concentration,MIC)的测定参考Chen Huaiqiong等[13]所用的肉汤稀释法,并略有修改。具体方法如下:使用TSB培养基将1.3.1节所得菌液浓度调整至5×105CFU/mL。随后使用DMSO配制硫辛酸溶液,将配制好的硫辛酸溶液溶解于TSB培养基中,利用等倍稀释法配制不同浓度的硫辛酸溶液,并与上述菌液等体积混合使得硫辛酸终质量浓度为5.00、2.50、1.25、0.625、0.312 5、0 mg/mL(对照组,CK)(DMSO体积分数为0.5%)。将混合好的细菌-硫辛酸混合液以每孔200 μL的体积加入至96 孔板中。同时,实验设置含有体积分数0.5% DMSO的TSB培养基作为背景空白对照组以扣除溶剂对OD值造成的影响。此时,将样品置于酶标仪中测定各组样品在630 nm波长处的OD值。随后,将样品置于37 ℃恒温培养箱中培养24 h后再次测定OD630nm。经培养24 h后,OD值变化小于0.05所对应最小的硫辛酸质量浓度即为硫辛酸对阪崎克罗诺杆菌的MIC。
1.3.3 硫辛酸对阪崎克罗诺杆菌亚抑制浓度的测定
硫辛酸对阪崎克罗诺杆菌亚抑制浓度(sub-minimum inhibitory concentration,SIC)的测定参照Shi Chao等的方法[14]。按1.3.1节的方法制备阪崎克罗诺杆菌菌悬液。向百孔板每孔中加入125 μL菌悬液(约106CFU/mL),随后每孔加入125 μL使用TSB培养基配制的硫辛酸溶液,使硫辛酸质量浓度分别为480、240、120、60、30、15、7.5、3.75 μg/mL。实验设置不添加硫辛酸的菌悬液作为对照组(CK),并设置TSB培养基作为背景空白对照组。将样品置于微生物全自动生长曲线分析仪中,于37 ℃下每隔1 h测定24 h内各孔样品在波长600 nm波长处的OD值,绘制生长曲线,并选择对阪崎克罗诺杆菌生长无明显抑制作用的浓度作为硫辛酸对阪崎克罗诺杆菌的SIC。
1.3.4 硫辛酸对阪崎克罗诺杆菌运动能力的影响
硫辛酸对阪崎克罗诺杆菌泳动及群集运动能力影响的测定参照Li Guanghui等[15]的方法。首先,配制泳动营养平板(含0.3%(质量分数,下同)琼脂LB肉汤)和群集营养平板(含0.5%琼脂、0.5%葡萄糖LB肉汤),将配制好的溶液加热煮沸至完全溶解,121 ℃高压灭菌。待培养基温度降低至45 ℃左右时,向其中加入硫辛酸,使硫辛酸终质量浓度分别为0(CK)、30、60 μg/mL并充分混匀后倒入培养皿(直径90 mm)。待培养基冷却后,吸取5 μL 1.3.1节中制备的菌悬液分别接种至泳动平板和群集平板中央,于37 ℃分别培养7 h和18 h。随后使用凝胶成像系统进行拍照,并记录阪崎克罗诺杆菌向周围运动所形成的面积。
1.3.5 硫辛酸对阪崎克罗诺杆菌生物被膜形成能力的影响
参考Naves等[16]的方法,按1.3.1节的方法制备阪崎克罗诺杆菌菌悬液,并使用TSB调节菌悬液OD600nm=1(浓度约为109CFU/mL)。随后,向上述菌悬液中加入硫辛酸溶液使其终质量浓度分别为0(CK)、30、60 μg/mL。随后,将各组样品转移至96孔细胞培养板中,每孔250 μL。于25 ℃下培养48 h后,使用酶标仪测定各孔样品在630 nm波长处的OD值。随后,吸除菌液并使用无菌水将各孔漂洗一次,烘干后使用质量分数1%结晶紫溶液对生物被膜进行染色并使用无菌水漂洗未与生物被膜结合的结晶紫染料,烘干后使用体积分数33%冰乙酸溶液溶解生物被膜-结晶紫复合物。最后,测定每孔样品在570 nm波长处的OD值。使用OD570nm与OD630nm的比值表示阪崎克罗诺杆菌生物被膜形成能力指数(specific biofilm formation,SBF),其中OD570nm反映生物被膜形成量,OD630nm反映菌悬液中细菌的数量。
1.3.6 硫辛酸对阪崎克罗诺杆菌黏附及侵入Caco-2细胞能力的影响
硫辛酸对阪崎克罗诺杆菌黏附及侵入Caco-2细胞能力影响的测定参照Amalaradjou等[17]的方法略有修改。将对数生长期的Caco-2细胞以1×105个/mL的浓度接种于24 孔细胞培养板中,于37 ℃、5% CO2环境下培养18 h,并使用PBS轻柔清洗两次。菌悬液制备同1.3.1节,向其中添加硫辛酸溶液使得各组终质量浓度分别为0(CK)、30、60 μg/mL。随后将各组样品置于37 ℃摇床培养6 h(130 r/min)后,4 ℃、5 000×g离心5 min,并使用PBS清洗2 次。使用含有10%(体积分数)FBS的DMEM培养液调整菌液浓度为106CFU/mL。随后,将制备好的阪崎克罗诺杆菌接种于准备好的Caco-2细胞中,使得感染复数(multiplicity of infection,MOI)为10,600×g离心5 min,置于37 ℃、5% CO2环境下培养1 h。
黏附实验:去除细胞上清液,使用PBS轻柔清洗3 次。向每孔加入0.1%(体积分数)Triton X-100,置于4 ℃孵育20 min以裂解细胞。收集所有液体进行10 倍梯度稀释并涂布于TSA平板上,将样品置于37 ℃培养24 h后读数。黏附率以处理组黏附菌量与CK组黏附菌量的比值表示。
侵入实验:去除细胞上清液,使用PBS轻柔清洗一次。向每孔加入含有100 μg/mL庆大霉素的1%FBS-DMEM培养液,于37 ℃、5% CO2条件下培养30 min。随后去除细胞上清液,使用PBS轻柔清洗3 次后,向每孔加入0.1% Triton X-100,置于4 ℃孵育20 min以裂解细胞。收集所有液体进行10 倍梯度稀释并涂布于TSA平板上,将样品置于37 ℃培养24 h后读数。侵入率以处理组侵入菌量与CK组侵入菌量的比值表示。
1.3.7 硫辛酸对阪崎克罗诺杆菌在小鼠巨噬细胞RAW 264.7中存活及增殖能力的影响
本实验参照Shi Chao等[18]的方法。将对数生长期的RAW 264.7细胞以1×105细胞/mL的浓度接种于24 孔细胞培养板中于37 ℃、5% CO2环境下培养12 h,使用无菌PBS轻柔清洗3 次。菌悬液制备同1.3.1节,向其中添加硫辛酸溶液使得各组终质量浓度分别为0(CK)、30、60 μg/mL。随后将各组样品置于37 ℃摇床培养6 h(130 r/min)后,离心(5 000×g,5 min,4 ℃)并使用PBS清洗2 次。使用10% FBS-DMEM培养液调整菌悬液浓度为106CFU/mL。随后,将制备好的阪崎克罗诺杆菌接种于准备好的RAW 264.7细胞中,使得MOI为10,于37 ℃、5% CO2条件下培养45 min后,吸除孔板中的液体,并使用PBS清洗1 次;向每孔加入含有100 μg/mL庆大霉素的1% FBS-DMEM培养液,于37 ℃、5% CO2环境下培养30 min。去除细胞上清液,使用PBS清洗一次。向每孔加入含有10 μg/mL庆大霉素的1% FBS-DMEM培养液,于37 ℃、5% CO2环境下分别培养0、24、48、72 h。于对应的时间点,取出孔板并去除每孔细胞上清液,使用PBS清洗3 次。向每孔加入0.1% Triton X-100,置于4 ℃孵育20 min以裂解细胞。收集所有菌体进行10 倍梯度稀释并涂布于TSA平板上,将样品置于37 ℃培养24 h后读数。
1.4 数据统计与分析
实验至少进行3 次重复,数据以平均值±标准差表示,使用SPSS 19.0软件处理实验数据,结果采用t检验进行显著性比较。P<0.05为差异显著,P<0.01为差异极显著。
2 结果与分析
2.1 硫辛酸对阪崎克罗诺杆菌的MIC

表 1 硫辛酸对阪崎克罗诺杆菌的MICTable 1 MICs of LA against C. sakazakii strains
如表1所示,硫辛酸对阪崎克罗诺杆菌3 株标准菌株及3 株分离菌株的MIC均为5.00 mg/mL。因此,硫辛酸可有效抑制阪崎克罗诺杆菌。由于阪崎克罗诺杆菌标准菌株ATCC 29544具有泳动群集运动能力、生物被膜形成能力、黏附及侵入肠上皮细胞能力以及在巨噬细胞中存活及增殖能力等毒力因子表型和基因学特征[19],因此选择菌株ATCC 29544作为后续研究对象。
2.2 硫辛酸对阪崎克罗诺杆菌ATCC 29544的SIC
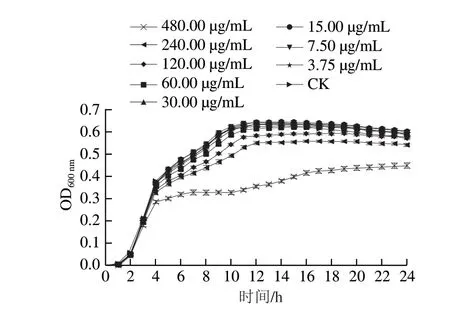
图 1 硫辛酸对阪崎克罗诺杆菌ATCC 29544生长曲线的影响Fig. 1 Effect of LA on the growth curve of C. sakazakii ATCC 29544
由图1可知,480、240、120 μg/mL硫辛酸可显著抑制阪崎克罗诺杆菌的生长。当硫辛酸质量浓度低于60 μg/mL时,在24 h内,硫辛酸对阪崎克罗诺杆菌的生长曲线没有明显影响,因此,本研究选择60、30 μg/mL作为硫辛酸对阪崎克罗诺杆菌的SIC。
2.3 硫辛酸对阪崎克罗诺杆菌ATCC 29544运动能力的影响
如图2所示,未使用硫辛酸处理的阪崎克罗诺杆菌其泳动圈面积为(24.91±0.72)cm2,经30、60 μg/mL硫辛酸处理后,阪崎克罗诺杆菌泳动圈面积分别极显著下降至(21.06±0.80)cm2和(18.40±1.04)cm2(P<0.01)。因此,硫辛酸可以抑制阪崎克罗诺杆菌的泳动能力,且呈现浓度依赖效应。
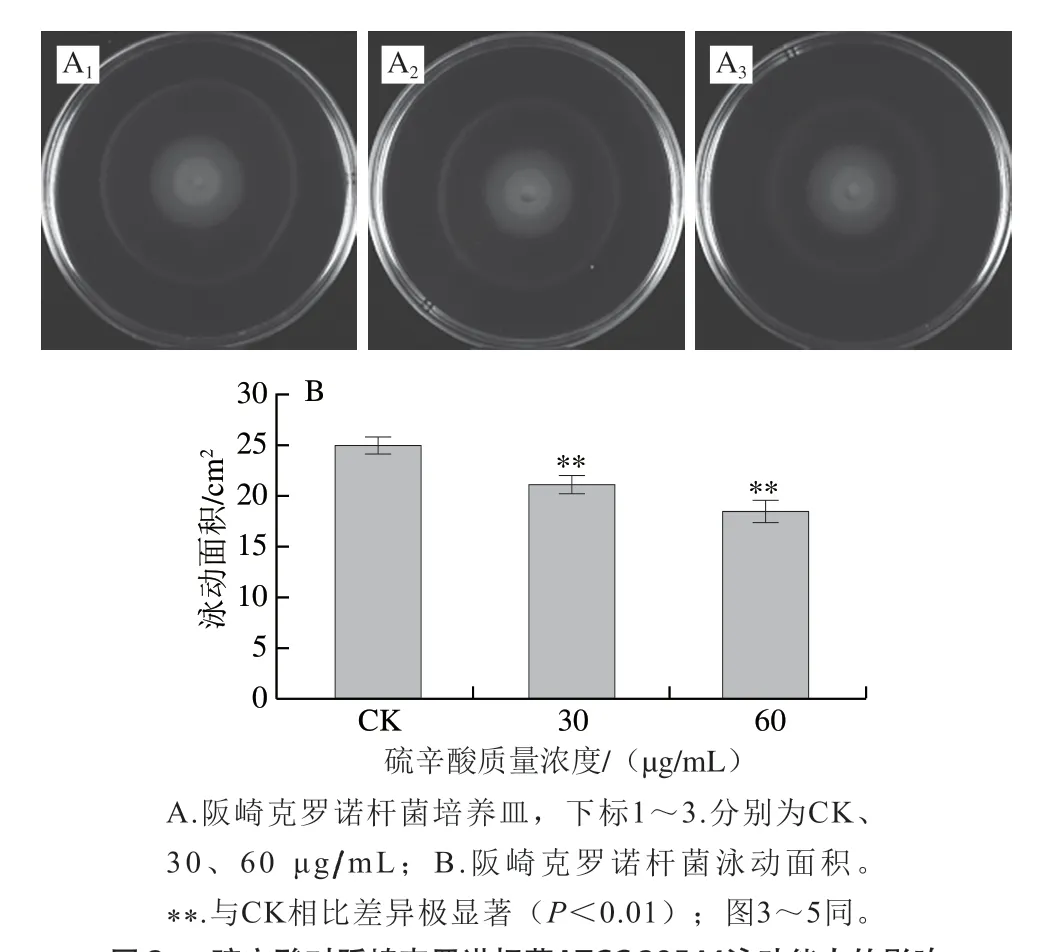
图 2 硫辛酸对阪崎克罗诺杆菌ATCC 29544泳动能力的影响Fig. 2 Effect of LA on swimming motility of C. sakazakii ATCC 29544

图 3 硫辛酸对阪崎克罗诺杆菌ATCC 29544群集能力的影响Fig. 3 Effect of LA on swarming motility of C. sakazakii ATCC 29544
由图3可知,30 μg/mL的硫辛酸对阪崎克罗诺杆菌群集运动面积无显著影响(P>0.05)。60 μg/mL的硫辛酸可显著减小阪崎克罗诺杆菌的群集运动圈面积,其面积极显著下降至CK组的71.41%(P<0.01)。
2.4 硫辛酸对阪崎克罗诺杆菌ATCC 29544生物被膜形成能力的影响
如图4所示,结果表明硫辛酸可显著降低阪崎克罗诺杆菌的生物被膜形成能力。未经硫辛酸处理的阪崎克罗诺杆菌SBF为2.31±0.26,经质量浓度为15 μg/mL的硫辛酸处理后,阪崎克罗诺杆菌SBF极显著下降至1.94±0.06(P<0.01)。经质量浓度为30、60 μg/mL的硫辛酸处理后,其生物被膜形成量分别极显著下降为CK组的82%和79%(P<0.01)。

图 4 硫辛酸对阪崎克罗诺杆菌ATCC 29544生物被膜形成能力的影响Fig. 4 Effect of LA on biofilm-forming capacity of C. sakazakii ATCC 29544
2.5 硫辛酸对阪崎克罗诺杆菌ATCC 29544黏附及侵入Caco-2细胞能力的影响
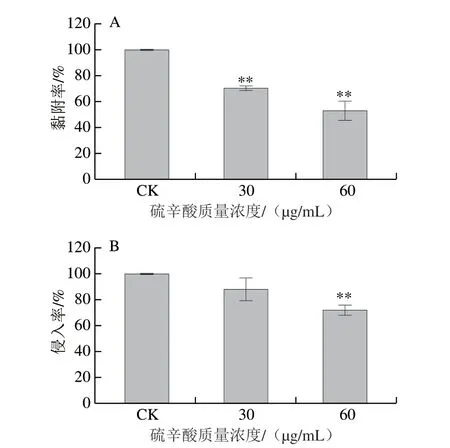
图 5 硫辛酸对阪崎克罗诺杆菌ATCC 29544黏附(A)及侵入(B)Caco-2细胞能力的影响Fig. 5 Effect of LA on the ability of C. sakazakii ATCC 29544 to adhere (A)and invade (B) Caco-2 cells
由图5A可知,SIC(60、30 μg/mL)的硫辛酸可极显著抑制阪崎克罗诺杆菌对Caco-2细胞的黏附能力(P<0.01)。经30、60 μg/mL的硫辛酸作用后,阪崎克罗诺杆菌对Caco-2细胞的黏附量分别下降至CK组的70.93%和53.27%。在侵入实验中(图5B),30 μg/mL的硫辛酸对阪崎克罗诺杆菌侵入细胞能力无显著影响(P>0.05)。60 μg/mL的硫辛酸可将侵入Caco-2细胞的阪崎克罗诺杆菌数量极显著下降至CK组的72.00%(P<0.01)。综上所述,硫辛酸可有效抑制阪崎克罗诺杆菌ATCC 29544黏附及侵入Caco-2细胞的能力。
2.6 硫辛酸对阪崎克罗诺杆菌ATCC 29544在RAW 264.7细胞中存活及增殖能力的影响
由图6可知,CK组中阪崎克罗诺杆菌在72 h内仍可在巨噬细胞中存活,并且在24~72 h内,阪崎克罗诺杆菌在巨噬细胞中存活并进行增殖。经质量浓度为30、60 μg/mL的硫辛酸处理后,阪崎克罗诺杆菌在72 h内在巨噬细胞中的存活量均有下降。且在72 h时,硫辛酸极显著降低了阪崎克罗诺杆菌在巨噬细胞中的存活量(P<0.01)。综上所述,SIC的硫辛酸可显著降低阪崎克罗诺杆菌在巨噬细胞RAW 264.7中存活及增殖能力。

图 6 硫辛酸对阪崎克罗诺杆菌ATCC 29544在巨噬细胞RAW 264.7中存活及增殖能力的影响Fig. 6 Effect of LA on survival and replication of C. sakazakii ATCC 29544 in RAW 264.7 cells
3 讨 论
细菌的感染能力与多种因素有关,其中菌体运动性、生物被膜形成能力、黏附及侵入宿主肠上皮细胞能力以及在巨噬细胞中存活及增殖能力等被认为是阪崎克罗诺杆菌感染宿主、造成宿主严重的系统性感染的重要原因[20]。本研究首先测定得出硫辛酸对阪崎克罗诺杆菌3 株标准菌株和3 株分离菌株的MIC均为5.00 mg/mL(表1)。随后确定硫辛酸对阪崎克罗诺杆菌ATCC 29544的SIC为30、60 μg/mL(图1)。在此基础上,本研究在不影响阪崎克罗诺肠杆菌存活及生长的条件下,从阪崎克罗诺杆菌运动能力、生物被膜形成能力、黏附及侵入宿主细胞能力以及在巨噬细胞中存活及增殖能力4 个方面,共同探究硫辛酸对阪崎克罗诺杆菌感染能力的体外抑制作用。
细菌的运动性与其对宿主的感染能力有着密切的联系,对其初步侵入并感染宿主细胞起到关键作用[21]。细菌依靠鞭毛运动定向侵入及作用于宿主细胞,因而运动性是致病菌一项重要的毒力因子,抑制致病菌的运动性是控制致病菌感染的有效途径[22]。本研究中,硫辛酸在SIC(30、60 μg/mL)下可抑制阪崎克罗诺杆菌的泳动及群集运动能力(图2、3)。前期研究结果表明,柠檬醛与百里醌在SIC下也可抑制阪崎克罗诺杆菌的泳动及群集运动能力[18-19]。类似地,100 μg/mL质量浓度的姜黄素可抑制副溶血性弧菌、哈维氏弧菌以及创伤弧菌的泳动和群集运动能力[23]。Bai Jinrong等证明0.312 5、0.625、1.25 mg/mL质量浓度的莽草酸可抑制金黄色葡萄球菌的运动能力[24]。在本研究中,硫辛酸抑制了阪崎克罗诺杆菌的泳动及群集运动能力,从而一定程度上降低了阪崎克罗诺杆菌在侵染初期对宿主细胞的定向侵入能力。
细菌的运动性在细菌黏附植物或动物组织表面过程中起到了重要的作用。细菌可通过这种能够附着在有生命或无生命材料表面的能力形成生物被膜,从而为细菌提供一定的物理保护屏障,使其能够抵抗多种外界压力,如热、渗透压、消毒剂以及抗生素等[25]。阪崎克罗诺杆菌可附着于塑料、玻璃、不锈钢以及硅胶等介质表面生长并形成生物被膜,该生存方式能够抵抗消毒剂的清除作用,增加易感人群感染的几率[7,26]。因此,抑制阪崎克罗诺杆菌生物被膜的形成能力有利于降低人体感染该菌的风险。本研究利用结晶紫可与生物被膜中胞外聚合物结合的特性,评价硫辛酸对阪崎克罗诺杆菌生物被膜形成能力的影响(图4)。类似地,Brackman等[27]使用经典结晶紫染色法证明肉桂醛可降低弧菌生物被膜的形成量。Kang Jiamu等[28]利用结晶紫染色法证明0.25~2.00 mg/mL质量浓度的没食子酸可显著抑制福氏志贺菌生物被膜形成量。Fan Qiuxia等[29]利用场发射扫描电子显微镜定性观察得到CoQ0可有效降低单增李斯特菌形成过程中的生物被膜黏附菌量。在本研究中,SIC的硫辛酸可显著降低阪崎克罗诺杆菌生物被膜形成能力,从而一定程度上降低其对外界环境的抵抗能力。Hartmann等[30]研究表明,鞭毛的缺失可大大降低细菌的附着能力,因此,硫辛酸对细菌运动能力及生物被膜形成能力的抑制作用是否是通过降低阪崎克罗诺杆菌鞭毛合成相关基因的表达来实现的,有待进一步探究。
致病菌对宿主细胞的黏附作用被认为是多数感染性疾病的起因,有研究表明,致病菌的黏附作用可使其依附于宿主细胞表面,避免被宿主的清洁机制清除[31]。同时黏附作用可使致病菌进一步侵入宿主细胞及组织进而引发宿主的感染[20,32]。经口摄入的阪崎克罗诺杆菌可通过黏附肠上皮细胞、穿越肠道屏障、侵入血管和宿主免疫系统从而穿透血脑屏障破坏宿主体内环境稳态进而引起宿主严重的系统性感染[20]。因此,阪崎克罗诺杆菌黏附并侵入宿主肠上皮细胞是引发系统性感染的第一步。研究表明,阪崎克罗诺杆菌ATCC 29544可黏附并侵入Caco-2细胞[33]。在本研究中,硫辛酸可有效抑制阪崎克罗诺杆菌黏附及侵入Caco-2细胞的能力(图5)。Amalaradjou等[17]证明肉桂醛可抑制阪崎克罗诺杆菌黏附及侵入宿主细胞人小肠上皮细胞INT 407、Caco-2细胞、大鼠小肠隐窝上皮细胞IEC-6及脑微血管内皮细胞BMEC细胞的能力。类似地,Li Guanghui等[15]发现SIC的安石榴苷可降低黏附及侵入人结肠癌细胞HT29的鼠伤寒沙门氏菌SL1344的菌量。研究表明,外膜蛋白OmpX和OmpA在阪崎克罗诺杆菌黏附宿主的过程中起到了重要的作用[34]。Shi Chao等[18]研究表明,百里醌可降低编码外膜蛋白OmpX和OmpA的基因的转录水平,从而一定程度上抑制阪崎克罗诺杆菌对HT29细胞的黏附及侵入作用。在本研究中,硫辛酸可降低阪崎克罗诺杆菌侵袭宿主细胞的能力,从而在阪崎克罗诺杆菌引发宿主感染的最初环节降低阪崎克罗诺杆菌的感染能力。
阪崎克罗诺杆菌能够在巨噬细胞内存活及增殖,这种能力使其能够逃避宿主的免疫应答,并进一步引发宿主更深层次的感染[35]。研究表明,阪崎克罗诺杆菌在被人巨噬细胞U937吞噬后能够继续在细胞中存活至96 h,其在巨噬细胞中复制和存活的能力使其得到了免疫系统的保护并有利于疾病的进一步扩散[36]。本研究结果表明,硫辛酸可显著降低阪崎克罗诺杆菌在巨噬细胞中的存活量及增殖量(图6)。前期研究表明,柠檬醛能够显著抑制阪崎克罗诺杆菌在巨噬细胞RAW 264.7内的生存和复制能力[19]。类似地,Muyyarikkandy等[37]证明SIC的乳酸菌代谢产物可抑制肠炎沙门氏菌、鼠伤寒沙门氏菌以及海德堡沙门氏菌在巨噬细胞中的存活能力。研究表明,阪崎克罗诺杆菌中的sod基因可编码超氧化物歧化酶,以合成该酶与巨噬细胞中的活性氧发生中和反应,从而抵抗巨噬细胞的杀菌作用[17]。因此硫辛酸是否是通过降低sod等相关基因的表达来降低其对抗宿主免疫反应的能力,从而使其难以在体内进一步发展,还有待进一步探讨。
综上所述,硫辛酸在体外可抑制阪崎克罗诺杆菌的感染能力,有潜力作为膳食补充剂应用于食品控制由阪崎克罗诺杆菌引起的相关感染。然而,当硫辛酸作为膳食补充剂应用体内抑制阪崎克罗诺杆菌的感染能力时,硫辛酸在体内的代谢以及与食品中的一些营养素的相互作用从而可能会影响到其在体内对阪崎克罗诺杆菌感染能力的抑制作用。因此,在后续实验中,将继续探究硫辛酸在体内对阪崎克罗诺杆菌感染能力的抑制作用,进一步为硫辛酸作为膳食补充剂应用于食品中控制阪崎克罗诺杆菌的感染能力提供理论依据。
4 结 论
本研究探究了硫辛酸对阪崎克罗诺杆菌感染能力的抑制作用。结果表明,硫辛酸对阪崎克罗诺杆菌具有一定的抑制效果,其对阪崎克罗诺杆菌的MIC为5.00 mg/mL;SIC的硫辛酸(30、60 μg/mL)可抑制阪崎克罗诺杆菌的泳动及群集运动能力、生物被膜形成能力;同时,SIC的硫辛酸可减弱阪崎克罗诺杆菌黏附及侵入Caco-2细胞的能力并降低其在巨噬细胞RAW264.7中存活及增殖的能力。本研究结果表明硫辛酸能够减弱阪崎克罗诺杆菌的感染能力,这为硫辛酸作为膳食补充剂用于预防和控制由阪崎克罗诺杆菌引起的相关感染提供理论依据。

