刺激参数优化对帕金森病双侧STN-DBS术后电刺激诱发的暂时性非运动精神症状的改善效果
吴 曦, 王家莉, 仇一青, 陈剑春, 胡小吾
海军军医大学附属长海医院神经外科, 上海 200433
刺激参数优化对帕金森病双侧STN-DBS术后电刺激诱发的暂时性非运动精神症状的改善效果
吴 曦△, 王家莉△, 仇一青, 陈剑春, 胡小吾*
海军军医大学附属长海医院神经外科, 上海 200433
目的探讨帕金森病双侧丘脑底核脑深部电刺激(STN-DBS)术后,在出现电刺激诱发的暂时性非运动精神症状(stimulation-induced transient nonmotor psychiatric symptoms,SITNPS)时,是否可通过流程图来确定诱发症状的触点,以及电刺激参数优化在去除精神症状的同时维持运动症状改善的最佳效果。方法回顾性分析了2015年1月1日至12月31日在长海医院神经调控门诊进行程控的帕金森病STN-DBS患者的程控资料。分析使用流程图确定SITNPS触点及程控调整方案的效果,并采用非盲法的统一帕金森病评估量表Ⅲ(unified Parkinson’s disease rating scale-Ⅲ,UPDRS-Ⅲ)评估患者运动功能的改变。结果共有1 287人次程控。11例患者出现了20次SITNPS,包括4次哭泣(2例)、4次莫名的欣快感或傻笑(2例)、2次空间定位感觉异常(1例)、2次幻觉(1例)及8次轻躁狂发作(5例)。通过优化程控参数,10例患者精神症状消失,且运动改善维持或好于发生SITNPS时;1例患者在多次程控后由于运动症状和非运动症状交替出现,在最后设定的刺激参数下,UPDRS-Ⅲ评分较前下降了2分。11例患者的UPDRS-Ⅲ评分在程控前后(Med off/IPG on)差异无统计学意义[(26.45±10.59)分vs(26.45±10.17)分,P=1.000]。结论本课题组设计的流程图有助于确定SITNPS诱发触点;程控参数优化可使患者SITNPS消失,且不影响运动功能的改善效果。
帕金森病;丘脑底核;脑深部电刺激;短暂性非运动精神症状
丘脑底核(subthalamic nucleus,STN)脑深部电刺激(deep brain stimulation, DBS)疗法可持续改善原发性帕金森病患者震颤、僵直、运动迟缓等症状以及药物引起的运动并发症[1-3]。由于丘脑底核及周边结构内含有与边缘系统相联系的神经传导束[4],因此在刺激STN使运动症状改善的同时,可能造成患者非运动症状的改变,甚至出现电刺激诱发的暂时性非运动精神症状(stimulation-induced transient nonmotor psychiatric symptoms,SITNPS),如抑郁[5]、焦虑[6]、淡漠[7]、激烈的攻击性行为[8]、躁狂[9]、莫名的大笑[10]、冲动控制障碍[11]等。由于非运动症状比运动症状更影响患者的生活质量[12],近年来程控(DBS刺激参数程序设置以控制患者症状,简称程控)医师越来越关注帕金森病的非运动症状,包括SITNPS。海军军医大学附属长海医院帕金森病治疗中心自2014年12月制定并启用了针对帕金森病患者SITNPS的流程图式的程控方案。本研究主要探讨该方案是否可以用于进行SITNPS后的可疑触点定位,以及能否通过程控参数优化,在避免患者出现明显暂时性非运动精神障碍的同时,仍然维持原有的最佳运动症状的治疗效果。
1 资料与方法
1.1 一般资料 回顾性分析2015年1月1日至12月31日在海军军医大学附属长海医院神经调控门诊进行程控的原发性帕金森病植入双侧STN-DBS患者的程控记录,包括新植入DBS开机后进行滴定程控的患者和达到最佳刺激参数后因各种原因来门诊程控的患者。原发性帕金森病的诊断标准采用1997年版英国脑库标准。本研究在获得医院医学伦理委员会批准,患者知情同意并签署知情同意书。
1.2 运动功能评估方法 采用非盲法的统一帕金森病评估量表(unified Parkinson disease rating scale,UPDRS),评估并记录患者术前、发生SITNPS前最后1次调控后、重新程控至SITNPS消失后的运动功能。评估医师均有国际帕金森病及其他运动障碍疾病协会的UPDRS评分表培训证书。
1.3 认知和精神病学评估方法 患者术前和术后3、6、12个月时,常规使用UPDRS-Ⅰ、UPDRS-Ⅱ、简易智能精神状态检查量表(mini-mental state examination, MMSE)和汉密尔顿抑郁评估量表-17项(Hamilton depression scale 17, HAMD-17)进行认知和抑郁状态的评估。SITNPS的诊断:通过患者家属对患者行为的描述和患者对自身情绪感觉的描述,由神经内科医师用Young躁狂量表(Young mania rating scale, YMRS)[13]评估。新植入DBS开机的患者仅进行术前评估。
1.4 SITNPS的评估和电刺激参数记录 分析程控记录本中患者的程控主诉、家属对患者精神症状的描述和程控过程中患者的异常精神症状。记录SITNPS发生时电刺激激活触点、刺激方式、电压/电流、脉宽、频率。记录程控过程中刺激参数的改变及最终调整后的刺激参数。确定造成SITNPS触点的方法和程控方案按照既往制定的流程图完成(图1、图2)。程控后随访3个月,无相似的精神、心理症状复发,确定SITNPS消失。
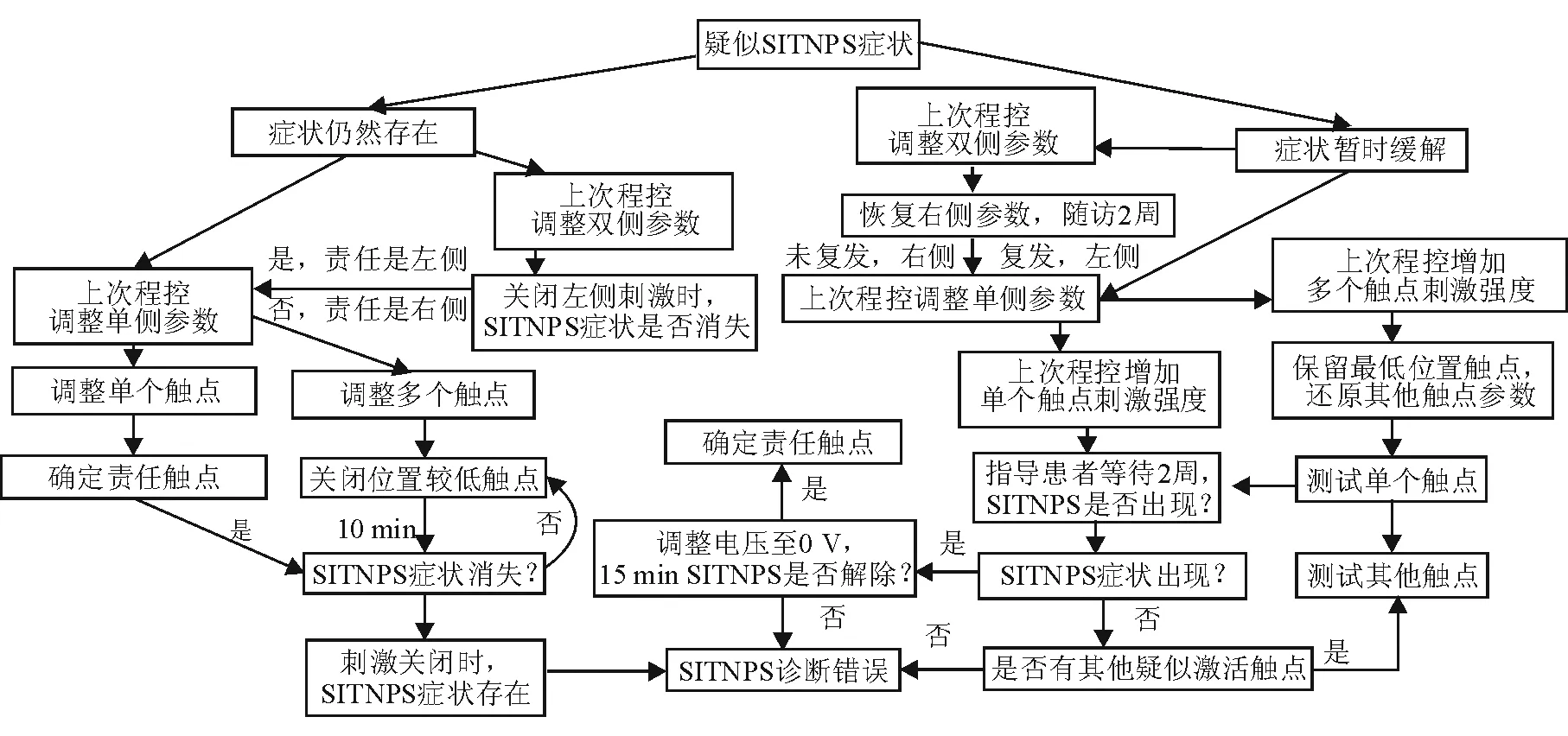
图1 确定引起SITNPS的流程图

图2 程控消除SITNPS流程图
1.5 统计学处理 采用SPSS 19.0(IBM, US)软件进行统计分析。刺激参数设置前后UPDRS-Ⅲ的比较采用配对t检验。检验水准(α,双侧)为0.05。
2 结 果
2.1 患者基线资料 共145例原发性帕金森病患者进行双侧STN-DBS术并首次开机,进行最佳程控参数的调整;另有1 142人次进行了刺激参数调整,包括166例双侧STN-DBS植入超过1年的患者和231例开机后未满1年的患者。其中,11例患者发生了SITNPS。11例患者中,男性5例,女性6例;手术时年龄52~74岁,平均年龄为(63.45 ± 8.27)岁;病程7~17年,平均(11.91 ± 3.33)年。11例患者认知功能正常或轻微减退,6例服用抗抑郁药物治疗,术后抗抑郁药物没有减量和调整。11例患者术前左旋多巴等效剂量为(942.5±232.7) mg,术后减为(284.5±187.8) mg。11例患者基线资料详见表1,出现SITNPS时的情况见表2,出现SITNPS前最后1次刺激参数见表3。

表1 患者的基线资料
MMSE:简易智能精神状态检查量表;HAMD:汉密尔顿抑郁评估量表;LEDD: 左旋多巴等效剂量;UPDRS:非盲法的统一帕金森病评估量表.*抗抑郁治疗前(治疗后)

表2 患者出现SITNPS时的临床表现
YMRS:Young躁狂量表
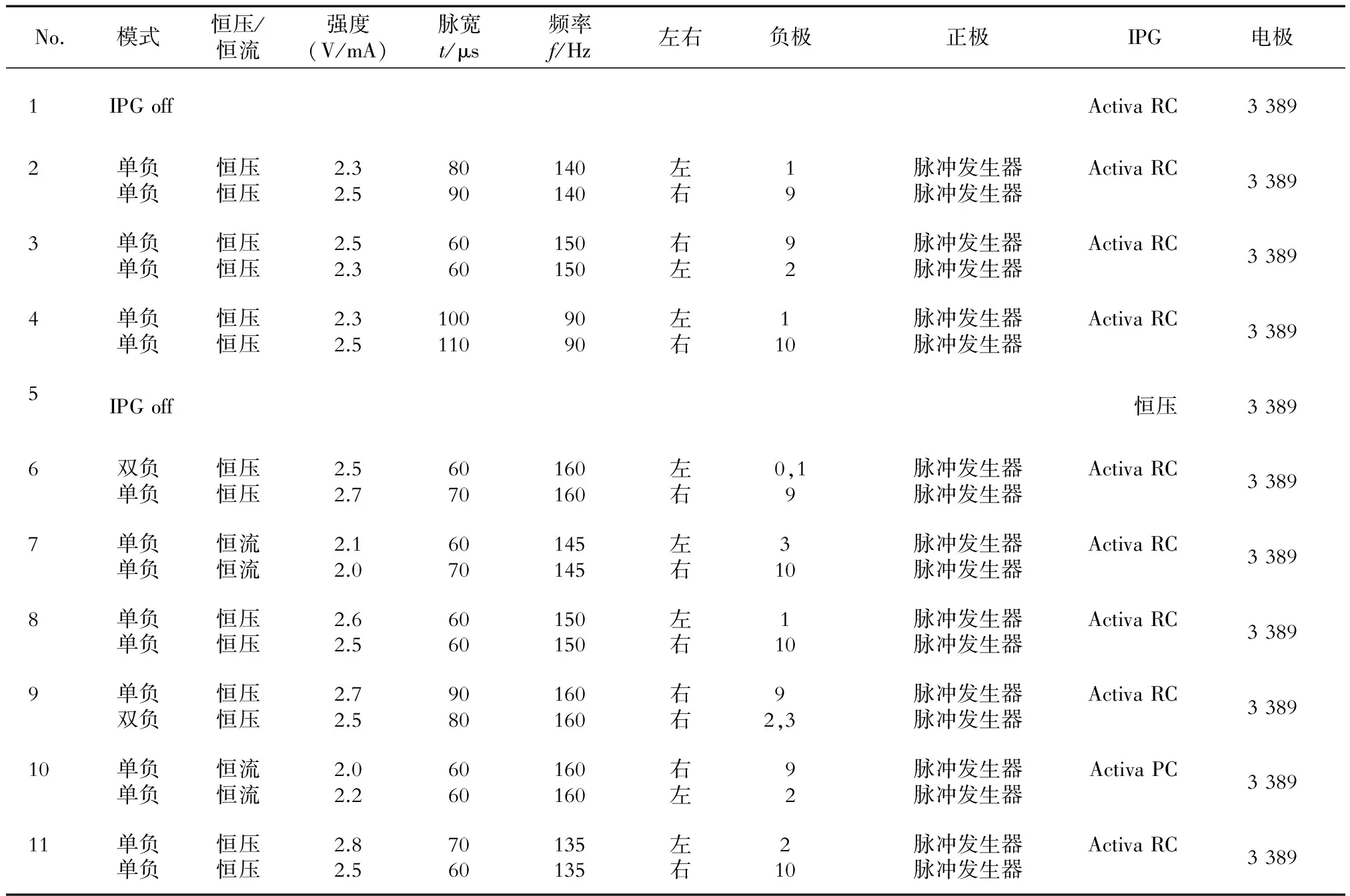
表3 SITNPS出现前最后1次刺激参数
IPG:脉冲发生器
2.2 SITNPS发作时的表现 11例患者出现20次SITNPS发作,包括4次哭泣(2例)、4次莫名的欣快感或傻笑(2例)、2次空间定位感觉异常(1例)、2次幻觉(1例)、8次轻躁狂发作(5例)。其中,5例患者SITNPS发生在首次开机进行最佳程控参数滴定过程中,2例患者发生在首次开机后2 d内,4例DBS植入超过1年的患者中有3例于程控过程中出现SITNPS。
2.3 程控对SITNPS及运动症状的影响
2.3.1 11例患者的程控参数调整 通过调节程控参数(表4),10例维持了原来的运动能力且精神症状消失。程控调整方案:降低电压、升高脉宽2例(患者1、11),维持电压不变、使用正负双点(Bipolar)刺激2例(患者2、7),降低电压、降低频率、升高脉宽1例(患者9),降低电压、降低频率、交叉电脉冲(Interleaving)3例(患者3、4、10),更换背侧激活触点2例(患者5、8)。11例患者出现SITNPS时UPDRS-Ⅲ评分(Med off/IPG on)与程控后评分(Med off/IPG on)差异无统计学意义[(26.45±10.59)分vs(26.45±10.17)分,P=1.000);表5]。
2.3.2 患者的6的程控过程 患者6在多次程控(表6)后,由于运动症状和非运动症状交叉出现,在最后调整的刺激参数下,UPDRS-Ⅲ评分较前下降了2分。患者6以“关期”的肩部疼痛为主诉来门诊进行程控,在增加双负刺激(Double polar)电压后症状改善,肩膀僵硬缓解、疼痛减轻,但是出现了轻微的头部“戴帽子样”束缚感,在服药(开期)时,出现了SITNPS。患者最终选择了第8次的程控参数。通过流程图,我们确定了诱发SITNPS的触点,并通过程控使患者的运动功能保留,但是患者出现了其他新发的非运动症状。与患者充分沟通后,患者选择在没有新发非运动症状时适当改善肩部疼痛,但是牺牲了一部分手和手腕动作的灵活性。
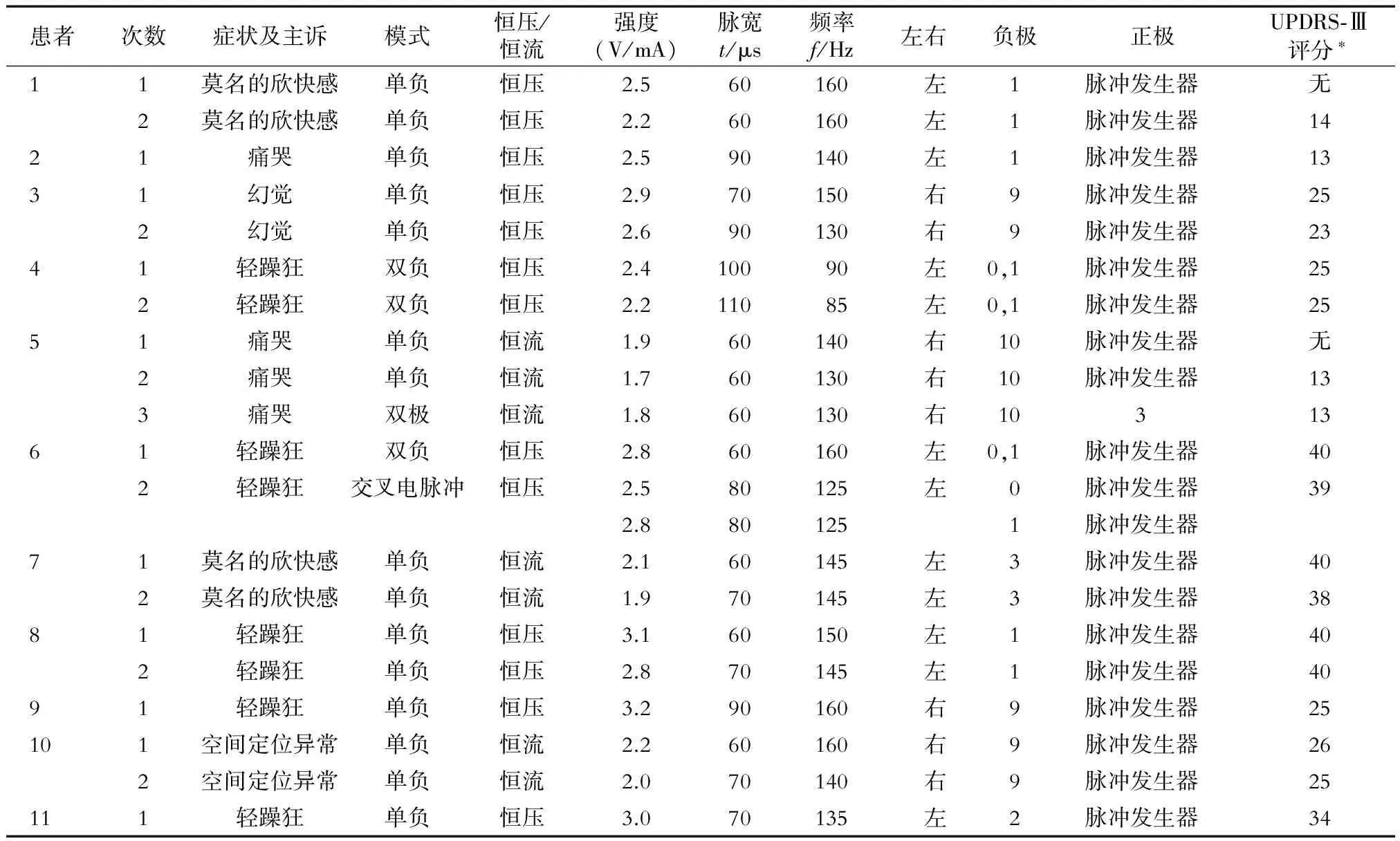
表4 诱发SITNPS时的刺激参数和运动症状评分
*药物关期/IPG开

表5 程控后消除SITNPS并维持最佳运动症状的刺激参数
3 讨 论
STN-DBS应用于临床后,SITNPS随之出现[10,14]。其被认为是DBS治疗带来的不良反应,表现形式复杂多样。DBS对患者带来的精神心理影响,有时由电刺激直接导致,有时与患者对DBS预期疗效满足与否引发的情绪波动有关[15],需要仔细鉴别。电刺激引起的轻微情绪波动更适合进行STN相关精神神经研究[16],而缺乏临床意义。因此,本研究中的SITNPS是家属或患者认为需要调控干预的临床症状明显的精神、心理改变。
本研究发现,大多SITNPS患者在程控参数重新设置48 h内即表现出相关症状,部分患者发生于服抗帕金森病药[5]后开期状态下或服药数小时之后。因此,每次程控后,患者都应在服药开期状态下充分评估其精神、心理状态,然后再让患者离开医院,并提醒患者家属警惕患者SITNPS的发生(有些SITNPS患者自己无法察觉)[17]。
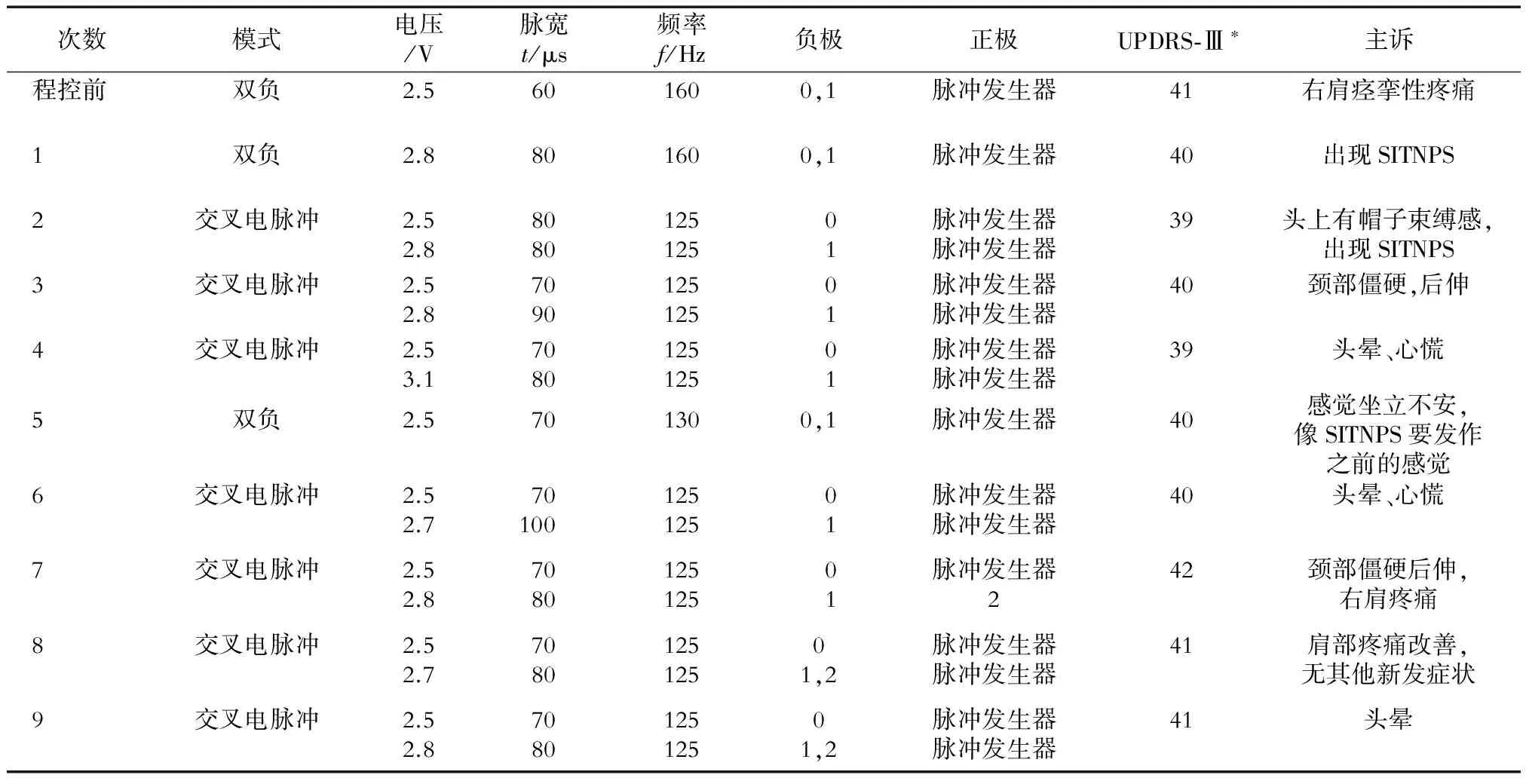
表6 患者6的程控过程
*药物关期/IPG开
本研究发现,SITNPS往往发生于程控医师根据患者的主诉增加刺激点电压或脉宽时。而此时患者的运动症状改善,或较术前更好,如何在维持运动改善状态同时避免SITNPS的发生,既往文献报道较少。本课题组在2014年根据既往文献报道和本中心的经验,制定了确定诱发SITNPS触点的方案及程控流程,以期快速缓解患者SITNPS同时尽可能改善患者的运动症状。临床研究[15,18]显示,SITNPS与高电压相关,说明引起边缘系统神经网络改变的结构被激活。多种减小或改变激活域范围以避开上述神经网络的程控方法也可以改善SITNPS,如降低电压[18]、更换为bipolar模式[17]、更换背侧激活触点[9,19-20]。但是,上述程控参数的调整使激活域减小的同时[21],也能增强对运动症状相关神经通路的刺激强度[22]。因此,本研究通过适当增加电压来增强激活域内的刺激强度。高频刺激可以使激活域内的不同神经细胞表现不同的应答[23],激活域内的神经细胞对不同频率的刺激也可能表现不同的应答,从而出现不同的临床表现[24]。降低刺激频率也可以降低激活域内的刺激强度,因此本研究尝试降低刺激频率以减轻SITNPS的发作。交叉电脉冲的使用要求刺激频率降低到125 Hz及以下,还可以让不同触点有独立的激活域,因此在降低刺激诱发不良反应的同时可提高刺激效果[25]。位于STN前内下部的触点更容易引发SITNPS[16],如果上述程控方案仍然无法消除SITNPS,同时不能最大程度改善运动症状时,改为更背侧的触点,以获得更大的刺激参数调整范围。
经过1年筛查,11位患者被确定存在需要调控干预的SITNPS,并使用流程图成功定位了诱发SITNPS的触点,经过刺激参数程控后,患者SITNPS症状消失。其中,8例患者的运动功能较发生SITNPS前没有下降,甚至改善;2例患者SITNPS在第1次开机调试时出现,其运动症状改善率约70%。患者6因为调控过程中出现其他的非运动症状,因此没能获得与发生SITNPS时相同的运动改善[6]。因此,SITNPS并不限制患者的运动症状改善。
综上所述, 通过本课题组设计的流程图可以确定SITNPS诱发触点,并可通过适当的程控使患者SITNPS消失的同时获得最佳的运动症状改善。本研究的局限性在于患者数量较少、SITNPS的种类较少,且采用的流程图主要针对Medtronic Activa PC和RC,应用于其他型号的IPG时需要进行调整。
[ 1 ] CASTRIOTO A, LOZANO A M, POON Y Y, et al.Ten-year outcome of subthalamic stimulation in Parkinson disease: a blinded evaluation[J]. Arch Neurol, 2011,68(12):1550-1556.
[ 2 ] RIZZONE M G, FASANO A, DANIELE A, et al. Long-term outcome of subthalamic nucleus DBS in Parkinson’s disease: from the advanced phase towards the late stage of the disease?[J]. Parkinsonism Relat Disord, 2014, 20(4):376-381.
[ 3 ] JANSSEN M L, DUITS A A, TURAIHI A H, et al. Subthalamic nucleus high-frequency stimulation for advanced Parkinson’s disease: motor and neuropsychological outcome after 10 years[J].Stereotact Funct Neurosurg, 2014,92(6):381-387.
[ 4 ] ROSSI P J, GUNDUZ A, OKUN M S.The subthalamic nucleus, limbic Function, and Impulse Control[J].Neuropsychol Rev, 2015,25(4):398-410.
[ 5 ] FUNKIEWIEZ A, ARDOUIN C, CAPUTO E, et al. Long term effects of bilateral subthalamic nucleus stimulation on cognitive function, mood, and behaviour in Parkinson’s disease[J]. J Neurol Neurosurg Psychiatry, 2004, 75(6):834-839.
[ 6 ] KIM H J, JEON B S, PAEK S H. Nonmotor symptoms and subthalamic deep brain stimulation in Parkinson’s disease[J]. J Mov Disord, 2015, 8(2):83-91.
[ 7 ] DRAPIER D, DRAPIER S, SAULEAU P, et al. Does subthalamic nucleus stimulation induce apathy in Parkinson’s disease?[J]. J Neurol 2006, 253(8):1083-1091.
[ 8 ] SENSI M, ELEOPRA R, CAVALLO M A, et al. Explosive-aggressive behavior related to bilateral subthalamic stimulation[J].Parkinsonism Relat Disord, 2004,10(4):247-251.
[ 9 ] RAUCHER-CHÉNÉ D, CHARREL C L, DE Maindreville A D, et al.Manic episode with psychotic symptoms in a patient with Parkinson’s disease treated by subthalamic nucleus stimulation: improvement on switching the target[J].J Neurol Sci, 2008,273(1-2):116-117.
[10] KRACK P, KUMAR R, ARDOUIN C, et al.Mirthful laughter induced by subthalamic nucleus stimulation[J].Mov Disord, 2001,16(5):867-875.
[11] VOLKMANN J, DANIELS C, WITT K. Neuropsychiatric effects of subthalamic neurostimulation in Parkinson disease[J]. Nat Rev Neurol, 2010, 6(9):487-498.
[12] FLODEN D, COOPER S E, GRIFFITH S D, et al. Predicting quality of life outcomes after subthalamic nucleus deep brain stimulation[J]. Neurology, 2014,83(18):1627-1633.
[13] YOUNG R C, BIGGS J T, ZIEGLER V E, et al. A rating scale for mania: reliability, validity and sensitivity[J]. Br J Psychiatry, 1978, 133:429-435.
[14] KULISEVSKY J, BERTHIER M L, GIRONELL A, et al.Mania following deep brain stimulation for Parkinson’s disease[J].Neurology, 2002,59(9):1421-1424.
[15] MERCADO R, CONSTANTOYANNIS C, MANDAT T, et al. Expectation and the placebo effect in Parkinson’s disease patients with subthalamic nucleus deep brain stimulation[J]. Mov Disord, 2006,21(9):1457-1461.
[16] ABULSEOUD O A, KASASBEH A, MIN H K, et al. Stimulation-induced transient nonmotor psychiatric symptoms following subthalamic deep brain stimulation in patients with Parkinson’s disease: association with clinical outcomes and neuroanatomical correlates[J]. Stereotact Funct Neurosurg, 2016,94(2):93-101.
[17] MANDAT T S, HURWITZ T, HONEY C R. Hypomania as an adverse effect of subthalamic nucleus stimulation: report of two cases[J].Acta Neurochir (Wien), 2006,148(8):895-897, discussion 898.
[18] CHOPRA A, TYE S J, LEE K H, et al.Voltage-dependent mania after subthalamic nucleus deep brain stimulation in Parkinson’s disease: a case report[J].Biol Psychiatry, 2011,70(2):e5-e7.
[19] UGURLU T T, ACAR G, KARADAG F,et al. Manic episode following deep brain stimulation of the subthalamic nucleus for Parkinson’s disease: a case report[J]. Turk Neurosurg, 2014,24(1):94-97.
[20] MALLET L, SCHÜPBACH M, N’DIAYE K, et al. Stimulation of subterritories of the subthalamic nucleus reveals its role in the integration of the emotional and motor aspects of behavior[J]. Proc Natl Acad Sci U S A, 2007,104(25):10661-10666.
[22] YOUSIF N, BAYFORD R, BAIN P G, et al.The peri-electrode space is a significant element of the electrode-brain interface in deep brain stimulation: a computational study[J].Brain Res Bull, 2007,74(5):361-368.
[23] WILSON D, MOEHLIS J. Clustered desynchronization from high-frequency deep brain stimulation[J].PLoS Comput Biol, 2015,11(12):e1004673.
[24] JIA F, GUO Y, WAN S, et al.Variable frequency stimulation of subthalamic nucleus for freezing of gait in Parkinson’s disease[J].Parkinsonism Relat Disord, 2015,21(12):1471-1472.
[25] MIOCINOVIC S, KHEMANI P, WHIDDON R, et al. Outcomes, management, and potential mechanisms of interleaving deep brain stimulation settings[J]. Parkinsonism Relat Disord, 2014,20(12):1434-1437.
Improvement effect for stimulus parameter programming on stimulation-induced transient nonmotor psychiatric symptoms after bilateral subthalamic nucleus deep brain stimulation for Parkinson disease
WU Xi△, WANG Jia-li△, QIU Yi-qing, CHEN Jian-chun, HU Xiao-wu*
Department of Neurosurgery, Changhai Hospital, Navy Military Medical University, Shanghai 200433, China
Objective: Stimulation-induced transient non-motor psychiatric symptom (SITNPS) was one of the side effects following bilateral subthalamic nucleus deep brain stimulation (STN-DBS) in Parkinson disease (PD) patients. The electrode contact inducing these psychiatric symptoms and the protocol to eliminate SITNPS with maintaining the optimal motor function were designed in this study, and the effectiveness of these algorithms was analyzed.MethodsAll the PD patients who underwent programming sessions after STN-DBS implantations from January 1, 2015, to December 31, 2015, at the DBS programming clinic of Changhai Hospital were retrospectively analyzed. Only patients who were diagnosed with SITNPS were enrolled in this study. In these patients, the electrode contact inducing SITNPS was found and the programming protocol algorithms were used. The unified Parkinson disease rating scale part Ⅲ (UPDRS-Ⅲ) score was assessed with non-blinded method to analyze the motor functions before and after programming.ResultsThere were 1 287 patients-time enrolled in this study, and 11 patients were diagnosed with SITNPS of totally 20 times. Among these patients, 2 cases had 4 episodes of crying, 2 cases had 4 episodes of mirthful laughter, 1 case had 2 episodes of abnormal sense of spatial orientation, 1 case had 2 episodes of hallucination and 5 cases had 8 episodes of hypomania. After programming sessions, the mental symptoms in 10 patients were disappeared and the motor functions were maintained or better compared with SITNPS. In 1 patient, the motor and non-motor symptoms occurred alternately, at last, the UPDRS-Ⅲ score was decreased by 2 scores after stimulus parameter setting. There was no statistical difference of UPDRS-Ⅲ score before and after final stimulation parameter setting (without SITNPS) in 11 cases ([26.45±10.59]vs[26.45±10.17],P=1.000).ConclusionsThe flow diagram in this study is helpful for determining electrode contact inducing SITNPS in PD patients, and the modified programming protocol employed in treatment of these symptoms is effective to make SITNPS disappear, without influencing the curative effect on motor function.
Parkinson disease; subthalamic nucleus; deep brain stimulation; transient nonmotor psychiatric symptoms
2016-12-19接受日期2017-09-12
国家重点研发计划“数字诊疗装备研发”试点专项课题(2016YFC0105900). Supported by “Digital Equipment of Diagnosis and Treatment” Special Program of National Key Research and Development Plan (2016YFC0105900).
吴 曦, 博士,讲师、主治医师. E-mail:wuxi_smmu@sina.com 王家莉, 技师. E-mail:1664108205@qq.com
△共同第一作者(Co-first authors)
*通信作者(Corresponding author). Tel: 021-31161787,E-mail:huxiaowu_smmu@sina.com
10.12025/j.issn.1008-6358.2017.20161169
R 742.5
A
[本文编辑] 姬静芳

