miRNA-744-5p靶向TGFβ-1抑制胃癌侵袭迁移的机制研究
龚理杰 吕佳 徐继 钱振渊 叶再元⋆
miRNA-744-5p靶向TGFβ-1抑制胃癌侵袭迁移的机制研究
龚理杰 吕佳 徐继 钱振渊 叶再元⋆
目的 检测胃癌组织中和人胃癌细胞株中miRNA-744-5p的表达情况,并通过改变胃癌细胞株中miRNA-744-5p的表达,观察人胃癌细胞株侵袭、迁移能力的变化并探讨生物学机制。方法 通过荧光定量PCR(qRT-PCR)检测37例胃癌患者的胃癌组织及其配对的癌旁组织中miRNA-744-5p的表达水平,并对胃癌细胞株和正常胃黏膜上皮细胞株中的miRNA-744-5p表达水平进行检测。在胃癌细胞中分别转染miRNA-744-5p模拟物(mimic)、抑制物(inhibitor)以上调、下调miRNA-744-5p的表达,通过Transwell试验检测其对胃癌细胞侵袭、迁移能力的影响。将通过生物信息学软件筛选的miRNA-744-5p潜在的靶基因进行双荧光素酶试验及Western blot 试验验证,并探讨其促转移的分子机制。结果 胃癌组织、胃癌细胞株的miRNA-744-5p表达水平较正常胃黏膜组织、正常胃黏膜上皮细胞株均显著降低(P<0.05)。分别上调、下调胃癌细胞中miRNA-744-5p的表达水平,能够抑制、促进胃癌细胞的侵袭、迁移能力。miRNA-744-5p与TGFβ-1间存在反向调控的关系,TGFβ-1是miRNA-744-5p的靶基因。进一步实验证明,下调miRNA-744-5p的表达时,TGFβ-1表达上调,而当上调miRNA-744-5p的表达时,TGFβ-1表达下调。结论 在胃癌组织中miRNA-744-5p 的表达水平降低,导致TGFβ-1在胃癌组织中的高表达以促进胃癌细胞的侵袭、迁移。
胃癌 miRNA-744-5p TGFβ-1 侵袭 迁移
Objective To detect the miR-744-5p expression level in gastric cancer(GC)tissue and cells,and to observe the effects of invasion and migration on the gastric cancer cell due to the changes of miRNA expression. To explore the biological function of miR-744-5p in GC.Methods The miR-744-5p expression level was detected in 37 paired GC tissues and normal gastric mucosal tissues by real-time PCR. The expression levels of miR-744-5p in fi ve GC cell lines and the normal gastric mucosal cell(GES-1)were detected similarly. SGC-7901 which with the highest expression level were transected with miR-744-5p inhibitor,and AGS which with the lowest expression level were transected with miR-744-5p mimics.Then they were selected to use for the invasion and migration tests. TGFβ-1 was predicted as a target gene of miR-744-5p by screening of the miRBase Targets,TargetScan Release 5.0 and PicTar databases and identif i ed by the luciferase reporter assay and Western Blot. Results The expression levels of miR-744-5p were lower in GC tissues and cells than in their pair-matched adjacent normal tissues and normal gastric mucosal cell. Up-regulation and down-regulation the expression of miR-744-5p levels could restrain and promote GC cells invasion and migration ability. TGFβ-1 expression was inversely correlated with miR-186-3p expression in GC. TGFβ-1 is one of target gene of miR-744-5p. Conclusions MiR-744-5p is down-regulated in GC tissues and cell lines and associates with the metastasis of GC cell by targeting TGFβ-1.
Gastric cancer MiRNA-744-5p TGFβ-1 Invasion Migration
在我国,胃癌是最常见的恶性肿瘤之一,居肿瘤死亡第2位[1]。根治性手术联合化疗仍然是胃癌患者的首选治疗方案[2]。然而较多胃癌患者确诊时已属中晚期,即使进行根治手术联合化疗其5年生存率仍<20%[3]。成熟微小RNA(miRNAs)是一段长度在18~25nt的非编码RNA核苷酸序列,其通过与靶基因的3'UTR区特异性结合,从而影响mRNA转录,抑制蛋白质翻译[4]。研究表明,miRNA的异常表达可能会抑制肿瘤生成,也可能促进肿瘤进展[5]。其中miR-744-5p是新近发现的一个在多种肿瘤发生、发展过程中起重要作用的微小RNA,本文初步探索miR-744-5p在胃癌发生、发展中的作用。
1 材料和方法
1.1 细胞培养 人胃癌细胞株SGC-7901,MKN-45,MKN-28,AGS,BGC-823和正常胃黏膜上皮细胞株GES-1均购自上海中国科学院细胞库;细胞培养均用含有10%胎牛血清(杭州四季青生物工程材料有限公司)和抗生素(100U/ml链霉素和100U/ml青霉素)的1640培养基(美国Hyclon公司),并置于37℃含有5%的培养箱中。贴壁细胞传代时用0.02% EDTA/0.25%胰蛋白酶消化3~5min。
1.2 临床标本 37例新鲜胃癌组织标本及配对癌旁组织均取自2014年1月至12月浙江省人民医院诊断为胃癌并手术切除的患者(年龄41~74岁,男21例,女16例),术前均未行化疗,并冷藏于-80℃冰箱。所有患者均知情并签署同意书,本项目经浙江省人民医院伦理委员会批准。
1.3 RNA提取,cDNA合成和荧光定量PCR 细胞和新鲜组织标本RNA提取参照Trizol试剂盒使 用 说 明(Thermo Fisher Scientific),cDNA 的合 成 采 用the Superscript Ⅲ cDNA synthesis kit(TaKaRa),miRNA的表达水平检测采用SYBR green法(TaKaRa)。内参RNU6b的特定正向引物为 5'-CGCTTCACGAATTTGCGTGTCAT-3'。miRNA-744-5p的特定引物为5'-ACACTCCAGCTGGGT GCGGGGCTAGGGCTAAC-3'。PCR反应体系是:95℃预热 5min,95℃ 10s,60℃ 10s 、72℃ 10s共 40个循环。结束后分析其熔化曲线。组织样本及细胞株中miRNA-744-5p相对于内参RNU6B的相对表达水平采用 2-ΔΔCt法进行比较。
1.4 转染 将胃癌细胞株在六孔板中培养,铺板浓度2.0×105/每孔,24h后将miR-744-5p表达相对较高的SGC-7901细胞转染miR-744-5p抑制剂(锐步生物医药),将miR-744-5p表达相对较低的AGS细胞转染miR-744-5p模拟物(锐步生物医药),模拟物对照组和抑制剂对照组采取平行设置。转染采用Lipofectamine 3000试剂盒(Qiagen公司)步骤并按其说明书进行。转染24 h 后,收集细胞用于后续实验。
1.5 Transwell实验 收集转染24h后的胃癌细胞。Transwell迁移实验采用 Costar Transwell 试剂盒(康宁公司),侵袭实验采用含有人工基底膜板的侵袭小室(康宁公司),转染后的细胞(侵袭实验用1.5×105个细胞,迁移实验用8.0×104个细胞)用无血清培养基重悬后被放入Transwell小室上室中,下室中加入30%胚牛血清,迁移实验在37℃ 5% CO2环境中孵育24h,侵袭实验在37℃ 5%CO2环境中孵育48h。随后将Transwell膜用无水酒精固定,上表面非侵入性的细胞用棉签擦去,然后经苏木精和伊红染色,最后在高倍显微镜下拍摄穿过膜的细胞数。
1.6 荧光素酶报告实验和目标基因识别 应用生物信息学软件预测miRNA-744-5p的靶基因TGFβ-1,确定miRNA-744-5p与靶基因TGFβ-1的作用位点,构建转染质粒并分以下3组:NC组:共转染pYr-MirTarget报告质粒、miR-744-5p模拟物的HEK293细胞。TGFβ-1-野生组:共转染pYr-MirTarget-TGFβ-1-3U报告质粒、miR-744-5p模拟物的HEK293细胞。TGFβ-1-突变组:共转染pYr-MirTarget-TGFβ-1-3U-D报告质粒、miR-744-5p模拟物的HEK293细胞。萤火虫荧光素酶反应:在荧光发光计的试管中先后加入100μl的LARII试剂和20μl PLB裂解液,混匀,产生萤火虫荧光信号,置入检测仪测量发光值。海参荧光素酶反应:同一样品中加入100μl Stop&Glo试剂,停止上述反应,同时启动海参荧光素酶反应,置入检测仪检测发光值。对每个转染组进行标准化荧光素酶活性检测,所有转染实验均设置三个复孔。
1.7 蛋白质印记分析 分别收集转染后的胃癌细胞,经过水洗、裂解后溶于RIPA缓冲液中,并用蛋白浓度测定试剂盒(Thermo公司)测定蛋白质浓度,检测采用BCA(bicinchoninic acid)法。将等效量(30~50μg)的蛋白质在10% SDS-PAGE胶中电泳分离,再转印到PVDF膜上(Millipore公司)。PVDF膜经含5%的脱脂奶粉Tris-缓冲液中封闭2h,再加入TGFβ-1(proteintech公司)一抗,在4℃的环境下振荡孵育过夜。将孵育过夜的膜用TBST清洗3次后放入含辣根过氧化物酶和1:1000稀释的二抗中孵育1h,TBST洗涤3次,加入ECL试剂(三一重工),利用化学发光凝胶成像系统(ChemiDoc MP,Bio-rad)检测Western blot条带信号。
1.8 统计学方法 采用SPSS22.0统计软。检测miR-744-5p的荧光定量PCR表达水平和荧光素酶相对活性采用(x±s)表示。正态分布结果通过配对样本t检验或单因素方差分析,非正态分布结果且比较多个相关组样本时,采用Wilcoxon检验或Kruskal-Wallis H检验。P<0.05为差异有统计学意义。
2 结果
2.1 miRNA-744-5p在胃癌组织及胃癌细胞株中的表达水平 miRNA-744-5p在胃癌组织中的表达水平明显低于在正常胃黏膜组织中的表达水平[(0.336±0.028)vs(0.179±0.025),P<0.05];miRNA-744-5p在胃癌细胞株 BGC-823、MKN-45、7901、MKN-28、AGS 中的表达水平均低于在正常胃黏膜上皮细胞株GES-1中的表达水平(P<0.05),且不同胃癌细胞株间两两比较,miRNA-744-5p在胃癌细胞株SGC-7901中相对高表达(P<0.05),而在胃癌细胞株AGS中相对低表达(P<0.05)。见图1。
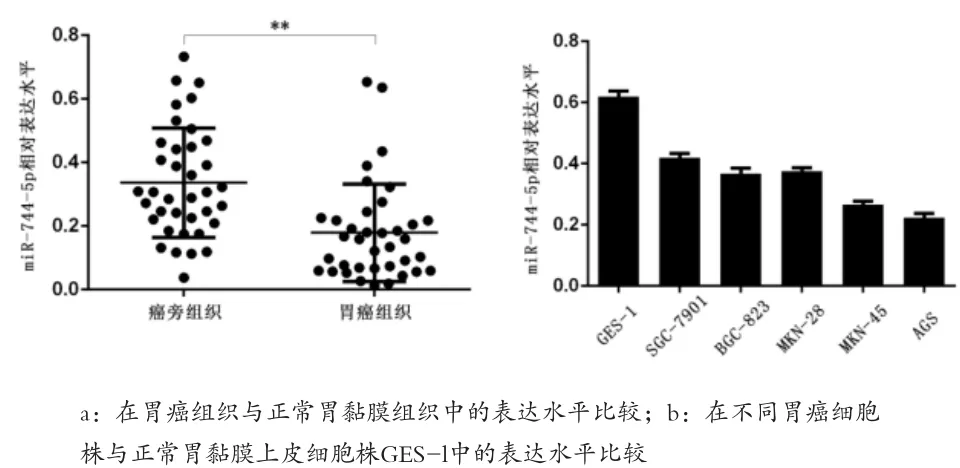
图1 miRNA-744-5p在胃癌组织及胃癌细胞株中的表达水平
2.2 miRNA-744-5p对胃癌SGC-7901、AGS细胞侵袭、迁移能力的影响 与阴性对照组比较,胃癌SGC-7901细胞转染miRNA-744 inhibitor 后侵袭、迁移能力均显著增强;胃癌AGS细胞转染miRNA-744 mimics 后侵袭、迁移能力均显著减弱。见图2。
2.3 miRNA-744-5p靶基因预测与验证 生物信息学软件预测到在TGFβ-1的3'-UTR 区有1 个miRNA-744-5p的结合位点。Western blot结果显示胃癌细胞中上调miRNA-744-5p的表达能够显著抑制TGFβ-1的表达(P<0.05),当抑制miRNA-744-5p的表达时可上调的TGFβ-1(P<0.05)。双荧光素酶试验结果显示WT 组中的荧光素酶活性明显低于NC组(P<0.05);而MUT组的荧光素酶活值与NC 组比较无统计学差异(P>0.05)。同时Western blot结果显示,在胃癌7901细胞中,转染miRNA-744 inhibitor 下调miRNA-744表达后,TGFβ-1的表达显著上调(P<0.05)。与此相反,在胃癌AGS细胞中上调miRNA-744-5p的表达,TGFβ-1的表达显著下调(P<0.05)。
3 讨论
近年来,越来越多的研究表明,miRNA-744在多种肿瘤的发生、发展中起重要作用,如宫颈癌、鼻咽癌、肝癌和胰腺癌等恶性肿瘤。在宫颈癌中,miRNA-744通过靶向调节Bcl-2影响肿瘤细胞的凋亡能力抑制宫颈癌的增长和进展[6]。在鼻咽癌中,miR-744作为原癌基因通过靶向调控ARHGAP5基因,从而抑制肿瘤细胞的转移与进展[7]。在肝癌细胞中miR-744的低表达与其肝癌患者的预后密切相关[8]。虽然,miRNA-744在大多数肿瘤中低表达,呈现出抑癌基因的功能,但也有相关研究报道,miRNA-744在肿瘤中呈现高表达,发挥致癌作用,如在胰腺癌中,miRNA-744通过抑制抑SFRP1,GSK3β和TLE3的表达,激活Wnt/β-catenin信号通路,以此促进肿瘤的进展[9]。而miR-744-5p在胃癌中的作用却鲜有研究。本资料显示,与在正常胃黏膜组织中相比,miRNA-744-5p在胃癌组织中呈现低表达;下调miRNA-744-5p的表达能够显著增强胃癌细胞的侵袭、迁移能力,而上调其表达能够抑制胃癌细胞的侵袭、迁移能力。提示miRNA-744-5p在胃癌中呈现抑癌基因的功能。通过生物信息数据库检索发现TGFβ-1可能为miRNA-744-5p的1个靶基因。TGFβ-1是调节细胞生长和分化的TGF-β超家族中的一员[10]。其参与执行较多细胞功能,包括控制细胞生长、细胞增殖、细胞分化和细胞凋亡[11]。在一些恶性肿瘤的发生发展当中,TGF-β1也起到重要作用。如在乳腺癌中TGFβ-1表现出两面性,在肿瘤早期可抑制肿瘤生长及影响细胞凋亡,在肿瘤晚期其又转而成为肿瘤促进因子[12]。在膀胱癌中,通过STMN1基因调节TGFβ-1的表达从而促进膀胱癌侵袭、迁移的能力[13]。研究表明,TGF-β1可诱导上皮间质转化(EMT)发生,降低肿瘤细胞间的粘附力并增强其侵袭能力[14]。有文献报道,miR-744-5p可能参与TGFβ-1的转录后调节,存在靶向关系[15]。本资料结果显示相对于阴性对照组,高表达miR-744-5p组的荧光素酶活性明显降低;且对于TGFβ-1 3'末端有突变的实验组,miR-744-5p并不能改变其荧光素酶活性。采用免疫印迹试验进一步证实miR-744-5p与TGFβ-1间存在反向调控的关系,因此作者认为TGFβ-1可能是miR-744-5p下游的靶向调控位点。
综上所述,miR-744-5p在胃癌组织细胞中表达下调,且高表达miR-744-5p可以抑制胃癌细胞的侵袭迁移能力,而miR-744-5p在胃癌细胞中的抑癌作用可能是通过靶向调控TGFβ-1的表达来实现。
[1] Chen W,Zheng R,Baade PD,et al. Cancer statistics in China,2015.Ca A Cancer Journal for Clinicians,2016,66(2): 115.
[2] De Vitaf. Treatment of gastric cancer. Onkologie,2014,75(5): 32-9.
[3] Coccolini F,Cotte E,Glehen O,et al. Intraperitoneal chemotherapy in advanced gastric cancer. Meta-analysis of randomized trials.European Journal of Surgical Oncology,2014,40(1): 12-26.
[4] Bartel DP. MicroRNAs: target recognition and regulatory functions. Cell, 2009, 136(2): 215-33.
[5] Bartel DP. MicroRNAs: Genomics,biogenesis,mechanism,and function. Cell,2007.
[6] Chen XF,Liu Y. MicroRNA-744 inhibited cervical cancer growth and progression through apoptosis induction by regulating Bcl-2.Biomedicine & Pharmacotherapy,2016,81(379-87.
[7] Fang Y,Zhu X,Wang J,et al. MiR-744 functions as a protooncogene in nasopharyngeal carcinoma progression and metastasis via transcriptional control of ARHGAP5. Oncotarget,2015,6(15): 13164.
[8] Tan YL,Bai ZG,Zou WL,et al. miR-744 is a potential prognostic marker in patients with hepatocellular carcinoma. Clinics &Research in Hepatology & Gastroenterology,2014,39(3): 359.
[9] Zhou W, Li Y, Gou S, et al. MiR-744 increases tumorigenicity of pancreatic cancer by activating Wnt/β-catenin pathway.Oncotarget, 2011,6(35): 37557-69.
[10] Kajdaniuk D, Marek B, Borgiel-Marek H, et al. Transforming growth factor β1(TGFβ1)in physiology and pathology.Endokrynologia Polska, 2013,64(5): 384.
[11] Fabregat I,Fernando J,Mainez J,et al. TGF-beta signaling in cancer treatment. Current Pharmaceutical Design,2014,20(17): 2934.
[12] Zarzynskz JM. Two faces of TGF-beta1 in breast cancer.Mediators of Inflammation,2014,2014(1): 141747.
[13] Liu J,Cao J,Zhao X. miR-221 facilitates the TGFbeta1-induced epithelial-mesenchymal transition in human bladder cancer cells by targeting STMN1. BMC Urology,2015,15(1): 1-9.
[14] Pang MF,GeorgoddakI AM,Lambut L,et al. TGF-β1-induced EMT promotes targeted migration of breast cancer cells through the lymphatic system by the activation of CCR7/CCL21-mediated chemotaxis. Oncogene,2016,35(6): 748.
[15] Martin J, Jenkins RH, Bennagi R, et al. Post-Transcriptional Regulation of Transforming Growth Factor Beta-1 by MicroRNA-744. Plos One, 2011, 6(10): e25044.
浙江省医药卫生科学研究项目(2017KYB018)
310053 浙江中医药大学(龚理杰 吕佳)
310014 浙江省人民医院(徐继 钱振渊 叶再元)
*通信作者

