小鼠皮层神经元机械损伤后miR-124的动态变化及意义
苏鑫洪 叶玉勤 杨永祥 贺晓生
(第四军医大学西京医院神经外科,陕西 西安 710032)
小鼠皮层神经元机械损伤后miR-124的动态变化及意义
苏鑫洪 叶玉勤 杨永祥 贺晓生*
(第四军医大学西京医院神经外科,陕西 西安 710032)
目的观察体外培养小鼠皮层神经元机械损伤后微小核糖核酸-124 (miR-124)的表达变化,初步探讨miR-124对小鼠创伤性脑损伤后神经轴突再生与修复可能的影响。方法孕15~18 d C57BL/6种孕鼠胚胎脑皮质层神经元体外培养7 d,以10 μL移液器塑料滴头在培养皿内划割,造成机械性损伤,伤后不同时间点(1 h, 6 h, 12 h, 24 h, 72 h, 144 h)分别采用实时定量聚合酶链法(RT-PCR)检测miR-124和蛋白质印记法(Western Blot)检测神经纤毛蛋白(Nrp-1)、微管相关蛋白(Tau)、生长相关蛋白43(Gap-43)的表达水平。然后用miR-124模拟物和抑制剂分别对体外培养的皮层神经元进行干预,观察miR-124表达量的改变对实验的影响。结果神经元机械损伤后miR-124和Nrp-1、Tau、Gap-43的表达均显著升高(P<0.05),且存在一定的正相关性。用miR-124模拟物和抑制剂分别显著升高和降低miR-124的表达后,Nrp-1、Tau、Gap-43表达显著下降,其中抑制剂组下降较模拟物组明显(P<0.05)。结论创伤区miR-124的适度高表达可能与轴突再生有密切联系,这为本课题组今后尝试梯度调控miR-124以调节神经轴突再生与修复提供了实验依据。
机械损伤; 微小核糖核酸-124; 轴突再生修复
创伤性脑损伤(traumatic brain injury, TBI)后大量神经元细胞变性坏死会导致严重的神经功能缺失[1],促进损伤的神经元再生和轴突致靶,恢复受损神经功能是神经科学研究的热点问题。近年来,随着一类非编码小RNA的发现和研究,为促进中枢神经再生修复提供了新思路。微小核糖核酸(microRNA, miRNA)是一些5'端带磷酸基团、3'端带羟基,长度在20~25个核苷酸的单链核糖核酸分子。它本身不编码蛋白质表达,但可通过转录后水平调节靶蛋白的表达。其中,微小核糖核酸124(microRNA-124, miR-124)是神经系统特异性的microRNA,占哺乳动物大脑皮质总microRNA的25%~48%[2]。它可通过5'端的种子序列和3'端非编码区发生完全或不完全的配对结合而发挥影响蛋白质的功能和合成的作用,从而达到对各生理功能的调节和控制[3]。但TBI后脑内的miR-124时空变化特征及其对神经轴突再生与修复有何影响,至今尚无定论。并且,由于动物个体差异和干扰因素较多,在体模型也有造模不稳定的缺陷,体外模型则具有很好的重复性、实验条件可控性强等显著优点。为此,本研究利用小鼠体外皮层神经元机械损伤模型,通过实时定量聚合酶链反应(real-time polymerase chain reaction, RT-PCR)和蛋白印记(Western Blot)等方法,检测损伤后不同时间点miR-124和神经纤毛蛋白(neuropilin-1, Nrp-1)、微管相关蛋白(microtubule-associated protein tau, Tau)、生长相关蛋白43(growth associated protein-43, Gap-43)的表达及变化特征,以期探讨TBI后miR-124表达量的变化与轴突再生的关系,初步研究miR-124对轴突再生与修复的调控作用。
材料与方法
一、材料
兔抗小鼠Nrp-1单克隆抗体,兔抗小鼠Gap-43单克隆抗体和兔抗小鼠Tau单克隆抗体购自英国Abcam公司,抗β-actin兔多克隆抗体和辣根过氧化物酶标记山羊抗兔二抗购自中国万类生物科技,二喹啉甲酸蛋白定量试剂盒(BCA Protein Assay Kit)购自中国碧云天生物技术研究所,Trizol和miR-124模拟物、miR-124抑制剂、miR-124阴性对照购自上海生工生物工程有限公司,microRNA定量组合试剂盒购自大连宝生物工程有限公司,胎牛血清和杜尔贝科改良伊戈尔培养基(Dulbecco's modified Eagle's medium, DMEM)购自美国GIBCO公司,脂质体RNA转染剂购自美国Invitrogen公司,15~18 d C57BL/6种孕鼠(由第四军医大学实验动物中心提供)。
二、小鼠脑皮层神经元原代培养
脱颈法处死孕鼠, 体表用75%乙醇消毒。无菌状态下快速取出胎鼠置于冰盒上,解剖显微镜下剥离胎鼠大脑皮层,置于平衡盐溶液中,仔细剥去脑膜及血管组织,弃去液体后,用平衡盐溶液再漂洗l次,用眼科剪将脑皮质组织块剪碎,然后用巴斯德管吹打成匀浆液。1000 r/min离心5 min,弃上清。加入胰酶消化液,于37 ℃,50 mL/L CO2孵箱中消化20 min。通过40 μm细胞滤膜去除未消化组织。1000 r/min离心5 min,弃上清。加入含200 mL/L胎牛血清的DMEM培养液, 室温下终止消化10 min,DMEM培养液漂洗l次,用吸管在含200 mL/L胎牛血清的DMEM培养液中将消化后的组织块吹打成细胞悬液,显微镜下计数,以5×105个细胞/孔将细胞悬液接种于6孔培养板。置于37 ℃ 、50 mL/L CO2孵箱,培养5~7 d,每隔2~3 d半量换液1次。
三、机械损伤模型建立
在6孔细胞培养皿内以10 μL移液器塑料滴头于培养皿内划割培养的神经元,横竖各9道,造成神经元机械损伤。
四、皮层神经元转染
在体外培养7 d后,皮层神经元细胞可用于转染。转染根据脂质体RNA转染试剂盒的说明书进行。根据预实验,miR-124模拟物和转染剂的比例为5 ∶3。miR-124模拟物(2.5 μL)和转染剂(1.5 μL)融入基础培养基(neurobasal-A)中使转染液总体积为500 μL,室温下孵育20 min。将转染液分别加入相应的分组神经元的培养皿中,转染6 h。转染6 h后,将转染液更换为neurobasal-A,继续培养24 h后备用。miR-124抑制剂和阴性对照以相同方法进行处理,备用。
五、实验分组
在体外培养7 d后,细胞被随机分为5组:对照组、机械损伤组、机械损伤+ miR-124抑制剂组(inh-124)、机械损伤+miR-124模拟物组(mimic-124)和机械损伤+miR-124阴性对照组(NC-124)。其中,TBI组分为六个亚组,分别为:1 h、6 h、 12 h、24 h、72 h和144 h (n=3)。根据上述实验分组在实验后的观察结果,选取创伤后24 h这一时间点进行inh-124、mimic-124和NC-124组的观测。
六、实时定量聚合酶链反应法(RT-PCR)检测各组miR-124表达量变化
按Trizol说明书提取皮层神经元组织中的总RNA。按SYBR Green Master Mix Kit说明书操作,实时定量PCR仪扩增。以U6为内参照,用2-△△ct方法计算实验组与对照组miR-124的表达差异。miR-124及U6引物由生工生物工程(上海) 股份有限公司合成,miR-124及U6引物序列为:miR-124上游:5'- TA AGGCACGCGGTGAATG-3',下游:5'-GTGCAGGGTC CGAGGT-3',U6上游:5'-TGGCCCCTGCGCAAGGATG-3',下游:5'- AACGCTTCACGAATTTGCGT-3'。PCR反应条件为:95 ℃预变性5 min;95 ℃变性20 s,60 ℃退火30 s,72 ℃延伸30 s,40个循环;最后72 ℃延伸7 min。
七、Western Blot检测Nrp-1、Tau、Gap-43表达量的变化
取相应皮层神经元组织,加入动物细胞蛋白裂解液1 mL,冰上充分匀浆;12 000 r/min,离心20 min,收集上清液;BCA法蛋白定量;聚丙烯酰胺凝胶电泳分离蛋白;结束后将蛋白转移至硝酸纤维素膜上;丽春红染膜后按蛋白分子量裁剪硝酸纤维素膜;20 mL含5%脱脂奶粉的洗膜缓冲液(tris buffered saline tween, TBST)室温封闭1 h;Nrp-1(1 ∶4000)、Tau(1 ∶10 000)、Gap-43(1 ∶15 000)与β-actin (1 ∶3000)抗体4 ℃ 孵育过夜;TBST洗10 min×3次后再与辣根过氧化物酶标记的二抗(1 ∶15 000)室温孵育1 h;TBST洗10 min×3次后用增强型化学发光试剂显色,暗室曝光、显影和定影。用Image J图像分析系统测定条带的灰度值,选择β-actin作为内参照,以相应蛋白条带灰度值/β-actin条带灰度值的结果表示各蛋白表达水平。
八、统计学方法
结 果
一、机械损伤后miR-124 表达水平变化
实验组损伤后各时间点的miR-124表达均高于对照组(P<0.05),创伤后1 h、6 h、12 h、24 h、72 h和144 h其相对表达水平分别为对照组的(1.53±0.22) 倍、(2.57±0.31) 倍、(4.19±0.29) 倍、(3.88±0.18) 倍、(2.98±0.17) 倍、(1.87±0.39) 倍,且于损伤后12 h表达量最高,之后呈下降趋势,到144 h其表达水平仍高于对照组(P<0.05),如图1所示。
二、机械损伤后Nrp-1、Tau、Gap-43表达水平变化
实验组Nrp-1表达量于1 h开始上升,24 h达高峰后逐渐下降,总体表达水平均高于对照组(P<0.05)。实验组Tau在损伤后表达量持续上升,到72 h时表达量最高,之后下降,总体表达水平均高于对照组(P<0.05)。实验组Gap-43在创伤后6 h表达才开始升高,在6 h、12 h、24 h时高表达(P<0.05),之后表达下降,在144 h时表达量与对照组无显著差异(P>0.05),如图2所示。
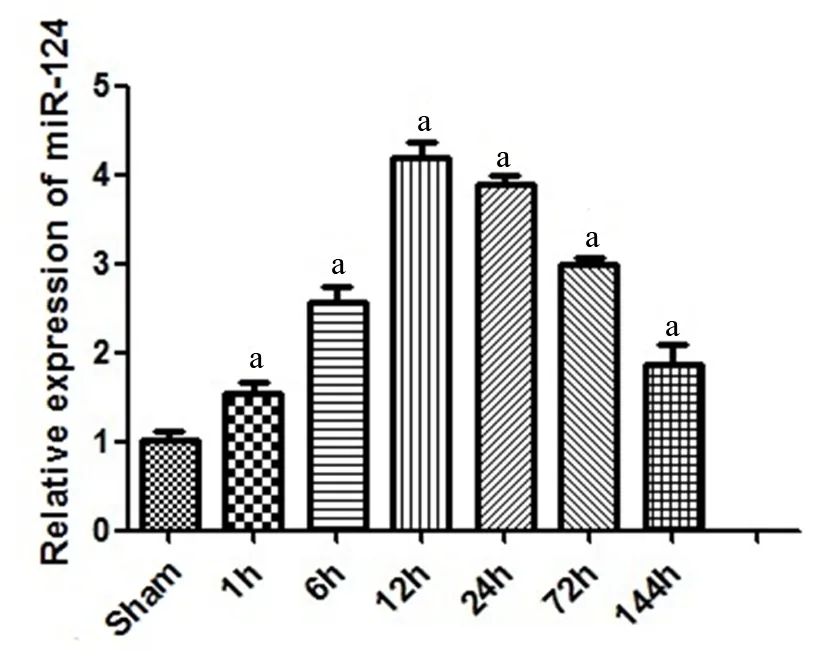
图1 实时PCR法检测在不同时间点miR-124的相对表达量与正常对照组比较
Fig 1 The relative expression of miR-124 at different time points comparing to the sham group detected by RT-PCR
aP<0.05,vssham group.

图2 Western Blot法检测在不同时间点Nrp-1、Tau、Gap-43的相对表达量与正常对照组比较
Fig 2 The relative expressions of Nrp-1, Tau and Gap-43 at different time points comparing to the sham group detected by Western Blot
A: Western Blot for Nrp-1,Tau,Gap-43; B: Statistical representation for the expression of Nrp-1; C: Statistical representation for the expression of Tau; D: Statistical representation for the expression of Gap-43.
aP<0.05,vssham group;bP>0.05,vssham group.
三、转染后miR-124的表达对Nrp-1、Tau、Gap-43的影响
我们选取创伤后24 h这一时间点进行对比,因为在上述实验中,此时的miR-124、Nrp-1、Tau和Gap-43的相对表达量改变均较显著。转染miR-124 mimic和inhibitor后, miR-124的相对表达量与对照组有显著差异,分别为6.88±0.78和0.35±0.06(P<0.05)。而miR-124 negative control组与对照组无显著差异(P>0.05),如图3所示。在相同时间点,Nrp-1、Tau和Gap-43的相对表达量均显著降低,且miR-124 inhibitor组降低较miR-124 mimic显著(P<0.05),如图4所示。

图3 RT-PCR法检测机械损伤后24 h时各组miR-124的相对表达量
Fig 3 The relative expressions of miR-124 of all groups at 24 h after mechanical injury detected by RT-PCR
aP<0.05,vssham group;bP>0.05,vssham group.
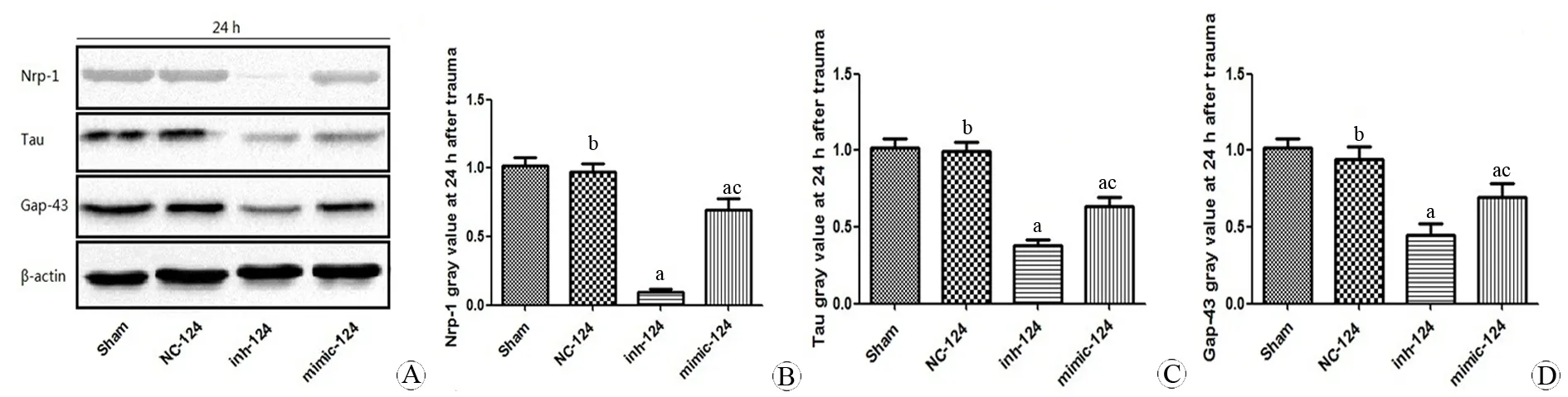
图4 Western Blot法检测创伤后24 h时各组的Nrp-1、Tau、Gap-43的表达量变化
Fig 4 The relative expressions of Nrp-1, Tau and Gap-43 of all groups at 24 h after mechanical injury detected by Western Blot
A: Western Blot for Nrp-1, Tau and Gap-43 of all groups at 24 h after mechanical injury; B: Statistical representation for the expression of Nrp-1; C: Statistical representation for the expression of Tau; D: Statistical representation for the expression of Gap-43.
aP<0.05,vssham group;bP>0.05,vssham group;cP<0.05,vsinh-124 group.
讨 论
TBI致死率和致残率极高,是神经外科最常见的严重疾患,其诊断、治疗和预后判断都是难点。虽然在中枢神经损伤后,由于多重附加因素针对再生的阻碍作用和环境对于固有再生能力的对抗作用,导致轴突再生困难,但目前研究[4]已肯定小鼠中枢神经系统具有一定的可塑性。在生理和病理刺激情况下,“休眠”状态的神经干细胞激活,进入增殖分化阶段,并迁入特定区域,替代并修复受损的神经元,在一定程度改善神经功能缺损[5]。然而只有再生轴突的定向生长及其与靶组织的正确连接才是神经功能修复的关键。目前我们认为,只有促进更多的神经干细胞分化为神经细胞,神经细胞产生足够多的轴突,才更有利于研究如何对其进行正确引导而致靶。
近年来,microRNA对神经元的再生和轴突修复的机制研究是热点。Cheng等[6]发现敲除内源性miR-124可以使室管膜下区(subventricular zone, SVZ)的神经干细胞一直处于分裂前体状态,而过表达miR-124则导致SVZ神经干细胞和间充质干细胞向神经元分化[7-8]。此项研究虽然成功通过上调miR-124促进了神经元的分化,但在轴突的功能恢复上未见报道。另有研究表明[9],在神经发育过程中,如果miR-124基因缺失,会使小鼠大脑体积变小、轴突生长缺陷、甚至神经细胞死亡等重大发育表型变化。本研究选择了三种蛋白通过Western Blot法检测其相对表达量的变化:Nrp-1(Neuropilion-1)是轴突生长受体蛋白,可以决定轴突的命运,研究证实[10-11],Sema3A(Semaphorin的家族成员)是一种抑制性轴突导向因子。在中枢损伤部位及周围组织中,Sema3A和Nrp-1过表达,会导致轴突生长锥坍塌和轴突过早停止生长,阻碍着新的轴突网络建立。Tau蛋白是含量最高的微管相关蛋白,它集中表达于神经元轴突。正常脑中Tau蛋白的细胞功能是与微管蛋白结合促进其聚合形成微管;与形成的微管结合,维持微管稳定性,降低微管蛋白分子的解离,并诱导微管成束[12],可以作为神经元轴突生长的标记蛋白。GAP-43是一种轴突膜蛋白,为神经特异性的蛋白质,参与神经细胞分化和突触发育形成[13]。它能调解轴突延伸,改变细胞形态,作为细胞内信号,可大大增强与G蛋白偶联的受体转运作用。
本研究在C57BL/6小鼠皮层神经元体外培养机械损伤模型[14]的基础上,观察到伤后1 h,miR-124表达开始增多,12 h即达最高峰,24 h、72 h、144 h逐渐减少,但仍高于对照组。通过Western Blot法检测我们观察到在创伤后Nrp-1、Tau和Gap-43的表达较对照组均显著升高(P<0.05),miR-124的变化与之呈正相关。证明了在中枢神经系统中,神经元损伤后的轴突再生和修复可能与miR-124存在密切的关系。我们选取miR-124和Nrp-1、Tau、Gap-43均显著表达的创伤后24 h作为观察的时间点,将实验组分为mimic-124 mimic、inh-124和NC-124三个亚组,通过转染技术对此时间点的miR-124表达进行干预。通过上述实验结果可以推测,过表达或抑制miR-124表达,都不利于轴突的再生修复。其中,相比于过表达miR-124,在抑制miR-124表达后,轴突的修复受到的阻碍更明显。所以,只有适量的miR-124高表达,才更有利于损伤后的轴突修复。而这个浓度梯度目前还不清楚,有待研究的进一步深入探讨。基于Nrp-1和Tau在轴突的再生修复过程中的重要作用和GAP-43在神经再生[15]和轴突修复中扮演着十分重要的角色,结合本研究我们可以初步推测:在神经元机械损伤后的病理状态下,大量miR-124被表达并可能参与神经元分化[6,16]和轴突的再生与修复。适度的miR-124高表达对轴突的生长尤为重要。
综上所述,本实验在体外神经元损伤模型中证实了适当的miR-124高表达可能与轴突再生有密切联系。但是,就目前小鼠中枢神经系统自发进行的轴突修复,能否正确的发出生长锥并与靶细胞产生有功能的连接,还有待实验验证。正确引导轴突生长和致靶才是恢复机体功能的关键,这是今后研究的一个目标。总之,miR-124的这种时间和空间特异性表达,为我们深入研究TBI后神经元轴突再生的机制提供了新思路。
1贺晓生. 神经干细胞移植在创伤性脑损伤再生与修复中的作用和影响因素 [J]. 中华神经外科疾病研究杂志, 2012, 11(1): 1-3.
2CAO X, YEO G, MUOTRI A R, et al. Noncoding RNAs in the mammalian central nervous system [J]. Annu Rev Neurosci, 2006, 29: 77-103.
3CAO X, PFAFF S L, GAGE F H. A functional study of miR-124 in the developing neural tube [J]. Genes Dev, 2007, 21(5): 531-536.
4YE Y, XU H, SU X, et al. Role of MicroRNA in governing synaptic plasticity [J]. Neural Plast, 2016: 4959523. doi: 10.1155/2016/4959523.
5ZHAO C, DENG W, GAGE F H. Mechanisms and functional implications of adult neurogenesis [J]. Cell, 2008, 132(4): 645-660.
6CHENG L C, PASTRANA E, TAVAZOIE M, et al. miR-124 regulates adult neurogenesis in the subventricular zone stem cell niche [J]. Nat Neurosci, 2009, 12(4): 399-408.
7ZHAO Y, JIANG H, LIU X W, et al. MiR-124 promotes bone marrow mesenchymal stem cells differentiation into neurogenic cells for accelerating recovery in the spinal cord injury [J]. Tissue Cell, 2015, 47(2): 140-146.
8WANG Y, WANG D, GUO D. MiR-124 promote neurogenic transdifferentiation of adipose derived mesenchymal stromal cells partly through RhoA/ROCK1, but not ROCK2 signaling pathway [J]. PLoS One, 2016, 11(1): 273-285.
9SUN A X, CRABTREE G R, YOO A S. MicroRNAs: regulators of neuronal fate [J]. Curr Opin Cell Biol, 2013, 25(2): 215-221.
10CHIU H, ALQADAH A, CHANG C. The role of microRNAs in regulating neuronal connectivity [J]. Front Cell Neurosci, 2014, 7(1): 283-289.
11HOU S T, KEKLIKIAN A, SLINN J, et al. Sustained up-regulation of semaphorin 3A, Neuropilin1, and doublecortin expression in ischemic mouse brain during long-term recovery [J]. Biochem Biophys Res Commun, 2008, 367(1): 109-115.
12DIXIT R, ROSS J L, GOLDMAN Y E, et al. Differential regulation of dynein and kinesin motor proteins by tau [J]. Science, 2008, 319(5866): 1086-1089.
13DONOVAN S L, MAMOUNAS L A, ANDREWS A M, et al. GAP-43 is critical for normal development of the serotonergic innervation in forebrain [J]. J Neurosci, 2002, 22(9): 3543-3552.
14刘开东, 周定标, 尚爱加, 等. 体外培养原代神经元损伤模型的建立及损伤后脑红蛋白的表达 [J]. 中国微侵袭神经外科杂志, 2008, 13(2): 68-70.
15LATCHNEY S E, MASIULIS I, ZACCARIA K J, et al. Developmental and adult GAP-43 deficiency in mice dynamically alters hippocampal neurogenesis and mossy fiber volume [J]. Dev Neurosci, 2014, 36(1): 44-63.
16LIU K, LIU Y, MO W, et al. MiR-124 regulates early neurogenesis in the optic vesicle and forebrain, targeting NeuroD1 [J]. Nucleic Acids Res, 2011, 39(7): 2869-2879.
DynamicchangeandsignificanceofmiR-124invitroaftermechanicaldamageofcorticalneuronsinmice
SUXinhong,YEYuqin,YANGYongxiang,HEXiaosheng
DepartmentofNeurosurgery,XijingHospital,FourthMilitaryMedicalUniversity,Xi'an710032, China
ObjectiveThe changes of microRNA-124 (miR-124) in vitro after mechanical damage of cortical neurons, and the influence of miR-124 on axon regeneration and repair after traumatic brain injury in mice were explored.MethodsPrimary cortical neurons were obtained from fetal C57BL/6 mice and cultivated for 7 d. Petri dishes were manually scratched with a 10 μL plastic stylet needle following a 9×9 square grim. Cells were collected at 1 h, 6 h, 12 h, 24 h, 72 h and 144 h after injury for experiments. The real-time polymerase chain reaction (RT-PCR) and Western Blot were used to test the relative expressions of miR-124 and Neuropilin-1 (Nrp-1), microtubule-associated protein tau (Tau), growth associated protein 43 (Gap-43), respectively. Then miR-124 mimic and inhibitor were used to intervene the cortex neuron in vitro to observe how the change of miR-124 expression quantity affected the experiment.ResultsMiR-124, Nrp-1, Tau and Gap-43 were significantly increased after mechanical damage of cortical neurons (P<0.05) and there was a positive correlation between them. The miR-124 mimic and inhibitor were significantly increased and decreased the expression of miR-124 respectively and then caused a significant reduction in the expressions of Nrp-1, Tau, Gap-43 and the decrease in inhibitor group was more significant than that of mimic group (P<0.05).ConclusionModerate high expression of miR-124 may be closely related to the axon regeneration. The result provides the experimental basis for regulating the expression of miR-124 gradually to regulate neural axon regeneration and restoration.
Mechanical damage; MiR-124; Axon regeneration and repair
1671-2897(2017)16-229-05
国家自然科学基金资助项目(81471264)
苏鑫洪,硕士研究生,E-mail: xhsu1987@sina.com
*通讯作者: 贺晓生,教授、主任医师,博士生导师,E-mail: hexiaos@fmmu.edu.cn
R 651
A
2016-09-18;
2017-01-07)