人巨细胞病毒蛋白pp65在胶质瘤中的表达及意义
李鹏起 李秉琴 闫志丰 陈晓燕 袁亮 董秋峰 杨鑫 李三中 甄海宁 费舟
(1第四军医大学西京医院神经外科,陕西 西安 710032; 2海东市乐都区人民医院妇产科,青海 海东 810700)
·脑胶质细胞瘤诊治研究·
人巨细胞病毒蛋白pp65在胶质瘤中的表达及意义
李鹏起1李秉琴2闫志丰1陈晓燕1袁亮1董秋峰1杨鑫1李三中1*甄海宁1*费舟1
(1第四军医大学西京医院神经外科,陕西 西安 710032;2海东市乐都区人民医院妇产科,青海 海东 810700)
目的探讨人巨细胞病毒(HCMV)蛋白pp65在胶质瘤中的表达水平及其意义。方法采用免疫组化方法检测HCMV蛋白pp65在175例人脑胶质瘤组织及10例正常人脑组织中的表达,分析其表达水平与胶质瘤临床病理学特征的关系。结果pp65蛋白在胶质瘤组织中的表达水平明显高于正常人脑组织(Z=-4.338,P=0.000);pp65蛋白在高恶性度胶质瘤中的免疫染色强度明显强于低恶性度胶质瘤(Z=-0.960,P=0.037),而pp65蛋白免疫染色强度与胶质瘤的病理级别无明显的相关性(r=0.096,P=0.208),以及pp65蛋白免疫染色强度与胶质瘤患者的性别(r=0.138,P=0.069)、年龄(r=0.016,P=0.837)和肿瘤部位(r=-0.147,P=0.052)也均无明显相关性。结论HCMV感染及其蛋白pp65表达可能与人脑胶质瘤的发生存在一定关系,但其确切的致瘤机制尚需进一步研究。
人巨细胞病毒; 磷酸化糖蛋白65; 胶质瘤; 免疫组化
胶质瘤是中枢神经系统发病率最高的恶性肿瘤,其发病率约占颅内肿瘤的45%。尽管在胶质瘤的影像诊断、手术治疗、放射治疗以及药物治疗方面取得了很大的进展,但胶质瘤患者的预后并未得到根本的改善,经规范的综合治疗后,目前恶性胶质瘤患者的中位生存期尚不足15个月。因此,需要对胶质瘤的病因学和发病机制进行更深入的研究,以期为临床提供新的更为有效的治疗策略。近年来有研究显示在人胶质瘤以及其它类型的恶性肿瘤中存在人巨细胞病毒(human cytomegalovirus, HCMV)的感染及其病毒蛋白的表达,提示HCMV可能与人类某些恶性肿瘤的发生和发展存在一定关系,但研究结果仍存在很大分歧[1-2]。基于此,本研究采用免疫组化方法检测了HCMV磷酸化糖蛋白65(phosphorylated glycoprotein 65, pp65)在人脑胶质瘤组织中的表达水平,并进一步分析了pp65蛋白表达水平与胶质瘤临床病理学特征的关系。
材料与方法
一、病例和标本
175例胶质瘤组织均取自西京医院神经外科手术切除的肿瘤标本,10例正常人脑组织为该科室在脑外伤内减压术或高血压脑出血皮层造瘘术中获得。本组胶质瘤患者男性102例,女性73例;年龄2~81岁,平均(40.1±16.8)岁;肿瘤位于幕上150例,幕下25例。胶质瘤标本均经福尔马林固定、石蜡包埋,由西京医院病理科行HE染色及相关肿瘤标志物免疫组化染色,按照2007年WHO中枢神经系统肿瘤分类和分级标准进行确诊,其中Ⅰ级25例,包括毛细胞型星形细胞瘤13例、节细胞胶质瘤12例;Ⅱ级50例,包括弥漫型星形细胞瘤25例、原浆型星形细胞瘤1例、肥胖型星形细胞瘤1例、少突胶质细胞瘤7例、少突星形细胞瘤11例、室管膜瘤4例、脊索样胶质瘤1例;Ⅲ级47例,包括间变型星形细胞瘤12例、间变型少突胶质细胞瘤21例、间变型少突星形细胞瘤12例、间变型节细胞胶质瘤2例;Ⅳ级53例,包括胶质母细胞瘤42例、巨细胞胶质母细胞瘤1例、胶质肉瘤1例、髓母细胞瘤6例、原始神经外胚层肿瘤3例。低恶性度胶质瘤(包括Ⅰ级和Ⅱ级)75例,高恶性度胶质瘤(包括Ⅲ级和Ⅳ级)100例(表1)。
二、免疫组化方法
采用聚合物-过氧化物酶(polymer-peroxidase, PP)免疫组化两步法。胶质瘤组织蜡块连续切片,厚3 μm,贴于涂有3-氨丙基三乙氧基硅烷(3-aminopropyl-triethoxysilane, APES)防脱片胶的载玻片,60 ℃烤片8 h后备用。石蜡切片常规脱蜡至水,浸于乙二胺四乙酸(ethylene diamine tetraacetic acid, EDTA)缓冲液(pH=9.0)中高压热修复2 min 15 s。切片用3% H2O2于室温下孵育10 min,以封闭内源性过氧化物酶活性。用动物血清工作液于室温下孵育1 h,以封闭非特异性结合位点。HCMV pp65一抗(英国Leica公司)稀释度为1 ∶50,4 ℃冰箱孵育过夜(12~18 h)。EnVision复合物液(丹麦Dako公司)于室温下孵育30 min。二氨基联苯胺(diaminobenzidine, DAB)显色,苏木素复染。常规脱水、透明、中性树胶封片。以HCMV蛋白pp65表达阳性的结肠癌组织切片作为阳性对照,用磷酸盐缓冲溶液(phosphate buffered solution, PBS)代替一抗作为阴性对照。
三、结果判定
HCMV蛋白pp65免疫组化染色强度根据阳性细胞百分率和着色程度两个方面综合评定为-~+++。每例标本在瘤细胞免疫反应较强的区域,于×400高倍镜下随机选取3~5个视野,共计数1000个细胞。阳性细胞百分率评分:≤5%为0分,6%~25%为1分,26%~50%为2分,> 50%为3分。着色程度评分:无色为0分,浅黄色为1分,黄色为2分,深黄色或棕褐色为3分。两者之乘积为切片的染色分值,以此评定染色强度:-(0分),+(1、2分),++(3、4分),+++(6、9分)。
四、统计学分析
采用SPSS 19.0软件包进行统计学分析,HCMV蛋白pp65表达水平与患者性别、年龄、肿瘤部位、病理级别的关系采用Spearman等级相关分析;pp65蛋白表达水平在胶质瘤与正常人脑组织,高、低不同恶性程度胶质瘤之间的差异采用Wilcoxon秩和检验。P<0.05表示差异有统计学意义。
结 果
一、HCMV蛋白pp65在胶质瘤和正常人脑组织中的表达
pp65蛋白免疫反应信号定位于胞核和/或胞浆,以胞核为主(图1)。pp65蛋白在175例胶质瘤组织中有138例呈现阳性表达,阳性表达率78.9%;而在10例正常人脑组织中均无表达;pp65蛋白在胶质瘤组织中的表达水平明显高于正常人脑组织(Z=-4.338,P=0.000)。
二、HCMV蛋白pp65表达与胶质瘤临床病理学特征的关系
pp65蛋白在高恶性度胶质瘤中的免疫染色强度明显强与低恶性度胶质瘤(Z=-0.960,P=0.037),而pp65蛋白免疫染色强度与胶质瘤的病理级别无明显的相关性(r=0.096,P=0.208),以及pp65蛋白免疫染色强度与胶质瘤患者的性别(r=0.138,P=0.069)、年龄(r=0.016,P=0.837)和肿瘤部位(r=-0.147,P=0.052)也均无明显相关性(表1)。
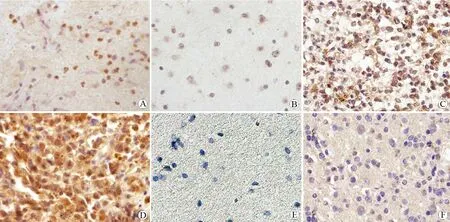
图1 HCMV蛋白pp65在人胶质瘤中的表达(免疫组化,DAB显色,×400)
Fig 1 Expression of pp65 protein of human cytomegalovirus in human brain gliomas (Immunohistochemistry, DAB coloration, ×400)
A: Pilocytic astrocytoma (WHO Grade I) with moderate expression of protein pp65 (Graded ++); B: Diffuse astrocytoma (WHO Grade Ⅱ) with low expression of protein pp65 (Graded +); C: Anaplastic oligodendroglioma (WHO Grade III) with strong expression of protein pp65 (Graded +++); D: Glioblastoma (WHO Grade IV) with strong expression of protein pp65 (Graded +++); E: Normal human brain tissue with negative expression of protein pp65; F: Anaplastic oligodendroglioma (WHO Grade Ⅲ) with negative expression of protein pp65 (negative control, the same specimen as shown in Picture C).
表1 HCMV蛋白pp65表达与胶质瘤临床病理学特征的关系 (n, %)
Tab 1 The relationship between pp65 expression of HCMV and clinicopathological features of gliomas (n, %)
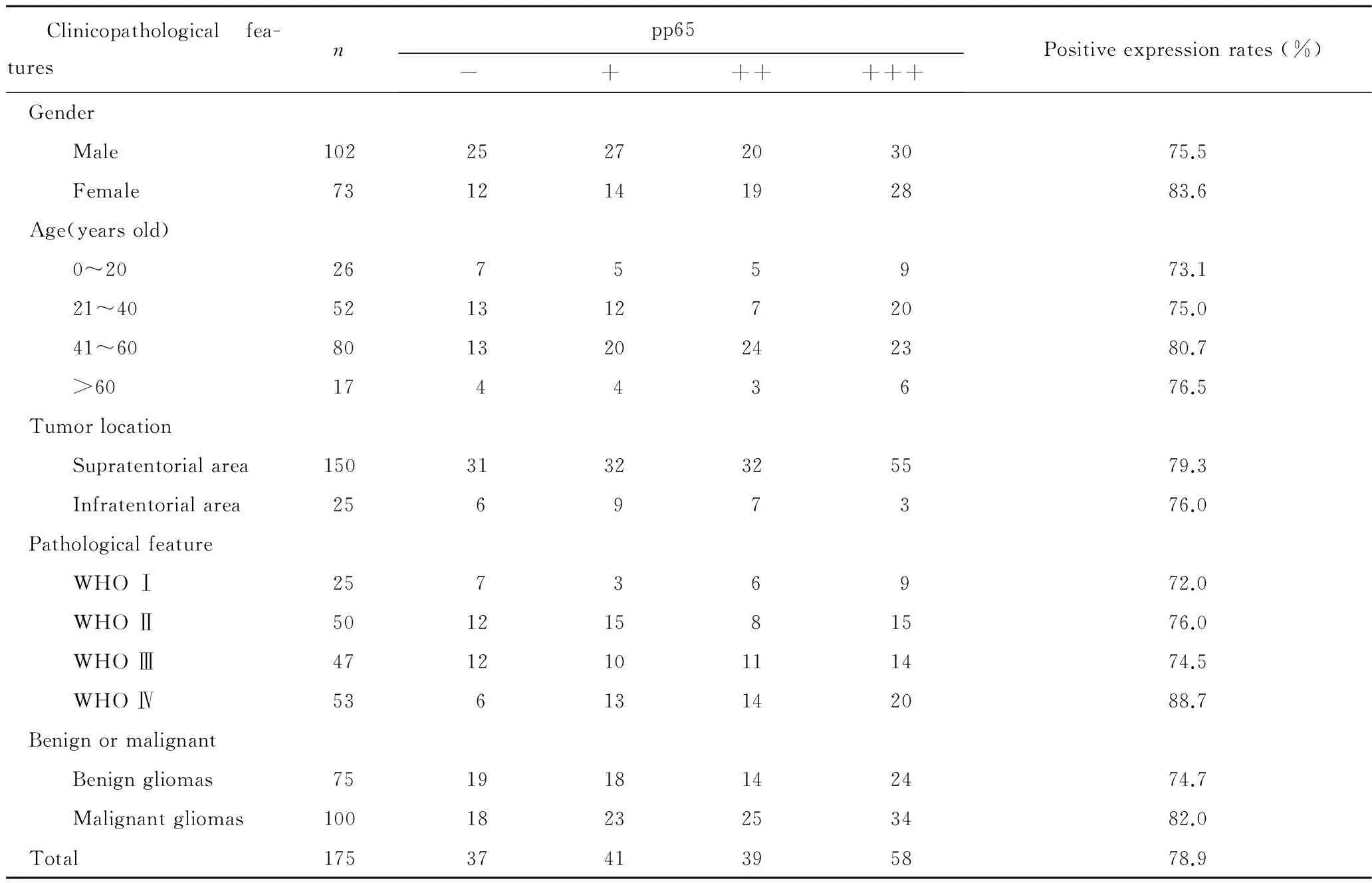
Clinicopathologicalfea-turesnpp65-++++++Positiveexpressionrates(%) Gender Male1022527203075.5 Female731214192883.6 Age(yearsold) 0~2026755973.1 21~4052131272075.0 41~60801320242380.7 >6017443676.5 Tumorlocation Supratentorialarea1503132325579.3 Infratentorialarea25697376.0 Pathologicalfeature WHOⅠ25736972.0 WHOⅡ50121581576.0 WHOⅢ471210111474.5 WHOⅣ53613142088.7 Benignormalignant Benigngliomas751918142474.7 Malignantgliomas1001823253482.0 Total1753741395878.9
讨 论
HCMV属于疱疹病毒β亚科,是人类疱疹病毒组中最大的一种病毒。HCMV基因结构为双链线状DNA,全长约235 kb,整个基因组编码约165种蛋白[3]。pp65蛋白是由HCMV基因UL83编码的一种被膜蛋白,属于低基质磷酸化蛋白,具有高度的保守性,含有561个氨基酸,分子质量65 kD。pp65是HCMV感染后发生细胞免疫反应的主要靶点之一,其与人体免疫系统相关分子结合,可阻止HCMV感染的细胞被人体免疫系统相关分子攻击,具有免疫逃避功能[4]。HCMV在人群中的感染非常普遍,根据不同国家和地区其感染率可达70%~100%。HCMV在通常情况下呈隐性感染,但在免疫功能低下的人群(如艾滋病、器官移植和恶性肿瘤等患者)中可引起严重疾病。此外,有研究显示HCMV感染及其相关蛋白具有致瘤可能,相关机制涉及肿瘤细胞的存活、增殖、凋亡、侵袭、血管生成、细胞周期调控和信号转导通路改变等[5-6]。
2002年,Cobbs等[7]首先报道了HCMV在人脑胶质瘤组织中存在很高的感染率,而在正常人脑组织及脑膜瘤等良性肿瘤中则无HCMV感染。作者采用免疫组化方法检测27例WHO Ⅱ~Ⅳ级胶质瘤标本中HCMV蛋白IE1-72的表达,结果显示在所有被检测的胶质瘤组织中均有IE1-72蛋白的表达;对其中10例胶质瘤标本检测了HCMV蛋白pp65的表达,结果也均有pp65蛋白的阳性表达,作者认为HCMV感染与人脑胶质瘤的发生可能存在密切关系。2008年,Mitchell等[8]采用免疫组化方法在30/33例胶质母细胞瘤中检测到pp65蛋白的表达,阳性表达率高达91%,再次提示在人胶质瘤组织中存在HCMV的感染,并与胶质瘤的发生可能有关。Shamran等[9]的研究也取得了类似的结果。与以上研究报道相对应,也存在许多相反的研究结果。Lau等[10]采用免疫组化方法检测22例胶质瘤,包括3例弥漫型星形细胞瘤、3例室管膜瘤、2例少突胶质细胞瘤、6例间变型星形细胞瘤和8例胶质母细胞瘤,结果显示在以上胶质瘤组织中均无pp65蛋白的表达以及HCMV感染的迹象。Poltermann等[11]的研究同样也认为在人脑胶质瘤组织中并无HCMV感染的证据。Baumgarten等[12]采用免疫组化方法检测123例脑肿瘤标本,包括91例胶质母细胞瘤、20例髓母细胞瘤和12例神经母细胞瘤,结果显示pp65蛋白仅在1例胶质母细胞瘤中呈弱阳性表达。可见,关于在胶质瘤组织中是否存在HCMV感染及其蛋白表达仍存在严重分歧,其原因可能与肿瘤标本的选择、检测方法的不同以及不同地区和种族HCMV感染的水平存在差异有关。
国内学者Ding等[13]和Xing等[14]分别采用免疫组化方法检测67例和79例脑胶质瘤标本,结果显示pp65蛋白在脑胶质瘤组织中均有很高的阳性表达率。本研究采用免疫组化方法检测175例脑胶质瘤标本,这是目前国内外最大宗的一组研究资料,结果显示pp65蛋白在脑胶质瘤组织中阳性表达率为78.9%,而在正常人脑组织中均无表达,pp65蛋白在脑胶质瘤中的表达水平明显高于正常人脑组织,提示HCMV感染及其pp65蛋白表达与脑胶质瘤的发生存在一定关系。Ding等[13]的研究结果显示pp65蛋白的表达阳性率在胶质瘤的病理级别间无明显差异,而Xing等[14]的研究结果显示在高级别胶质瘤中pp65蛋白的表达阳性率要高于低级别胶质瘤。本研究结果显示pp65蛋白在高恶性度胶质瘤中的免疫强度明显强于低恶性度胶质瘤,而pp65蛋白免疫染色强度在胶质瘤不同病理级别间无统计学显著差异(表1)。以上研究结果之间的差异可能与胶质瘤组织标本的选择以及具体的免疫组化方法的不同有一定关系,此外也尚不能完全排除pp65蛋白在胶质瘤发展和演进过程中发挥一定的作用。本研究结果还显示pp65蛋白的表达水平与胶质瘤患者的性别、年龄和肿瘤生长部位均无明显的相关性,提示胶质瘤患者不同的性别、年龄和胶质瘤发生部位有着相似的HCMV感染几率。
总之,本研究结果显示HCMV感染及其pp65蛋白表达与国人脑胶质瘤的形成可能存在一定的病因学关系,但其确切的致瘤作用机制尚需进一步深入研究。
1LAWLER S E. Cytomegalovirus and glioblastoma: controversies and opportunities [J]. Neuro Oncol, 2015, 123(3): 465-471.
2WEN P Y. Controversies in neuro-oncology: does valganciclovir have a role in the treatment of high-grade gliomas? [J]. Neuro Oncol, 2014, 16(3): 329.
3BHATTACHARJEE B, RENZETTE N, KOWALIK T F. Genetic analysis of cytomegalovirus in malignant gliomas [J]. J Virol, 2012, 86(12): 6815-6824.
4TOMTISHEN J R. Human cytomegalovirus tegument proteins (pp65, pp71, pp150, pp28) [J/OL]. Virol J, 2012, 9: 22. doi: 10.1186/1743-422X-9-22.
5AHANI N, SHIRKOOHI R, ROKOUEI M, et al. Overexpression of enhancer of zeste human homolog 2 (EZH2) gene in human cytomegalovirus positive glioblastoma multiforme tissues [J/OL]. Med Oncol, 2014, 31(11):252. doi: 10.1007/s12032-014-0252-9.
6闫志丰, 李三中, 董秋峰, 等. 人巨细胞病毒感染在颅咽管瘤中的表达及意义[J]. 中华神经外科疾病研究杂志, 2016, 15(2): 148-151.
7COBBS C S, HARKINS L, SAMANTA M, et al. Human cytomegalovirus infection and expression in human malignant glioma [J]. Cancer Res, 2002, 62(12): 3347-3350.
8MITCHELL D A, XIE W, SCHMITTLING R, et al. Sensitive detection of human cytomegalovirus in tumors and peripheral blood of patients diagnosed with glioblastoma [J]. Neuro Oncol, 2008, 10(1): 10-18.
9SHAMRAN H A, KADHIM H S, HUSSAIN A R, et al. Detection of human cytomegalovirus in different histopathological types of glioma in Iraqi patients [J/OL]. Biomed Res Int, 2015: 642-652. doi: 10.1155/2015/642652.
10LAU S K, CHEN Y Y, CHEN W G, et al. Lack of association of cytomegalovirus with human brain tumors [J]. Mod Pathol, 2005, 18(6): 838-843.
11POLTERMANN S, SCHLEHOFER B, STEINDORF K, et al. Lack of association of herpesviruses with brain tumors [J]. J Neurovirol, 2006, 12(2): 90-99.
12BAUMGARTEN P, MICHAELIS M, ROTHWEILER F, et al. Human cytomegalovirus infection in tumor cells of the nervous system is not detectable with standardized pathologico-virological diagnostics [J]. Neuro Oncol, 2014, 16(11): 1469-1477.
13DING D, HAN S, WANG Z, et al. Does the existence of HCMV components predict poor prognosis in glioma? [J]. J Neurooncol, 2014, 116(3): 515-522.
14XING Y, WANG Y, WANG S, et al. Human cytomegalovirus infection contributes to glioma disease progression via upregulating endocan expression [J/OL]. Transl Res, 2016, 177: 113-126. doi: 10.1016/j.trsl.2016.06.008.
Expressionandsignificanceofpp65proteinofhumancytomegalovirusingliomas
LIPengqi1,LIBingqin2,YANZhifeng1,CHENXiaoyan1,YUANLiang1,DONGQiufeng1,YANGXin1,LISanzhong1,ZHENHaining1,FEIZhou1
1DepartmentofNeurosurgery,XijingHospital,FourthMilitaryMedicalUniversity,Xi'an710032;2DepartmentofGynecologyandObstetrics,LeduDistrictPeople'sHospitalofHaidongCity,Haidong810700, China
ObjectiveThe expression and significance of pp65 protein of human cytomegalovirus (HCMV) in gliomas were investigated.MethodsThe expression of pp65 protein of HCMV was detected by immunohistochemistry in 175 cases of human brain glioma and 10 cases of normal human brain tissue, as well as the relationship between its expression and clinicopathological features of gliomas was further analyzed.ResultsExpression of pp65 protein in gliomas was significantly higher than that in normal human brain tissues (Z=-4.338,P=0.000). Immunostaining intensity of pp65 protein in malignant gliomas was significantly higher than that in benign gliomas (Z=-0.960,P=0.037), while the immunostaining intensity of pp65 protein was not significantly associated with the pathological grade (r=0.096,P=0.208), as well as with the gender (r=0.138,P=0.069), age (r=0.016,P=0.837) and tumor site (r=-0.147,P=0.052) of glioma patients.ConclusionHCMV infection and its protein pp65 expression may be associated with the tumorigenesis of human brain gliomas, however its exact oncogenous mechanism needs further study.
Human cytomegalovirus (HCMV); Pp65; Glioma; Immunohistochemistry
1671-2897(2017)16-202-05
陕西省社会发展攻关计划基金资助项目(2014K11-01-02-07);西京医院学科助推计划创新人才基金资助项目(XJZT08R09)
李鹏起,硕士研究生,住院医师,E-mail: wwwqinghailpq@sina.com
*通讯作者: 李三中,副主任医师,E-mail: sunny_3c@126.com;甄海宁,副教授、副主任医师,硕士生导师,E-mail: zhenhn@fmmu.edu.cn
R 373; R 739.41
A
2016-10-07;
2016-11-25)