烤烟品系LY1306在PEG干旱胁迫下的生理响应及转录组学分析
周炎,丁松爽,赵莉,赵世民,史宏志,杨惠娟
1 河南农业大学 国家烟草栽培生理生化基地,河南 郑州 450002;2 河南省烟草公司 洛阳市公司,河南 洛阳 471026
随着全球的气候变暖,人类及动植物所面临的生态问题愈加严峻。对于作物生长来说,水资源短缺导致的干旱问题正是亟待解决的问题之一[1]。干旱导致植物失水,体内活性氧积累,对组织造成伤害,造成巨大的经济损失。烟草是我国重要的经济作物,也是常用的模式植物。研究烟草对干旱胁迫的生理响应可为培育烟草耐旱品种提供理论依据,也可为其他作物的抗旱研究提供思路。转录组测序技术近年来在多领域均有广泛应用,植物的干旱胁迫也是较为热门的研究领域,但目前以烟草为对象,以转录组测序为手段研究其对干旱胁迫信号响应的文章尚不多见。
LY1306是由系统选育的G80变异株系依次与K326、89112杂交育成的适应性强、抗性好、易烘烤的烤烟品系,该品系较适应丘陵山区的气候条件,在干旱少雨、灌溉不充分的地区生长较好,表现出明显的抗旱特性[2]。对LY1306品系的抗旱机理的研究可以深入了解该品系的抗旱特性。本文通过PEG模拟干旱条件并结合转录组分析,阐述了干旱胁迫条件下LY1306品系烟叶的生理变化及应激响应基因表达组学特征,继而为烟草抗旱育种奠定基础。
1 材料与方法
1.1 试验材料
实验于2015年至2016年于河南农业大学国家烟草栽培生理生化基地实施, 供试品系为LY1306,设置3个处理,分别是15%PEG-6000处理0 h、16 h、24 h,每个处理3个重复。运用漂浮育苗培育LY1306 46 d,烟草幼苗长至4片叶后移栽至珍珠石中,以MS培养基(不含糖,不含琼脂)为营养物质培养。移栽后23 d,选取长势相同的烟株进行处理。分别在移入15%PEG-6000前和移入后16 h、24 h时,选取烟草叶片(统一选取大于5 cm叶片,从上往下数第4和第5片叶子),液氮速冻后,保存于-70℃ 冰箱。并将3个重复样品等量混合,提取RNA,对其进行后续的转录组测序分析。另外选取长势相同的未处理烟苗作为对照组(CK),在每次取样前分别拍照记录实验组和处理组的叶片状态。
1.2 烟草生理指标测定
1.2.1 叶片水势测定
采用小液流法测定叶片水势。
1.2.2 抗氧化酶活性测定
超氧化物歧化酶(SOD),过氧化物酶(POD)和过氧化氢酶(CAT)的活性测定均采用苏州科铭生物技术有限公司生产的相应微量法试剂盒。
1.2.3 丙二醛(MDA)和脯氨酸(PRO)含量测定
分别采用苏州科铭生物技术有限公司的丙二醛(malondialdehyde,MDA)微量法试剂盒和脯氨酸(PRO)微量法试剂盒测定样品中MDA和PRO含量。
1.3 烟草叶片RNA 提取及测序
样品总RNA提取由上海欧易生物医学科技有限公司进行。DNase消化DNA后,用带有Oligo(dT)的磁珠富集真核生物mRNA;加入打断试剂将mRNA打断成短片段,以打断后的mRNA为模板, 用六碱基随机引物合成一链cDNA,二链合成反应体系合成二链cDNA,在cDNA二链合成时以dUTP代替dTTP,连接不同接头,再利用UNG酶法将含有dUTP的一条链进行消化,只保留连接不同接头的cDNA一链;采用试剂盒纯化cDNA一链;纯化的cDNA一链进行末端修复、加A尾并连接测序接头,再进行片段大小选择,最后进行PCR扩增;构建好的文库用Agilent 2100 Bioanalyzer质检合格后,使用Illumina HiSeqTM 2500测序仪进行测序。
1.4 RNA-Seq 序列的分析
由Illumina HiSeqTM2500测序所得的数据经质控(QC)过滤得到clean reads,用tophat/bowtie2将clean reads比对到参考序列。再通过统计reads在参考序列上的分布情况及覆盖度,判断比对结果是否通过第二次质控(QC of alignment)。通过后进行一系列后续分析,依据DESeq[3]软件包中的NB(负二项分布检验的方式)对reads数进行差异显著性检验,并采用basemean值来估算表达量。并从基因表达结果中,筛选FC>2,且P<=0.05的基因为样品间差异表达的基因。
1.5 差异表达基因的注释及分析
对差异表达基因进行GO(Gene Ontology)富集分析,结合GO注释结果对其功能进行描述。统计每个GO条目中所包括的差异基因个数,并用超几何分布检验方法计算每个GO条目中差异基因富集的显著性。利用KEGG(Kyoto Encyclopedia of Genes and Genomes)数据库对差异基因进行Pathway分析,并用超几何分布检验的方法计算每个Pathway条目中差异基因富集的显著性。分析结果top20按照每个条目对应的-log10Pvalue排序,同时过滤掉包含差异基因数目小于3的条目。
2 结果与分析
2.1 15%PEG-6000处理前后烤烟LY1306品系叶片形态和水势变化
经过对比可以看出(图1),PEG处理16 h后,烤烟LY1306品系叶片出现少量失水症状,叶尖发软。处理24 h后,叶尖叶缘出现失水萎蔫症状。但总体来说,与对照组相比萎蔫症状不明显。

图1 15%PEG-6000处理不同时间对烤烟LY1306品系叶片状态的影响Fig.1 Influence of 15% PEG-6000 treatment of different duration on leaf status
在实验中,叶片水势随着干旱处理时间的延长而降低,且前16 h水势下降较多,比0 h下降了20.6%,16 h后水势下降较少,24 h比0 h降低了26.5%(图2)。
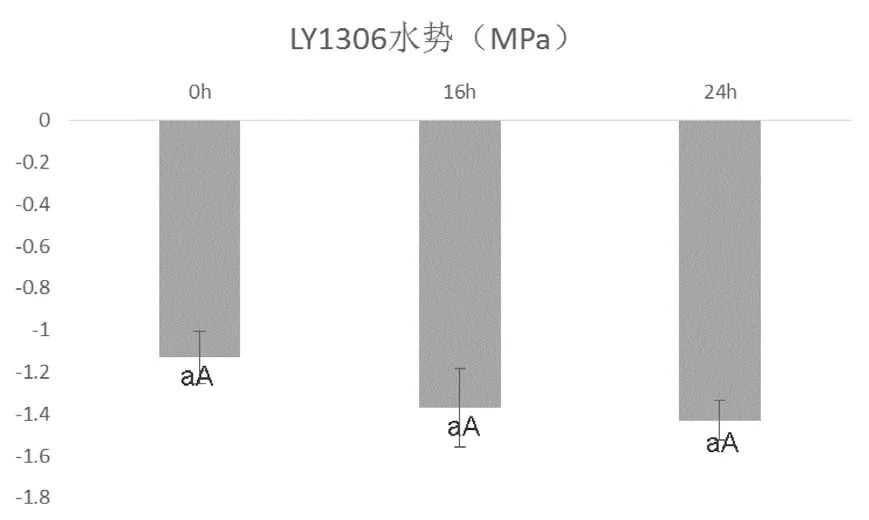
图2 15%PEG-6000处理不同时间对烤烟LY1306品系叶片水势的影响Fig.2 Influence of 15% PEG-6000 treatment of different duration on leaf water potential
2.2 15%PEG-6000模拟干旱胁迫对烤烟LY1306品系抗氧化酶活性的影响
实验表明(图3,图4),随干旱胁迫时间的延长,SOD和POD活性随干旱胁迫时间的延长均呈现出上升趋势,但上升速率不同。SOD活性前期上升缓慢,后期迅速上升,16 h与24 h时分别是0 h的1.13倍和2.75倍。POD活性随干旱胁迫时间的延长逐渐增强,且前期上升速度与SOD相比更快。16 h、24 h时POD活性分别为0 h的2.56倍和4.2倍。与SOD、POD相反,CAT活性随干旱胁迫时间的延长逐渐下降,且下降速度先慢后快(图5)。16 h与24 h的CAT活性分别比0 h下降了4.7%和22.8%。
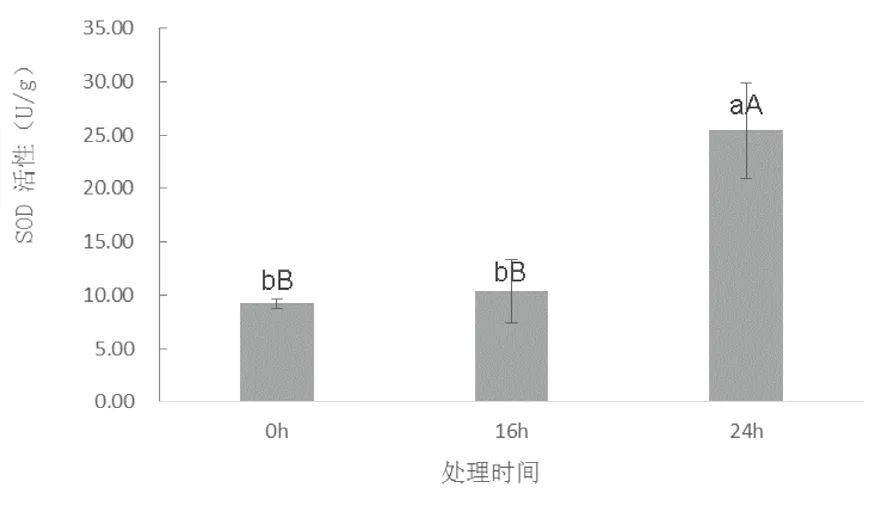
图3 15%PEG-6000处理下LY1306叶片中SOD活性变化Fig.3 changes of SOD activity in LY1306 leaves under the treatment of 15%PEG-6000

图4 15%PEG-6000处理下LY1306叶片中POD活性变化Fig.4 changes of POD activity in LY1306 leaves under the treatment of 15%PEG-6000
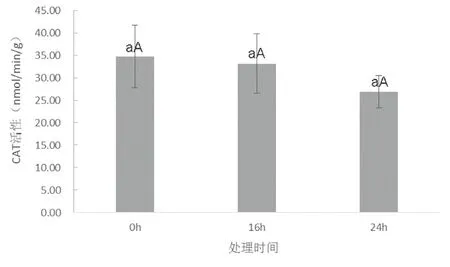
图5 15%PEG-6000处理下LY1306叶片中CAT活性变化Fig.5 changes of CAT activity in LY1306 leaves under the treatment of 15%PEG-6000
2.3 15%PEG-6000模拟干旱胁迫对烤烟LY1306品系丙二醛和脯氨酸含量的影响
LY1306叶片中的丙二醛(MDA)含量呈现出先上升后下降的趋势(图6),其峰值出现在16 h。叶片中脯氨酸含量随着干旱处理时间的延长呈现出先上升后趋于平稳的趋势(图7)。具体表现为24 h>16 h>0 h。脯氨酸含量在干旱胁迫前16 h迅速增长,比0 h增加了2.8倍;16 h后增长缓慢,处理24 h叶片脯氨酸含量仅略高于16 h,这与叶片水势的变化趋势基本吻合。
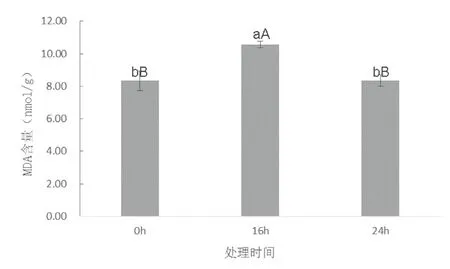
图6 15%PEG-6000处理下LY1306叶片中丙二醛(MDA)含量变化Fig.6 changes of MDA content in LY1306 leaves under the treatment of 15%PEG-6000
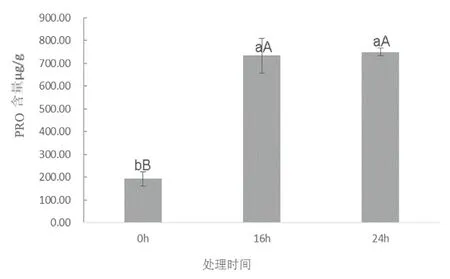
图7 15%PEG-6000处理下LY1306叶片中脯氨酸(PRO)含量变化Fig.7 changes of PRO content in LY1306 leaves under the treatment of 15%PEG-6000
上述结果表明,15%PEG模拟的干旱胁迫下,烤烟品系LY1306叶片中POD和SOD升高较为明显,但对干旱信号的响应速度不同;脯氨酸在干旱胁迫发生后迅速响应并大量积累。
2.4 15%PEG-6000处理后LY1306叶片转录组表达分析
3个样本(15%PEG-6000处理0 h、16 h、24 h)经测序后分别得到原始序列52493886,53206758,53175198条,经质控过滤后分别得到干净序列51423972,51969504,52153830条,其中比对上参考序列的分别有49135898,49576507,49257835条,占总干净序列的百分比分别为95.55%,95.39%,94.44%,说明测序数据质量良好。
经差异表达分析,相比于0 h,15%PEG处理16 h的样本共筛选出3547个差异表达基因,其中1589个基因表达上调,1958个基因表达下调;PEG处理24 h的样本共筛选出3141个差异表达基因,其中1579个基因表达上调,1562个基因表达下调。
2.5 PEG处理后叶片差异表达基因的GO分析
差异表达基因GO分类,共对应到生物过程(Biological process,BP)、细胞组成(Cellular component,CC)和分子功能(Molecular Function,MF)3大类。15%PEG处理16 h样本的差异基因中,上调基因共注释到1331个条目(图8)。其中注释到生物过程、细胞组成和分子功能的条目数量分别为741、138和452个。15%PEG处理24 h的样本中上调基因共注释到1507个条目(图9),其中注释到生物过程、细胞组成、分子功能的条目数分别为839、189、479个。
从图中可以看出,生物过程中的盐胁迫响应(response to salt stress)、赤霉素响应(response to gibberellin),细胞成分中的细胞质核周区(perinuclear region of cytoplasm)和分子功能中的转录因子活性(transcription factor activity)在处理16 h和24 h样本中均表现为上调。
2.6 PEG处理后叶片差异表达基因的KEGG代谢通路分析
经过KEGG代谢通路分析(图10),15%PEG处理16 h的样本中,差异表达基因被富集到184个代谢通路,其中112个通路发生上调,141个通路发生下调;显著富集(P<0.05)的通路为36个,其中28个上调,31个下调。PEG处理24 h的样本差异表达基因被富集到164个通路,其中上调通路117个,下调通路128个;其中P<0.05发生显著富集的共有38个,30个上调通路,35个下调通路。可看出随着干旱胁迫时间的延长,显著富集的通路数目无论上调还是下调均有所增加。
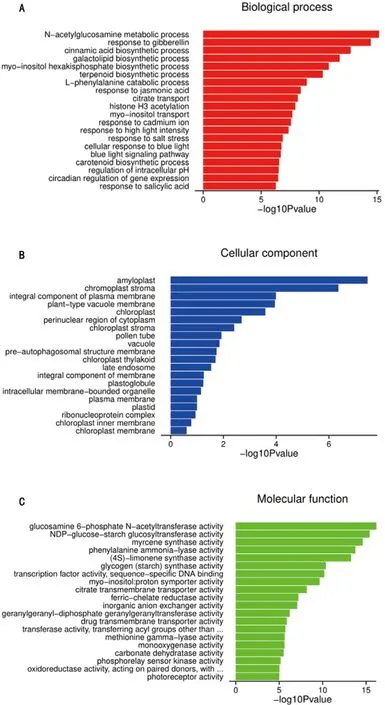
图8 15%PEG-6000处理16 h后烤烟LY1306品系相对于0 h上调表达基因GO分析Fig.8 GO analysis of up-regulated genes in LY1306 the flue-cured tobacco line under the treatment of 15%PEG-6000 for 16 h
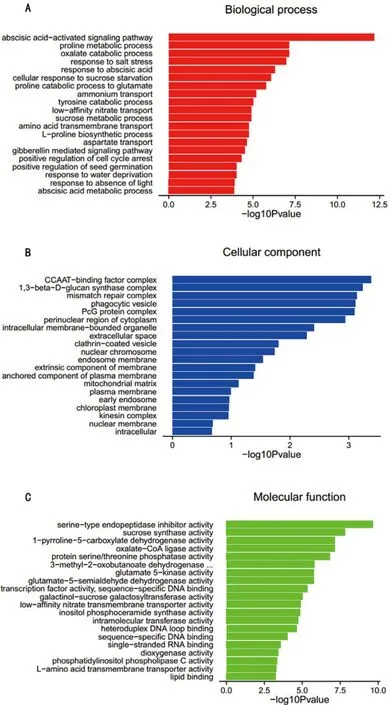
图9 15%PEG-6000处理24 h后烤烟LY1306品系相对于0 h上调表达基因GO分析Fig.9 GO analysis of up-regulated genes in LY1306 the flue-cured tobacco line under the treatment of 15%PEG-6000 for 24 h
经分析,15%PEG处理16 h的样品中,苯丙烷生物合成(Phenylpropanoid biosynthesis)、苯丙氨酸代谢(Phenylalanine metabolism)、亚油酸代谢(Linoleic acid metabolism)、萜类合成(Monoterpenoid biosynthesis)、植物激素信号转导(Plant hormone signal transduction)、氮代谢(Nitrogen metabolism)和α-亚麻酸代谢(alpha-Linolenic acid metabolism)等通路上调。
苯丙烷生物合成(ko00940)和苯丙氨酸代谢(ko00360)通路中苯丙氨酸解氨酶(phenylalanine ammonia-lyase,PAL)、等发生上调。亚油酸代谢(ko00591)和α-亚麻酸代谢(ko00592)通路中,脂氧合酶(lipoxygenase,LOX2S)等基因表达上调。植物激素信号转导(ko04075)中的脱落酸、乙烯、茉莉酸途径均上调表达。氮代谢(ko00910)中碳酸酐酶(carbonic anhydrase,CA)基因表达上调。
15%PEG处理24 h的样品中,发生上调的代谢通路为植物激素信号转导(Plant hormone signal transduction)、抗原加工提呈(Antigen processing and presentation)、淀粉蔗糖代谢(Starch and sucrose metabolism)、磷脂酰肌醇信号系统(Phosphatidylinositol signaling system)和精氨酸脯氨酸代谢(Arginine and proline metabolism)等。
植物激素信号转导(ko04075)中,脱落酸途径明显表达上调。生长素途径中的生长素响应因子(auxin response factor,ARF)基因和茉莉酸途径的MYC2转录因子基因表达上调。抗原加工提呈(ko04612)通路中免疫系统的核转录因子(nuclear transcription factor Y,NFY)等表达上调。淀粉蔗糖代谢(ko00500)中6-磷酸海藻糖合成酶(trehalose 6-phosphate synthase,2.4.1.15,otsA)、α-淀粉酶(alpha-amylase ,amyA )、β-淀粉酶(beta-amylase)等表达上调。精氨酸脯氨酸代谢(ko00330)中的谷氨酸-5-激酶(glutamate 5-kinase,proB)、δ-1-吡咯啉-5-羧酸合成酶(delta-1-pyrroline-5-carboxylate synthetase,P5CS)、1-吡咯啉-5-羧酸脱氢酶(1-pyrroline-5-carboxylate dehydrogenase)、脯氨酸脱氢酶( proline dehydrogenase,putA)等基因表达上调。
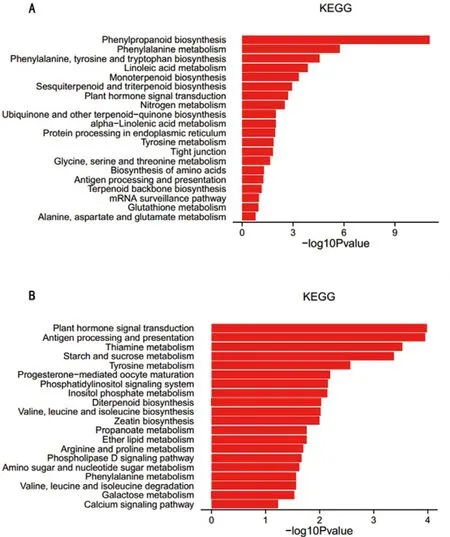
图10 15%PEG处理后烤烟LY1306品系相对于0 h上调表达基因KEGG代谢通路分析Fig.10 KEGG pathway analysis of up-regulated genes in LY1306 the flue-cured tobacco line under the treatment of 15%PEG-6000.
3 讨论
3.1 15%PEG-6000模拟干旱胁迫下烤烟LY1306品系中SOD和POD是主要应激酶
当植物遭受干旱胁迫时,体内原有的氧化平衡被破坏,细胞膜脂发生强烈的过氧化作用,MDA大量积累,对细胞产生毒害,导致植株失水甚至死亡[4],SOD、POD、CAT这几种酶彼此协调作用,提高了植株对活性氧清除的能力[5]。SOD是活性氧清除的第一步,它将活性氧歧化成H2O2,再由POD和CAT进一步分解[6]。有研究表明,适度的干旱胁迫诱导能够提高植物体内抗氧化酶活性,降低植物细胞膜脂过氧化程度[7-8]。
脯氨酸是植物体内最有效的一种渗透调节物质,有助于植物细胞和组织的持水和防止脱水。Kramble等最早在萎蔫的黑麦草叶片中发现脯氨酸大量积累。有研究表明,水稻幼苗在干旱胁迫下脯氨酸含量增加,并与丙二醛和质膜透性呈极显著相关,脯氨酸还具有清除活性氧的作用[9-11]。
总的来说烤烟LY1306品系中POD、SOD是响应PEG模拟干旱的主要抗氧化酶。脯氨酸能迅速响应外界信号并大量积累,其产生机制受反馈调节,将叶片水势维持在较低水平,防止大量失水并清除部分活性氧,减少细胞损伤。水势的变化与脯氨酸变化基本吻合。
3.2 15%PEG-6000处理后烤烟LY1306品系有多条抗旱相关通路上调
15%PEG处理16 h的叶片中,影响光合作用放氧反应和固碳过程的半乳糖脂及碳酸酐酶(CA)表达上调,维持了干旱胁迫下光合速率的相对稳定[12-13]。
L-苯丙氨酸代谢通路中上调的苯丙氨酸解氨酶(PAL)是连接初级代谢和苯丙烷类代谢、催化苯丙烷类代谢第一步反应的酶,也是苯丙氨酸代谢途径的关键酶和限速酶[14],还可以参与植保素的合成,包括酚类、异黄酮类和萜烯类,提高植物防御反应。许多植物激素如生长素、赤霉素和乙烯都可诱导植物PAL基因的表达。GO及KEGG分析显示赤霉素等植物激素信号转导途径表达上调。研究拟南芥幼苗对渗透胁迫的耐受性发现,赤霉素可响应非生物胁迫信号,使植物生长停滞以增强胁迫耐受性[15-16]。
在亚油酸和α-亚麻酸代谢通路中上调表达的脂氧合酶(LOX)在响应干旱胁迫过程中有重要作用。在植物中,LOX主要以亚油酸、亚麻酸为底物,参与调控与生成一些抗性信号分子如ABA、茉莉酸(JA)及植物挥发性物质等[17-22]。JA不仅本身作为信号分子参与了对干旱胁迫的防御反应,还能诱导PAL等抗逆相关酶基因的表达,同时能提高植物体内PRO含量和SOD、POD等抗氧化酶活性,提高渗透调节能力[23-24]。
本实验16 h处理中KEGG植物激素信号转导中ABA途径上调表达。ABA是干旱胁迫下植物体内主要的信号传导物质,与JA相似的是,ABA也能够促进PRO的积累,清除部分活性氧;同时,ABA能够促使蔗糖转化为葡萄糖和果糖,有利于提高植物的渗透调节能力[25-29],也有研究表明,在非生物胁迫条件下,ABA可以促进碳水化合物的积累[30],GO结果中上调的糖原(淀粉)合酶活性与之相符。此外ABA还可以通过促进气孔关闭减少蒸腾失水。
PEG处理24 h样本的转录组结果显示,植物激素信号转导通路中ABA、 JA、IAA等上调,与PEG处理16 h的样本相似。此外,样本上调表达通路还有脯氨酸代谢、糖类合成及代谢、转录因子调控等。
KEGG分析表明,精氨酸脯氨酸代谢通路中参与脯氨酸合成的谷氨酸激酶、δ-1-吡咯啉-5-羧酸合成酶(P5CS)和负责脯氨酸代谢为谷氨酸的1-吡咯啉-5-羧酸脱氢酶(P5CDH)、脯氨酸脱氢酶基因发生上调。谷氨酸途径合成脯氨酸主要是通过谷氨酸激酶(GK)催化生成中间产物△1-吡咯啉-5-羧酸(P5C),再经由P5CS和P5CR催化生成脯氨酸[31]。合成途径中的关键酶GK和P5CS受到脯氨酸的反馈调控,将脯氨酸浓度控制在适当水平[32]。脯氨酸代谢过程中,先经由脯氨酸脱氢酶催化为△1-二氢吡咯-5-羧酸(P5C),再由P5CDH催化下氧化为谷氨酸。同时Iyers等[33]研究发现,P5C等脯氨酸代谢中间产物可诱导水稻细胞中部分渗透调节基因的高效表达。
GO分类及KEGG代谢通路分析显示,PEG处理24 h样本中,糖类合成及代谢活性也发生上调。蔗糖合酶、6-磷酸海藻糖合成酶、β-葡萄糖苷酶、α-淀粉酶、β-淀粉酶和葡萄糖6-磷酸异构酶(GPI)基因表达上调。蔗糖、海藻糖合成量升高,大分子淀粉、纤维素被降解为还原糖,参与植物的渗透调节。PEG处理16 h的样本淀粉合酶活性在ABA诱导下上升,随着干旱胁迫时间的延长,大分子糖类逐渐分解,作为渗调物质抵抗干旱胁迫。同时,GPI参与的糖酵解过程可为植株供能。
此外,GO分析显示CCAAT-盒结合因子(CBF)的核转录因子NFY基因表达量上调。NFY广泛存在于植物中,并可参与调节多种生理进程,如逆境胁迫、叶绿体发育和光合作用等[34]。有研究发现[35],与野生型对照相比,遗传转化NF-Y家族转录因子TaNFYB3;1的转基因烟草植株,在干旱和盐分胁迫处理后,植株的形态和干物质重均显著提高,叶绿素、可溶性蛋白含量明显增加,SOD、POD活性显著增强。
同时有研究表明[36-37],一些植物激素如乙烯、赤霉素、脱落酸等也能诱导 SOD 、POD基因的表达, 其中 ABA对基因表达调控的作用尤为明显;此外,转录因子对SOD、POD基因的表达调控作用也十分显著。GO及KEGG分析表明,不同处理时间的LY1306叶片中植物激素及转录因子调控发生上调,与SOD,POD活性的上升趋势相符。
综上所述,植物激素转导、糖类合成代谢、转录因子调控是两个处理时间共同上调的代谢通路,直接或间接地调控了SOD、POD及脯氨酸等抗旱相关物质基因的表达。除此之外,15%PEG-6000处理16 h时,烤烟LY1306品系还主要通过脯氨酸生成和糖类合成调节渗透势,亚油酸代谢和次生代谢来响应干旱胁迫;PEG处理24 h时,LY1306主要通过脯氨酸、磷脂、糖类代谢等途径来响应干旱胁迫。可以看出,LY1306有多种应对干旱胁迫的方式,各通路互为补充,互相串联,共同对抗不同程度的干旱胁迫。
4 结论
在15%PEG模拟的干旱胁迫条件下,烤烟LY1306品系能迅速通过植物激素信号转导、亚油酸代谢和次生代谢等多种方式放大并传递胁迫信号,诱导SOD、POD和脯氨酸的表达,导致干旱胁迫下烟叶SOD、POD活性和脯氨酸含量大大增加。同时转录因子等途径也被激活,对抵御干旱起到一定的作用。但烤烟LY1306品系的具体抗旱机制仍有待深入研究。
[1]邵艳军,山仑.植物耐旱机制研究进展[J].中国生态农业学报,2006,(04):16-20.SHAO Yanjun,SHAN Lun.Advances in the studies on drought tolerance mechanism of plants[J].Chinese Journal of Eco-Agriculture, 2006, 14(4): 16-20.
[2]赵莉, 杨惠娟, 赵世民, 等.烤烟新品系LY1306烟叶质量评价与分析[J].江西农业学报, 2017, 29(01): 57-61,68.ZHAO Li,YANG Huijuan,ZHAO Shimin, et al.Leaf Quality Evaluation and Analysis of Flue-cured Tobacco New Line LY1306[J].Acta Agriculturae Jiangxi, 2017, 29(01): 57-61,68.
[3]Anders S,Huber W.Differential expression of RNA-Seq data at the gene level-the DESeq package.2012.
[4]邵艳军,山仑,李广敏.干旱胁迫与复水条件下高粱、玉米苗期渗透调节及抗氧化比较研究[J].中国生态农业学报,2006,14(1).68-70.SHAO YanJun,SHAN Lun,LI Guangmin.Comparison of osmotic regulation and antioxidation between sorghum and maize seedlings under soil drought stress and water recovering conditions[J].Chinese Journal of Eco-Agriculture, 2006, 14(1).68-70.
[5]夏新莉, 郑彩霞, 尹伟伦.土壤干旱胁迫对樟子松针叶膜脂过氧化、膜脂成分和乙烯释放的影响[J].林业科学, 2000, 36(3):8-12.XIA Xinli,ZHENG Caixia,YIN Weilun.Effect of drought stress on the peroxidation of membrane lipids, the composition of membrane fatty acids and ethylene evolutionof needles of pinus sylvestris var.mongolica litv[J].Scientia Silvae Sinicae, 2000,36(3): 8-12.
[6]钟鹏, 朱占林, 李志刚, 等.PEG处理对大豆幼苗活力及膜系统修复的影响[J].中国农学通报, 2004, (3):126-128+164.ZHONG Peng, ZHU Zhanlin, LI Zhigang, et , al.Effect of PEG on vigour index and membrane systems repair in different genetypical soybean seedings[J].Chinese Agricultural Science Bulletin, 2004,(3):126-128+164.
[7]杨春雷,林国平,杨久红,等.烟草种子渗透调节技术及机理研究[J].中国烟草学报, 2009, 15(02): 50-54.YANG Chunlei,LIN Guoping,YANG Jiuhong,et al.Study on technique and mechanism of osmocondition in tobacco seed[J].Acta Tabacaria Sinica, 2009, 15(02): 50-54.
[8]LIU Zhiling,CHENG Dan.Plant drought-resistant physiology research progress and breeding[J].Chinese Agricultural Science Bulletin, 2011, 27(24): 249-252 (in Chinese).
[9]宗会,刘娥娥,郭振飞,等.干旱、盐胁迫下LaCl3和 CPZ 对稻苗脯氨酸积累的影响[J].作物学报, 2001, (02): 173-177.ZONG Hui,LIU E’e,GUO Zhenfei,et al.Effects of LaCl3 and CPZ on proline accumulation of rice seedling under drought and salt stresses[J].Acta Agronomica Sinica, 2001, (02): 173-177.
[10]刘娥娥,宗会,郭振飞,等.干旱、盐和低温胁迫对水稻幼苗脯氨酸含量的影响[J].热带亚热带植物学报, 2000, (03): 235-238.LIU E’e,ZONG Hui,GUO Zhenfei,et al.Effects of drought,Salt and chilling stresses on proline accumulation in shoot of rice seedlings[J].Journal of Tropical and Sub tropical Botany, 2000,(03): 235-238.
[11]Jiang MY,Guo SC,Zhang XM.Proline accumulation in rice seedings exposed to hydroxylradical stress in relation to antioxidation [J].Chin.Sci.Bull,1997, 42.
[12]阳振乐.光合膜双半乳糖脂与光系统Ⅱ核心复合物的相互作用[A].中国生物物理学会.第九次全国生物物理大会学术会议论文摘要集[C].中国生物物理学会, 2002:1.YANG Zhenle.The interaction between photosynthetic membrane Bi gal and photosystem II core complex[A].Biophysical Society of China, 2002:1.
[13]蒋春云,马秀灵,沈晓艳,等.植物碳酸酐酶的研究进展[J].植物生理学报,2013, 49(06):545-550.JIANG Chunyun,MA Xiuling,SHEN Xiaoyan,et al.Progress in research on plant Carbonic Anhydrase[J].Plant Physiology Journal.2013, 49(06): 545-550.
[14]高雪.植物苯丙氨酸解氨酶研究进展[J].现代农业科技, 2009,(01): 30-33.GAO Xue.Advances in plant phenylalanine ammonia lyase[J].Modern Agricultural Science And Technology, 2009, (01): 30-33.
[15]SkiryczA, ClaeysH, DeBodtS, et al.Pause-and-stop:the effectsofosm otic stress on cell proliferation during early leaf development in Arabidopsis and a role for ethylene signaling in cell cyclearrest[J].Plant Cell, 2012, (5): 1876-1888.
[16]崔建东,李艳,牟德华.苯丙氨酸解氨酶(PAL)的研究进展[J].食品工业科技, 2008, (07): 306-308.CUI Jiandong,LI Yan,MOU Dehua.Research progress of Phenylalanine ammonia lyase[J].Science and Technology of Food Industry, 2008, (07): 306-308.
[17]Feussner I,Wasternack C.The lipoxygenase pathway[J].AnnuRev Plant Biol, 2002, 53: 275-297.
[18]蒋科技,皮妍,侯嵘,等.植物内源茉莉酸类物质的生物合成途径及其生物学意义[J].植物学报, 2010, 45(02): 137-148.JIANG Keji,PI Yan,HOU Rong,et al.Jasmonate biosynthetic pathway: its physiological role and potential application in plant secondary metabolic engineering[J].Chinese Bulletin of Botany,2010, 45(02): 137-148.
[19]刘华山,陈平华,杨素勤,等.茉莉酸对烤烟烟苗生长的影响[J].中国烟草学报, 2000, (01):36-39.LIU Huashan,CHEN Pinghua,YANG Suqin,et al.Effect of jasmonic acid on the growth of tobacco seedlings[J].Acta Tabacaria Sinica, 2000, (01):36-39.
[20]葛云侠,姚允聪,张杰,等.干旱胁迫对杏脂氧合酶活性的影响[J].果树学报, 2007, (01): 102-104.GE Yunxia,YAO Yuncong,ZHANG Jie,et al.Relationship between lipoxygenase activity and senescence in apricotleaves under drought stress.Journal of Fruit Science, 2007, (01): 102-104.
[21]Yang XY, Jiang WJ, Yu HJ.The expression profiling of the lipoxygenase (LOX) family genes during fruit development, abiotic stress and hormonal treatments in cucmber (Cucumis sativus L.) [J].Int J Mol Sci, 2012, 13: 2481-2500.
[22]曹嵩晓,张冲,汤雨凡,等.植物脂氧合酶蛋白特性及其在果实成熟衰老和逆境胁迫中的作用[J].植物生理学报, 2014,50(08): 1096-1108.CAO Songxiao,ZHANG Chong,TANG Yufan,et al.Protein characteristic of the plant lipoxygenase and the function on fruit ripening and senescence and adversity stress[J].Plant Physiology Journal, 2014, 50(08): 1096-1108.
[23]潘瑞炽,古焕庆.茉莉酸甲酯对花生幼苗生长和抗旱性的影响[J].植物生理学报, 1995, (03): 215-220.PAN Ruichi,GU Huanqing.Effect of methyl jasmonate on the growth and drought resistance, in peanut seedlings.Acta Phytophysiologica Sinica, 1995, (03): 215-220.
[24]汪新文.茉莉酸参与植物逆境胁迫的研究进展[J].安徽农学通报, 2008, (06): 29-35+24.WANG Xinwen.Advances in research on jasmonic acid participating in plant stress[J].Anhui Agricultural Science Bulletin,2008, (06): 29-35+24.
[25]王霞,候平,尹林克,等.土壤缓慢水分胁迫下柽植物内源激素的变化[J].新疆农业大学学报, 2000, 23(4): 41- 43.WANG Xia,HOU Ping,YIN Linke,et al.Change of hormone of tamarix under slow soil-water stress[J].Journal of Xinjiang Agricultural University, 2000, 23(4): 41- 43.
[26]史吉平,李广敏,池书敏.钙对水分胁迫条件下玉米幼苗内源激素含量的影响[J].河北农业大学学报, 1994, 17(3): 48- 51.SHI Jiping,LI Guangmin,CHI Shumin.The effect of Ca2+on endogenous hormones of maize seedlings under water stress[J].Journal of Hebei Agricultural University, 1994, 17(3): 48- 51.
[27]陈立松,刘星辉.水分胁迫对荔枝叶片内源激素含量的影响[J].热带作物学报, 1999, 20(3): 31- 35.CHEN Lisong,LIU Xinghui.Effect of water stress on endogenous hormone content in litchi leaves[J].Chinese Journal of Tropical Crops, 1999, 20(3): 31- 35.
[28]潘根生,吴伯千,沈生荣,等.水分胁迫过程中茶树新梢内源激素水平的消长及其与耐旱性的关系[J].中国农业科学, 1996,29(5): 9-15.PAN Gensheng,WU Boqian,SHEN Shengrong,et al.Fluctuation of endogenous plant hormone levels inleaves of tea plant (Camellia sinensisl.) during waterstress and Its relation to drought tolerance[J].Scientia Agricultura Sinica, 1996, 29(5): 9-15.
[29]李宗庭.植物激素及其免疫检测技术[M].南京:江苏科学技术出版社, 1996.LI Zongting.Plant hormones and their immunological detection techniques[M].Nanjing: Jiangsu science and Technology Press,1996.
[30]Kempa S,Krasensky J,Dal Santo S,et al.A central role of abscisic acid in stress-regulated carbohydrate metabolism[J].Plos One 2008, 3: e3935.
[31]Roosens N H, Bitar F A, Loenders K, et al.Overexpression of ornithine-δ-aminotransferase increases proline biosynthesis and confers osmotolerance in transgenic plants[J].Molecular Breeding,2002, 9(2): 73-80.
[32]Hu C A, Delauney A J, Verma D P S.Anovel bifunctional enzyme(Δ’-pyrroline-5-carboxylate synthetase) catalyzesthe first two steps inproline biosynthesis[J].Proc Natl Acad Sci USA, 1992, 89: 9354-9358.
[33]Iyer S, Caplan A. Products of Proline Catabolism Can InduceOsmotically Regulated Genes in Rice[J].Plant Physiology,1998, 116: 203-211.
[34]李文滨,李胜畅,王志坤.核因子Y在植物中的分类及其功能概述[J].东北农业大学学报, 2012, (01):12-18.LI Wenbin,LI Shengchang,WANG Zhikun.Review of structure and function of nuclear factor Y in plant[J].Journal of Northeast Agricultural University, 2012, (01): 12-18.
[35]张珉.小麦NF-Y家族转录因子TaNF-YB3;1分子特征及介导植株抵御干旱和盐分逆境的功能研究[D].河北农业大学, 2013.ZHANG Min.The Molecular Characterization of Wheat NF-Y Family Member Ta NF-YB3;1 and Its Roles in Mediating Plant Tolerance to Stresses of Drought and Salt[D].Agricultural University of Hebei, 2013
[36]马旭俊,朱大海.植物超氧化物歧化酶(SOD)的研究进展[J].遗传, 2003, (02): 225-231.MA Xujun,ZHU Dahai.Functional Roles of the Plant Superoxide Dismutase[J].HEREDITAS( Beijing) 25(2): 225~231, 2003
[37]顾雯雯,胡亚婷,韩英,等.植物过氧化物酶同工酶的研究进展[J].安徽农业科学, 2014, 42(34): 12011-12013.GU Wenwen,HU Yating,HAN Ying,et al.Research Progress of Peroxidase Isozymes in Plants[J].Journal of Anhui Agri.Sci.2014, 42(34): 12011-12013

