一种蚜茧蜂基因组DNA提取方法
孔博,张宏瑞,和淑琪,谷星慧,杨硕媛,张立猛,李正跃
1 云南农业大学植物保护学院,云南昆明 650201;2 云南省烟草公司玉溪市公司,云南玉溪 653100
蚜茧蜂科(Aphidiidae)隶属昆虫纲(Insecta)膜翅目(Hymenoptera)姬蜂总科(Ichneumonoidea),许多种类广泛分布于世界各地[1]。蚜茧蜂作为蚜虫的一种重要寄生性天敌,一些种类在蚜虫的生物防治中已被广泛应用。其中燕麦蚜茧蜂(Aphidius evenaeHaliday)、麦蚜茧蜂(Ephedrus plagiator(Nees))、粗脊蚜茧蜂(A.colemaniVicreck)、和烟蚜茧蜂(A.gifuensisAshmead)对麦蚜、棉蚜(Aphis gossypiiGlover)和烟蚜(Myzus persicae(Sulzer))的防治效果显著[2-5]。
深入研究蚜茧蜂的分类鉴定及其起源和进化,对利用蚜茧蜂防治蚜虫具有重要的指导意义。由于蚜茧蜂体型微小(大多在1.0 ~ 2.4 mm之间),种间相似度高,种内还存在体色、触角节数等变异,仅依靠外部形态特征难以对其种类进行准确鉴定。此外,田间采集到僵蚜后,必须带回室内等蚜茧蜂成虫羽化后才能进行形态鉴定,对僵蚜内的蛹或其寄生蚜体内的蚜茧蜂幼虫则很难进行形态鉴定,因此,迫切需要开展蚜茧蜂的分子鉴定,并探讨其物种的起源及进化。
目前,研究人员已成功利用DNA条形码对蚜虫类[6]、双翅目[7]、鳞翅目[8]、鞘翅目[9]等昆虫进行种类鉴定及系统发育研究。对于体型较大的昆虫,一般可以利用虫体较小的部分(如左前足胫节)提取DNA,从而保留标本用于形态鉴定或种类核对。对于蚜茧蜂这类小型昆虫来说,一般采用常规试剂盒提取DNA的方法(柱离心法),研磨整个虫体提取DNA,但该方法无法保留标本做形态鉴定及种类核对。在保留虫体标本的前提下,找到一种适宜的提取方法从单个个体中获得较高质量的DNA,是利用分子手段进行物种鉴定和系统发育研究的关键。因此,本研究在参考前人工作的基础上[10-13],对DNA提取的柱离心法进行改进,建立了穿刺昆虫腹部DNA提取方法,并通过DNA产量、质量和线粒体DNA COI基因序列扩增对其进行评价。旨在为进一步研究蚜茧蜂的亲缘关系及系统发育关系提供一定的基础资料。
1 材料与方法
1.1 实验材料
蚜茧蜂标本采集信息见表1,用于实验的7种蚜茧蜂标本,均为75%乙醇浸泡并冷藏于4℃冰箱中,一些蚜茧蜂保存时间超过2年。
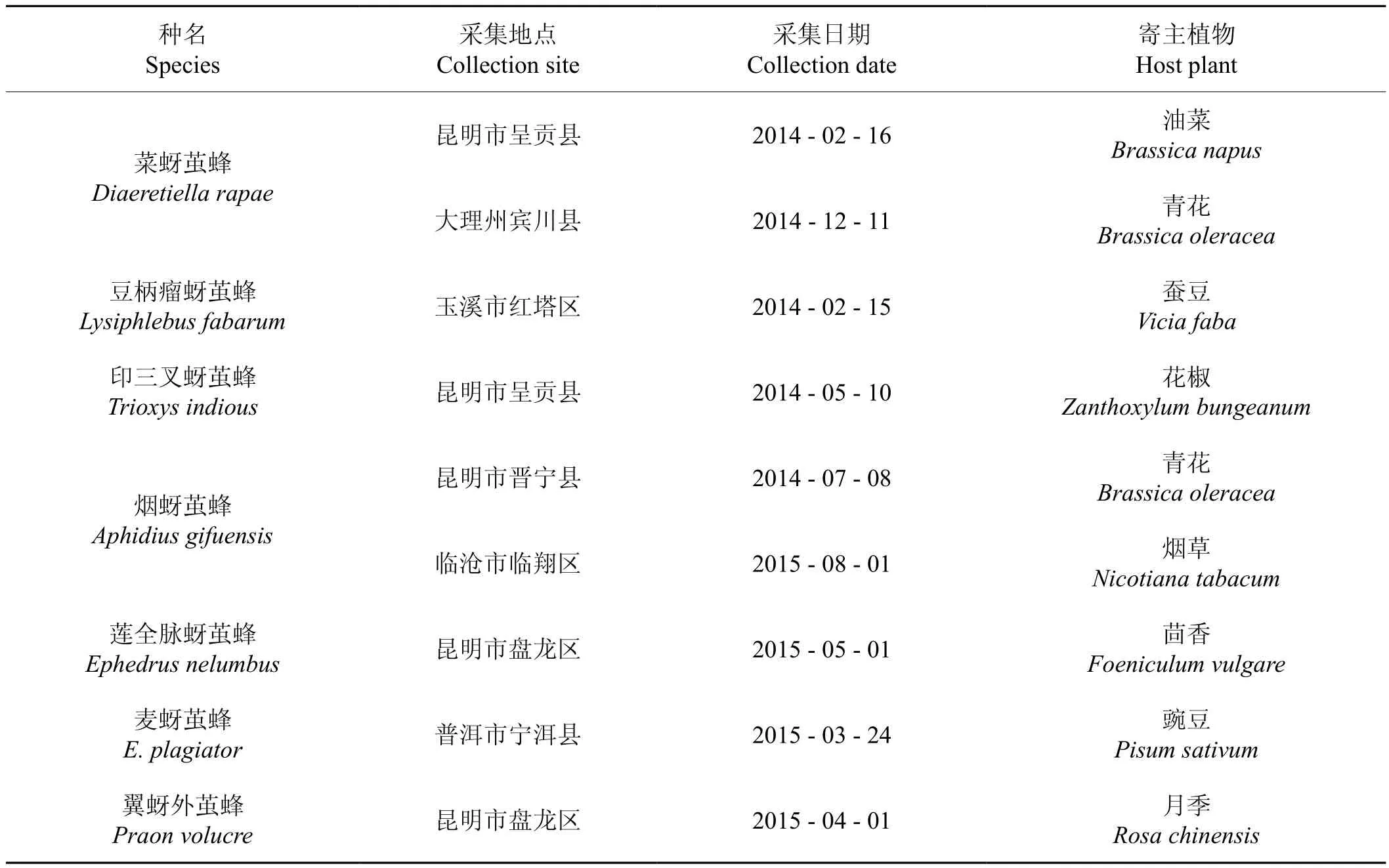
表1 蚜茧蜂标本的来源及保存方式Tab.1 The sources and ways of preservation of Aphidiidae specimens
1.2 DNA提取方法
1.2.1 穿刺法提取DNA
提取7种蚜茧蜂的基因组DNA,除菜蚜茧蜂和烟蚜茧蜂各提取2头外,其余每种均提取1头,共9个样品。参照HiPure Tissue DNA Kits(昆明速科生物科技有限公司,Magen)试剂盒提取方法,部分步骤有改进。
(1)将蚜茧蜂从75%乙醇储存液中取出置于载玻片上,待虫体上的乙醇挥发后,向虫体上滴加2 μL Buffer ATL消化液,解剖镜下,用灭菌的“00”号昆虫针由蚜茧蜂腹部4 ~ 5节间膜穿刺。将穿刺过的蚜茧蜂移入1.5 mL离心管,移液枪吸取50 μL Buffer ATL消化液滴入离心管,再取178 μL Buffer ATL消化液来回冲洗载玻片上穿刺蚜茧蜂的位置,连同之前的Buffer ATL消化液一同吸入离心管中。最后加入20 μL Proteinase K,低速涡旋混匀。55℃水浴3 h,水浴期间偶尔轻微摇晃离心管,使标本充分与消化液接触。
(2)转移步骤(1)中得到的消化液至1.5 mL离心管中,将蚜茧蜂取出保存于75%乙醇中,以便制作玻片标本进行形态鉴定。
(3)加入250 μL Buffer DL至消化液中,最高速度涡旋混匀30 s,70℃水浴10 min。之后向消化液中加入250 μL无水乙醇,最高速度涡旋混匀30 s。
(4)将柱子放入2 mL收集管,转移上一步骤(3)所得到的混合液至柱子中,10000×g离心1 min。
(5)弃虑液,将柱子放入收集管,加500 μL Buffer GW1入柱子中,10000×g 离心1 min。
(6)弃虑液,将柱子放入收集管,加650 μL Buffer GW2入柱子中,10000×g离心1 min。该步骤重复2次。
(7)弃虑液,将柱子放入收集管中,10000×g离心2 min。
(8)将柱子装于新的1.5 mL离心管中,加90 μL预热至70℃的Buffer AE入柱子中。放置3 min,10000×g离心1 min。
(9)弃柱子,把含蚜茧蜂DNA的滤液保存于4℃冰箱中。
1.2.2 研磨法提取DNA
对4种蚜茧蜂进行研磨提取DNA。除菜蚜茧蜂和烟蚜茧蜂各提取2头外,豆柄瘤蚜茧蜂和麦蚜茧蜂各提取1头,共6个样品。参照HiPure Tissue DNA Kits(昆明速科生物科技有限公司,Magen)试剂盒的提取方法。
(1)将蚜茧蜂从75%乙醇液中取出,置于载玻片上,待虫体上的乙醇充分挥发后,将蚜茧蜂移至1.5 mL离心管中,用灭菌的研磨棒研磨蚜茧蜂。磨碎后用230 μL Buffer ATL消化液冲洗研磨棒,冲洗液进入离心管,加入20 μL Proteinase K,涡旋混匀。55℃水浴3 h,水浴期间偶尔轻微摇晃离心管,使标本充分与消化液接触。
(2)10000×g 离心3 min,转移上清液至新的1.5 mL离心管中。
之后的步骤与1.2.1中步骤(3)—(9)相同。
1.3 DNA质量检测
取2 μL DNA提取物,无菌水稀释100倍,充分混匀,紫外分光光度计测定在260 nm和280 nm处的吸光度值(OD值)。通过OD260和OD280的比值来评价所提取DNA的产量和纯度。
1.4 PCR扩增
利用COI基因的通用引物LCO1490(5'-GGTCAA CAAATCATAAAGATATTGG-3')和HCO2198(5'-TA AACTTCAGGGTGACCAAAAAATCA-3')[14]提取的总DNA进行PCR扩增,PCR反应体系:DNA模板5 μL、10 pmol/L的上游和下游引物各1 μL、15 μL Master Mix、用ddH2O定容至30 μL。扩增的条件:94℃预变性2 min,94℃变性30 s,55℃退火30 s,72℃延伸45 s,共35个循环,最后在72℃充分延伸10 min。
1.5 PCR产物检测
配制1%的琼脂糖凝胶,内含5 μL GoldView I型核酸染色剂。Marker采用的是DL-1000,电泳缓冲液为0.5×TBE(PH 8.0),电压80 V,室温下电泳1.5 h,紫外分析仪下观察、拍照。
1.6 测定蚜茧蜂COI序列与GenBank数据库比对
将穿刺法获得的扩增产物送昆明硕擎生物有限公司测序。采用MEGA5.1对所得序列进行整理,通过GenBank的blast功能进行COI序列比对。
2 结果与分析
2.1 提取物DNA纯度和产量评价
两种方法提取蚜茧蜂DNA的OD值及DNA质量和浓度如表2所示。穿刺法提取的DNA提取物的OD260/OD280在1.51 ~ 1.91之间,研磨法提取的DNA提取物的OD260/OD280在1.63 ~ 1.82之间,两种DNA提取物的纯度OD260/OD280无显著性差异,均在正常范围内。两种方法的DNA提取物浓度分别在29 ~ 55 ng/μL、85 ~ 116 ng/μL之间,平均浓度分别为41 ng/μL、100 ng/μL。提取物浓度存在显著性差异,研磨法提取的DNA产量明显高于穿刺法提取的DNA产量。
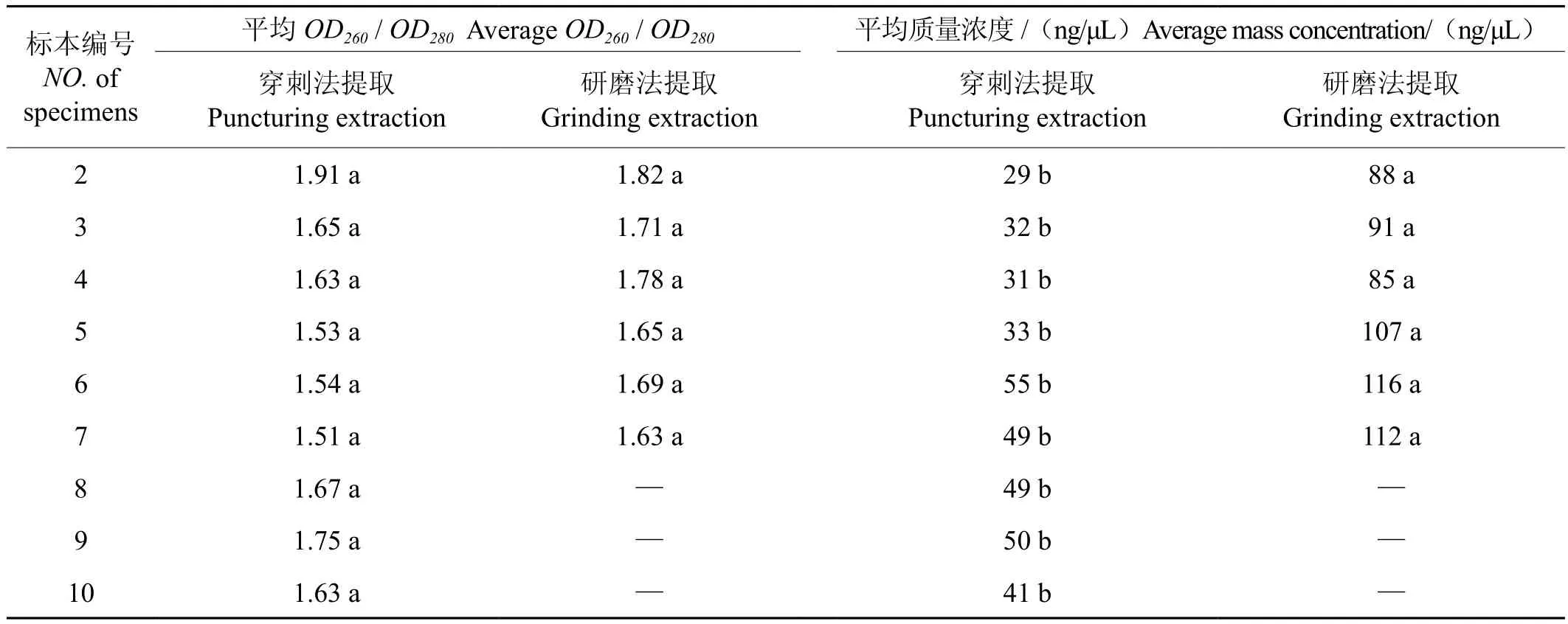
表2 蚜茧蜂基因组DNA的OD比值和质量浓度Tab.2 OD value and concentration of Aphidiidae genomic DNA
2.2 DNA提取物的PCR扩增
DNA提取物进行PCR扩增的电泳检测,结果如图1所示。实验所获得的DNA条带完整清晰,DNA提取物片段在500 ~ 700 bp之间,不存在杂带。可见穿刺法提取的DNA质量较好,PCR扩增结果稳定。

图1 利用引物LCO1490和HCO2198的穿刺法提取(A)和研磨法提取(B)扩增结果Fig.1 Amplification pattern of genomic DNA using the primer pairs of LCO1490 and HCO2198 by puncturing extraction (A) and grinding extraction (B)
2.3 蚜茧蜂COI序列在GenBank数据库中的比对结果
通过GenBank中的Blast功能,穿刺法获得蚜茧蜂COI序列的比对结果如表3所示。通过测序公司测序获得菜蚜茧蜂序列2条,与GenBank中其它菜蚜茧蜂序列的相似度为99%,同时GenBank中还显示与其他蚜茧蜂种类的比对结果(表3)。豆柄瘤蚜茧蜂序列1条,与GenBank中其它豆柄瘤蚜茧蜂序列的相似度为99% ~ 100%。翼蚜外茧蜂序列1条,与GenBank中其它翼蚜外茧蜂序列的相似度为95% ~ 99%。麦蚜茧蜂序列1条,在GenBank中与黍蚜茧蜂(E.nacheri)序列的相似度很高,达到99%,标本进行形态学核对后鉴定为麦蚜茧蜂。烟蚜茧蜂序列2条,在GenBank中无相似序列,目前GenBank上只下载到1条烟蚜茧蜂序列,标本进行形态学核对后鉴定为烟蚜茧蜂。通过序列比对可以看出实验获得序列均为相应蚜茧蜂的序列,从而说明DNA提取物的PCR扩增条带正确。

表3 蚜茧蜂COI序列在GenBank中的比对结果Tab.3 Blast result of Aphidiidae COI sequence in GenBank
3 讨论与结论
通过对比穿刺法和研磨法提取蚜茧蜂DNA,探寻既能有效获得蚜茧蜂DNA用以PCR扩增,又能保留虫体进行标本核对的DNA提取方法。结果表明,两种方法提取的DNA产量都能满足PCR扩增要求,但穿刺法既能提取到质量较好的DNA,同时还能保留蚜茧蜂的重要形态鉴定特征。蚜茧蜂寄生于蚜虫体内形成僵蚜,从化蛹到羽化无需取食,因此腹部穿刺提取的DNA模板绝大部分属于蚜茧蜂DNA,外源DNA极少。本实验得出的所有PCR产物没有经过克隆,直接进行PCR产物测序,而得出序列的峰图是单峰无杂质背景的。因此,即便含有外源DNA,对扩增蚜茧蜂的COI基因并没有影响。用于实验的一些蚜茧蜂浸液标本保存超过2年,也能提取出质量较好的DNA,这与常虹等[15]的研究结果一致,超过2年的浸液标本,只有动物组织DNA提取试剂盒提取到的DNA扩增后能得到清晰的单一扩增条带。
在提取DNA的过程中,需要利用缓冲液对标本进行预处理,有利于细胞温和地部分恢复原有的生理环境,使细胞内蛋白质分子与DNA之间交联得以解离,为后期提取DNA创造条件[16-17]。由于腹部第一节(腹柄节)是蚜茧蜂的主要形态鉴定特征,微针穿刺法采用从蚜茧蜂腹部的第二节起用无菌微针穿刺。目前,本实验室还利用这种方法在保留标本进行形态鉴定的前提下,成功提取蓟马的基因组DNA[18],表明该方法适用于各类体型较小昆虫的DNA提取。
本研究采用改进的柱离心法,适用于从保存年限较长的标本中提取符合PCR扩增条件的DNA。此外,对于数量较少的标本,能够提取到适宜扩增的DNA进行分子鉴定,并保留虫体标本进行种类核对。
[1]陈家骅, 石全秀.中国蚜茧蜂(膜翅目: 蚜茧蜂科)[M].福州:福建科学技术出版社, 2001: 29-178.CHEN Jiahua, SHI Quanxiu.Systematic studies on Aphidiidae of china (Hymenoptera: Aphidiidae) [M].Fu Zhou: Fujian Science and Technology Press, 2001: 29-178.
[2]卢美瑢, 孙琳, 李存芝, 等.麦田天敌对麦蚜控制作用的考察[J].云南农业大学学报, 1987, 2(1): 9-13.LU Meirong, SUN Lin, LI Cunzhi, et al.An investigation on the role of natural enemies suppressing the wheat aphids[J].Journal of Yunnan Agricultural University, 1987, 2(1): 9-13.
[3]ZAMANI A A, TALEBI A A, FATHIPOUR Y, et al.Temperaturedependent functional response of two aphid parasitoids, Aphidius colemani and Aphidius matricariae (Hymenoptera: Aphidiidae), on the cotton aphid[J].Journal of Pest Science, 2006, 79(4): 183-188.
[4]崔宇翔, 胡小曼, 李佛琳, 等.滇西北高原烟蚜茧蜂繁育及田间防治蚜虫效果[J].云南农业大学学报, 2011, 26(S2): 123-128.CUI Yuxiang, HU Xiaoman, LI Folin, et al.Aphidius gifuensis rearing and its effect of aphids control in the filed in northwest plateau of Yunnan[J].Journal of Yunnan Agricultural University, 2011, 26(S2): 123-128.
[5]谷星慧, 杨硕媛, 余砚碧, 等.云南省烟蚜茧蜂防治桃蚜技术应用[J].中国生物防治学报, 2015, 31(1): 1-7.GU Xinghui, YANG Shuoyuan, YU Yanbi, et al.Application of biological control technology of Myzus persicae with Aphidius gifuensis in Yunnan province[J].Chinese Journal of Biological Control, 2015, 31(1): 1-7.
[6]王剑峰, 乔格侠.DNA条形编码在蚜虫类昆虫中的应用[J].动物分类学报, 2007, 32(1): 153-159.WANG Jianfeng, QIAO Gexia.Application of DNA barcoding to aphidinea (Insecta, Hemiptera) studies[J].Acta Zootaxonomica Sinica, 2007, 32(1): 153-159.
[7]池宇, 王诗迪, 张春田.基于线粒体COI基因的双翅目昆虫研究进展[J].昆虫分类学报, 2010, 32(S1): 71-77.CHI Yu, WANG Shidi, ZHANG Chuntian.Advance of diptera based on mitochondrial COI gene[J].Entomotaxonomia, 2010, 32(S1): 71-77.
[8]武宇鹏, 丁亮, 李捷, 等.DNA条形码的应用进展及讨论[J].环境昆虫学报, 2011, 33(1): 99-106.WU Yupeng, DING Liang, LI Jie, et al.DNA barcoding:current progresses and discussions[J].Journal of Environmental Entomology, 2011, 33(1): 99-106.
[9]张媛, 郭晓华, 刘广纯, 等.DNA条形码在鞘翅目昆虫分子系统学研究中的应用[J].应用昆虫学报, 2011, 48(2): 410-416.ZHANG Yuan, GUO Xiaohua, LIU Guangchun, et al.Application of DNA barcodes to molecular systematics of Coleoptera[J].Chinese Journal of Applied Entomology, 2011, 48(2): 410-416.
[10]吕宝乾, 彭正强, 符悦冠, 等.茧蜂标本基因组DNA提取及RAPD分析[J].热带作物学报, 2004, 25(4): 58-62.LV Baoqian, PENG Zhengqiang, FU Yueguan, et al.Genomic DNA extraction and PAPD analysis of Braconidae specimen[J].Chinese Journal of Tropical Crops, 2004, 25(4): 58-62.
[11]王银竹, 余道坚, 张润杰, 等.基于mtDNA COI基因的十种长小蠹分子系统进化研究(鞘翅目: 长小蠹科)[J].昆虫学报,2010, 53(4): 457-463.WANGYinzhu, YU Daojian, ZHANG Runjie, et al.Molecular phylogeny of ten Platypodid species (Coleoptera: Platypodidae)based on mitochondrial cytochrome oxidase I gene[J].Acta Entomologica Sinica, 2010, 53(4): 457-463.
[12]李敏, 席丽, 朱卫兵, 等.基于DNA条形码的中国普缘蝽属分类研究(半翅目: 异翅亚目)[J].昆虫分类学报, 2010, 32(1): 36-42.LI Min, XI Li, ZHU Weibing, et al.Application of DNA Barcoding to Plinachtus (Hemiptera: Heteroptera) from China[J].Entomotaxonomia, 2010, 32(1): 36-42.
[13]周青松, 张同心, 于芳, 等.DNA条形码在膜翅目昆虫中的应用分析[J].应用昆虫学报, 2013, 50(1): 19-28.ZHOU Qingsong, ZHANG Tongxin, YU Fang, et al.Application of DNA barcoding to Hymenopteran taxonomy[J].Chinese Journal of Applied Entomology, 2013, 50(1): 19-28.
[14]FOLMER O, BLACK M, HOEH W, et al.DNA primers for amplification of mitochondrial cytochrome coxidase subunit I from diverse metazoan invertebrates[J].Molecular Marine Biology and Biotechnology, 1994, 3(5): 294-299.
[15]常虹, 郝德君, 杨晓军, 等.小蠹科昆虫基因组DNA提取方法的比较研究[J].北京林业大学学报, 2013, 35(2): 75-79.CHANG Hong, HAO Dejun, YANG Xiaojun, et al.Comparison of four genomic DNA extraction methods with Scolytidae beetles[J].Journal of Beijing Forestry University, 2013, 35(2): 75-79.
[16]张德华, 周开亚, 孙红英.乙醇保存的动物标本基因组DNA提取方法的比较[J].生物学杂志, 2004, 21(6): 46-48.ZHANG Dehua, ZHOU Kaiya, SUN Hongying.Comparison of analytical methods for extracting genomic DNA from ethanolpreserved animal specimens[J].Journal of Biology, 2004, 21(6): 46-48.
[17]闫晗, 董君, 黄静, 等.不同固定剂处理的对虾基因组DNA提取方法研究[J].应用化工, 2012, 41(3): 548-551,553.YAN Han, DONG Jun, HUANG Jing, et al.Study on the DNA extraction from shrimp specimens by different methods[J].Applied Chemical Industry, 2012, 41(3): 548-551,553.
[18]张利娟, 沈登荣, 张宏瑞, 等.蓟马基因组DNA 提取方法的改进[J].应用昆虫学报, 2011, 48(3): 775-781.ZHANG Lijuan, SHEN Dengrong, ZHANG Hongrui, et al.Method improvement for extraction genomic DNA from thrips[J].Chinese Journal of Applied Entomology, 2011, 48(3): 775-781.

