鞘内注射右美托咪定对大鼠吗啡耐受及脊髓炎性反应的影响*
巩红岩,郑 芳,左志超,刘景景,王庆志,赵国安△
(1.新乡医学院第一附属医院麻醉科,河南新乡 453000;2.新乡医学院第一附属医院医学
鞘内注射右美托咪定对大鼠吗啡耐受及脊髓炎性反应的影响*
巩红岩1,郑 芳2,左志超1,刘景景1,王庆志3,赵国安1△
(1.新乡医学院第一附属医院麻醉科,河南新乡 453000;2.新乡医学院第一附属医院医学
目的探讨鞘内注射右美托咪定对大鼠吗啡耐受及脊髓炎性反应的影响。方法采用随机数字表法将33只体质量180~200 g雄性SD大鼠,分为3组(n=11):对照组(NS组)、吗啡组(M组)、右美托咪定+吗啡组(Dex组)。NS组鞘内注射无菌生理盐水10 μL,1次/d,共7 d;M组鞘内注射吗啡15 μg,1次/d,共7 d;Dex组鞘内注射15 μg吗啡和1.5 μg右美托咪定,1次/天,共7 d。于吗啡鞘内注射第1、3、5、7天给药前和给药后30 min测定大鼠的热痛阈。Western blot法检测脊髓中小胶质细胞标记物Iba-1、白细胞介素1β(IL-1β)、肿瘤坏死因子α(TNF-α)和磷酸化p38MAPK(p-p38)的蛋白表达水平。免疫组织化学法检测脊髓Iba-1阳性细胞密度。结果随着吗啡鞘内注射次数增加,M组和Dex组热水甩尾实验最大镇痛效应百分比(MPE)逐渐下降(P<0.05)。与NS组比较,M组甩尾实验MPE在吗啡注射的第1、3、5、7天较高(P<0.05);与M组比较,Dex组甩尾实验MPE于吗啡注射的第3、5、7天较高(P<0.05)。与NS组比较,M组大鼠脊髓Iba-1阳性细胞密度及Iba-1、IL-1β、TNF-α和p-p38蛋白表达水平明显升高(P<0.05);与M组比较,Dex组大鼠脊髓Iba-1阳性细胞密度及Iba-1、IL-1β、TNF-α和p-p38蛋白表达水平明显降低(P<0.05)。结论鞘内注射右美托咪定可缓解吗啡耐受的形成,其机制可能与抑制脊髓小胶质细胞介导的炎性反应相关。
右美托咪定;吗啡;药物耐受性;小胶质细胞;炎症
吗啡在神经病理性痛和晚期癌痛等慢性疼痛的治疗中应用广泛,但长期反复使用可诱发药物耐受现象[1-2]。最近的研究表明,吗啡耐受的形成机制可能与脊髓小胶质细胞激活相关[1-3]。激活的小胶质细胞可诱发促炎因子的释放,干扰脊髓神经元的正常功能甚至导致神经元凋亡。而右美托咪定是临床上广泛应用的镇静药物。动物实验表明,右美托咪定可抑制脊髓损伤诱发的小胶质细胞激活和炎症因子释放[4-5]。因此,本实验拟探讨鞘内注射右美托咪定对吗啡耐受形成及脊髓炎性反应的影响。
1 材料与方法
1.1主要材料和设备 右美托咪定(批号90619DK,Abbott公司,美国),吗啡(批号070901,沈阳第一制药厂),BCA试剂盒(批号AR1110,武汉博士德生物工程有限公司),抗小胶质细胞标记物Iba-1抗体(批号016-20001,Wako公司,日本),磷酸化p38MAPK(p-p38)抗体(批号ab178867,Abcam公司,美国),肿瘤坏死因子α(TNF-α)抗体(批号ab6671,Abcam公司,美国),白细胞介素1β(IL-1β)抗体(批号sc-7884,Santa Cruz公司,美国),β-actin抗体(批号BM0627,武汉博士德生物工程有限公司)。
1.2实验分组 33只体质量180~200 g雄性SD大鼠,购自新乡医学院实验动物中心。采用随机数字表法,分为3组(n=11):对照组(NS组)、吗啡组(M组)、右美托咪定+吗啡组(Dex组)。NS组鞘内注射无菌生理盐水10 μL,1次/d,共7 d;M组鞘内注射吗啡15 μg(溶于生理盐水),1次/d,共7 d,以建立吗啡耐受模型[6];Dex组鞘内注射15 μg吗啡和1.5 μg右美托咪定[7],1次/d,共7 d。于吗啡鞘内注射第1、3、5、7天给药前和给药后30 min行痛阈测定。
1.3鞘内置管 参照文献[4-5],于吗啡注射前行鞘内置管术。腹腔注射戊巴比妥钠30 mg/kg,于正中线L4~5间隙处切开皮肤,分离周围软组织,经椎间隙轻轻刺破硬脊膜及蛛网膜,可见清亮的脑脊液流出,之后将PE-10导管置入约8 cm。置管后仔细固定导管并缝合伤口。鞘内试验性注射1%利多卡因20 μL(利多卡因实验),如30 s后大鼠出现双后肢瘫软,则表明鞘内置管成功。利多卡因实验阴性或术后出现四肢瘫痪、单侧肢体瘫痪者则不纳入后续实验。
1.4痛阈测定 参照文献[2-3,8],分别采用热水甩尾实验测量热痛阈。热痛阈测定:将大鼠尾末端1/3浸入50 ℃热水中,记录鼠尾浸入水中至出现甩尾反应的时间。为避免鼠尾损伤,限定浸入时间不超过10 s,如浸入时间达到15 s仍不出现甩尾反应,记为15 s。给药前和给药后30 min各进行3次甩尾实验,每次间隔5 min,取平均值作为最终的热痛阈值。计算最大镇痛效应百分比(MPE),MPE=(给药后热痛阈-基础热痛阈)/(10.0-基础热痛阈)×100%。
1.5Western blot检测 最后一次痛阈测定后,每组取6只大鼠,使用过量的戊巴比妥钠(80 mg/kg)处死,取出L4~6节段的脊髓,采用蛋白提取试剂盒提取脊髓蛋白,并使用BCA试剂盒测定样本蛋白浓度。蛋白采用聚丙烯酰胺凝胶电泳后电转至0.45 μm孔径的聚偏氟乙烯(PVDF)膜上,5%的脱脂牛奶中室温封闭1 h后,加入β-actin抗体(1∶500)、Iba-1抗体(1∶1 000)、TNF-α抗体(1∶1 000)、磷酸化p38MAPK抗体(1∶500)或IL-1β抗体(1∶1 000),4 ℃孵育过夜。次日,加入辣根过氧化物酶标记的二抗(1∶5 000)室温孵育2 h,洗膜后ECL显影曝光,采用Image Lab3.0软件进行灰度分析。蛋白表达水平以目标蛋白灰度值/β-actin蛋白灰度值表示。
1.6免疫荧光检测 每组取5只大鼠,腹腔注射戊巴比妥钠50 mg/kg麻醉下,打开胸腔经升主动脉灌注预冷的4%多聚甲醛250 mL。取出脊髓L4~6节段,经后固定和蔗糖脱水后制成冰冻切片。经0.3% TritonX-100破膜和正常山羊血清室温封闭后,加入抗Iba-1抗体(1∶600)4 ℃孵育过夜。次日,PBS漂洗后避光加入Cy3标记的荧光二抗(1∶300)室温孵育2 h。之后使用PBS洗去残余二抗,加入4′6-二脒基-2-苯基吲哚,其中总细胞数由DAPI行核染色,甘油封片后于免疫荧光显微镜下观察技术。Iba-1阳性细胞密度=Iba-1阳性细胞数/总细胞数(DAPI)。

2 结 果
随着吗啡鞘内注射次数增加,M组和Dex组甩尾实验MPE逐渐下降(P<0.05)。与NS组比较,M组甩尾实验MPE在注射吗啡的第1、3、5、7天较高(P<0.05);与M组比较,Dex组甩尾实验MPE于注射吗啡的第3、5、7天均较高(P<0.05),见表1。
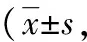
表1 3组不同时间点甩尾实验MPE结果%)
a:P<0.05,与NS组比较;b:P<0.05,与M组比较
与NS组比较,M组大鼠脊髓Iba-1、IL-1β、TNF-α和p-p38蛋白表达水平明显升高(P<0.05),Iba-1阳性细胞密度也显著增多(P<0.05);与M组比较,Dex组大鼠脊髓Iba-1、IL-1β、TNF-α和p-p38蛋白表达水平明显降低(P<0.05),Iba-1阳性细胞密度明显降低(P<0.05),见表2,图1、2。
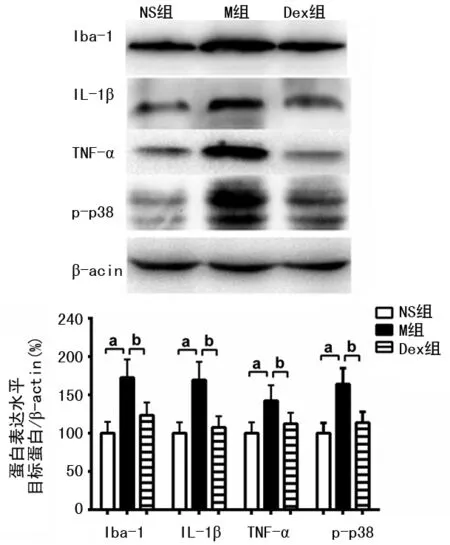
a:P<0.05,与NS组比较;b:P<0.05,与M组比较
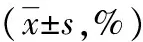
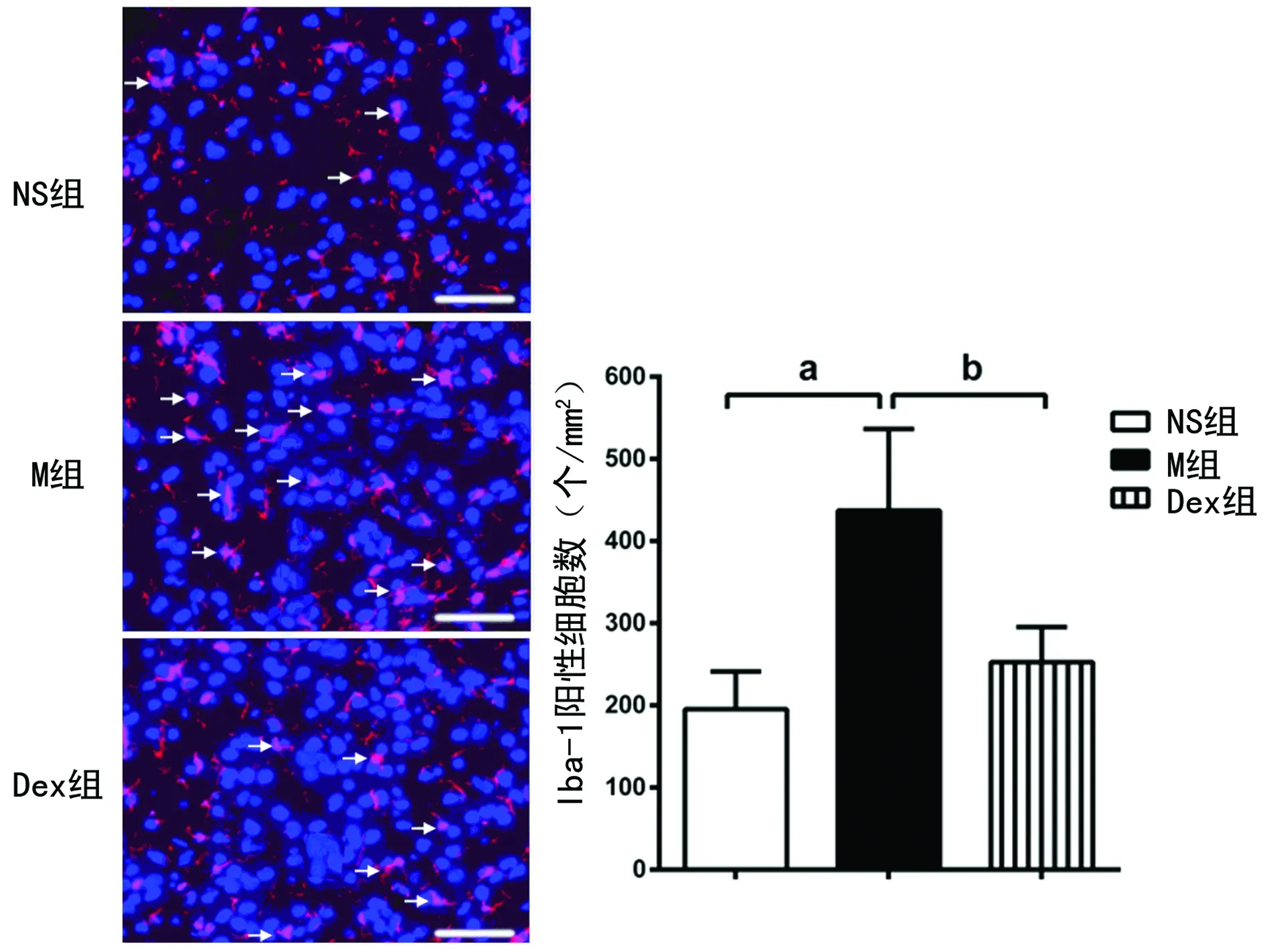
白色箭头为Iba-1(小胶质细胞标记物)阳性细胞(红色荧光);a:P<0.05,与NS组比较;b:P<0.05,与M组比较
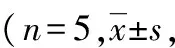
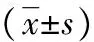
表2 3组大鼠脊髓Iba-1、IL-1β、TNF-α和p-p38蛋白表达水平的比较
a:P<0.05,与NS组比较;b:P<0.05,与M组比较
3 讨 论
本实验研究结果表明,鞘内注射右美托咪定可减轻连续注射吗啡诱发的脊髓小胶质细胞增多和炎症因子产生,继而缓解大鼠吗啡耐受。
参照文献[2-3,8-9],本研究采用鞘内连续7 d注射吗啡15 μg的方法建立大鼠吗啡耐受模型。本实验行为学结果显示,吗啡注射7 d内大鼠甩尾实验MPE均逐渐下降,提示大鼠吗啡耐受模型建立成功。而与单纯吗啡注射组(M组)比较,鞘内注射右美托咪定1.5 μg (1次/天,共7 d)减轻了连续注射吗啡所造成的甩尾实验MPE下降,说明鞘内注射右美托咪定可缓解吗啡耐受的形成。
研究表明,吗啡耐受的形成机制可能与阿片类受体脱敏[9]、谷氨酸受体或转运体功能障碍[10]相关。而近期研究表明脊髓小胶质细胞的过度激活可能在吗啡耐受形成中发挥关键作用[1,3]。而右美托咪定是临床上常用的镇静药物,临床研究表明椎管内注射右美托咪定可减少椎管内局部麻醉药物的用量并增加镇痛效果[1,3]。同时,动物研究显示,右美托咪定可通过减少小胶质细胞过度激活缓解神经元凋亡[4]。而本研究结果表明,鞘内注射右美托咪定,可在缓解吗啡耐受的形成的同时,还可显著减少吗啡诱发的脊髓小胶质细胞标记物Iba-1的过度表达和小胶质细胞密度增加,说明右美托咪定缓解吗啡耐受的效果可能与其特异性抑制小胶质细胞的激活相关。
小胶质细胞可通过细胞特异性的p-p38信号通路激活[1,3],分泌促炎因子(如IL-1β[1,3]、TNF-α[11]),干扰脊髓神经元的正常功能,从而参与介导吗啡耐受的形成。而已有研究表明,右美托咪定抑制脊髓损伤模型中小胶质细胞介导的促炎因子释放[5]。本研究结果与之一致,鞘内注射右美托咪定可减少吗啡连续注射介导的脊髓促炎因子释放,并抑制p-p38信号通路的激活。这提示,右美托咪定可能通过缓解吗啡诱导的小胶质细胞p-p38信号通路激活,减少促炎因子的释放,继而缓解吗啡耐受的形成。
综上所述,鞘内注射右美托咪定可缓解吗啡耐受的形成,其机制可能与抑制脊髓小胶质细胞介导的炎性反应相关。
[1]Cui Y,Liao XX,Liu W,et al.A novel role of minocycline:attenuating morphine antinociceptive tolerance by inhibition of p38 MAPK in the activated spinal microglia[J].Brain Behav Immun,2008,22(1):114-123.
[2]Zhou D,Chen ML,Zhang YQ,et al.Involvement of spinal microglial P2X7 receptor in generation of tolerance to morphine analgesia in rats[J].J Neurosci,2010,30(23):8042-8047.
[3]Cui Y,Chen Y,Zhi JL,et al.Activation of p38 mitogen-activated protein kinase in spinal microglia mediates morphine antinociceptive tolerance[J].Brain Res,2006,1069(1):235-243.
[4]Brissaud O,Lebon S,Schwendimann L,et al.Neuroprotective effects of dexmedetomidine against glutamate agonist-induced neuronal cell death are related to increased astrocyte brain-derived neurotrophic factor expression[J].Anesthesiology,2013,118(5):1123.
[5]Can M,Gul S,Bektas S,et al.Effects of dexmedetomidine or methylprednisolone on inflammatory responses in spinal cord injury[J].Acta Anaesthesiol Scand,2009,53(8):1068-1072.
[6]Wang Z,Ma W,Chabot JG,et al.Calcitonin gene-related peptide as a regulator of neuronal CaMKⅡ-CREB,microglial p38-NFkB and astroglial ERK-Stat1/3 cascades mediating the development of tolerance to morphine-induced analgesia[J].Pain,2010,151(1):194-205.
[7]Brummett CM,Hong EK,Janda AM,et al.Perineural dexmedetomidine added to ropivacaine for sciatic nerve block in rats prolongs the duration of analgesia by blocking the hyperpolarization-activated cation current[J].Anesthesiology,2011,115(4):836-843.
[8]江伟,刘金变,严海.吗啡耐受大鼠脊髓 NR2B 与 mGluR5 的相互作用[J].中华麻醉学杂志,2009,29(2):136-139.
[9]Lene M,Whistler L.The role of muopioid receptor desensitization and endocytosis in morphine tolerance and dependence[J].Curr Opin Neurobiol,2007,17(5):556-564
[10]Tai Y,Wang Y,Tsai R,et al.Amitriptyline preserves morphine′s antinociceptive effect by regulating the glutamate transporter GLAST and GLT-1 trafficking and excitatory amino acids concentration in morphine-tolerant rats[J].Pain,2007,129(3):343-354.
[11]Shen C,Tsai R,Wong C.Role of neuroinflammation in morphine tolerance:Effect of tumor necrosis factor-α[J].Acta Anaesthesiol Taiwan,2012,50(4):178-182.
Effectsofintrathecaladministrationofdexmedetomidineonmorphinetoleranceandinflammatoryresponseinrats*
GongHongyan1,ZhengFang2,ZuoZhichao1,LiuJingjing1,WangQingzhi3,ZhaoGuoan1△
(1.DepartmentofAnesthesiology,FirstAffiliatedHospitalofXinxiangMedicalUniversity,Xinxiang,Henan453000,China;2.MedicalImagingCenter,FirstAffiliatedHospitalofXinxiangMedicalUniversity,Xinxiang,Henan453000,China;3.SchoolofBasicMedicalSciences,XinxiangMedicalUniversity,Xinxiang,Henan453000,China)
ObjectiveTo investigate the effects of intrathecal dexmedetomidine administration on the development of morphine tolerance and spinal inflammatory responses.MethodsThirty-three male SD rats weighing 180~200 g were randomly divided into 3 groups (n=11):Saline group (group NS),Morphine group (group M) and Dexmedetomidine group (group Dex).Animals of group NS were intrathecally injected with 10 μL of saline daily for seven days;Animals in group M were intrathecally injected with 15 μg of morphine daily for seven days;Animals in group Dex were intrathecally injected with a mixture of 15 μg morphine and 1.5 μg dexmedetomidine daily for seven days.At 1,3,5 and 7 day of intrathecal injection,hot water tail-flick test were used to evaluate analgesic response to thermal stimuli.After the last episode of behavioral test,Western blot analysis was applied to determine the protein levels of Iba-1 (microglial marker),IL-1β,TNF-α and phospho-p38MAPK (p-p38) in the spinal cord.In addition,microglia in the spinal cord was immuno-stained with anti-Iba-1 antibody and the densities of microglia were calculated.ResultsIn group M and Dex,the values of maximal possible effect (MPE) in tail-flick test decreased gradually along with repeated morphine administration (P<0.05).Compared with group NS,the values of MPE in tail-flick test at 1,3,5 and 7 day of morphine tolerance were higher in group M (P<0.05).Compared with group M,the values of MPE in tail-flick test at 3,5 and 7 day of morphine tolerance were higher in group Dex (P<0.05).Compared with group NS,the spinal protein levels of Iba-1,IL-1β,TNF-α and p-p38 as well as the density of Iba-1 positive cells in group M were increased (P<0.05).However,Compared with group M,the of Iba-1,IL-1β,TNF-α and p-p38 as well as the density of Iba-1 positive cells were decreased(P<0.05).ConclusionIntrathecal dexmedetomidine administration can attenuate morphine tolerance by inhibiting microglia-mediated inflammatory responses in the spinal cord.
dexmedetomidine;morphine;drug tolerance;drug tolerance;inflammatory
影像中心,河南新乡 453000;3.新乡医学院基础医学院,河南新乡 453000)
河南省医学科技攻关计划项目(201204026)。
巩红岩(1980-),副主任医师,硕士,主要从事临床麻醉学研究。△
,E-mail:13462371221@163.com。
10.3969/j.issn.1671-8348.2017.34.005
R641
A
1671-8348(2017)34-4771-03
2017-08-03
2017-09-05)

