β-TCP/PLGA复合BMSCs联合高压氧修复海水浸泡兔桡骨骨缺损的作用研究*
张 淦,程迅生,陈肖松,马武秀,陈聪聪,符来想
(中国人民解放军第105医院骨科,合肥 230031)
β-TCP/PLGA复合BMSCs联合高压氧修复海水浸泡兔桡骨骨缺损的作用研究*
张 淦,程迅生△,陈肖松,马武秀,陈聪聪,符来想
(中国人民解放军第105医院骨科,合肥 230031)
目的探讨β-磷酸三钙/聚乳酸-羟基乙酸共聚物(β-TCP/PLGA)复合骨髓间充质干细胞(BMSCs)联合高压氧修复海水浸泡骨缺损的疗效。方法复苏和传代的BMSCs接种于β-TCP/PLGA支架上,构建组织工程骨。60只新西兰兔在双侧桡骨制作1.5 cm的骨缺损,经海水浸泡3 h后,分成4组,A组:空白对照组;B组:单纯BMSCs组;C组:BMSCs+高压氧组;D组:β-TCP/PLGA+BMSCs高压氧组。分别于术后4、8、12周分别X射线摄片处死后取桡骨。通过X线片、苏木素-伊红(HE)染色和免疫组织化学检测,评价各组海水浸泡骨缺损修复效果。结果影像学检查,术后12周A组骨缺损未完成修复,断端硬化;B组骨缺损部分修复;C组骨缺损基本完成修复,髓腔未通;D组骨缺损完成修复,髓腔再通。各个时间点骨痂灰度值D组>C组>B组>A组(P<0.05)。组织学观察,术后12周,A组少量板层骨;B组少量板层骨形成,少量骨小梁生成;C组大量板层骨形成,骨小梁排列欠规则;D组大量板层骨形成,骨小梁排列规则。免疫组织化学检测各组表达骨钙素(OCN)强度,术后4周最强,术后8周减弱,术后12周达到最低。术后4周和8周,OCN表达强度D组>C组>B组>A组(P<0.05),术后12周各组差异无统计学意义(P>0.05)。结论β-TCP/PLGA复合BMSCs联合高压氧是修复海水浸泡骨缺损的有效方法之一。
β-磷酸三钙/聚乳酸-聚羟乙酸;骨缺损;海水浸泡;高压氧;骨髓间充质干细胞
海水浸泡骨缺损与单纯的骨缺损有着明显不同,表现在骨膜成骨能力下降[1],相关的生长因子表达延迟和下降[2],给治疗带来困难。骨组织工程是治疗骨缺损的有效措施[3],包括种子细胞、生长因子和支架3个要素。聚乳酸-羟基乙酸共聚物(PLGA)是应用最为广泛的高分子材料支架之一,但是PLGA水溶性差,缺少骨诱导能力,代谢产物会引起免疫反应,力学性能差。实验证明可以通过增加β-磷酸三钙(β-TCP)改变其性能[4]。β-TCP/PLGA在单纯骨缺损中发挥重要的作用,但在海水浸泡骨缺损中是否也可以起到很好的作用尚不明确,现报道如下。
1 材料与方法
1.1主要材料 β-TCP/PLGA(山东省医用高分子材料重点实验室);台式离心机(湖南湘仪仪器有限公司);动物实验高压氧舱 (上海杨园医用氧舱厂);骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSCs)完全培养基、BMSCs(广东赛业生物科技有限公司);磷酸盐缓冲液(美国Sigma公司);乙二胺四乙酸(EDTA)脱钙液、4%多聚甲醛(武汉博士德生物工程有限公司)。
1.2实验分组 60只新西兰兔,体质量2.5~3.0 kg,雌雄不限,采用随机数表法随机分成4组,每组15只。A组:空白对照组;B组:单纯BMSCs组;C组:BMSCs+高压氧组;D组:β-TCP/PLGA/BMSCs+高压氧组。
1.3骨缺损模型制备和高压氧治疗 参照马武秀等[5]的方法,兔耳缘静脉3%戊巴比妥钠(30 mg/kg)麻醉,剪去前肢前臂前外侧毛,常规消毒铺巾,在前臂中间前外侧做3~5 cm的纵行切口,逐层分离皮下组织、筋膜、肌肉、骨膜直至暴露桡骨,注意避开血管和神经。制作1.5 cm的骨缺损,立即将前肢置于事先制备好的海水浸泡3 h,随后彻底清创,60只新西兰兔按照实验分组分别植入预先制备好的组织工程骨或者单纯的BMSCs,空白对照组不植入任何材料。逐层缝合肌肉、筋膜和皮肤。连续3 d给予青霉素40万U肌肉注射。C、D组给予高压氧处理,高压氧治疗参照陈聪聪等[6]的方法,术后立即给予高压氧治疗,每天1次,连续14 d。
1.4观察指标 (1)X线片观察:术后4、8、12周各组抽取4只兔麻醉后行双侧桡骨正位X射线摄片检查。于图片骨缺损间隙随机选取5个观察点,用Photoshop 7.0软件分析并计算各观察点骨痂灰度值。(2)苏木素-伊红(HE)染色,光镜下观察:术后4、8、12周随机抽取4只兔摄片后处死,取桡骨中段。4%多聚甲醛固定,EDTA脱钙1个月,乙醇梯度脱水,包埋,石蜡切片,沿桡骨纵轴行切片厚度为5 μm。行HE染色,观察新生骨形成和移植材料的残余。(3)免疫组织化学检测:抗骨钙素(OCN)单克隆抗体为一抗,在术后4、8、12周对组织行免疫组织化学染色。

2 结 果
2.1BMSCs细胞形态观察 细胞接种2~3 h即可贴壁生长,在倒置相差显微镜下见细胞呈梭形或椭圆形,细胞呈漩涡状生长,7~9 d细胞长满培养皿90%,见图1。
2.2流式细胞鉴定结果 细胞阳性表达CD29、CD44,阴性表达CD34、CD45,见图2。
2.3X线片检查结果 术后4周,A组有少量云雾状骨痂影形成,B组云雾状骨痂影较A多,C组云雾状骨痂影较B组多,D组大量骨痂影形成,较C组多。术后8周,B、C、D组新生骨痂量进一步增多, A组骨痂少量增加。术后12周,A组断端硬化,形成骨不连;B组缺损区未完成修复,出现大块缺损;C组骨缺损基本完成修复,髓腔未完全再通;D组骨缺损完成修复,髓腔再通,塑性良好,见图3。各组不同时间点骨痂灰质度D组>C组>B组>A组,差异有统计学意义(P<0.05),见表1。
2.4HE染色结果 术后4周A组缺损区可见少量纤维性骨痂形成,以软骨细胞为主;B、C、D组可见软骨性骨痂,可见成骨细胞,其中D组最多,C组少于D组,B组少于C组。术后8周,A组缺损区见大量纤维组织,可见少量成骨细胞;B组新生骨增多,出现大量不规则的骨小梁;C组出现大量新生骨,出现排列较为整齐的骨小梁,并且出现少量板层骨;D组新生骨进一步增多,大量排列规则的骨小梁形成,可见成熟的板层骨。术后12周,A组少量板层骨形成,缺损区被大量纤维组织填充;C组板层骨形成,骨小梁排列规则,髓腔未完全再通;D组大量板层骨形成,缺损区已经被新生骨完全填充修复,髓腔形成,髓腔内大量血细胞,可见大量哈弗式系统。见图4。
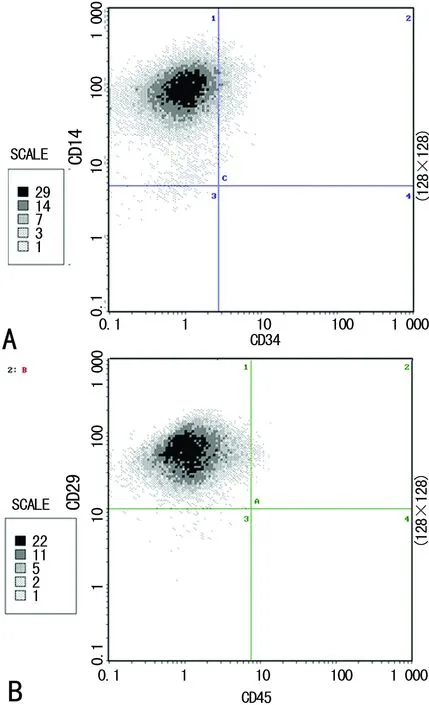
A:CD44+/CD34-;B:CD29+/CD45
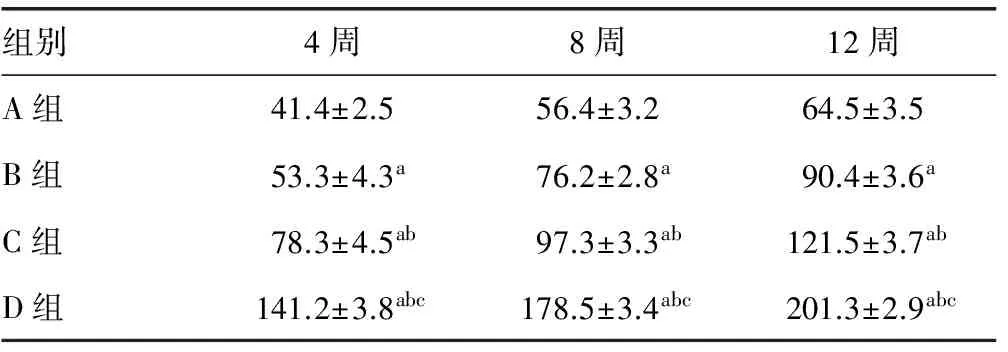
图2 流式细胞学检测表1 各组不同时间点骨痂灰质度检测结果(n=45)
a:P<0.05,与同时间点A组比较;b:P<0.05,与同时间点B组比较;c:P<0.05,与同时间点C组比较

图3 影像学检查
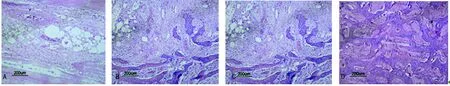
A:A组;B:B组;C:C组;D:D组
图4术后12周各组HE染色(×100)
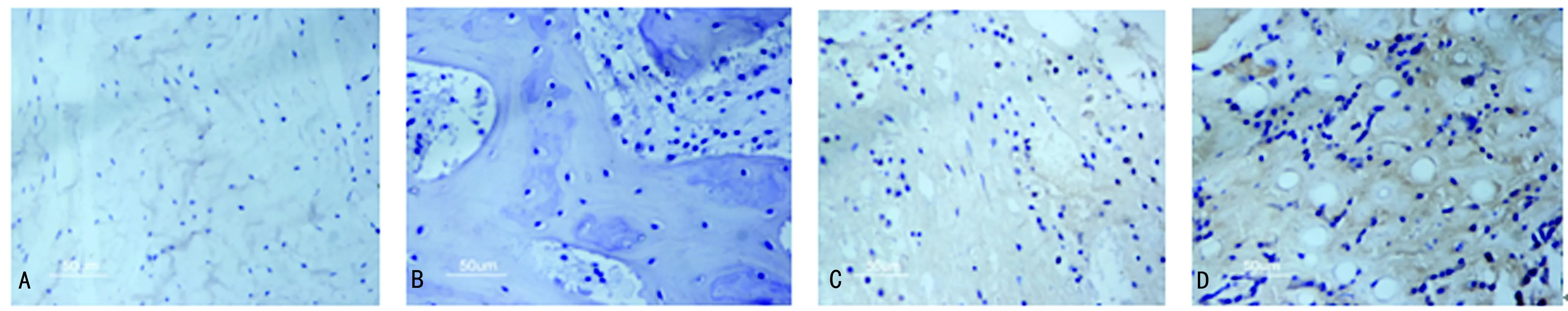
A:A组;B:B组;C:C组;D:D组
图5免疫组织化学检测术后4周各组OCN表达
2.5免疫组织化学结果 OCN主要表达于成骨细胞,各组表达OCN强度,于术后4周最强(图5),术后8周减弱,术后12周达到最低。术后4周和8周,OCN表达强度D组>C组>B组>A组(P<0.05),术后12周各组差异无统计学意义(P>0.05),见表2。
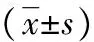
表2 各组不同时间点OCN表达水平
a:P<0.05,与同时间点A组比较;b:P<0.05,与同时间点B组比较;c:P<0.05,与同时间点C组比较
3 讨 论
BMSCs在组织工程中是应用最为广泛的种子细胞。间充质干细胞(MSC)不表达特异性的细胞表面分子,使得鉴定干细胞变得困难。目前主要通过排除法鉴定,实验结果表明细胞传至5代后,CD44、CD29阳性表达,CD34、CD45阴性表达,结果与王鲲等[7]的研究一致,证明用于实验的细胞具有MSC的特征。Kang等[8]使用异体BMSCs,因为自体BMSCs从髂前上棘钻孔抽取,会增加感染概率,引起疼痛。同时异体BMSCs不会引起免疫排斥反应,因为缺乏表达人类白细胞抗原Ⅱ(HLA-Ⅱ)。实验使用异体BMSCs修复兔骨缺损并未出现免疫排斥反应,HE染色未见免疫调节细胞和巨噬细胞,影像学检查和组织学观察,表明自体BMSCs移植与异体BMSCs效果相似。在本实验中的HE染色,未见免疫细胞存在新生骨周围,表明β-TCP/PLGA支架材料生物相容性良好。
β-TCP具有良好的生物相容性和生物降解性,研究表明其可以促进 MSC 的增殖和成骨分化[9],Masaoka等[10]报道了β-TCP有骨传导性和骨诱导性,参与了猕猴股骨缺损修复的过程。PLGA具有良好的生物降解性和可塑性,可应用于骨治疗。由于降解产物集聚在移植区域,免疫细胞会抑制PLGA周围的骨组织再生,PLGA移植会引起免疫反应。在本实验中组织学切片未发现免疫细胞浸润和明显的免疫反应,在观察期间D组未发现免疫反应。Yoshida等[11]报道了PLGA/β-TCP未刺激免疫反应产生,和本实验结果一样。可能原因是β-TCP为碱性能中和PLGA所产生的酸性。此外BMSCs也起到一定的作用[12]。
材料在动物体内的降解主要有两种途径,一是材料在体液中发生溶解,其二是破骨细胞和成骨细胞的吞噬作用使支架降解[13-15]。材料的降解产生大量的钙离子和磷酸根离子,为新生骨的形成提供大量的物质原料,加速了骨缺损修复。Bizenjima等[16]用TRAP染色检验破骨细胞的活性,研究表明在移植后4周残余支架表面存在破骨细胞,表明破骨细胞参与支架的降解过程。支架的力学性能也是衡量支架的一个重要指标,支架良好的力学性能能在降解过程中起到支撑作用。本实验用PLGA增加材料的力学强度,避免了支架的过早塌陷,保持了良好的空间结构,为新生骨组织的长入提供支撑。Kang等[4]的实验在β-TCP的基础上添加PLGA使得PLGA/β-TCP的抗压强度从2.90 MPa增强到4.19 MPa,弯曲强度从1.46 MPa增强到2.41 MPa,韧性从0.17 MPa增强到1.44 MPa。并且PLGA/β-TCP的细胞附着性,细胞增殖能力和诱导活性未改变。骨缺损修复是一个新生组织不断长入支架内,使得支架的整体力学强度不断增加,同时支架不断降解,为新生骨生长提供空间的复杂过程。本实验表明PLGA/β-TCP是合适的骨组织工程支架。
本研究中给予高压氧处理,其作用如下:(1)高压氧提高动脉血氧分压,增加弥散距离,改善组织的氧供。(2)高压氧促进血管内皮细胞、纤维细胞增生及胶原纤维合成。促进侧支循环的形成,改善血液循环和加强组织营养,加速骨组织修复[17]。(3)高压氧抗感染,高压氧抑制细菌生长,提高吞噬细胞吞噬坏死组织的能力,加速坏死组织清除[18]。
本实验将BMSCs与β-TCP/PLGA支架复合后,在体外构建成组织工程骨,移植入海水浸泡兔桡骨骨缺损模型。X射线摄片检测发现,术后4周β-TCP/PLGA复合BMSCs组新生骨痂最多,其余组少量骨痂,随着时间的增加骨痂逐渐增多。至术后12周,D组实现骨性连接恢复,髓腔再通,塑形良好,组织学见大量规则骨小梁,哈弗氏系统形成,生物力学优于其他组。证实β-TCP/PLGA植骨材料的骨缺损修复效果优于其他组。说明实验用的β-TCP/PLGA搭载BMSCs联合高压氧是有效的治疗海水浸泡骨缺损的方法。
[1]王长生,程迅生.兔肢体软组织开放性损伤合并海水浸泡伤对骨膜的影响[J].中华航海医学与高气压医学杂志,2010,17(2):77-80.
[2]陈肖松,程迅生.海水浸泡对兔胫骨开放性骨折愈合进程的影响[J].中华航海医学与高气压医学杂志,2011,18(3):142-149.
[3]Xu L,Sun X,Bai J,et al.Reosseointegration following regenerative therapy of tissue-engineered bone in a canine model of experimental peri-implantitis[J].Clin Implant Dent Relat Res,2016,8(2):379-391.
[4]Kang Y,Scully A,Young DA,et al.Enhanced mechanical performance and biological evaluation of a PLGA coated β-TCP composite scaffold for load-bearing applications[J].Eur Polym J,2011,47(8):1569-1577.
[5]马武秀,程迅生,陈肖松,等.海水浸泡兔桡骨开放性骨缺损最佳植骨时间的研究[J].中华航海医学与高压氧医学杂志,2012,19(2):85-90.
[6]陈聪聪,程迅生,马武秀,等.高压氧对兔桡骨开放性缺损海水浸泡后异体骨髓间充质干细胞移植修复效果的影响[J].中华航海医学与高气压医学杂志,2014,21(1):26-30.
[7]王鲲,伏小平,杨志华,等.骨髓间充质干细胞移植修复高原大鼠股骨缺损[J].中国组织工程研究,2014,18(14):2185-2190.
[8]Kang SH,Chung YG,Oh IH,et al.Bone regeneration potential of allogeneic or autogeneic mesenchymal stem cells loaded onto cancellous bone granules in a rabbit radial defect model[J].Cell Tissue Res,2014,355(1):81-88.
[9]Kasten P,Luginbuhl R,van Griensven M,et al.Comparison of human bone marrow stromal cells seeded on calcium-deficient hydroxyapatite,beta-tricalcium phosphate and demineralized bone matrix[J].Biomaterials,2003,24(15):2593-2603.
[10]Masaoka T,Yoshii T,Yuas M,et al.Bone defect regeneration by a combination of a β-tricalcium phosphate scaffold and bone marrow stromal cells in a non-human primate model[J].Open Biol Engin J,2016,10(1):2-11.
[11]Yoshida T,Miyaji H,Otani K,et al.Bone augmentation using a highly porous PLGA/b-TCP scaffold containing fibroblast growth factor-2[J].J Periodontal Res J Periodontal Res,2015,50(2):265-273.
[12]Zhu H,Yang F,Tang B,et al.Mesenchymal stem cells attenuated PLGA-induced inflammatory responses by inhibiting host DC maturation and function[J].Biomaterials,2015,53:688-698.
[13]Lu J,Dejou J,Koubi G,et al.The biodegradation mechanism of calcium phosphate biomaterials in bone[J].J Biomed Mater Res,2002,63(4):408-412.
[14]Kang Y,Yao Y,Yin G,et al.A study on the in vitro degradation properties of poly(L-lactic acid)/beta-tricalcuim phosphate(PLLA/beta-TCP) scaffold under dynamic loading[J].Med Eng Phys,2009,31(5):589-594.
[15]Zheng Q,Xia Z,Zeng H,et al.Biodegradation of tricalcium phosphate ceramics by osteoclasts[J].J Tongji Med Univ,1998,18(4):257-261.
[16]Bizenjima T,Takeuchi T,Seshima F,et al.Effect of poly(lactide-co-glycolide)(PLGA)-coated beta-tricalcium phosphate onthe healing of rat calvarial bone defects:a comparative study with pure-phase beta-tricalcium phosphate[J].Clin Oral Implants Res,2016,27(11):1360-1367.
[17]谭嘉,谭海涛,陈国平,等.高压氧对小鼠胫骨骨折愈合过程中骨生物力学特性及胶原蛋白含量的影响[J].中国骨科临床与基础研究杂志,2012,4(1):48-56.
[18]Butler J,Foex B.Best evidence topic report:hyperbaric oxygen therapy in acute fracture management [J].Emerg Med J,2006,23(7):571-572.
Studyontheeffectofβ-TCP/PLGAscaffoldsseededBMSCscombingwithhyperbaricOxygenonbonedefectwithseawaterimmersinginrabbitradius*
ZhangGan,ChengXunsheng△,ChenXiaosong,MaWuxiu,ChenCongcong,FuLaixiang
(DepartmentofOrthopedics,the105thHospitalofChinesePeople′sLiberationArmy,Hefei,Anhui230031,China)
ObjectiveTo investigate therapeutic effects of β-TCP/PLGA scaffolds seeded bone marrow mesenchymal stem cells (BMSCs) combing with hyperbaric oxygen (HBO) on bone defect with seawater immersing in rabbit radius.MethodsBMSCs were seeded into the β-TCP/PLGA scaffolds to construct tissue engineering bone.60 New Zealand rabbits were created 1.5 cm bone defect in bilateral radius,and then bilateral wound limbs were immersed in seawater for 3 h.After debridement,all rabbits were randomly divided into 4 groups.In group A nothing was implanted into the bone defect.Only BMSCs was implanted in group B.BMSCs+HBO was given in group C.β-TCP/PLGA BMSCs+HBO was given in group D.At postoperative 4,8,12 weeks rabbits were sacrificed after radiography radius.X-ray radiography,HE staining,immunohistochemical observation were used to evaluate repairing effect of bone defect with seawater immersing.ResultsRadiographic analysis demonstrated that the bone defects were completely repaired with recanalization of the medullary cavity in group D,bone defects were partially repaired with partial recanalization of the medullary cavity in group C,bone defects were incompletely repaired in group B;bone defect repair unfinished and the broken ends were sclerous in group A.Each time point group D>group C>group B>group A in callus grey value (P<0.05).HE staining indicated after 12 weeks,a small amount of lamellar bone formated in group A;a small amount of lamellar bone formated in group B;a large amount of lamellar bone formated in group C;a large amount of lamellar bone formated in group D.Immunohistoehemical result indicated at postoperative 4 weeks,the expressions of osteocalcin(OCN) in each group were at high levels,the expressions decreased significantly at postoperative 8 weeks,the expressions were at a low level at postoperative 12 weeks.At postoperative 4 and 8 weeks,the expression levels of OCN were group D>group C>group B>group A (P<0.05),there was no significant difference at postoperative 12 weeks between the 4 groups (P>0.05).Conclusionthe β-TCP/PLGA composite BMSCs combined hyperbaric oxygen is the effective method to repair seawater immersed bone defect in rabbit.
β-TCP/PLGA;bone defect;seawater immersing;hyperbaric oxygen;BMSCs
南京军区医学科技创新重点课题(11Z011)。
张淦(1988-),住院医师,硕士,主要从事骨折愈合机制的研究。△
,E-mail:18909696280@163.com。
10.3969/j.issn.1671-8348.2017.34.004
R681
A
1671-8348(2017)34-4766-05
2017-08-01
2017-09-03)

