3型酸敏感离子通道在髓核致炎大鼠背根神经节中的表达研究
林士明 陈亦鹏 潘浩 王栋 贾高永 胡庆丰
3型酸敏感离子通道在髓核致炎大鼠背根神经节中的表达研究
林士明 陈亦鹏 潘浩 王栋 贾高永 胡庆丰
目的 通过观察3型酸敏感离子通道(ASIC3)信号通路阻断剂阿米洛利对髓核致炎大鼠背根神经节(DRG)中ASIC3表达的影响,探索ASIC3在髓核组织诱导发生根性疼痛过程中的可能机制。方法 48只大鼠采用随机数字表法分为对照组、模型组和阿米洛利组3组,每组16只。对照组在暴露L5DRG后直接缝合。模型组取出大鼠尾部的髓核组织置于暴露的L5DRG上,缝合切口。阿米洛利组在模型组的基础上,于术后2周内每天腹腔内注射20μg/kg阿米洛利。对照组和模型组不进行药物干预。造模成功后分别于术后2、4、6、8、10、12d检测大鼠后足的机械刺激缩足阈值(PWT)。采用RT-PCR法和Western blot法测定ASIC3、TNF-α和IL-6 mRNA和蛋白表达水平。术后1、3、7和14d采用ELISA法检测外周血及DRG上清液中的TNF-α和IL-6水平,并检测一氧化氮(NO)水平。结果 与对照组比较,术后12d时模型组大鼠后足的PWT显著下降(P<0.01),术后14d模型组大鼠DRG中ASIC3的mRNA和蛋白水平上调(均P<0.01),外周血和DRG中NO、TNF-α、IL-6水平均上调(均P<0.01)。与模型组比较,阿米洛利组大鼠后足的PWT在8d内下降,之后逐渐增加,术后10和12d大鼠后足的PWT明显高于模型组(均P<0.01),术后14d DRG中ASIC3的mRNA和蛋白水平下降(均P<0.05),外周血和DRG中NO、TNF-α、IL-6水平均显著降低(均P<0.01)。结论ASIC3可能在由髓核突出引起的神经根性疼痛中起重要作用。ASIC3可能通过上调NO及细胞炎性因子(TNF-α和IL-6)的表达并增强这些介质的疼痛加强作用,诱导痛觉过敏从而引起神经根性疼痛。
椎间盘 髓核 3型酸敏感离子通道 炎症
椎间盘突出后引起的根性疼痛与髓核致炎背根神经节(dorsal root ganglion,DRG)的受压和髓核接触神经根后诱导的炎性反应及自身免疫过程有关。椎间盘突出后,髓核组织分泌的促炎细胞因子如TNF-α、IL-6、IL-1β和IL-8水平增加[1-3]。此外,免疫球蛋白、氢、一氧化氮(NO)和磷脂酶A2也参与到椎间盘疾患的病理生理反应[4]。髓核与神经根接触后诱导的炎症反应是复杂的,各种细胞介质和炎症通路参与其中。酸敏感离子通道(acid sensing ion channel,ASIC)蛋白是阿米洛利敏感性Na+通道/变性蛋白家族的成员,其形成同聚和异聚功能膜通道[5],其中ASIC3已被证实与缺血、炎症或组织酸中毒相关疼痛的传导紧密相关,使髓核适应椎间盘的酸性和高渗生物龛。本研究拟观察ASIC3信号通路阻断剂阿米洛利对髓核致炎大鼠DRG中ASIC3表达的影响,并检测大鼠后足机械刺激缩足阈值(pain withdrawal threshold,PWT) 及外周血和 DRG中 NO、TNF-α、IL-6水平,以探索ASIC3在髓核组织诱导发生根性疼痛过程中的可能机制。
1 材料和方法
1.1 实验动物条件 48只清洁级成年雄性SD大鼠,体重220~240g,由浙江中医药大学实验动物中心提供,实验动物许可证号:SCXY(浙)2013-0016。实验在浙江中医药大学实验动物中心进行,实验室温度22~25℃、12h明暗循环,大鼠自由饮水摄食。实验程序遵循美国国立卫生研究院制定的《实验动物护理和使用指南》(第9版,2010年)。动物实验方案通过浙江中医药大学医学动物实验伦理委员会批准。
1.2 实验方法
1.2.1 手术方法 通过腹腔内注射水合氯醛(100g/L)麻醉大鼠。以大鼠髂嵴最高点连线为中心作25~30mm正中纵切口暴露脊柱及两侧组织,切除L5下关节突、L6上关节突和L5半椎板,暴露左侧L5DRG及部分脊髓硬膜囊。采用18G的皮肤穿刺针头在L5~6椎间盘进行穿刺,针头用持针器夹持,尖端保留5mm长度,于纤维环前外侧方平行终板方向刺入,深度控制在5mm,刺入后维持5s;然后,断尾,纵向切开鼠尾根部,从2个椎间盘内取髓核组织共0.4mg,置于L5DRG上,术毕逐层缝合肌肉、筋膜和皮肤。术后肌肉注射2万U青霉素(80万U/0.48g,H37021359,齐鲁制药有限公司)预防感染。
1.2.2 实验分组及给药方法 48只大鼠采用随机数字表法分为对照组、模型组和阿米洛利组3组,每组16只。各组处理及给药方法如下:(1)对照组在上述手术过程中暴露L5DRG后直接缝合。(2)模型组按上述手术方法进行造模。(3)阿米洛利组:按上述手术方法进行造模,并于术后2周内每天腹腔内注射20μg/kg阿米洛利(H10900015,美国Sigma公司)。对照组和模型组不进行药物干预。术后1、3、7、14d,每天随机处死3只大鼠并取出L5DRG,采用5ml注射器刺入L5~6椎间隙水平内取外周血,-20℃保存。
1.2.3 大鼠后足的PWT测定 各组随机选取4只大鼠分别于术后 2、4、6、8、10、12d 采用 Up-Down 法测定大鼠后足的PWT。检测工具为8根强度呈对数递增方式的Von Frey纤毛机械刺激针(BIO-EVF3,上海玉研科学仪器有限公司),间隔5min重复刺激3次,初始刺激强度为2.04g,每次刺激时间为4~6s。在测试前30min,将大鼠置于测定PWT值用的笼子内适应测试环境。
1.2.4 ASIC3、TNF-α和 IL-6 mRNA表达水平测定采用RT-PCR法。术后14d,以Trizol法提取L5DRG中总RNA。取1μg总RNA进行逆转录。逆转录条件:37℃60min,85℃ 5min,4℃ 5min。以 GAPDH 为内参,设计引物:ASIC3 上游为 5′-CGCTATGTGGCTCGGAAGTG-3′,下游为 5′-TGTAGGACTCGCTGCGGTTG-3′;TNF-α 上游为 5′-CTGAGGTCAACCTGCCCAAG-3′,下游为 5′-GGCTGGGTAGAGAACGGATG-3′;IL-6 上游为 5′-CACCAGGAACGAAAGTCAAC-3′,下游为 5′-GGCTGTCAACAACATCAGTC-3′。通过逆转录合成的cDNA 2μl进行RT-PCR扩增。RT-PCR反应条件为:95℃10min,95℃15s,60℃1min,95℃15s,60℃15s循环扩增。采用ABI Prism 7300 SDS(美国ABI公司)仪器分析数据。
1.2.5 ASIC3、TNF-α和IL-6蛋白表达水平测定 采用Western blot法。术后14d,将DRG剪成细小的碎片,按每20mg组织加入150~250μl裂解液的比例加入裂解液(裂解液中加入蛋白酶和磷酸酶抑制剂),匀浆器匀浆直至完全裂解。裂解后的样品4℃12 000g离心15min,取上清液,进行蛋白含量测定。蛋白含量采用紫外分光光度法在562nm处进行浓度测定。灌胶上样进行SDS聚丙烯酰胺凝胶恒压电泳后,半干法将蛋白转移至硝酸纤维素膜上,用立春红染色观察转印是是否成功,5%脱脂奶粉的Tris缓冲液4℃过夜封闭,洗膜后分别加入兔抗鼠 ASIC3(1∶400)、TNF-α(1∶1 000)、IL-6(1∶1 000)一抗溶液,4℃杂交过夜,用洗膜液漂洗后加入1∶1 000稀释的二抗杂交 1h后,取出用洗膜液冲洗,ECL显色,并使用Image J.1.46软件分析灰度值。
1.2.6 TNF-α和IL-6水平测定 采用ELISA法测定术后1、3、7、14d外周血及DRG上清液中的TNF-α和IL-6水平。试剂盒由上海恒斐生物科技有限公司提供。
1.2.7 NO水平检测 将外周血和DRG以1 000g离心10min,收集上清液,使用NO测定试剂盒(型号A012,南京建成生物工程研究所)在术后1、3、7和14d测定NO水平。
1.3 统计学处理 采用SPSS 17.0统计软件。计量资料以表示,多组间比较采用单因素方差分析,两两比较采用LSD-t检验。P<0.05为差异有统计学意义。
2 结果
2.1 3组大鼠DRG中ASIC3的mRNA和蛋白表达水平比较 模型组及阿米洛利组大鼠DRG中ASIC3的mRNA和蛋白水平均高于对照组(均P<0.01),而阿米洛利组大鼠DRG中ASIC3的mRNA和蛋白表达水平均低于模型组(均P<0.05),见图1。
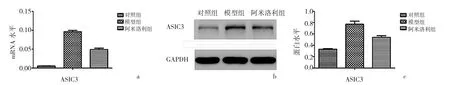
图1 3组大鼠DRG中ASIC3的mRNA和蛋白表达水平比较(a:3组大鼠ASIC3的mRNA表达水平比较;b:3组大鼠ASIC3蛋白表达电泳图;c:3组大鼠ASIC3的蛋白表达水平比较)
2.2 大鼠后足 PWT的变化情况 术后 2、4、6、8、10、12d模型组大鼠后足的PWT与对照组比较差异均有统计学意义(均P<0.01)。阿米洛利组大鼠后足的PWT在术后8d内下降,之后逐渐增加;术后10和12d大鼠后足的PWT明显高于模型组,差异均有统计学意义(均 P<0.01),见图 2。
2.3 3组大鼠外周血和DRG中NO、TNF-α和IL-6表达水平的比较 模型组及阿米洛利组大鼠外周血和DRG 中术后 1、3、7、14d 的 NO、TNF-α 和 IL-6表达水平较对照组显著上调(均P<0.05),且模型组术后3、7、14d的NO、TNF-α和IL-6表达水平较阿米洛利组也显著上调(均P<0.01),见表1~3。通过RT-PCR法和Western blot法测量3组大鼠DRG也发现类似的结果,见图3。
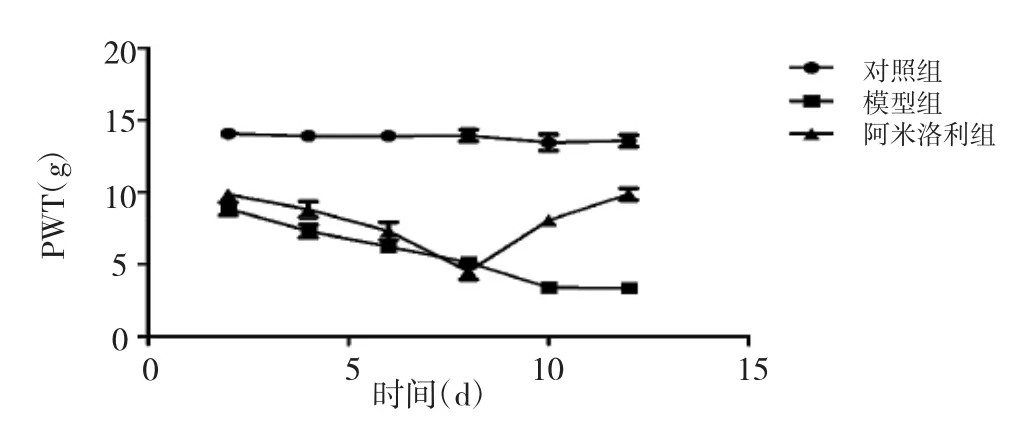
图2 大鼠后足PWT的变化情况

表1 3组大鼠外周血和DRG中NO表达水平的比较(μmol/L)
3 讨论
椎间盘突出引起的椎神经根病与DRG损伤密切相关。大量的证据表明ASIC3可能涉及椎神经根病的各种因素和各种类型的疼痛,例如缺血性、炎性、机械性和神经根性疼痛[6-8]。然而,ASIC3信号通路阻断剂在椎神经根病中的作用还是未知的。本研究中,笔者加入了ASIC3信号通路阻断剂阿米洛利,从而进一步探讨ASIC3在椎间盘突出引起的神经根性疼痛的作用机制。椎间盘是含髓核组织的特殊生物力学结构,通过分泌基质高分子,提高渗透压来使其适应所施加的机械负荷。最近一些研究把焦点转移到由髓核组织与神经根和周围组织接触引发的炎症过程[9-10]。髓核被认为是有限的血管供应的闭合组织,椎间盘纤维环破裂后,髓核通过裂隙突出椎管内,此时髓核作为一个特异性抗原,将导致自身免疫反应发生,通过释放各种细胞炎性介质引起一系列炎症反应[11-12]。本研究通过将髓核置于DRG的模型组与未将髓核置于DRG的对照组比较,发现模型组DRG神经元中ASIC3的mRNA和蛋白表达水平显著增加,表明细胞炎症反应可以引起ASIC3在DRG神经元的上调,而腹腔内注射阿米洛利则显著抑制了DRG神经元中ASIC3表达的增加。
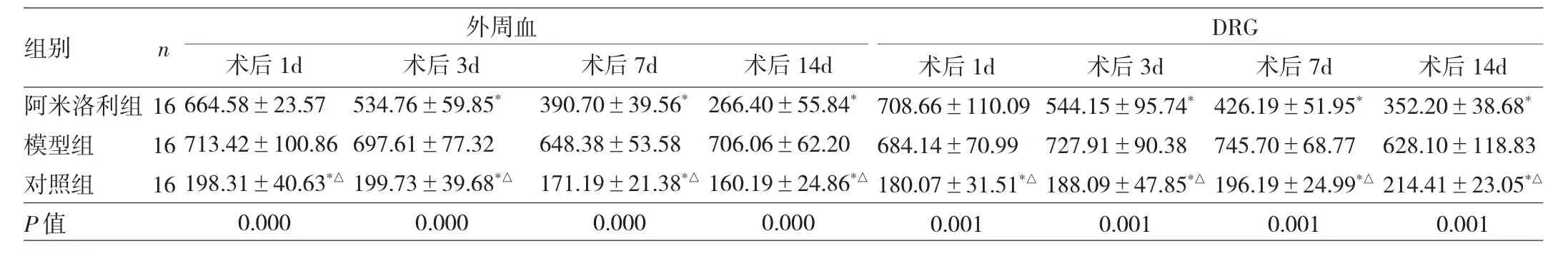
表2 3组大鼠外周血和DRG中TNF-α表达水平的比较(ng/L)
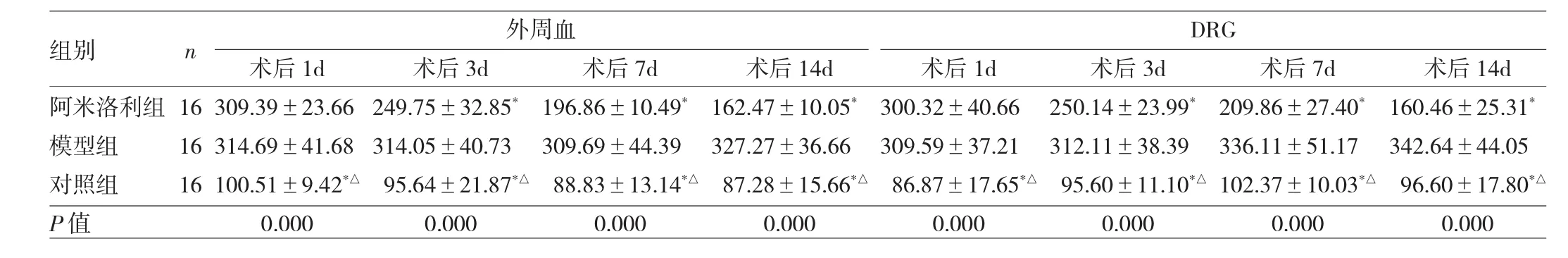
表3 3组大鼠外周血和DRG中IL-6表达水平的比较(ng/L)
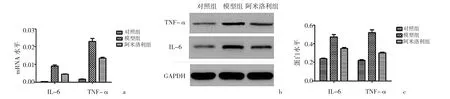
图3 3组大鼠DRG中TNF-α和IL-6的mRNA和蛋白表达水平比较(a:3组大鼠IL-6和TNF-α的mRNA表达水平比较;b:3组大鼠IL-6和TNF-α蛋白表达电泳图;c:3组大鼠IL-6和TNF-α的蛋白表达水平比较)
痛觉过敏是所有炎症过程的共同特征,其特征性在于感受伤害阈值的降低和对于热和机械刺激的敏感增加[13]。本研究模型组中大鼠后足的PWT在术后12d内持续下降,在10d时下降最为明显。然而,由髓核组织诱导的痛觉过敏在阿米洛利组中得到显著改善,在术后8d开始显著上升。表明ASIC3与痛觉过敏密切相关,阿米洛利可减轻ASIC3介导的痛觉过敏。
NO和细胞炎性因子(TNF-α和IL-6)与神经肽的增加相关,在先前研究中观察到,用细胞炎性因子抑制剂阻断其上游信号通路可以减少外周和中枢神经系统疼痛[14-15]。本研究模型组术后14d,通过ELISA和生化检测到外周血和DRG中NO、TNF-α和IL-6水平均增加。通过Western blot法也同样检测到DRG中TNF-α和IL-6水平均增加。阿米洛利组显著抑制了术后3、7、14d NO、TNF-α和IL-6水平的上调。表明ASIC3与炎症过程密切相关,可以促进多种炎性因子的表达并增强这些介质的疼痛加强作用。而阿米洛利通过抑制ASIC3的表达从而降低细胞炎性因子的表达,减缓局部的炎症反应。
综上所述,椎间盘突出发生后,髓核介导的炎症反应可以引起ASIC3在DRG神经元上的表达上调,而ASIC3又可促进多种细胞炎性因子(TNF-α和IL-6)的表达,使局部形成正反馈,加强这些介质的疼痛加强作用,诱导痛觉过敏从而引起神经根性疼痛。抑制ASIC3则可以减弱髓核组织对DRG的炎症损伤而致的痛觉过敏,减缓神经根性疼痛。
[1] Sasaki N,Sekiguchi M,Kikuchi S,et al.Effects of asialo-erythropoietin on pain-related behavior and expression of phosphorylated-p38 map kinase and tumor necrosis factor-alpha induced by application of autologous nucleus pulposus on nerve root in rat[J].Spine(Phila Pa 1976),2011,36(2):86-94.doi:10.1097/BRS.0b013e3181f137a8.
[2] Zu B,Pan H,Zhang X J,et al.Serum levels of the inflammatory cytokines in patients with lumbar radicular pain due to disc herniation[J].Asian Spine J,2016,10(5):843-849.doi:10.4184/asj.2016.10.5.843.
[3] Dagistan Y,Cukur S,Dagistan E,et al.Role of expression of inflammatory mediators in primary and recurrent lumbar disc herniation[J].J Korean Neurosurg Soc,2017,60(1):40-46.doi:10.3340/jkns.2015.0911.002.
[4] Amin R M,Andrade N S,Neuman B J.Lumbar disc herniation[J].Curr Rev Musculoskelet Med,2017,10(4):507-516.doi:10.1007/s12178-017-9441-4.
[5] Stankowska D L,Mueller B H,Oku H,et al.Neuroprotective effects of inhibitors of Acid-Sensing ion channels(ASICs)in optic nerve crush model in rodents[J].Curr Eye Res,2017:1-12.doi:10.1080/02713683.2017.1383442.[Epub ahead of print]
[6] Gao M,Long H,Ma W,et al.The role of periodontal ASIC3 in orofacial pain induced by experimental tooth movement in rats[J].Eur J Orthod,2016,38(6):577-583.doi:10.1093/ejo/cjv082.
[7] Munro G,Christensen J K,Erichsen H K,et al.NS383 selectively inhibits acid-sensing ion channels containing 1a and 3 subunits to reverse inflammatory and neuropathic hyperalgesia in rats[J].CNS NeurosciTher,2016,22(2):135-145.doi:10.1111/cns.12487.
[8] 胡四平,汪卫星,刘洋,等.局部注射酸敏感离子通道抑制剂阿米洛利对胫骨癌痛大鼠疼痛行为学的影响[J].浙江医学,2013,35(8):623-625.
[9] Ohtori S,Inoue G,Eguchi Y,et al.Tumor necrosis factor-alpha-immunoreactive cells in nucleus pulposus in adolescent patients with lumbar disc herniation[J].Spine(Phila Pa 1976),2013,38(6):459-462.doi:10.1097/BRS.0b013e3182739cb4.
[10] de Souza Grava A L,Ferrari L F,Defino H L.Cytokine inhibition and time-related influence of inflammatory stimuli on the hyperalgesia induced by the nucleus pulposus[J].Eur Spine J,2012,21(3):537-545.doi:10.1007/s00586-011-2027-8.
[11] Kalb S,Martirosyan N L,Kalani M Y,et al.Genetics of the degenerated intervertebral disc[J].World Neurosurgery,2012,77(3-4):491-450.doi:10.1016/j.wneu.2011.07.014.
[12] 朱宇,姜宏,俞鹏飞.腰椎间盘突出后重吸收的研究进展[J].中国脊柱脊髓杂志,2014,24(12):1124-1128.doi:10.3969/j.issn.1004-406X.2014.12.12.
[13] Yagi J,Wenk H N,Naves L A,et al.Sustained currents through ASIC3 ion channels at the modest pH changes that occur during myocardial ischemia[J].Circ Res,2006,99(5):501-509.doi:10.1161/01.RES.0000238388.79295.4c.
[14] Studer R K,Aboka A M,Gilbertson L G,et al.p38 MAPK inhibition in nucleus pulposus cells:a potential target for treating intervertebral disc degeneration[J].Spine(Phila Pa 1976),2007,32(25):2827-2833.doi:10.1097/BRS.0b013e31815b757a.
[15] HayashiY,Ohtori S,Yamashita M,et al.Direct single injection of p38 mitogen-activated protein kinase inhibitor does not affect calcitonin gene-related peptide expression in dorsal root ganglion neurons innervating punctured discs in rats[J].Spine(Phila Pa 1976),2009,34(26):2843-2487.doi:10.1097/BRS.0b01-3e3181b8db15.
Effect of amiloride on ASIC3 expression in dorsal root ganglion following nerve root inflammation induced by nucleus pulposus in rats
LIN Shiming,CHEN Yipeng,PAN Hao,et al.
Department of Orthopedics,Guang Xing Hospital Affliated to Zhejiang Uniuersity of Traditional Chinese Medicine,Hangzhou 310007,China
Objective To investigate the effect of amiloride on the expression of acid sensing ion channel 3 (ASIC3)in dorsal root ganglion(DRG)following nerve root inflammation induced by nucleus pulposus in rats. Methods Forty eight SD rats were randomly divided into control group(Sham,n=16),inflammation group(NP,n=16),inflammation+amiloride group(NP+Ami,n=16).The L5DRG was exposed in rats of NP and NP+Ami groups by surgery,and sham surgery was performed in sham group.Intraperitoneal injection of amiloride 20μg/kg was given to rats in NP+Ami group q.d for 2 weeks after surgery,and no amiloride was given to rats in sham group and NP group.The mechanical pain withdrawal threshold(PWT)was evaluated at 2,4,6,8,10 and 12d after modeling.The expression of ASIC3,TNF-α,IL-6 mRNA and protein were examined by Real-time PCR and Western blot,respectively.TNF-α and IL-6 concentrations present in peripheral blood and DRG were determined at 1,3,7 and 14d after the surgical procedures using ELISA method.NO levels were examined by biochemistry test. Results Rats exposed to the NP showed decreased PWT at 12d after surgery(P<0.01),and the levels of ASIC3 and the NO,TNF-α,IL-6 were up-regulated in DRG induced by NP 14d after surgery(all P<0.01).Compared to NP group the mechanical PWT decreased at 8d after surgery and then gradually increased at 10 and 12d after surgery in NP+Ami group (all P<0.01).ASIC3 was down-regulated(both P<0.05),and the levels of NO,TNF-α,IL-6 were significantly decreased at 14d after surgery(all P<0.01)in NP+Ami group. Conclusion ASIC3 may upgrade the expression of NO and inflammatory cytokines TNF-α and IL-6 to induce hyperalgesia and never root pain.
Intervertebral disc Nucleus pulposus ASIC3 Inflammation
10.12056/j.issn.1006-2785.2017.39.24.2017-918
浙江省中医药科技计划项目(2015ZA157);杭州市科技计划重点项目(20150733Q60)
310007 杭州,浙江中医药大学附属广兴医院骨科
胡庆丰,E-mail:huqingfeng258@163.com
2017-04-22)
陈丽)

