脑血疏口服液对脑缺血再灌注损伤大鼠的神经保护作用及机制
, , ,,晓辉,
脑血疏口服液对脑缺血再灌注损伤大鼠的神经保护作用及机制
蒋锋,王莉,山媛,崔小丽,王晓辉,程仙送
目的研究脑血疏口服液对脑缺血再灌注损伤大鼠的神经保护作用及机制方法将120只SD大鼠随机分为4组:假手术组、对照组、脑血疏治疗组(治疗组)、脑血疏预处理组(预处理组);采用线栓法建立大鼠大脑中动脉闭塞再灌注模型,观察大鼠神经行为学、脑梗死体积及脑组织病理形态学变化,并检测脑组织中白细胞浸润、髓过氧化物酶(MPO)活性、细胞间黏附分子-1(ICAM-1)、白介素-1(IL-1)的表达。结果假手术组大鼠在神经功能缺损评分、脑梗死体积均低于其他3组,差异有统计学意义(P<0.01);脑组织中白细胞浸润、MPO活性、ICAM-1及IL-1的表达较其他3组均低,差异有统计学意义(P<0.01)。治疗组、预处理组与对照组相比,大鼠的神经功能缺损评分低、脑梗死体积小,坏死范围缩小,差异有统计学意义(P<0.01);白细胞浸润、MPO活性、ICAM-1和IL-1的表达较对照组减少,差异有统计学意义(P<0.01)。与治疗组相比,预处理组大鼠的神经功能缺损评分低,脑梗死体积缩小(P<0.05),其中白细胞浸润、ICAM-1和IL-1的表达较治疗组减少(P<0.05);MPO活性两组间比较差异无统计学意义(P>0.05)。结论脑血疏口服液对大鼠脑缺血再灌注损伤有神经保护作用,其机制可能通过抑制脑缺血再灌注损伤后的炎性反应而发生作用,预防用药效果优于脑缺血发生后用药。
脑缺血再灌注损伤;脑血疏口服液;髓过氧化物酶;白介素-1;细胞间黏附分子-1
缺血性脑血管病是临床上常见神经系统疾病,表现为局部脑血流障碍,主要由于动脉栓塞或原位血栓导致血管结构发生改变,继发多种病理变化[1-3],最终导致脑组织坏死。脑缺血发生后改善脑部血流供应为治疗重点,但血流改善后所引发的缺血再灌注损伤一直是临床治疗的难点,常为研究焦点。本实验通过观察大鼠脑缺血再灌注损伤后的炎性反应,探讨脑血疏口服液在脑缺血再灌注损伤中的脑保护作用及其机制,为临床用药提供理论依据。
1 材料与方法
1.1 动物分组及给药方式 选择健康雄性SD大鼠120只,体重250g~300g(西安交通大学医学院动物中心提供),昼夜循环光照,自由食水。适应性饲养3d后随机分为4组:假手术组、对照组、脑血疏治疗组(治疗组)、脑血疏预处理组(预处理组),每组30只。在动物模型建立前7d开始,预处理组每日灌服脑血疏口服液,每8h1次(1mL/kg),其余3组给予等量盐水灌服。脑血疏治疗组在造模后每8h灌服脑血疏口服液1mL/kg,其余3组灌服同样体积的生理盐水,共7d。
1.2 动物模型制作 大脑中动脉闭塞再灌注(MCAO/R)模型制作采用改良的Longa法。即解剖分离暴露颈部血管,采用线栓法短时间栓塞左侧大脑中动脉,2h后拔出栓线,恢复缺血脑区的血液灌注,建立MCAO/R模型。假手术组只解剖分离暴露颈部血管,不插入栓线。
1.3 大鼠神经神经功能缺损评分 参考Longa5级评分法,对大鼠神经功能缺损症状进行评分,0分:无神经功能缺损症状;1分:提尾时对侧前肢不能完全伸直;2分:向病灶对侧转圈征象;3分:向病灶对侧倾倒;4分:不能自发行走及意识丧失。
1.4TTC染色、脑梗死体积计算 每组随机选10只大鼠,10%水合氯醛深度麻醉后断头处死,完整取出鼠脑,将脑组织切片,行TTC染色,后将脑片转至100g/L甲醛液中,冰箱冷藏固定24h。取出后数码相机照相,将染色结果输入计算机,利用图像处理软件Image-ProPlus6.0分别计算出各个脑片缺血侧的总体积和梗死区域的体积,再求出梗死区域占大脑半球总体积的百分比计算并记录。
1.5 免疫组化和生化指标检测 每组随机选10只大鼠,10%的水合氯醛过量腹腔注射麻醉,迅速剪开胸腔,暴露心脏,经升主动脉插管后,先用200ml的生理盐水快速冲洗,然后用4 ℃4%多聚甲醛500mL(先快后慢)继续灌注内固定至少1.5h。断头取脑,4%多聚甲醛固定,包埋成蜡片,进行HE染色,在光镜下观察脑组织病理变化。免疫组化染色后,在高倍镜下观察脑组织中白细胞数、细胞间黏附分子-1(ICAM-1)阳性血管数、白介素-1(IL-1)阳性细胞数。
每组剩余10只,到观察终点时间处死各组大鼠,用生理盐水制成20%的脑组织匀浆,取0.45mL20%的组织匀浆,按照试剂说明书,采用紫外分光光度计比色法用于测定髓过氧化物酶(MPO)。
2 结 果
2.1 各组大鼠神经行为评分比较 大鼠处死时间点前评分,除假手术组,其他3组均出现了不同程度的神经功能缺损症状。治疗组和预处理组大鼠神经功能缺损评分均低于对照组(P<0.01); 预处理组大鼠神经功能缺损评分较治疗组低(P<0.01)。详见表1。

表1 各组大鼠神经功能缺损评分比较 分
2.2 各组大鼠脑梗死体积比较 由TTC染色结果可见,假手术组脑片全部呈红色,对照组、治疗组和预处理组大鼠缺血侧额顶叶皮质及纹状体区可见明显的白色梗死灶,治疗组、预处理组梗死体积明显小于对照组(P<0.01);预处理组梗死体积较治疗组缩小(P<0.05)。详见表2。

表2 各组大鼠脑梗死体积比较 (±s) %
2.3 各组大鼠脑组织MPO活性比较 采用比色法检测脑组织MPO活性,对照组明显高于假手术组(P<0.01);治疗组和预处理组中MPO的活性均下降,与对照组相比差异有统计学意义(P<0.01),而治疗组与预处理组比较差异无统计学意义(P>0.05)。详见表3。

表3 各组大鼠脑组织MPO活性比较(±s) U/g
2.4 大鼠脑组织病理变化HE染色结果可见到假手术组细胞层次清晰,排列紧密,细胞结构,形态正常,神经细胞胞质,核染色均匀,核仁清楚,核膜完整,间质内未见出血、坏死及水肿。而对照组梗死侧有片状坏死,少量神经元残存,细胞排列松散,形态不规则,神经细胞与细胞间质分离,细胞深染固缩,胞浆尼氏体消失,胞核固缩,核仁消失。治疗组和预处组可见缺血区只有少量灶状坏死,染色较均匀,神经细胞固缩程度轻,胞膜及核仁仍清晰可见,细胞周围间隙增宽不明显。
2.5 各组脑组织白细胞、ICAM-1、IL-1含量比较 脑组织中的白细胞数、ICAM-1阳性血管数、IL-1阳性细胞数,对照组明显高于假手术组(P<0.01),治疗组和预处理组与对照组相比明显减少(P<0.01),预处理组较治疗组减少(P<0.01)。详见表4。

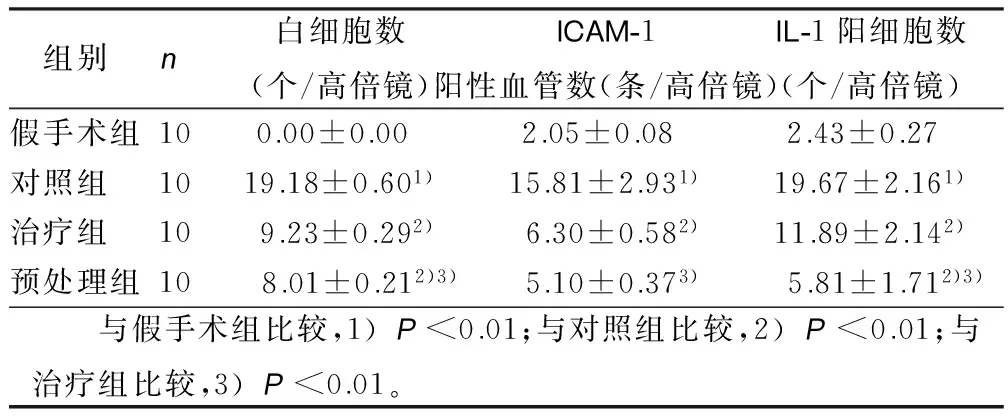
组别n白细胞数(个/高倍镜)ICAM-1阳性血管数(条/高倍镜)IL-1阳细胞数(个/高倍镜)假手术组100.00±0.00 2.05±0.08 2.43±0.27 对照组 1019.18±0.601)15.81±2.931)19.67±2.161)治疗组 109.23±0.292)6.30±0.582)11.89±2.142)预处理组10 8.01±0.212)3)5.10±0.373) 5.81±1.712)3) 与假手术组比较,1)P<0.01;与对照组比较,2)P<0.01;与治疗组比较,3)P<0.01。
3 讨 论
脑梗死是由于血管堵塞导致脑血流减少而引起脑损伤,脑缺血时间越长,脑损伤越重,预后越差,若脑血流很快恢复,则损伤可逆,缺血半暗带内的神经细胞仍可恢复正常[4-5],但长时间发生脑缺血,恢复血流后会造成脑缺血再灌注损伤(指脑组织缺血一定时间后再恢复血液灌注,脑组织细胞损伤反而进一步加重),其发生机制非常复杂,目前认为存在多种因素[6-7]。
炎性反应是脑梗死发生后引起脑损伤的重要机制之一,包括:①白细胞等炎症细胞被激活,释放大量细胞因子,直接产生损伤作用;②白细胞和血管内皮细胞表面黏附分子异常高表达,白细胞黏附于血管内皮,进一步发挥损伤作用。认为白细胞浸润和小胶质细胞、星型胶质细胞的激活是炎性反应的标志[8-9],胶质细胞主要引起细胞免疫,诱导大量炎性介质释放[10],参与炎性反应的介质很多,其中主要包括IL-1、ICAM-1、肿瘤坏死因子(TNF)等。其中白细胞浸润、迁移、聚集是炎症反应的重要环节,中性粒细胞和单核巨噬细胞是炎症反应的主要细胞,MPO存在于中性粒细胞的嗜天青颗粒中,其活性是判断中性粒细胞浸润程度的可靠指标[11],其主要功能是在吞噬细胞内杀灭微生物,可以通过过氧化氢和氯离子生成次氯酸盐,并形成具有氧化作用的自由基。在炎症反应中大量自由基生成可加重脑组织的损伤。
脑缺血发生后,白细胞被活化,活化的白细胞向缺血区域迁移,并释放多种炎性介质和炎性趋化因子,加速白细胞的聚集、迁移。脑缺血时,微血管内皮细胞受到损伤,其中ICAM-1表达增强,ICAM-1促使白细胞与血管内皮细胞黏附,穿过血管内皮,向缺血区浸润、迁移、黏附,聚集在微血管内的白细胞又引起微血管堵塞,减少脑血流量,引起脑血栓形成。IL-1是重要的炎性因子,对白细胞有趋化作用,中枢神经系统内细胞均可表达IL-1[12],但过量的IL-1表达,促使大量的白细胞向缺血区浸润,聚集,放大了炎症级联反应且可通过NO、钙离子超载,上调细胞凋亡基因的作用对脑组织造成直接损伤。本实验结果显示,与假手术组比较,其他三组MPO活性、ICAM-1及IL-1表达均增高,也说明炎性反应参与了脑缺血再灌注损伤。
脑血疏口服液由黄芪、水蛭、石菖蒲、牛膝、牡丹皮、大黄、川芎等药组成,其中水蛭具有抗凝、抗血栓、抗炎、抗肿瘤、脑保护等多种药效[13]。通过本实验可看到,给予脑血疏口服液干预后,大鼠的神经功能缺损症状较对照组轻,脑梗死体积也较对照组明显缩小,神经细胞坏死程度减轻,提示脑血疏口服液在脑缺血再灌注损伤中起到神经保护作用。同时脑血疏口服液明显抑制了白细胞浸润程度,以及炎性因子ICAM-1和IL-1表达,这可能是脑血疏口服液发挥神经保护作用的机制之一。实验同时发现预处理组在神经保护方面作用优于治疗组,缺血发生前给药效果优于缺血发生后给药,推测可能存在改善侧支循环和脑细胞功能等其他因素,所以血管堵塞后的脑损害相对轻,脑血疏口服液能否用于脑梗死的预防治疗中,仍需更多实验来证实。
脑血疏口服液目前临床主要应用于脑出血的治疗中,结合药物成分及功效,发现其在脑缺血中的神经保护作用,可用于急性脑梗死的临床治疗,预防用药可能减轻患者脑梗死发生后的脑损害。
[1] 张均田,张庆柱,张永祥.神经药理学[M].北京:人民卫生出版社,2008:672 -700.
[2]DoyleKP,SimonRP,Stenzel-pooreMP.Mechanismsofischemicbraindamage[J].Neuropharmacology,2008,55(3):310 -318.
[3]RosamondW,FlegalK,FridayG,etal.Heartdiseaseandstrokestatistics-2007update:areportfromtheAmericanHeartAssociationStatisticsCommitteeandStrokeStatisticsSubcommittee[J].Circulation,2007,115(5):e69 -e171.
[4] 贾建平.神经病学[M].北京:人民卫生出版社,2013: 130.
[5]VenketasubramanianN,ChanBP,ChangHM,etal.Brainattack:needingresuscitation[J].SingaporeMedJ,2011,52(8):620 -630.
[6]GuoMF,YuJZ,MaCG.Mechanismsrelatedtoneuroninjuryanddeathincerebralhypoxicischaemia[J].FoliaNeuropathol,2011,49(2): 78 -87.
[7]DziedzicT.Systemicinflammationasatherapeutictargetinacuteischemicstroke[J].ExpertRevNeurother,2015,15(5):523 -531.
[8]ZaleskaMM,MercadoML,ChavezJ,etal.Thedevelopmentofstroketherapeutics:promisingmechanismsandtranslationalchallenges[J].Neuropharmacology,2009,56 (2):329-341.
[9]EkdahlCT,KokaiaZ,LindvalO.Braininflammationandadultneurogenesis:thedualroleofmicroglia[J].Neuroscience,2009,158(3):1021-1029.
[10]PeiJ,YouX,FuQ.Inflammationinthepathogenesisofischemicstroke[J].FrontBiosci(LandmarkEd),2015(20):772-783.
[11] 李惠. 髓过氧化物酶及其多态性与冠状动脉疾病的研究进展[J]. 中国心血管病研究杂志,2007,5(1):70-72.
[12] 吕洋,沈维高,刘国辉.脑缺血再灌注损伤中IL-1β的作用及机制[J].北京大学学报(自然科学版),2004,5(6):524 -528.
[13] 艾鑫,刘翠.脑血疏口服液对急性脑梗死大鼠的神经保护作用[J].中西医结合心脑血管病杂志,2015,13(11):1278-1280.
R743 R285.5
A
10.3969/j.issn.1672-1349.2017.23.012
1672-1349(2017)23-2986-03
陕西省人民医院(西安 710061),E-maildocjiangfeng@163.com
信息:蒋锋,王莉,山媛,等.脑血疏口服液对脑缺血再灌注损伤大鼠的神经保护作用及机制J.中西医结合心脑血管病杂志,2017,15(23):2986-2988.
2016-09-15)
(本文编辑 郭怀印)

