ELISA法快速检测食品中重金属含量的研究进展
苟珍琼,兰洋,郑韵,刘卫,董全*
1(西南大学 食品科学学院,重庆,400715) 2(重庆工商大学 环境与资源学院,重庆,400067)
ELISA法快速检测食品中重金属含量的研究进展
苟珍琼1,2,兰洋1,郑韵1,刘卫1,董全1*
1(西南大学 食品科学学院,重庆,400715) 2(重庆工商大学 环境与资源学院,重庆,400067)
重金属超标会对人体健康产生极大危害,世界各国日渐重视食品中重金属的限量标准,同时对重金属分析检测方法的研究也越来越多。传统的重金属检测方法比较成熟,灵敏度高,但操作繁琐、费用高昂、依赖大型仪器设备以及需要专业技术人员操作等。酶联免疫(enzyme-linked immune sorbent assay,ELISA)法是一种特异性强、灵敏度高的检测方法,并能用于现场快速检测,故得以迅速发展。ELISA法检测重金属主要包括四大关键步骤:样品前处理、人工抗原的合成、特异性抗体的制备、ELISA方法的选择。该文主要综述了ELISA法在检测重金属方面的最新研究成果,并对该检测技术的研究方向进行了展望。
酶联免疫;样品前处理;人工抗原;抗体;间接竞争法
比重大于4.5的金属被称为重金属,如铬(Cr)、铅(Pb)、镉(Cd)、砷(As)、汞(Hg)、铜(Cu)等,它们往往在动物和植物体内不断积聚,再经由食物链富集,最后进入人体并在人体内与蛋白质及酶等发生强烈的相互作用,使它们失去活性,从而危害人体健康[1-2]。我国食品中重金属超标问题也时有发生,杨丽萍[3]等发现,山东省境内集市肉兔肌肉组织的铅含量为0.12 mg/kg,超过我国限量标准(0.1 mg/kg);高彭[4]等连续7年对北京市顺义区的猪肾的重金属镉残留进行监测,结果发现猪肾中镉含量明显高于肝脏。此外,水产品、海产品、水果、蔬菜以及粮食等均存在重金属超标的现象[5-6]。目前,重金属检测已成为食品安全检测的一项重要内容。
传统的重金属检测方法有很多,例如原子吸收分光光度法(AAS)、高效液相色谱法(HPLC)、原子荧光分光光度法(AFS)、电感藕合等离子体法(ICP)等[7-8]。电感藕合等离子体法又分为电感藕合等离子质谱法(ICP-MS)和电感藕合等离子原子发射光谱法(ICP-AES)。经过多年的发展,传统的重金属检测方法已日趋成熟,例如HPLC灵敏度高、操作简便、重复性好且可同时测定多种元素。但该方法检测费用高,流动相消耗大且多数有毒,并且可供使用的结合剂有限,给该方法带来了很多的局限性。这些传统的重金属检测方法均有各自的优点,也存在一些难以解决的问题:如有的方法仪器设备昂贵、专业技术要求高、难以应用于现场实时快速检测等[9-13]。
ELISA(enzyme-linked immune sorbent assay)广泛用于食品、医学检测,近年来许多学者研究用于重金属的检测,自从酶联免疫法(ELISA)首次被ENGVALL等[14]建立以来,与传统检测技术相比,有操作简便、特异性强、灵敏度高、适用于现场检测等优点,因而 ELISA法在重金属的检测中得以快速发展。本文综述了ELISA法在检测重金属方面的最新研究成果,主要包含以下4个方面的内容:样品前处理、人工抗原的合成、特异性抗体的制备以及ELISA方法的选择,并对该检测技术的研究方向进行了展望。
1 样品前处理
随着酶联免疫检测技术在重金属检测上的快速发展,ELISA试剂盒的应用解决了传统检测技术的一些弊端,现已成为了一种快速、简便和可靠的检测手段。ELISA检测方法只能在液相环境中进行,即只能检测离子态重金属,而金属往往以结合态存在于样品中,因此需要通过前处理使样品中待测的金属离子释放到液相检测环境中,同时还可除去干扰因子避免对后续检测结果的影响。故建立一套快速、精确、环保且适用于ELISA法检测重金属含量的样品前处理的方法具有重要的意义。目前适用于ELISA法快速检测食品中重金属含量的样品前处理方法主要有:湿式消化法、微波消解法、浸提法等[15-17]。
1.1 湿式消化法
湿式消化法是通过氧化性强酸如硝酸(HNO3)、高氯酸(HClO4)、硫酸(H2SO4)等,结合加热来处理样品使样品中的金属离子释放出来。此方法对大多数样品适用,但存在中间环节较多、耗时长的缺陷,样品消化时会采用大量具有腐蚀性的强酸且有大量有害气体释放,对人体有害且污染环境。江丽芳[18]采用HNO3和HClO4预处理牛奶样品,并进一步探究了消化液(HNO3-HClO4)的最优处理条件,实验发现HNO3-HClO4(体积比5∶1)消化液的空白吸光度相对较低,故HNO3-HClO4最优比例是5∶1(体积比)。
1.2 微波消解法
微波消解法是利用微波的激活以及穿透能力,同时采用密封装置(多是消解罐),并加入适量的酸,例如HNO3、H2O2等,从而让金属离子释放出来。在本法中酸的选择是特别重要的,胡进[12]等比较了HNO3、H2SO4、HCl等几种酸对海带中金属离子的消解效果,发现使用HNO3的消解效果较好,HCl会引入氯离子,H2SO4会引入硫离子,均会与其他离子结合形成多原子离子从而影响测定,因此最终选用HNO3,并用智能加热器120 ℃预消解10 min,再采用四步消解程序进行微波消解海带样品。为了防止消解罐压力超过限制,同时又要确保样品消解完全,需要在微波消解前进行预消解,除了前面提到的海带,由于不同基质的样品需要预消解,当样品量较大时,也同样需要预消解。倪张林[19]等在对油茶籽油进行微波消解时,由于加入样品量比较大,故先将样品在电热板上180 ℃预消解约2 h。微波消解法的消解程序根据食品基质的差异和仪器的不同采用不同的压力、温度和时间条件,具体方式见表1。

表1 样品前处理-微波消解法Table1 Sample pretreatment-microwave digestion methods
注:- .该文献中未报道;消解程序中的时间均指保持时间。
丁仲仲[20]等比较了湿式消解和微波消解2种方法在处理坛紫菜中重金属的优劣,结果发现与湿法消解法相比,微波消解法操作简便、节约试剂、消解效果好等优点。因此该方法是传统处理重金属含量检测的最常用的前处理方法,但其仍然需要由专业人员在实验室条件下进行操作,并且会使用一些腐蚀性强的浓酸(如浓HNO3)。
1.3 酸浸提法
酸浸提法通常是采用HCl、HNO3、H2SO4等稀酸直接浸提所需组分,在酸性条件下,使得金属元素以离子态析出。程水清[23]等采用稀HCl和国标法(HNO3-HClO4消解)对蔬菜样品中重金属进行提取并测定其含量,研究发现,采用稀HCl消解所得的标准偏差明显低于国标法(HNO3-HClO4消解),再加上国标法浸提时间长且易污染,而稀酸浸提法高效、快速且操作简便,说明稀酸浸提法的效果不仅可以达到要求,而且还优于国标法。此外,汪慧[24]等采用3种不同的稀酸(HCl、H2SO4、HNO3)对易受重金属污染的水产品(近江牡蛎、翡翠贻贝和基围虾)浸提,与微波消解样品前处理的结果进行比较,发现稀HNO3的浸提效果比稀HCl和稀H2SO4的好,并进一步采用ELISA法对浸提液中镉进行检测,发现检测结果与传统方法ICP-AES检测结果的线性相关性良好(98%),表明对于检测水产品中重金属残留时,稀酸浸提法完全可以达到ELISA法检测重金属的要求。
近年来,稀酸浸提法因其具有高效准确、操作简单、费用低廉以及环境友好等优点而在多种食品上均有应用[23-25],但仍有一些重金属用稀酸浸提的效果差,只能进行初步筛选;随着研究的不断深入和技术的不断进步,相信稀酸浸提法会逐渐成为ELISA法检测重金属样品前处理的理想技术。
2 人工抗原的合成
由于重金属离子自身为小分子物质,无免疫原性,不能直接免疫动物产生特异性抗体,再加上金属离子带有电荷,会与动物体内的生物分子反应从而导致动物中毒。重金属ELISA检测技术以重金属螯合物特异性抗体为基础,然而特异性抗体的制备关键是要先合成优质的重金属人工抗原。重金属人工抗原的合成主要分为以下两步:(1)制备重金属螯合物,多是选择与目标金属具有高度亲和性的螯合物制备重金属螯合物;(2)偶联载体蛋白,将第一步制备的重金属螯合物与合适的载体蛋白偶联,得到重金属-螯合物-载体蛋白复合物即是免疫原。
不同离子的人工抗原所用的螯合剂、载体蛋白以及评定方法大体相似,但合成过程中选择适宜的载体蛋白是很重要的,不同的载体蛋白将导致ELISA试剂盒不同的灵敏性。黄佳俊[26]等选用异硫氰酸苄基乙二胺四乙酸(ITCBE)作为螯合物,并采用了2种载体蛋白钥孔戚血蓝素(KLH)和牛血清白蛋白(BSA),成功制备Hg2+抗原Hg-ITCBE-KLH、Hg-ITCBE-BSA,发现Hg-ITCBE-KLH(34.75%)的E-氨基的替换程度比Hg-ITCBE-BSA(40.61%)的低;这是由于KLH分子质量较大且结构比BSA复杂,由于空间阻碍有些E-氨基无法与螯合剂反应,导致KLH的E-氨基的替换程度比BSA低,类似的情况也在Pb2+的人工抗原中发现[27]。同样的金属离子(Hg2+)以及载体蛋白BSA,选用不同的金属螯合物获得的抗原也不同,邢海波[28]等采用谷胱甘肽(GSH)金属螯合剂,与BSA进行偶联,获得的抗原Hg-GSH-BSA中E-氨基的替换程度为59.70%,相对于黄佳俊等采用ITCBE制备的Hg-ITCBE-BSA(40.61%),提高了将近20%。
目前常见双功能螯合剂有GSH、乙二胺四乙酸(EDTA)、ITCBE、二乙烯三胺五乙酸(DTPA)等,常见的载体蛋白有KLH、BSA、卵清蛋白(OVA),常见的评定方法有二喹啉甲酸(BCA)法、SDS-PAGE电泳、三硝基苯磺酸法(TNBS)、考马斯亮蓝(Bradford)法石墨炉原子吸收光谱法(GFAAS)、紫外光谱扫描(UV)等方法,较多地评价指标是通过偶联率(比)以及氨基的替换程度(见表2)。

表2 人工抗原的合成方法Table 2 Synthesis of artificial antigen
注:偶联程度中%代表氨基的替换率,比例代表蛋白与免疫原中金属的偶联比。
3 特异性抗体的制备
ELISA法的检测效果依赖于高效价和高特异性的抗体,抗体的制备又分为单克隆抗体和多克隆抗体的制备。REARDAN等[32]早在1985年首次采用金属-螯合剂抗原制备出了单克隆抗体,为重金属的检测提供了一种重金属免疫学检测的新思路。易翠平[33]等以免疫抗原Cd-IEDTA-BSA注射小鼠,制备了Cd2+的单克隆抗体,效价达1∶51 200,亲和常数4.55×108mol/L,特异性实验表明特异性良好。方淑兵[34]等通过免疫新西兰大白兔获得Hg2+特异性抗体,除了与铜、镍的交叉反应率分别为13.5%、10.8%,并无与其他金属离子有明显的交叉反应,证明抗体具有不错的特异性。张鹏[35]通过小鼠腹腔注射,成功制备出亲和常数均在108mol/L以上的铅单克隆抗体,其血清效价均达1∶16 000。翟一凡[36]等采用合成的完全抗原(Pb-DTPA-OVA)免疫小鼠,制备出铅的多克隆抗体,效价高达1∶400 000,大幅度提高了抗体的效价;特异性实验表明,除了与Fe3+的交叉反应率为5%以外,与其他重金属离子的交叉反应均低于1%。
4 ELISA法检测重金属常用方法
4.1 间接竞争法
间接竞争法的原理是待检测样品中的竞争物和重金属完全抗原共同竞争结合单克隆抗体相同表位,通过酶标二抗孵育,底物显色后可通过标准曲线得到待检测样品中的重金属离子的浓度。该方法是最早使用的免疫学检测方法,该方法比较成熟和完善,也是目前应用最多的方法。随着研究的深入,ELISA 法检测重金属样品灵敏度已经完全可以达到传统的技术的水平,郭常伟[37]等制备重金属铜离子单克隆抗体,并建立间接竞争ELISA 检测方法,ELISA检测结果发现单抗对Hg2+、Zn2+和Co2+的交叉反应率分别为1.46、8.75、17.5%,并无与其他金属离子有明显的交叉反应,IC50值为12.5 ng/mL,最低检测限为2.0 ng/mL。并与ICP-AES 检测结果进行比较,竞争ELISA法与ICP-AES法的总符合率超过94%,表明该法与ICP-AES法的检测结果一致性较好。
4.2 直接竞争法
直接竞争法的原理与间接竞争法类似,该方法相对于间接竞争法来说,其无需加二抗,一方面降低了实验成本、简化了操作步骤;另一方面其检测灵敏度高、特异性强。但该法较间接竞争法起步相对较晚,应用没有间接竞争法普遍。LIU[38]等采用直接竞争ELISA法检测农产品中Cd2+,IC50值为2.30 μg/L,检测限为0.2 μg/L,并表现出高特异性,并且结果与GFAAS法的检测结果的符合率高达99%,加之其简便性和经济性,完全适用于农产品中重金属的检测。LIU[39]等采用的直接竞争法检测引用水和人体血清中的Cu2+,检出限可以达到0.032 μg/mL,灵敏度IC50值为0.89 μg/mL,检测范围为0.25~8.13 μg/mL,与其他金属的交叉反应率均小于1%(除Hg2+7.19%外),证明其专一性好,且与AAS法的检测结果的符合率高达94%。
传统重金属检测方法比较成熟,灵敏度高,但需要专业技术人员以及仪器设备较大、较笨重且成本高[40],随着研究的深入,ELISA法检测重金属样品也日臻成熟,灵敏度多已达到ng至pg级水平,加之ELISA法检测重金属的方便性,该方法在很多方面已得到了广泛应用,常见的重金属ELISA法检测对比(见表3)。
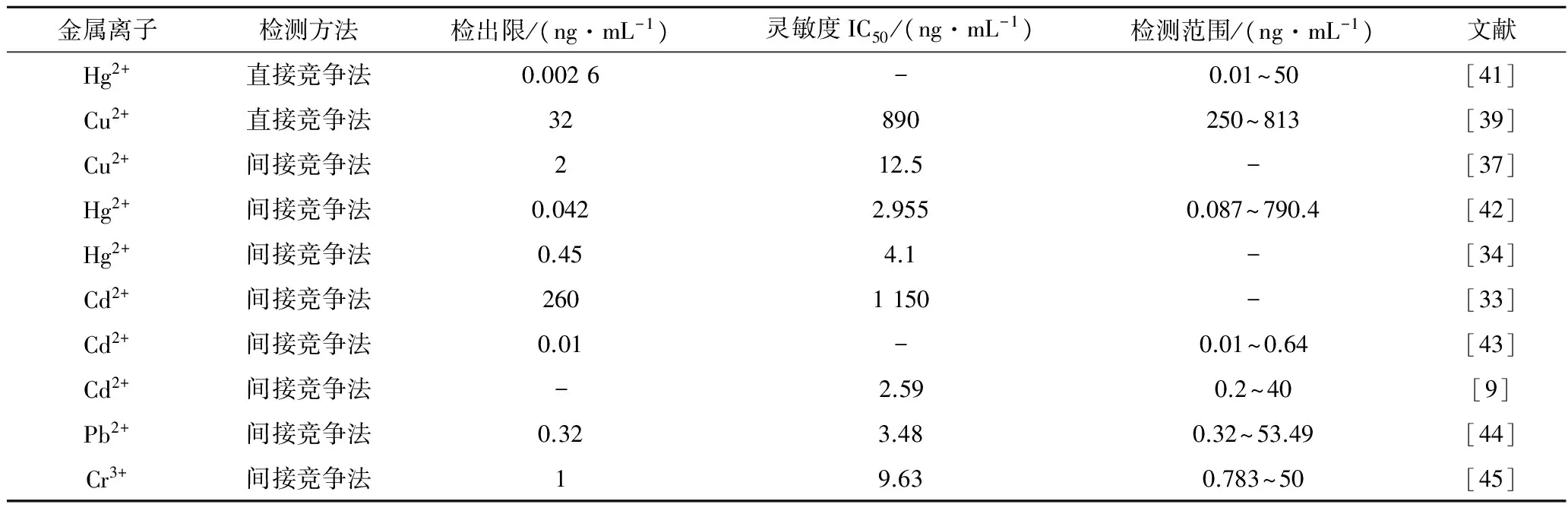
表3 常见重金属含量的ELISA法检测Table 3 ELISA methods for detection of heavy metals
注:“-”表示该文献中未报道。
5 结论与展望
ELISA法检测重金属存在检测过程操作简便、特异性强、灵敏度高且适用于现场检测等优点,是一种具有特异性强和灵敏度高的检测方法。随着研究的深入,ELISA 法检测重金属样品已被广泛应用,但ELISA法在检测重金属含量时也存在一些不足,以后的研究可以考虑从以下几方面深入:(1)进一步研究稀酸浸提法,保持其方便环保的同时,提高其对重金属离子的浸提效果,开发出一套适用于ELISA法检测重金属样品前处理的方法;(2)优化人工抗原的合成方法。目前,重金属人工抗原的合成时间比较长,步骤也较复杂;(3)针对不同金属离子载体蛋白选择作进一步研究。由于载体蛋白的结构存在差异,因此选择不同的载体蛋白将导致ELISA试剂盒不同的灵敏性;(4)进一步提高特异性抗体的专一性。虽然特异性抗体与绝大多数金属离子的交叉反应率低,但往往会与某一种甚至某几种金属离子存在较大的交叉反应。
[1] 王增焕,林钦,王许诺,等.华南沿海牡蛎重金属含量特征及其风险评估[J].水产学报,2011,35(2):291-297.
[2] 王增焕,贾晓平,林钦,等.广东沿海近江牡蛎重金属含量特征及其风险分析[J].农业环境科学学报,2012,31(3):607-612.
[3] 杨丽萍,姜文学,高淑霞,等.山东省肉兔组织中农药、重金属残留现状调查[J].山东农业科学,2010(11):101-102.
[4] 高彭,梁和平,陈东宛,等.2004-2010年北京市顺义区猪肾中镉污染水平监测[J].职业与健康,2011,27(6):596,721.
[5] 邓小鹏,彭克俭,陈亚华,等.4种茄科植物对矿区污染土壤重金属的吸收和富集[J].环境污染与防治,2011,33(1):46-51.
[6] 于瑞莲,徐加庆,胡恭任,等.施用污泥对小白菜生长及其迁转重金属的影响[J].生态学杂志,2011,30(1):82-86.
[7] STANISIC S M,IGNJATOVIC L M,MANOJLOVIC D D,et al.The comparison of sample extraction procedures for the determination of cations in soil by IC and ICP-AES[J].Central European Journal of Chemistry,2011,9(3):481-491.
[8] GEANA E I,IORDACHE A M,VOICA C,et al.Comparison of three digestion methods for heavy metals determination in soils and sediments materials by ICP-MS technique[J].Asian Journal of Chemistry,2011,23(12):5213-5216.
[9] GAO W,NAN T,TAN G,et al.Development of a sensitive monoclonal antibody-based enzyme-linked immunosorbent assay for the analysis of cadmium ions in water,soil and rape samples[J].Food and Agricultural Immunology,2012,23(1):27-39.
[10] ABBASPOUR A,REFAHI M,KHALAFI-NEZHAD A,et al.Carbon composite-PVC based membrane coated platinum electrode for chromium determination[J].Journal of Hazardous Materials,2010,184(1-3):20-25.
[11] 解楠,葛宇,徐红斌,等.微波消解-电感耦合等离子体质谱测定香辛料中铅砷镉铬铜锰锌和镍[J].食品科学,2011,32(2):195-197.
[12] 胡进,陆锡锋,张成,等.微波消解-电感耦合等离子体质谱测定海带中铅、镉、铬、铜和锌[J].食品科学,2012,33 (20):286-288.
[13] 解楠,曹程明,徐红斌,等.微波消解-电感耦合等离子体质谱测定水产品中铅、砷、镉、铬、镍含量[J].食品工业科技,2011,32(7):426-428.
[14] ENGVALL E,PERLMANN P.Enzyme-linked immunosorbent assay (ELISA) quantitative assay of immunoglobuling[J].Immunochemistry,1971,8(9):871-878.
[15] SASAKI K,YONGVONGSOONTORN N,TAWARADA K,et al.Cadmium purification and quantification using immunochromatography[J].Journal of Agricultural and Food Chemistry,2009,57(11):4 514-4 519.
[16] 刘艳梅,钟辉,向军俭.重金属免疫学快速检测技术研究进展[J].食品科学,2014,35(17):306-311.
[17] 杜鉴,薛毅.食品添加剂中重金属元素前处理与检测方法研究进展[J].食品工业科技,2015,36(4):397-399.
[18] 江丽芳.湿式消化法测定牛奶中钙锌含量最优条件探讨[J].食品工业科技,2009,30(7):314-316.
[19] 倪张林,汤富彬,屈明华,等.微波消解-电感耦合等离子体质谱法测定油茶籽油中的5种重金属元素[J].食品科学,2013,34(4):165-167.
[20] 丁仲仲,娄永江,赵一霖.湿法消化与微波消解-ICP-AES法测定坛紫菜中重金属[J].宁波大学学报:理工版,2014,27(3):24-27.
[21] 丛俏,蔡艳荣.微波消解-ICP-AES法测定蔬菜中重金属含量[J].食品科学,2010,31(20):290-292.
[22] 徐小艳,孙远明,苏文焯,等.微波消解-石墨炉原子吸收光谱法连续测定水果和蔬菜中铅铬镉[J].食品科学,2009,30(10):206-208.
[23] 程水清,周贯勇.蔬菜中重金属元素测定的前处理方法[J].安徽农业科学,2006,34(16):3 889-3 890.
[24] 汪慧,江涛,唐勇,等.稀酸浸提水产品中重金属铜、铅和镉[J].食品科学,2014,35(12):88-92.
[25] 李支薇.用于碳水化合物类农产品重金属ELISA检测的样品前处理研究[D].广州:暨南大学,2012.
[26] 黄佳俊,王菊芳,刘功良,等.重金属汞螯合物人工抗原的合成与鉴定[J].中国生物工程杂志,2008,28(2):71-75.
[27] 刘功良,王菊芳,李志勇,等.铅螯合物人工抗原的制备与鉴定[J].生物技术通报,2009,11:158-162.
[28] 邢海波,奚涛,周培.重金属汞人工抗原的合成与鉴定[J].科技通报,2010,26(6):908-912.
[29] 蒋芸,严文静,刘丽强,等.重金属汞螯合物人工抗原的合成与鉴定[J].食品科学,2011,32(7):244-246.
[30] 韩盈盈,李小兵,刘国文,等.重金属镉离子人工抗原的合成与鉴定[J].吉林农业大学学报,2013,35(2):188-191.
[31] 张云显,刘发央,杨慧,等.重金属镉螯合物人工抗原的合成与鉴定[J].安徽农业科学,2009,37(14):6 319-6 321.
[32] REARDAN D T,MEARES C F,GOODWIN D A,et al.Antibodies against metal-chelates[J].Nature,1985,316(6025):265-268.
[33] 易翠平,苏芳,陈永发,等.重金属镉单克隆抗体的制备与鉴定[J].食品科学,2013,34(21):248-253.
[34] 方淑兵,王俊平,王硕,等.重金属汞酶联免疫检测方法的建立[J].食品工业科技,2012,33(16):86-88,91.
[35] 张鹏.重金属铅单克隆抗体的制备及ELISA检测方法的建立[D].雅安:四川农业大学,2010.
[36] 翟一凡,向军俭,唐勇,等.重金属铅多克隆抗体的制备及鉴定[J].食品科学,2010,31(13):180-183.
[37] 郭常伟,唐勇,向军俭,等.重金属铜离子单克隆抗体的制备及其间接竞争ELISA检测方法的建立[J].中国生物制品学杂志,2011,24(6):720-723.
[38] LIU G,WANG J,LI Z,et al.Development of direct competitive enzyme-linked immunosorbent assay for the determination cadmium residue in farm produce[J].Applied Biochemistry and Biotechnology,2009,159(3):708-717.
[39] LIU F,LOU Y,SHI X,et al.Preparation and characterization of monoclonal antibody specific for copper-chelate complex[J].Journal of Immunological Methods,2013,387(1-2):228-236.
[40] 隋佳辰,代佳宇,王向辉,等.食品中重金属砷检测的研究进展[J].食品与发酵工业,2016,42(5):289-294.
[41] ZHANG J,SHI P W,YAN P P,et al.Quantum dots based electrochemiluminescent immunosensor for ultrasensitive and specific determination of mercury (II) ions using gold nanoparticles and a monoclonal antibody[J].Journal of the Electrochemical Society,2015,162(1):22-26.
[42] ZHANG Y,LI X,LIU G,et al.Development of ELISA for detection of mercury based on specific monoclonal antibodies against mercury-chelate[J].Biological Trace Element Research,2011,144(1-3):854-864.
[43] 郝亚明.重金属铅、镉单克隆抗体的制备及ELISA检测方法的建立[D].长春:吉林大学,2011.
[44] 杨依锦,王俊平,王津,等.重金属铅酶联免疫检测方法的研究[J].食品与机械,2012,28(3):80-83.
[45] 颜露,唐勇,向军俭,等.抗重金属Cr3+单克隆抗体的制备及其应用[J].细胞与分子免疫学杂志,2011,27(4):422-424.
ProgressinrapiddeterminationofheavymetalsinfoodsbyELISA
GOU Zhen-qiong1,2,LAN Yang1,ZHENG Yun1,LIU Wei1,DONG Quan1*
1 (College of Food Science,Southwest University,Chongqing 400715,China)2 (College of Environment and Resources,Chongqing Technology and Business University,Chongqing 400067,China)
Excessive heavy metals are harm to human health,many countries have set up standards of heavy metals in food,and more and more studies are carried out on analysis and detection of heavy metals.The traditional detection methods are more mature with high sensitivity.But the operations usually are tedious and high cost,they need large-scale equipment and skilled professionals.ELISA method has developed rapidly due to its excellent specificity and sensitivity,and can be used for rapid detection on site.ELISA detection of heavy metals includes four key steps:sample pretreatment,synthesis of artificial antigen,preparation of specific antibody,and the appropriate ELISA method selection.The recent progress of ELISA detection of heavy metals is briefly reviewed.Future development trends and prospects are discussed to provide a relevant reference for detecting of heavy metals in food.
enzyme-linked immune sorbent assay; sample pretreatment; artificial antigen; antibody; indirect competitive
10.13995/j.cnki.11-1802/ts.014120
硕士研究生(董全教授为通讯作者,E-mail:dongquan@swu.edu.cn)。
重庆市“121”科技支撑示范工程(cstc2012jcfc-jfzh0033)
2017-02-22,改回日期:2017-06-02

