早产儿维生素D水平与肺部疾病的关系
周 勤 姜善雨 邱 婷 王 瑶 余仁强
南京医科大学附属无锡妇幼保健院1.新生儿科,2.儿童保健科,3.检验科(江苏无锡 214002)
早产儿维生素D水平与肺部疾病的关系
周 勤1姜善雨1邱 婷2王 瑶3余仁强1
南京医科大学附属无锡妇幼保健院1.新生儿科,2.儿童保健科,3.检验科(江苏无锡 214002)
目的 分析早产儿出生时血清25-羟维生素D[25(OH)D]水平与肺部疾病的关系。方法 选取2015年1月至2016年12月入住NICU的早产儿,收集其临床资料及血清25(OH)D检测结果;并根据平均血清25(OH)D水平将早产儿分为低维生素D组和高维生素D组,分析比较两组肺部疾病发生的差异。结果 共纳入早产儿115例,平均胎龄为(29.9±1.9)周,平均血清25(OH)D水平为(37.1±16.6)nmol/L。维生素D缺乏[25(OH)D<50 nmol/L]、不足[25(OH)D在50~74.9 nmol/L]和正常[25(OH)D≥75 nmol/L]的比率分别为71.3%、17.4%和11.3%。低维生素D组的持续气道正压通气、氧疗时间、新生儿呼吸窘迫综合征(RDS)和支气管肺发育不良(BPD)发生率以及住院天数均显著高于高维生素D组,差异有统计学意义(P均<0.05)。结论 早产儿低维生素D水平可能增加RDS、BPD的发生率,并延长住院时间。
25-羟维生素D; 新生儿呼吸窘迫综合征; 支气管肺发育不良; 早产儿
近年来,维生素D对胎儿及儿童骨骼外影响的研究越来越引起关注[1,2]。维生素D水平与生命早期肺发育、成熟及肺部疾病关系的研究是一个新兴的领域。妊娠期母体维生素D水平不足影响胎盘的发育与重量,增加早产风险,进而可能导致新生儿呼吸窘迫综合征(RDS)和支气管肺发育不良(BPD)发病率的增加[3-5]。此外,维生素D可能在胎盘形成以及细胞生长与分化中发挥重要作用,包括影响胎儿肺发育和肺成熟[6]。而新生儿期维生素D水平不足可能加重肺部疾病。由于妊娠期妇女普遍存在较高的维生素D缺乏发生率,且维生素D的胎盘转运主要发生在妊娠晚期,因而早产儿出生时更易发生维生素D缺乏[7-9]。本研究通过分析早产儿血清25-羟维生素D[25-hydroxyvitamin D,25(OH)D]水平与肺部疾病的关系,以期为早产儿肺部疾病的防治提供新思路。
1 对象和方法
1.1 研究对象
选取2015年1月—2016年12月入住南京医科大学附属无锡妇幼保健院新生儿重症监护室(NICU)符合入选标准的早产儿。入选标准:①出生胎龄<33周;②出生24小时内入院,并静脉采血行血生化检测;③获得监护人的知情同意;④病例资料完整。排除标准:①严重先天性畸形者;②出生严重疾病估计不能存活者;③入院首次肝、肾功能检测证实肝肾疾病或者新生儿筛查提示甲状腺功能减退者;④母亲所患疾病或所用药物可能影响维生素D水平者,如慢性肝肾疾病、甲状腺疾病、骨代谢疾病、孕期服用抗惊厥或抗癫痫等影响维生素D代谢的药物等。本研究通过医院伦理委员会的批准。
研究对象按出生24小时内血清25(OH)D水平分为高维生素D组和低维生素D组。高维生素D组:血清25(OH)D水平≥本组早产儿的平均水平;低维生素D组:血清25(OH)D水平<本组早产儿的平均水平。1.2 方法
1.2.1 临床资料收集 母亲的分娩方式、妊娠期并发症(包括妊娠期高血压、妊娠期糖尿病、宫内生长受限)及产前激素使用情况通过电子病例系统查阅产科病例获得。早产儿胎龄、出生体质量、性别、出生季节、Apgar评分从入住NICU时记录获得。早产儿入住NICU首次血气分析碱剩余值、新生儿转运生理稳定指数(transport risk index of physiologic stability,TRIPS)评分、住院期间治疗情况(包括喂养方式、静脉营养天数、口服维生素D天数、血管活性药物应用、肺表面活性物质应用、呼吸机治疗以及氧疗情况)、肺部并发症(包括湿肺、RDS、BPD、气胸、肺出血)以及临床转归(包括住院天数、出院体质量、院内病死率和上级或专科医院转诊数据)均在出院时由专人统一收集。
1.2.2 血清25(OH)D检测 所有研究对象均于入院后首次静脉采血时留取血标本,血标本在4℃下,以3 500 r/min,离心半径13.2 cm,离心10 min分离血清,进行25(OH)D水平检测。检测采用化学发光免疫分析法,所用仪器为LIAISON化学发光分析仪,血清25(OH)D试剂盒由美国DiaSorin公司提供。
1.2.3 血气分析 由桡动脉采血,采用GME Premier 3000及配套分析包完成。
1.2.4 维生素D水平的定义 维生素D缺乏为血清25 (OH)D<50.0 nmol/L,维生素D不足为血清25(OH)D水平在50.0~74.9 nmol/L,维生素D充足为血清25(OH)D≥75.0 nmol/L[10]。
1.2.5 新生儿RDS定义 指呼吸室内空气时患儿血氧分压(PaO2)<50 mmHg(6.6 kPa),存在中央性紫绀,需吸氧才能维持PaO2>50 mmHg(6.6 kPa),并伴有典型胸部X线表现[11]。
1.2.6 肺表面活性物质治疗RDS指征 <26周早产儿吸入氧体积分数(FiO2)>0.3;或>26周早产儿FiO2>0.4[11]。
1.2.7 BPD定义 指出生后28天仍需吸氧[12]。
1.3 统计学分析
应用SPSS 19.0进行数据分析。符合正态分布的计量资料以均数±标准差表示,两组间比较采用两独立样本t检验;非正态分布计量资料以中位数(四分位数间距)表示,组间比较采用秩和检验。计数资料以百分比或率表示,组间比较采用χ2或校正χ2检验。以P<0.05为差异有统计学意义。
2 结果
2.1 一般情况及血清25(OH)D水平
本研究共纳入早产儿115例,平均胎龄(29.9±1.9)周(24+1~32+6周),其中男79例、女36例,男女之比约为2∶1。平均血清25(OH)D水平为(37.1±16.6)nmol/L(14.8~95.5 nmol/L)。维生素D缺乏、不足和正常比率分别为71.3%(82/115)、17.4%(20/115)和11.3%(13/115)。82例维生素D缺乏早产儿中,男55例、女27例,男女之比约为2∶1。
低维生素D组50例,平均胎龄(30.1±1.8)周(24+1~32+6周),平均出生体质量(1 523±364)g(700~2 320 g),血清25(OH)D平均水平为(27.5±5.6)nmol/L(14.8~36.8 nmol/L);高维生素D组65例,平均胎龄(29.7±1.9)周(24+1~32+6周),平均出生体质量(1 484±408)g(640~2 370g),血清25(OH)D平均水平为(27.5±5.6)nmol/L(37.2~95.5 nmol/L)。
2.2 两组母婴相关因素比较
低维生素D组与高维生素D组间,母亲剖宫产率、妊娠期高血压、妊娠期糖尿病、宫内生长受限和产前激素使用率,以及早产儿的胎龄、出生体质量、性别、出生季节、5分钟Apgar评分、碱剩余值、TRIPS危重评分、母乳喂养率、静脉营养天数及早产儿补充维生素D天数的差异均无统计学意义(P>0.05)。见表1。
2.3 两组间呼吸支持治疗比较
与高维生素D组相比,低维生素D组接受肺表面活性物质(PS)治疗率高,持续气道正压通气(CPAP)时间以及氧疗时间增多,血管活性药物使用率降低,差异均有统计学意义(P<0.05)。两组间呼吸支持使用率、使用呼吸机时间、呼吸机机械通气率、高频呼吸机治疗率、常频呼吸机治疗率、CPAP使用率、氧疗率差异均无统计学意义(P>0.05)。见表2。
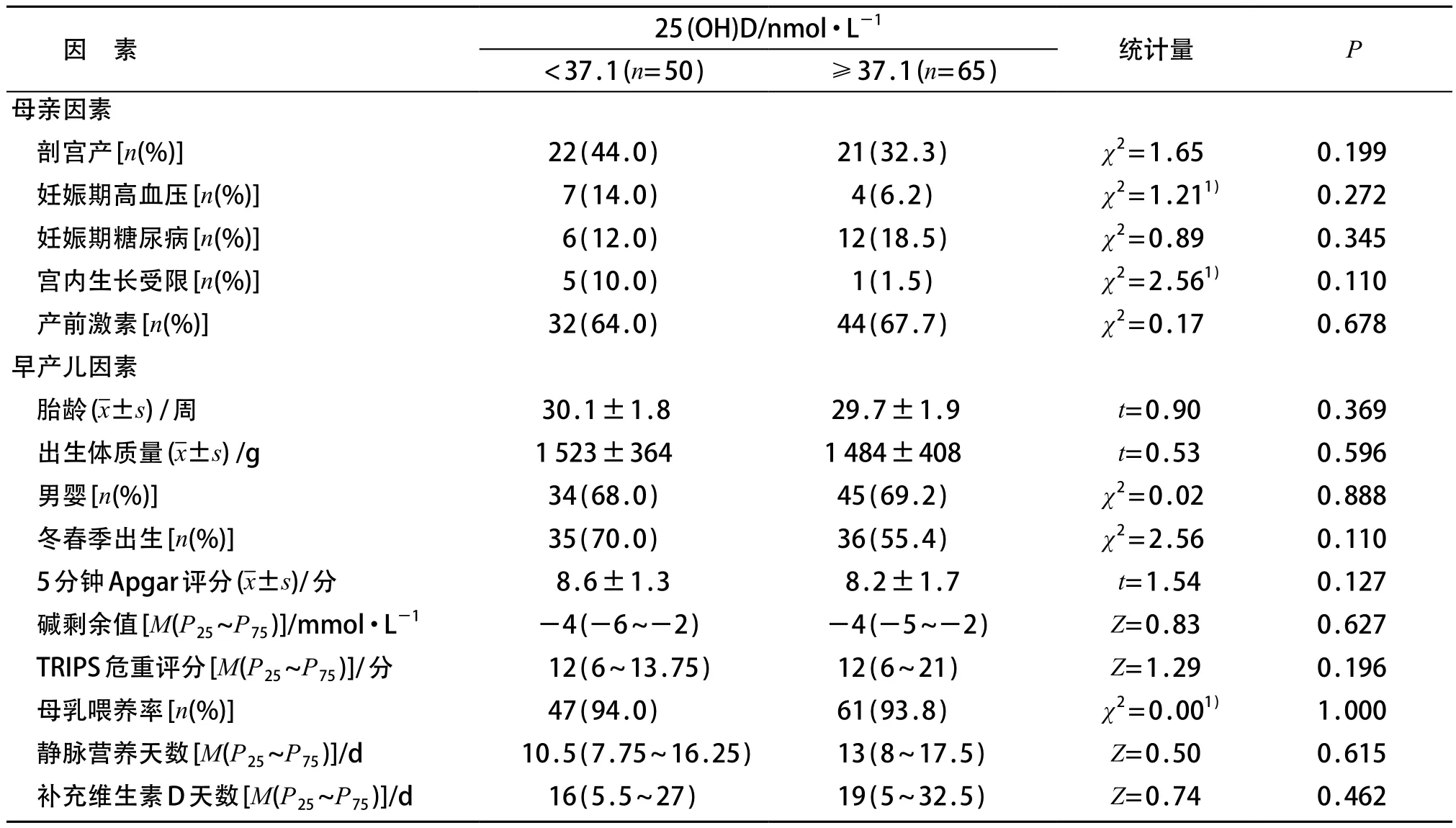
表1 两组间母婴相关因素比较
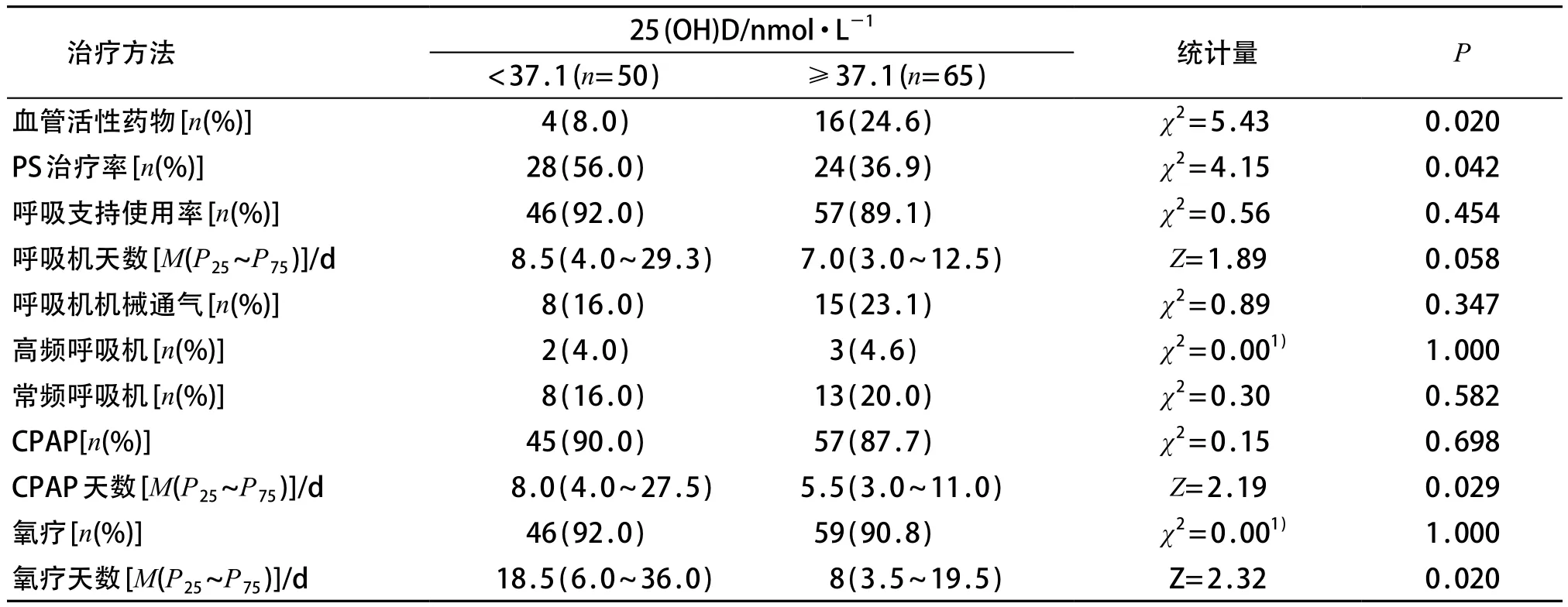
表2 两组间呼吸支持治疗比较
2.4 两组间肺部并发症发生率比较
低维生素D组RDS、BPD的发生率显著高于高维生素D组,差异均具有统计学意义(P<0.05)。两组间湿肺、气胸、肺出血的发生率差异均无统计学意义(P>0.05)。见表3。
2.5 两组间临床转归比较
低维生素D组住院天数显著长于高维生素D组,差异有统计学意义(P<0.05)。两组间出院体质量、院内死亡率和转诊率差异均无统计学意义(P>0.05)。见表4。

表3 两组间肺部并发症发生率比较[n(%)]

表4 两组间临床转归比较
低维生素D组死亡1例,为胎龄27+2周极早早产儿,家属放弃治疗后院内死亡;高维生素D组死亡2例,为胎龄24+1周极早早产儿、双胎儿,因晚发型败血症死亡。低维生素D组转诊1例,为巨大血管瘤。高维生素D组转诊8例,分别为早产儿视网膜病变(2区Ⅱ期,plus+)2例、新生儿坏死性小肠结肠炎(bell Ⅱ期)2例、颅内出血(Ⅲ度)1例、消化道穿孔1例、因家属意愿转诊2例。
3 讨论
目前,维生素D缺乏已成为全球性的公共卫生问题。在美国和印度,早产儿维生素D缺乏[25(OH)D<50 nmol/L]的发生率分别为64%和83%[13,14]。本研究显示,无锡地区早产儿维生素D缺乏的发生率为71.3%,略高于美国、低于印度,考虑与纳入研究早产儿胎龄、日照时间及饮食习惯等有关。
近年来,维生素D对呼吸系统影响的研究成为新热点。支气管上皮细胞可将循环血维生素D的前体25(OH)D3转化成局部活性维生素D3[1,25(OH)D3],活性维生素D3可减少炎症细胞因子和趋化因子分泌,增加抗菌肽合成,促进自噬、杀伤中性粒细胞以及抑制气道平滑肌增殖[15-17]。因此,学者开始研究分析维生素D水平与呼吸系统疾病如呼吸道感染、喘息、支气管哮喘等的相关性[18,19]。本研究发现,低维生素D组与高维生素D组间母亲剖宫产率、妊娠期高血压、妊娠期糖尿病、宫内生长受限和产前激素使用率,以及早产儿的胎龄、出生体质量、性别、出生季节、5分钟Apgar评分、碱剩余值、TRIPS危重评分、母乳喂养率、静脉营养时间及早产儿补充维生素D时间的差异均无统计学意义,提示两组间具有良好的可比性。
本研究低维生素D组接受PS治疗率、持续气道正压通气时间以及氧疗时间显著高于高维生素D组,考虑维生素D不足影响肺成熟及与PS合成与分泌有关。既往研究显示,活性维生素D3在胎儿肺成熟中发挥重要作用。活性维生素D3不仅能结合在Ⅱ型肺泡上皮细胞表面的特异性结合位点,促进Ⅱ型肺泡上皮细胞成熟,增加PS的合成与分泌,而且在肺生长过程中上皮-间质细胞相互作用中发挥重要作用[6,15]。通常认为,机体肺功能与体型大小密切相关,维生素D缺乏通过影响体型增长间接影响肺功能。事实上,维生素D缺乏直接影响肺功能和肺结构。在维生素D缺乏的小鼠模型实验结果显示,维生素D缺乏不影响体型增长,但降低肺活量及改变肺组织结构[20]。
既往研究显示,维生素D缺乏增加湿肺、RDS和BPD的发病率[4,5,21]。本研究显示,低维生素D组BPD发病率显著高于高维生素D组,提示低维生素D水平增加BPD的发病率。维生素D参与肺发育成熟。活性维生素D3与维生素D受体结合后被转运到细胞核与维生素D反应元件结合,调节维生素D靶基因的表达[22]。维生素D信号通路基因表达在肺发育的假腺期和囊状期上调,而假腺期和囊状期分别为支气管树和远端气道发育期[23]。此外,维生素D缺乏使肺部炎症发生增加,而炎症是BPD发生发展的共同病理生理基础。综上,低维生素D水平可能通过影响肺结构、肺功能及增加肺部炎症导致BPD的发生。此外,低维生素D组RDS的发生率显著高于高维生素D组,提示低维生素D水平增加RDS的发病率,与其他研究结果一致[4,24],考虑与维生素D影响肺表面活性物质的合成、分泌有关[6,15]。本研究结果未显示维生素D水平对湿肺的发生率的影响,考虑可能与本研究样本量较小有关。此外,本研究结果显示,维生素D不影响气胸、肺出血的发生率,但气胸、肺出血发生率较低,可能存在统计偏倚。
本研究结果显示,低维生素D水平增加早产儿住院时间,可能与维生素D缺乏增加BPD发生率有关,与其他研究结果一致[5]。本研究中尽管低维生素D组住院时间较高维生素D组长,而两组患儿出院体质量无明显差异,可能与低维生素D增加BPD发生率,而BPD患儿接受利尿剂、限制液体量治疗影响体质量增长有关。在临床转归方面,维生素D缺乏并不增加早产儿死亡率,相反却似乎降低了因早产儿视网膜病变、新生儿坏死性小肠结肠炎、重度颅内出血等疾病向上级或专科医院转诊的概率,维生素D缺乏可能是上述疾病的保护性因素。有待今后综合分析早产儿出生时血清25(OH)D水平与临床预后的关系。
综上,早产儿存在较高的维生素D缺乏发生率,低维生素D水平增加CPAP和氧疗时间,增加RDS及BPD发生率,延长早产儿住院时间。维生素D缺乏是否影响湿肺、气胸、肺出血等呼吸系统并发症,以及早产儿视网膜病变、新生儿坏死性小肠结肠炎的发生率,在未来的研究中尚需进一步探讨。
[1] Principi N, Bianchini S, Baggi E, et al. Implications of maternal vitamin D deficiency for the fetus, the neonate and the young infant [J]. Eur J Nutr, 2013, 52(3)∶ 859-867.
[2] Christesen HT, Elvander C, Lamont RF, et al. The impact of vitamin D in pregnancy on extraskeletal health in children:a systematic review [J]. Acta Obstet Gynecol Scand, 2012,91(12): 1368-1380.
[3] Yates N, Crew RC, Wyrwoll CS. Vitamin D deficiency and impaired placental function: potential regulation by glucocorticoids? [J]. Reproduction, 2017, 153(5): R163-R171.
[4] Fettah ND, Zenciroğlu A, Dilli D, et al. Is higher 25-hydroxyvitamin D level preventive for respiratory distress syndrome in preterm infants? [J]. Am J Perinatol, 2015,32(3): 247-250.
[5] Çetinkaya M, Çekmez F, Erener-Ercan T, et al. Maternal/neonatal vitamin D deficiency: a risk factor for bronchopulmonary dysplasia in preterms? [J]. J Perinatol, 2015,35(10): 813-817.
[6] Lykkedegn S, Sorensen GL, Beck-Nielsen SS, et al. The impact of vitamin D on fetal and neonatal lung maturation. A systematic review [J]. Am J Physiol Lung Cell Mol Physiol,2015, 308(7): L587-L602.
[7] Zhao X, Fang R, Yu R, et al. Maternal vitamin D status in the late second trimester and the risk of severe preeclampsia in southeastern China [J]. Nutrients, 2017, 9(2). pii: E138.
[8] McCarthy RA, McKenna MJ, Oyefeso O, et al. Vitamin D nutritional status in preterm infants and response to supplementation [J]. Br J Nutr, 2013, 110(1): 156-163.
[9] 余仁强, 廖祥鹏, 刘雪婷, 等. 早产儿维生素D水平分析[J]. 临床儿科杂志, 2017, 35(4): 259-263.
[10] Holick MF, Binkley NC, Bischoff-Ferrari HA, et al. Evaluation, treatment, and prevention of vitamin D deficiency:an Endocrine Society clinical practice guideline [J]. J Clin Endocrinol Metab, 2011, 96(7): 1911-1930.
[11] Sweet DG, Carnielli V, Greisen G, et al. European consensus guidelines on the management of neonatal respiratory distress syndrome in preterm infants--2013 update [J]. Neonatology,2013, 103(4): 353-368.
[12] 常立文. 支气管肺发育不良 [M]//邵肖梅, 叶鸿瑁, 邱小汕. 实用新生儿学. 4版. 北京: 人民卫生出版社, 2011.
[13] Monangi N, Slaμghter JL, Dawodu A, et al. Vitamin D status of early preterm infants and the effects of vitamin D intake during hospital stay [J]. Arch Dis Child Fetal Neonatal Ed,2014, 99(2): F166-F168.
[14] Natarajan CK, Sankar MJ, Agarwal R, et al. Trial of daily vitamin D supplementation in preterm infants [J]. Pediatrics,2014, 133(3): e628-e634.
[15] Konstantinopoulou S, Tapia IE. Vitamin D and the lung [J].Paediatr Respir Rev, 2017, 24: 39-43.
[16] Foong RE, Bosco A, Jones AC, et al. The effects of in utero vitamin D deficiency on airway smooth muscle mass and lung function [J]. Am J Respir Cell Mol Biol, 2015, 53(5):664-675.
[17] Greiller CL, Martineau AR. Modulation of the immune response to respiratory viruses by vitamin D [J]. Nutrients,2015, 7(6): 4240-4270.
[18] Dinlen N, Zenciroglu A, Beken S, et al. Association of vitamin D deficiency with acute lower respiratory tract infections in newborns [J]. J Matern Fetal Neonatal Med,2016, 29(6): 928-932.
[19] Chawes BL, Bønnelykke K, Jensen PF, et al. Cord blood 25(OH)-vitamin D def i ciency and childhood asthma, allergy and eczema: the COPSAC2000 birth cohort study [J]. PLoS One, 2014, 9(6): e99856.
[20] Zosky GR, Berry LJ, Elliot JG, et al. Vitamin D def i ciency causes def i cits in lung function and alters lung structure [J].Am J Respir Crit Care Med, 2011, 183(10): 1336-1343.
[21] Konca C, Kahramaner Z, Bulbul M, et al. Association between serum 25-hydroxyvitamin D levels and TTN [J].Horm Res Paediatr, 2014, 81(6): 397-401.
[22] Norman AW. Minireview: vitamin D receptor: new assignments for an already busy receptor [J]. Endocrinology,2006, 147(12): 5542-5548.
[23] Kho AT, Bhattacharya S, Tantisira KG, et al. Transcriptomic analysis of human lung development [J]. Am J Respir Crit Care Med, 2010, 181(1): 54-63.
[24] Ataseven F, Aygün C, Okuyucu A, et al. Is vitamin D def i ciency a risk factor for respiratory distress syndrome? [J].Int J Vitam Nutr Res, 2013, 83(4): 232-237.
Relationship between vitamin D level and lung diseases in premature infants
ZHOU Qin1, JIANG Shanyu1, QIU Ting2,WANG Yao3, YU Renqiang1(1.Department of Neonatology, 2.Departmant of Child Healthcare, 3.Department of Laboratory, Wuxi Maternity and Child Health Hospital Aff i liated to Nanjing Medical University, Wuxi 214002, Jiangsu, China)
Objective To analyze the relationship between serum 25(OH)D level and lung diseases in premature infants.Methods The clinical data and the results of serum 25 (OH) D were collected in the preterm infants admitted to NICU from January 2015 to December 2016. According to the average level of serum 25 (OH) D, the premature infants were divided into low vitamin D group and high vitamin D group, and the differences of lung diseases between two groups were compared. Results A total of 115 premature infants were enrolled. The mean gestational age was (29.9±1.9) weeks, and the mean serum 25(OH)D level was (37.1±16.6)nmol/L. The rates of vitamin D deficiency [25(OH)D<50 nmol/L], vitamin D insufficient [25(OH)D 50-75 nmol/L] , and normal[25(OH)D≥75 nmol/L] were 71.3%, 17.4%, and 11.3%, respectively. The persistent positive airway pressure, oxygen therapy time, the incidences of neonatal respiratory distress syndrome (RDS) and bronchopulmonary dysplasia (BPD), and hospitalization days in the low vitamin D group were signif i cantly higher than those in the high vitamin D group (P all<0.05). Conclusions Preterm infants with low vitamin D levels may increase the incidences of RDS and BPD, and prolong the length of hospitalization.
25(OH)D; neonatal respiratory distress syndrome; bronchopulmonary dysplasia; premature infant
doi∶10.3969/j.issn.1000-3606.2017.12.010
江苏省临床医学科技专项(No.BL2014025);江苏省卫计委妇幼保健科研项目 (No.F201427);江苏省妇幼保健重点学科项目(No.FXK201213);无锡市“科教强卫工程”医学重点学科、医学青年人才项目(No.ZDXK003、QNRC039)
余仁强 电子信箱:yurenqiang553@163.com
2017-04-05)
蔡虹蔚)

