儿童遗传性果糖不耐受症1例临床和基因突变分析
叶晓琴 常国营 李 娟 丁 宇 李 牛 王 剑 王秀敏 沈亦平
1.安徽省蚌埠市第三人民医院(安徽蚌埠 233000);2.上海交通大学医学院附属上海儿童医学中心(上海 200127)
儿童遗传性果糖不耐受症1例临床和基因突变分析
叶晓琴1*常国营2*李 娟2丁 宇2李 牛2王 剑2王秀敏2沈亦平2
1.安徽省蚌埠市第三人民医院(安徽蚌埠 233000);2.上海交通大学医学院附属上海儿童医学中心(上海 200127)
目的 分析遗传性果糖不耐受症(HFI)的临床及基因突变特点。方法 回顾分析1例HFI患儿的临床特征以及患儿及其父母的基因检测结果。基因检测采用高通量测序方法,并以Sanger测序进行验证。结果 患儿,女,4岁3个月。表现为反复低血糖发作,明显生长落后。病情稳定时乳酸、尿微量蛋白稍高,甲状腺激素、皮质醇、糖化血红蛋白、胰岛素、C肽等无异常。脑电图示痫样活动。基因测序显示存在醛缩酶B基因(ALDOB)复合杂合突变,3号内含子发现剪切突变(c.325-1G>A),8号外显子移码突变(c. 865delC;p.L289fs*10);其父亲携带移码突变,母亲携带剪切突变。结论 通过高通量测序技术,可确诊由ALDOB突变致病的HFI。
靶向基因测序; 低血糖; 果糖不耐受; ALDOB基因; 基因突变
儿童低血糖(血糖<3.9 mmol/L)可由众多因素引发,除饥饿等生理因素外,包括1型糖尿病、2型糖尿病、新生儿糖尿病以及胰岛素水平升高等病理因素均可诱发低血糖的发生,但仍有部分低血糖的发生原因不明[1,2]。近年研究发现,基因缺陷是低血糖发生的重要原因之一。目前共有270余种单基因突变的报道(人类孟德尔遗传在线数据库http∶//www.omim.org/)。遗传性果糖不耐受症(hereditary fructose intolerance,HFI)是一种糖代谢途径酶缺陷诱发的以低血糖为主要症状的先天性遗传病,该病患者若不能有效避免低血糖反复发作可能会继发其他多器官系统异常,严重者可导致死亡。如何快速准确地进行病因诊断是临床关注的焦点。现将1例通过靶向基因测序诊断的HFI的临床诊疗过程及基因分析结果报告如下,以期提高临床医师对该疾病的认识。
1 临床资料
患儿,女,汉族,上海儿童医学中心初诊年龄为4岁3个月。因反复低血糖2年余就诊。患儿入院前2年反复发生低血糖,常在饥饿时发作,表现为大汗、精神差、昏昏欲睡,伴四肢抖动、双眼上翻等,当地医院急诊查血糖低,静脉补充糖后可缓解。入院前3个月曾发生昏迷1小时,查血糖0.82 mmol/L,血钾1.56 mmol/L,予静脉补糖、钾后好转。入院前1个月来频繁出现大汗、四肢抖动等低血糖症状。患儿平素体质差,易患上呼吸道感染,不喜甜食。患儿G1P1,足月剖宫产,出生体质量3 350 g,产时无窒息,母孕史正常。患儿生长发育较落后。父母否认近亲结婚,家族中无类似疾病患者。体格检查:腋温36.8 ℃,脉搏99次/min,呼吸30次/min,血压105/64 mmHg。身高 94 cm(-2.7 SD),体质量 12 kg,体质指数(BMI)为13.6 kg/m2;神清,反应可,无特殊面容。心肺无殊。腹软,肝脏肋下3 cm,剑突下2.5 cm,质软;神经系统未见异常。实验室检查示血常规、粪常规、肝肾功能及电解质正常;三酰甘油1.94 mmol/L(↑),血氨19 ☒mol/L,乳酸3.00 mmol/L(↑);甲状腺功能、醛固酮、皮质醇以及促肾上腺皮质激素检测均未见异常;空腹血糖4.8 mmol/L,胰岛素8.7 ☒IU/mL,C肽 1.61 ng/mL,糖化血红蛋白(HbA1C)5.6%;尿常规示白蛋白+,尿微量白蛋白90.9 mg/L(↑)、尿转铁蛋白7.00 mg/L(↑)、尿α1微球蛋白38.3 mg/L(↑)、尿IgG 11.20 mg/L(升高),24小时尿电解质正常。脑电图示左颞、两枕区痫样活动。心脏彩超示左房、左室稍增大。甲状腺及腹部超声正常。头颅MRI平扫+增强未见异常。
经上海交通大学医学院附属上海儿童医学中心伦理委员会审查批准,并取得患儿父母知情同意后,采集患儿及其父母外周血2 mL,置于含乙二胺四乙酸(EDTA)抗凝试管,充分混匀;取200 ☒L全血,使用QIAamp DNA Blood Mini Kit 试剂盒(Qiagen,德国)提取基因组DNA,用NanoDrop 2000 分光光度计对所提DNA 定量。
采用高通量测序进行致病基因鉴定。取3 ☒g患儿的基因组DNA经M220型核酸打断仪(美国Covaris公司)处理后得到150~200 bp的DNA片段,采用SureSelect试剂盒(美国Agilent公司)制备测序文库,捕获探针为包含2 742个已知致病基因的Agilent Inherited Disease Panel 试剂盒(目标区域约为12 Mb)。经2200 TapeStation仪器(Agilent,美国)对文库样本进行质量及浓度检测(确认杂交捕获文库的峰值为310~350 bp,浓度为2~20 mmol/L)。使用HiSeq 2500 System(Illumina,美国)进行高通量测序。测序数据经Illumina Sequence Control Software(SCS)评估合格后,使用NextGENe软件(美国SoftGenetics公司)进行数据读取,读取完毕后的数据上传到美国Ingenuity Systems公司的Ingenuity Variant Analysis软件进行生物信息学分析。Ingenuity软件对变异筛选的参数包括:①去除测序质量差、可信度低的变异;②去除正常对照人群数据库(包括ExAC数据库和千人基因数据库)中频率>1%的变异;③去除“良性变异”,包括同义变异、经PolyPhen-2 和 SIFT软件预测为非有害的错义变异以及经MaxEntScan软件预测不会改变mRNA剪切的变异;④以“低血糖(hypoglycemia)”为临床指征筛选变异。结果显示患儿存在ALDOB基因的复合杂合突变,其中3号内含子发现1个杂合剪切突变(c.325-1G>A),8号外显子存在1个杂合的移码突变(c.865delC,p.L289fs*10),其中c.325-1G>A为国内外首次报道。
随后以Sanger测序验证ALDOB的基因变异。用于扩增ALDOB(GenBank序列号:NM_000035.3)基因的引物使用UCSC在线软件(http://genome.ucsc.edu/index.html)进行设计,针对ALDOB基因3号内含子和4号外显子区域的引物序列是:正向引物 5'-TGGGTCCCTCGCACTAATAC-3',反向引物5'-AAACCAGGTACGTGTGGCTC-3';针对ALDOB基因8号外显子区域的引物序列是:正向引物5'-AACTAGCTTCAGCAAAAGCAAAC-3',反向引物5'-TGACCTCTACTGCCACATTTTC-3'。使用rTaq DNA聚合酶(日本TaKaRa公司)进行聚合酶链反应(PCR),PCR产物经1%的琼脂糖凝胶电泳确认后使用QIAquick Gel Extraction Kit(德国Qiagen公司)进行纯化,纯化后的产物经ABI3730XL测序仪(美国Applied Biosystems公司)Sanger测序,测序数据使用美国SoftGenetics公司Mutation Surveyor软件进行分析。结果表明该患儿存在两处杂合变异,其父亲携带移码突变而母亲携带剪切突变(图1A)。采用HSF以及MaxEntScan在线软件对c.325-1G>A的分析结果表明,该变异可破坏原有的剪切位点,从而导致ALDOB基因mRNA水平的异常剪切(图1B)。使用Human Splicing Finder (HSF, http∶//www.umd.be/HSF3/HSF.html)和MaxEntScan (http∶//genes.mit.edu/burgelab/maxent/Xmaxentscanscoreseq.html)对ALDOB基因 c.325-1G>A变异进行剪切位点影响评估,结果显示c.325-1G>A可破坏原有的剪切位点(HSF软件的变异值为-32.84%,MaxEnt软件的变异值为-112.63 %。HSF软件的变异值<-10%、MaxEnt软件的变异值<-30%判定为剪切位点破坏)。
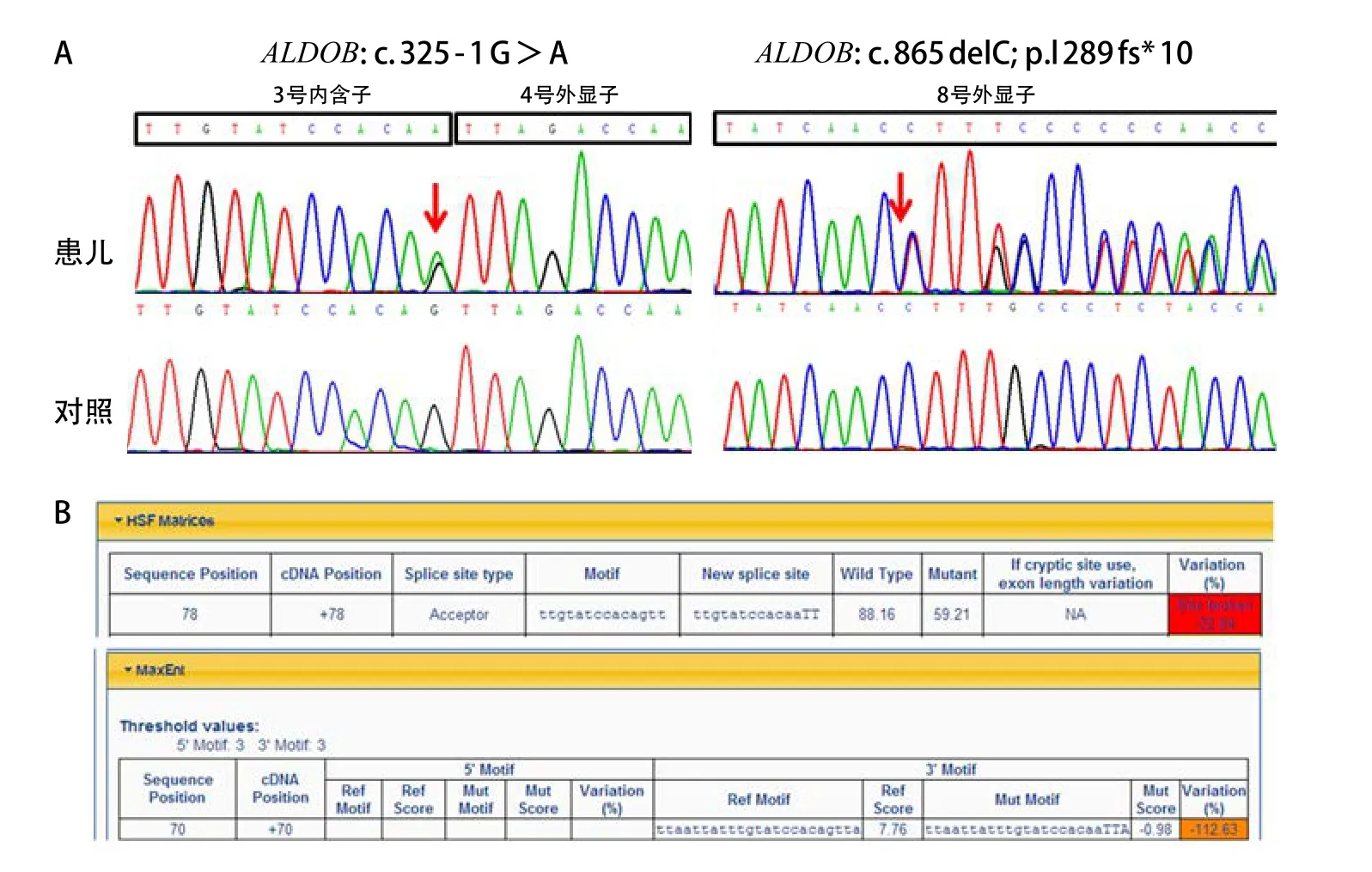
图1 患儿基因测序结果
确诊HFI后,患儿每日睡前按5 g/kg加食生玉米淀粉以避免夜间饥饿,同时服用左卡尼汀、辅酶Q10及维生素等改善代谢,另外告知日常饮食杜绝摄入含果糖的食物。患儿出院后定期门诊随访,未再见低血糖发生,生长发育良好,复查尿常规及肾功能均正常,尿微量蛋白较前好转。
2 讨论
HFI是由果糖二磷酸醛缩酶(fruetaidolase,fructose-1,6-diphosphatealdolase)缺陷导致的代谢病,属常染色体隐性遗传,1956 年Chambers等[3]首次报道。发病率在英国约为1∶22 000、波兰约为1∶31 000、欧洲中部约为1∶26 100,而中国人群的发病率未知[4]。该病临床表现各异,其重要临床特征为摄入果糖、蔗糖或山梨醇后发生严重低血糖。若不及时终止食入该类食物,患儿可发生肝、肾损伤及生长发育障碍,甚至死于进行性肝衰竭[5]。该病患儿年龄越小,症状越严重[6]。尤其是婴儿期断奶时,添加含果糖等食物可导致患儿喂食后20 ~ 30分钟即可发生呕吐、腹痛、昏迷等严重低血糖症状。多数患儿有拒甜食表现。实验室检查可有高转氨酶血症、高乳酸、低磷、高尿酸、高镁血症、蛋白尿、非特异性氨基酸尿、肾小管酸中毒等[7]。本例患儿以反复低血糖就诊,平素不喜甜食,存在生长发育障碍,实验室检查示肝肾功能、电解质等尚正常,尿蛋白+,尿微量蛋白升高,提示可能存在肾脏早期损伤。其脑电图示痫样活动可能继发于低血糖。
HFI由ALDOB基因(OMIM#612724)突变导致。该基因位于9q31.1,由9个外显子组成,其cDNA全长1 095 bp,编码由364个氨基酸组成的B型醛缩酶[8]。醛缩酶是一种同源四聚体的同工酶,主要催化果糖-1,6-二磷酸与果糖-1-磷酸之间的醇醛分裂。人体内存在3种组织特异性的醛缩酶:肌肉组织中的ALDOA,肝脏、小肠和肾脏组织中的ALDOB以及脑组织中的ALDOC[4]。HGMD数据库共收录了65个ALDOB基因的各类变异,包括错义、无义、缺失、插入、剪接位点突变等,亦有启动子区域突变报道[9,10]。目前尚无基因型与表型相关性报道,疾病严重程度与摄食情况、年龄、文化和饮食习惯密切相关。欧洲和北美患者中最常见的是A149P、 A174D和 N334K这三种突变[11]。中国人群中曾报道1例基因诊断明确的HFI患者存在ALDOB基因的纯合突变(c.479-482delAACA)[12]。本例患儿基因测序显示存在ALDOB基因的复合杂合突变(c.325-1G>A和c.865delC, p.L289fs*10),其中c.325-1G>A为首次报道,生物信息学分析表明其可破坏原有的mRNA正常剪切;c.865delC, p.L289fs*10已在HFI患者中报道过[13],是已知的致病变异。因此该患儿确诊为HFI。
本例患儿以不明原因低血糖为首发症状反复就医,因较长时间无法明确诊断并采取有效预防措施,患儿出现不同程度继发其他系统异常。糖代谢途径涉及的酶学反应及致病基因较多,仅从临床表型难以确诊。HFI这类肝脏代谢酶缺陷疾病的确诊主要依靠肝脏活检酶活性的测定和一些特殊检测手段,如HFI还可采用果糖耐受实验[14]。但这些方法创伤较大,存在一定程度的风险,且检测过程繁琐,因此难以在临床诊断中广泛采用。近年来的研究表明,基因测序特别是高通量测序适用于这类遗传代谢性病的诊断[15,16]。通过靶向基因测序,不仅使该例患儿在较短时间内得到确诊并接受有针对性的临床干预和治疗,同时也为再次生育提供产前咨询和产前诊断的依据。此外,本研究可为先天性酶缺陷诱发反复低血糖的临床诊治提供借鉴思路。
目前对于HFI无根治方法,主要是对症治疗及饮食控制。一旦确诊,需严格限制一切果糖、蔗糖或山梨醇等的摄入,避免低血糖发生。注意补充多种维生素,特别是水溶性维生素,防止微量元素缺乏。急性低血糖发作时主要给予葡萄糖静滴及肝、肾功能不全辅助治疗。并密切定期随访患儿肝、肾功能及生长发育等情况。
[1] Meneilly GS, Tessier DM. Diabetes, dementia and hypoglycemia [J]. Can J Diabetes, 2016, 40(1): 73-76.
[2] Méder Ü, Bokodi G, Balogh L, et al. Severe hyperinsulinemic hypoglycemia in a neonate: response to sirolimus therapy [J].Pediatrics, 2015, 136(5): e1369-e1372.
[3] Chambers RA, Pratt RT. Idiosyncrasy to fructose [J]. Lancet,1956, 271(6938): 340.
[4] Esposito G, Imperato MR, Ieno L, et al. Hereditary fructose intolerance: functional study of two novel ALDOB natural variants and characterization of a partial gene deletion [J].Hum Mutat, 2010, 31(12): 1294-1303.
[5] Mock DM, Perman JA, Thaler M, et a1. Chronic fructose intoxication after infancy in children with hereditary fructose intolerance. A cause of growth retardation [J]. N Engl J Med,1983, 309(13): 764-770.
[6] Ali M, Rellos P, Cox TM. Hereditary fructose intolerance [J].J Med Genet, 1998, 35(5): 353-365.
[7] Oppelt SA, Sennott EM, Tolan DR. Aldolase-B knockout in mice phenocopies hereditary fructose intolerance in humans[J]. Mol Genet Metab, 2015, 114(3): 445-450.
[8] Esposito G, Santamaria R, Vitagliano L, et al. Six novel alleles identified in Italian hereditary fructose intolerance patients enlarge the mutation spectrum of the aldolase B gene[J]. Hum Mutat, 2004, 24(6): 534.
[9] Coffee EM, Tolan DR. Mutations in the promoter region of the aldolase B gene that cause hereditary fructose intolerance[J]. J Inherit Metab Dis, 2010, 33(6): 715-725.
[10] Valadares ER, Cruz AF, Adelino TE, et al. Hereditary fructose intolerance in Brazilian patients [J]. Mol Genet Metab Rep,2015, 4: 35-38.
[11] Coffee EM, Yerkes L, Ewen EP, et al. Increased prevalence of mutant null alleles that cause hereditary fructose intolerance in the American population [J]. J Inherit Metab Dis, 2010,33(1): 33-42.
[12] 迟贞旎,洪洁,杨军,等.拒甜食、反复心慌、乏力—遗传性果糖不耐受症 [J].中华内分泌代谢杂志,2009,25(2)∶ 242-244.
[13] Cross NC, de Franchis R, Sebastio G, et al. Molecular analysis of aldolase B genes in hereditary fructose intolerance[J]. Lancet, 1990, 335(8685): 306-309.
[14] Kullberg-Lindh C, Hannoun C, Lindh M. Simple method for detection of mutations causing hereditary fructose intolerance[J]. J Inherit Metab Dis, 2002, 25(7): 571-575.
[15] Park KJ, Park S, Lee E, et al. A population-based genomic study of inherited metabolic diseases detected throμgh newborn screening [J]. Ann Lab Med, 2016, 36(6): 561-572.
[16] Colcloμgh K, Bellanne-Chantelot C, Saint-Martin C,et al. Mutations in the genes encoding the transcription factors hepatocyte nuclear factor 1 alpha and 4 alpha in maturity-onset diabetes of the young and hyperinsulinemic hypoglycemia [J]. Hum Mutat, 2013, 34(5): 669-685.
The analysis of clinical manifestations and genetic mutations in a child with hereditary fructose intolerance
YE Xiaoqin1, CHANG Guoying2, LI Juan2, DING Yu2, LI Niu2, WANG Jian2, WANG Xiumin2, SHEN Yiping2(1.The Third People’s Hospital of Bengbu, Bengbu 233000, Anhui, China; 2.Shanghai Children’s Medical Center Affiliated to Shanghai Jiaotong University School of Medicine, Shanghai 200127, China)
Objective To analysis the clinical and gene mutation characteristics of hereditary fructose intolerance (HFI).Methods The clinical features and the results of gene testing in the child with HFI and her parents were analyzed retrospectively.Gene sequencing was carried out by high-throughput sequencing and validated by Sanger sequencing. Results The 4-year-3-month old girl had recurrent hypoglycemia episodes and growth retardation. When the condition was stable, the levels of lactic acid and urine micro protein were slightly higher, and the levels of thyroid hormone, cortisol, glycosylated hemoglobin, insulin and C peptide were normal. EEG showed epileptiform activity. Gene sequencing revealed the presence of aldolase B gene (ALDOB)compound heterozygous mutations, a novel splicing mutations (c.325-1G>A) in intron 3 and a frameshift mutation (c. 865delC;p.L289fs*10) in exon 8. Her father carries a frameshift mutation, and her mother carries a splicing mutation. Conclusion The diagnosis of HFI caused by ALDOB mutation can be conf i rmed by high-throughput sequencing technology.
targeted gene sequencing; hypoglycemia; hereditary fructose intolerance; ALDOB gene; gene mutations
doi∶10.3969/j.issn.1000-3606.2017.12.002
李牛 电子信箱:liniu0509@163.com
*共同第一作者
2017-06-06)
蔡虹蔚)

