青海云杉休眠前后非结构性碳水化合物含量随海拔变化*
施 征,白登忠,张维诚,肖文发**
(1.中国林业科学研究院森林生态环境与保护研究所,国家林业局森林生态环境重点实验室,北京 100091;2.中国林业科学研究院,北京 100091)
青海云杉休眠前后非结构性碳水化合物含量随海拔变化*
施 征1,白登忠2,张维诚1,肖文发1**
(1.中国林业科学研究院森林生态环境与保护研究所,国家林业局森林生态环境重点实验室,北京 100091;2.中国林业科学研究院,北京 100091)
目的冬季低温是决定高山林线树种能否生存的重要生态因素。休眠前后树木体内碳水化合物的变化能够反映出其安全越冬的策略。但目前高山林线树种休眠前后体内碳水化合物的变化及机理尚不清楚。为了探讨林线树种越冬期间的生存策略,方法本文以祁连山林线青海云杉为对象,研究了不同海拔(2 900、3 000、3 100、3 200、3 300 m)成年树枝、叶休眠前后非结构性碳水化合物含量变化,包括可溶性糖(葡萄糖和果糖)、淀粉以及糖/淀粉比值的变化。结果表明:(1)休眠前青海云杉当年及1年生叶在高海拔处NSC含量高于中、低海拔处NSC含量,而在枝条中高、中、低海拔间没有显著差异。(2)休眠后叶中NSC含量最高值在中海拔3 100 m处,显著高于高海拔;不同组织中NSC含量高于休眠前,叶片中尤为明显。(3)与休眠前相比,休眠后可溶性糖及淀粉含量增加,淀粉含量增加幅度显著,引起可溶性糖/淀粉比值降低。结论青海云杉休眠前贮存足够的碳水化合物保证越冬期间的细胞渗透调节及能量代谢,并且休眠后气温升高时叶片和枝条的NSC能够得到迅速补充,为新枝条萌发提供充足的碳源, 反映了青海云杉在越冬期间的生存策略。
青海云杉;林线;非结构性碳水化合物;休眠
海拔梯度包含了温度、湿度、光照和土壤等诸多环境因子的剧烈变化,使其成为研究植物对环境变化响应的理想场所[1]。海拔梯度环境条件的异质性会导致林线树木在形态和生理上产生一定的变化[2]。高海拔树木能够生存、生长发育和繁衍取决于对剧烈变化的环境条件的生理生态响应和适应能力。所以,生长在高海拔环境的树种需要充足的碳水化合物供应支持其生长和代谢。树木体内积累的非结构性碳水化合物(non-structural carbohydrates, NSC)能够为树木休眠后恢复生长提供碳源,而且能在植物光合产物不足时起到缓冲作用,因此在很大程度上影响着植株的生长及对环境的响应[3]。NSC积累是否充足,能够反映出树木是否受到碳限制。NSC在树木体内的积累有季节性和组织之间的差异,而组织之间的差异可以反映出碳源和碳库之间的平衡关系[4-5]。以往的大量研究,主要集中在生长季节树木体内海拔梯度对碳水化合物含量的影响[2,6]。但是有人提出,在比较不同海拔梯度间的树木体内碳水化合物差异时应考虑到在同一发育时期或者是在同一物候期内比较(比如生长末期或者是休眠期)[7-8]。而对于非生长季内不同海拔梯度上林线树种碳水化合物含量变化的报道较少。非生长季内林线树种体内的NSC既要保证树种在低温环境下安全过冬,又提供来年新枝叶萌发所需要的营养。所以林线树种的冬季适应策略,决定着在林线树种的生存能力。
青海云杉(PiceacrassifoliaKom.)是祁连山森林的建群种,是祁连山区重要的水源涵养林,随海拔垂直分布,生长状况存在明显的海拔差异。目前对祁连山林线树种碳水化合物含量及其变化的报道相对较少[9],尤其是青海云杉休眠期的研究还未见报道。本研究以祁连山林线树种青海云杉为对象,研究休眠前后不同海拔青海云杉成年树当年和1年生中枝条及叶片中NSC及其组分含量的变化,探讨青海云杉冬季的适应策略,为深入研究祁连山林线形成机制提供科学依据。
1 材料与方法
1.1 采样地点

1.2 样品采集

1.3 样品分析方法
可溶性糖提取:参照于建国等[10]著《现代使用仪器分析方法》,略有改动。称1 g粉碎好的干燥植物样品于三角瓶中,加入50 mL蒸馏水,用锡纸封住瓶口,放入高压锅中蒸1小时,冷却后保证三角瓶中有20 mL溶液,过滤,滤液用Waters 244型高效液相色谱仪(美国)测定可溶性糖(果糖、葡萄糖)的含量。

Waters 244型高效液相色谱仪(美国)色谱条件——色谱柱:sugar-pak 1(美国);流动相:蒸馏水;流速:0.6 mL·min-1;柱温:70℃;检测器:视差检测器。
NSC为可溶性糖和淀粉含量的总和,其中可溶性糖包括葡萄糖和果糖两部分,所有含量均用百分比干重表示。
1.4 数据分析
所有数据均采用SPSS16.0软件进行分析。采用影响因子方差分析(ANOVA)分析海拔、采样时间及枝条年龄对非结构性碳水化合物含量的影响;采用one-way ANOVA 方法分析青海云杉组织中NSC及其组分含量在不同海拔间的差异显著水平,并进行LSD多重比较分析。
2 结果与分析
2.1 海拔、休眠对青海云杉NSC含量的影响
本研究影响采样的因素包括采样时间和海拔梯度,通过影响因子方差法(ANOVA)分析了采样时间、海拔梯度对青海云杉枝条中非结构性碳水化合物(NSC)含量的影响(表1)。结果显示,海拔梯度对当年生叶片中葡萄糖、可溶性糖含量以及糖/淀粉比值影响显著(P<0.05),对果糖、淀粉及NSC无显著影响(P>0.05)。而对1年生叶片中的各组分及糖/淀粉比值均有显著影响(P<0.05)。海拔梯度对当年生枝条中各组分的影响结果与1年生叶片相同。而在1年生枝条中,海拔只对果糖和NSC含量有显著影响(P<0.05)。
采样时间对各组织中非结构性碳水化合物NSC组分含量影响表明,当年生叶中除葡萄糖含量外,其它各组分含量及糖/淀粉比值均受采样时间的显著影响(P<0.05)。1年生叶和当年生枝条中NSC各组分含量及糖/比值受采样时间显著影响(P<0.05)。1年生枝条中果糖、淀粉、NSC含量及糖/淀粉比值受采样时间显著影响(P<0.05),葡萄糖和可溶性糖含量未显著受到采样时间的影响(P>0.05)。
当年生叶、1年生叶及当年生枝条中所测各组分均受到海拔×采样时间交互作用的显著影响(P<0.05),而1年生枝条中所测各组分均未受到海拔×采样时间的显著影响(P>0.05)。

表1 不同海拔青海云杉休眠前后非结构性碳水化合物及其组分含量影响因子方差分析(ANOVA)
2.2 休眠前后青海云杉不同组织中非结构性碳水化合物含量随海拔变化

休眠后,当年生叶中可溶性糖含量随海拔升高呈降低-升高-降低-升高的波动式变化,最高值在中海拔3 100 m出现,海拔间没有显著差异(P>0.05)。1年生叶可溶性糖含量随海拔变化趋势与当年生叶相同,但最高值出现在高海拔3 300 m,高海拔3 300 m可溶性糖含量显著高于低海拔2 900 m及中海拔3 000 m(P<0.05),而与其它海拔间差异不显著(P>0.05)。当年生枝条中可溶性糖含量随海拔升高呈升高-降低-升高的变化趋势,林线边缘3 300 m出现最高值,显著高于低海拔2 900 m和林线过渡带3 200 m(P<0.05)。1年生枝条中可溶性糖含量随海拔的变化趋势与当年生叶相同,最高值出现在3 300 m,显著高于低海拔2 900 m、中海拔3 000 m及林线过渡带3 200 m可溶性糖含量(P<0.05)。

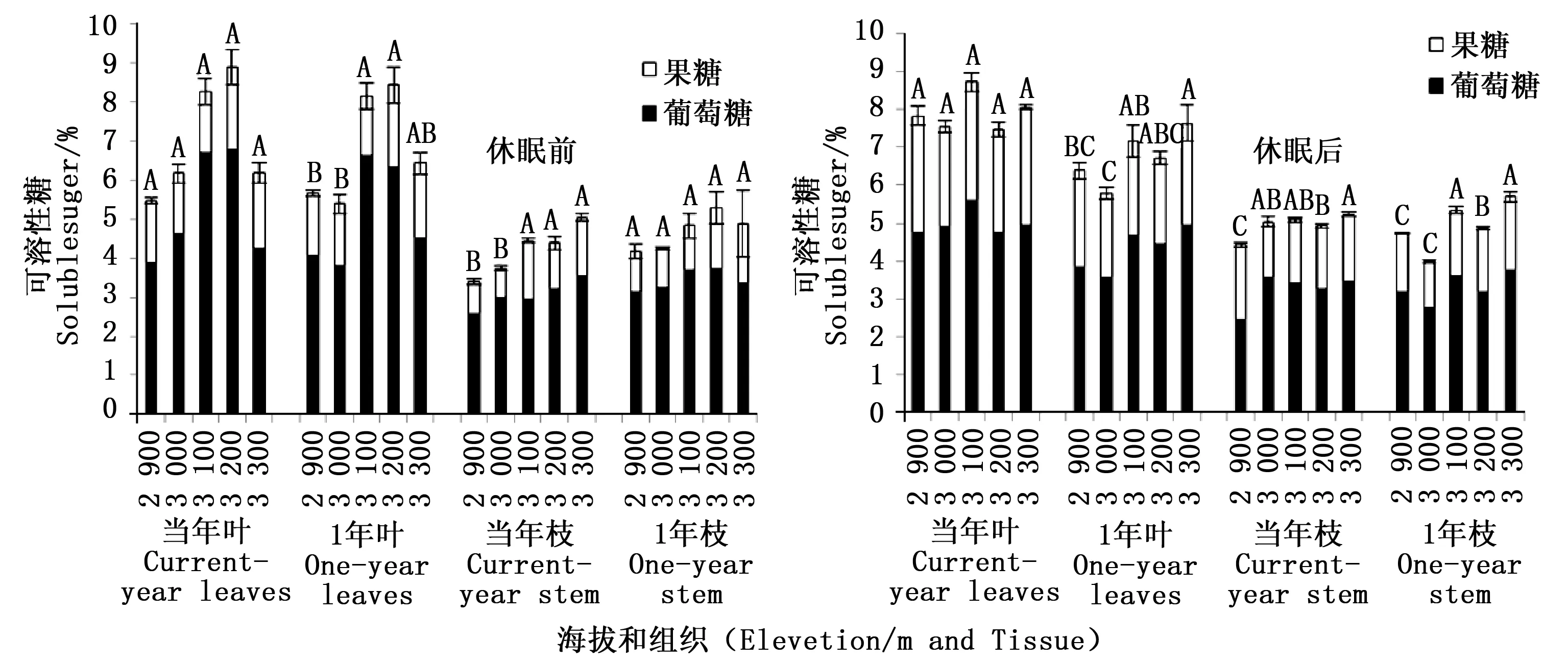
图1 休眠前后青海云杉不同组织中可溶性糖含量随海拔变化Fig.1 The contents of soluble sugar in different tissue of Picea crassifolia before and after dormancy
2.2.2 淀粉含量随海拔变化 青海云杉各组织中淀粉含量随海拔变化如图2。当年生叶中淀粉含量随海拔升高先下降,在海拔3 100 m达到最低值,随后又逐渐升高,最高值在海拔3 300 m出现,且显著高于海拔3 100 m和3 200 m的淀粉含量(P<0.05),与低海拔2 900 m没有显著差异(P>0.05)。1年生叶中淀粉含量随海拔变化趋势与当年生叶相同,随海拔升高淀粉含量降低,最低值在3 100 m,显著低于其它各海拔淀粉含量(P<0.05)。当年生枝淀粉含量随海拔升高呈降低-升高-降低的变化趋势,但各海拔间均没有显著差异(P>0.05)。1年生枝中淀粉含量随海拔升高呈先降低后升高的变化趋势,最低值出现在中海拔3 100 m,且各海拔间没有显著差异(P>0.05)。
休眠后,当年生叶中淀粉含量随海拔升高先降低在升高,最高值在3 100 m,而后随海拔升高淀粉含量又有所降低,海拔间没有显著差异(P>0.05)。1年生叶中淀粉含量随海拔升高呈降低-升高-降低的变化趋势,最高值在中海拔3 100 m,最低值在高海拔3 300 m。方差分析表明,海拔低海拔(2 900 m)、中海拔(3 100 m)的淀粉含量显著高于高海拔(3 200 m和3 300 m)(P<0.05)。当年生枝中淀粉含量随海拔逐渐升高,而在3 300 m淀粉含量呈下降趋势,最低值在海拔3 300 m,显著低于其它各海拔的淀粉含量(P<0.05)。1年生枝中淀粉含量随海拔升高呈降低-升高-升高的变化趋势,最高值在海拔3 200 m,显著高于海拔3 300 m和3 000 m的淀粉含量。比较休眠前后各组织中的淀粉含量发现,休眠后各组织总的淀粉含量均有明显增加。

图2 休眠前后青海云杉不同组织淀粉含量随海拔变化Fig.2 The contents of starch in different tissue of Picea crassifolia before and after dormancy
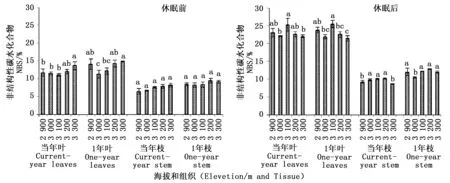
图3 休眠前后青海云杉不同组织中非结构性碳水化合物含量随海拔变化Fig.3 The contents of soluble sugar in different tissue of Picea crassifolia before and after dormancy
2.2.3 非结构性碳水化合物含量随海拔变化 青海云杉非结构性碳水化合物(NSC)含量随海拔变化如图3。休眠前,当年生叶中NSC含量随海拔升高整体呈上升趋势,最高值在海拔3 300 m,显著高于低海拔和中海拔(P<0.05)。1年生叶中的NSC含量随海拔升高呈先降低在升高的变化趋势,最低值在海拔3 000 m出现,最高值在林线边缘3 300 m,中海拔(3 000 m和3 100 m)的NSC含量显著低于高海拔和低海拔的NSC含量(P<0.05)。当年生枝NSC含量随海拔升高呈上升趋势,但海拔间差异不显著(P>0.05)。1年生枝条中NSC含量随海拔升高先逐渐降低,而后升高海拔3 200 m达最高值,到海拔3 300 m时又有所下降,海拔间没有显著差异(P>0.05)。
休眠后,各组织中的NSC含量明显高于休眠前。当年生叶和1年生叶随海拔变化趋势相同,均是随海拔升高呈下降-升高-下降的变化趋势。最高值均出现在中海拔3 100 m,最低值出现在高海拔3 300 m,最高值和最低值间差异显著(P>0.05)。当年生枝中NSC随海拔升高呈先升高在下降的变化趋势,最低值在海拔3 300 m,中海拔(3 000 m和3 100 m)及林线过渡带(3 200 m)的NSC含量显著高于3 300 m和2 900 m。1年生枝条中NSC含量随海拔升高与当年生叶的变化趋势形同,最高值在3 200 m出现,而最低值则在3 000 m,且海拔3 000 mNSC含量显著低于其它各海拔(P<0.05)。


表2 休眠前不同海拔青海云杉各组织可溶性糖含量与淀粉含量比值
不同小写字母表示不同海拔间的差异显著(Duncan 多重比较,P<0.05)
Different latters in each column indicate significat differences between elevations(Duncan multiple comparisons atP<0.05)

休眠前糖/淀粉比值明显高于休眠后,休眠前可溶性糖占得比重高,而休眠后淀粉含量增加,糖/淀粉比值降低。

表3 休眠后不同海拔青海云杉各组织可溶性糖含量与淀粉含量比值
不同小写字母表示不同海拔间的差异显著(Duncan 多重比较,P<0.05)
Different latters in each column indicate significat differences between elevations(Duncan multiple comparisons atP<0.05)
3 讨论
3.1 海拔对休眠前后青海云杉不同组织中NSC含量的影响
本研究发现,休眠前青海云杉当年生叶及1年生叶中NSC在高海拔(3 300 m和3 200 m)的含量不低于中低海拔(3 000 m和3 100 m),而在枝条中高中低海拔间没有显著差异。说明休眠前青海云杉各组织中NSC积累未受到海拔的限制,这与Shi[12]周永斌[6]、王彪[13]等同时期的研究结果一致。研究表明高海拔树种光合作用强度与低海拔没有明显差异[14-15],所以在生长季高山林线树木能够合成足够的光合产物,同时低温环境降低了树木的呼吸消耗使得树木体内积累大量的NSC。这可能是休眠前高海拔青海云杉NSC含量不低于中低海拔的原因之一。利用14C示踪方法对不同组织的NSC研究发现,树木呼吸代谢利用的碳水化合物主要是当年合成的NSC,而1年或2年形成的NSC主要用于年轮的生长和休眠期的代谢[16-17]。因此常绿树种当年生及1年生枝条叶片中的NSC对树木休眠和再生长很重要。可见休眠前青海云杉枝条和叶片中积累的NSC既能保证其安全越冬,也为来年新组织生长提供碳源。
休眠后青海云杉NSC含量表现为:海拔间比较,中海拔(3 100 m)叶中NSC含量著高于高海拔(3 200 m和3 300 m),当年生枝条NSC含量高于高海拔(3 300 m)与低海拔(2 900 m);休眠前后比较,各组织中的NSC含量显著高于休眠前,叶片中尤为明显。造成这种现象的原因一方面中海拔与高海拔相比温度相对较高,与低海拔相比光照充足,所以中海拔更有利于光合产物的形成和积累。造成这种现象的生理机制还有待于结合土壤温度、水分、休眠后各海拔的气温变化以及光照条件深入研究。另一方面休眠后的5月份气温上升,青海云杉针叶开始进行光合作用,而这时土壤温度还很低,根系活动受到限制,所有光合产物的利用率降低,大量的光合产物以淀粉的形式积累在叶片和枝条中,造成了淀粉含量的显著升高。另外,以往的研究表明常绿树在休眠后萌发前,枝条和针叶中淀粉含量会有一个显著的升高过程,保证幼枝在萌发过程中有充足的碳源[18-20]。青海云杉符合针叶树种的这一特性,淀粉含量的增加保证了新的枝叶萌发所需要的碳水化合物。所以,青海云杉休眠前后NSC含量的变化特点是林线树木长期适应高海拔恶劣环境的结果。
3.2 海拔对休眠前后青海云杉不同组织可溶性糖、淀粉含量及其比值的影响
非结构性碳水化合物(NSC)包括淀粉、果糖、葡萄糖、蔗糖及果聚糖等多种成分,未来气候变化不仅会对NSC 总量产生一定影响,更重要的是还可能会进一步影响到NSC中各组分的组成和含量[21]。可溶性糖通过提高组织细胞液渗透压,防止细胞内结冰,提高植物抗寒性,顺利度过寒冷季节。休眠前后,各组织在高海拔的可溶性糖含量高于中低海拔或者是没有显著差异。休眠后可溶性糖含量增加,果糖在可溶性糖含量中所占比重上升。造成青海云杉体内较高的可溶性糖含量的原因一方面是为了增加细胞液的浓度防止细胞结冰,安全越冬。另一方面可溶性糖的大量积累可能是林线树木长期进化中对低温环境适应的一种策略。以往的研究也表明,植物中的可溶性糖不仅是能量来源和结构性物质的重要组成元件,还具有信号物质的功能,调节相关基因的表达和酶活性,参与植物的生长发育调节以及应对不良环境[22-24]。迄今已证明,具有重要作用的糖信号主要是二糖和单糖,而单糖主要是葡萄糖和果糖[25-28]。分析认为青海云杉休眠前后可溶性糖组分的变化,可能是葡萄糖和果糖起到了信号物质的作用来调节对低温环境的感知和适应,同时单糖对休眠后青海云杉新生组织的发育及分化也可能起到了信号调节的作用。但是,可溶性糖组分的这种变化究竟又怎样的生理机制,还有待于进一步深入研究。

4 结论
本研究通过对休眠前后青海云杉不同组中的非结构性碳水化合物在海拔间变化的研究,发现青海云杉冬季的NSC含量表现为:不同海拔青海云杉休眠前积累足够的NSC,而休眠后光合产物的及时补充,保证了林线树种青海云杉安全越冬,并提供给新生组织发生所需的碳源。这是林线树种青海云杉在低温环境下确保物种延续的一种生存策略。
[1] Körner C. Alpine plant life: functional plant ecology of high mountain ecosystems[M]. Berlin, Heidelbergv Springer-Verlag, 2003, 2nd.
[2] 王庆伟, 齐 麟, 田 杰, 等. 海拔梯度对长白山北坡岳桦水分利用效率的影响[J]. 应用生态学报, 2014, 22:2227-2232.
[3] Hoch G, Richter A, Körner C. Non-structural carbon compounds in temperate forest trees[J]. Plant Cell Environment, 2003, 26:1067-1081.
[4] Fischer C, Höll W. Food reserves of scots pine (PinussylvestrisL.) II. Seasonal changes and radial distribution of carbohydrate and fat reserves in pine wood[J]. Tree, 1992,6:147-155.
[5] Simon M L, Victor J L. Seasonal changes in carbohydrate reserves in mature northernPopulustremuloidesclones[J]. Trees, 2003, 17:471-476.
[6] 周永斌, 吴栋栋, 于大炮. 长白山岳桦体内碳素供应状况[J]. 林业科学, 2010, 46(3):161-165.
[7] Hoch G. Carbon Reserves as Indicators for Carbon Limitation in Trees[J]. Progress in Botany, 2015, 76:321-346.
[8] 王金叶, 常学向, 葛双兰, 等. 祁连山(北坡)水热状况与植被垂直分布[J]. 西北林学院学报, 2001, 16(增):1-3.
[9] 胡启武, 吴 琴, 郑 林, 等. 青海云杉叶片稳定性碳同位素组成对水分温度变化的响应[J]. 山地学报,2010,28(6): 712-717.
[10] 刘福岭, 戴行钧. 食品物理化学分析方法[M].北京:中国林业出版, 1987.
[11] 于建国,王文芝.现代实用仪器分析方法[M].北京:中国林业出版社, 1994.
[12] Shi P L, Körner C, Hoch G. End of season carbon supply status of woody species near the treeline in western China[J]. Basic and Applied Ecology, 2006, 7:370-377.
[13] 王 彪,江 源,王明昌,等. 芦芽山不同海拔白杄非结构性碳水化合物含量动态[J]. 植物生态学报, 2015, 39(7):746-752.
[14] Piper F I, Caviers L A, Reyes-Díaz M,etal. Carbon sink limitation and frost tolerance control performance of the tree (Kageneckiaangustifolia)D.Don(Rosaceae) at the treeline in central Chile[J]. Plant Ecology, 2006, 185:29-39.
[15] Li M H, Hoch G, Körner C. Source/sink removal affects mobile carbohydrates inPinuscembraat the Swiss treeline[J]. Trees, 2002, 16:331-337.
[16] Li M H, Xiao W F, Wang S G,etal. Mobile carbohydrates in Himalayan treeline trees I. Evidence for carbon gain limitation but not for growth limitation[J]. Tree Physiology, 2008, 28:1287-1296.
[17] Carbone M S, Czunczuk C I, Keenan T F,etal. Age allocation and availability of nonstructural carbon in maturered maple trees[J]. New Phytologist, 2013, 200: 1145-1155.
[18] Dang H S, Zhang K R., Zhang Q F,etal. Temporal variations of mobile carbohydrates inAbiesfargesiiat the upper tree limits[J]. Plant Biology, 2015, 17(1):106-113.
[19] Schädel C, Bköchl A, Richter A,etal. Short-term dynamics of nonstructural carbohydrates and hemicelluloses in young branches of temperate forest trees during bud break[J]. Tree Physiology, 2009, 29: 901-911.
[20] Fischer C, Höll W. Food reserves of scots pine (PinussylvestrisL.) I. Seasonal changes in the carbohydrate and fat reserves of pine needles[J]. Tree, 1991, 5:187-195.
[21] 郑云普, 王贺新, 娄 鑫, 等.木本植物非结构性碳水化合物变化及其影响因子研究进展[J]. 应用生态学报, 2014, 25(4):1188-1196.
[22] Proels R K, Hückelhoven. Cell-wall invertases, key enzymes in the modulation of plant metabolism during defence Responses[J]. Molecular Plant Pathology, 2014, 15:858-864.
[23] Granot D, Davidschwatz R, Kelly G. Hexose kinases and their role in sugar-sensing and plant development[J]. Frontiers in Plant Science, 2013, 4:11-18.
[24] Lu Y, Sadaki Y, Li Y,etal. ABI1 regulates carbon/nitrogen-nutrient signal transduction independent of ABA biosynthesis and canonical ABA signaling pathways in Arabidopsis[J]. Journal of Experimental Botany, 2015, 106:1263-1268.
[25] Moore B, Zhou L, Rolland F,etal. Role of Arabidopsis glucose sensor HXK1 in nutrient, light, and hormonal signaling[J]. Science, 2003, 300:332-336.
[26] Cho Y H, Yoo S D. Signaling role of fructose mediated by FINS1/FBP in Arabidopsis thaliana.[J]. Plos Genetics, 2011, 7:70-76.
[27] Li P, Koornneef M. Fructose sensitivity is suppressed in Arabidopsis by the transcription factor ANAC089 lacking the membrane-bound domain[J]. Proceedings of the National Academy of Sciences, 2011, 108:3436-3441.
[28] 何亚飞, 李 霞, 谢寅峰. 植物中糖信号及其对逆境调控的研究进展[J]. 植物生理学报, 2016, 52:241-249.
[29] Zhu W Z, Xiao W F, Li M H,etal. Seasonal dynamics of mobile carbon supply inQuercusaquifolioidesat the upper elevational limit[J]. Plos ONE, 2012, 7(3): e3421.
VariationofNonstructuralCarbohydrates(NSC)inPiceacrassifoliaattheAlpineTreelineofQilianMountainsBeforeandAfterDormancy
SHIZheng1,BAIDeng-zhong2,ZHANGWei-cheng1,XIAOWen-fa1
(1.Research Institute of Forest Ecology, Environment and Protection, Chinese Academy of Forestry, Key Laboratory of Forest Ecology and Environment, the State Forestry Administration, Beijing 100091, China; 2.Chinese Academy of Forestry, Beijing 100091, China)
ObjectiveTo study the survival strategy of treeline trees in winter.MethodNonstructural carbohydrates (NSC) and their components (glucose, fructose, and starch) inPiceacrassifoliawere investigated along five altitude gradients (2 900 m, 3 000 m, 3 100 m, 3 200 m, and 3 300 m) in the Qilian mountains.Result(1) Before dormancy, the NSC contents in leaves at high altitudes were significantly higher (P<0.05) than those in low altitudes, while no significant difference was found in branches. (2) After dormancy, the content of NSC at middle altitude (3 100 m) was significantly higher than those of other altitudes; moreover, the NSC contents in all the tissues, especially the leaves, were higher than those before dormancy. (3) After dormancy, the soluble carbohydrates increased, but starch increased more compared to those before dormancy, resulting in a decrease in the ratio of soluble sugar/starch.ConclusionThese results reflects the adaptation strategy ofPiceacrassifolianear treeline that the reserved mobile carbon was enough to respiration metabolism and osmotic regulation during winter, and moreover, the NSC contents could have a quick compensation in the leaves and branches after dormancy, which provided the necessary carbon sources for the growth of new branches.
Piceacrassifolia; treeline; nonstructural carbohydrates; dormancy
10.13275/j.cnki.lykxyj.2017.06.004
2016-11-25
中国林业科学研究院中央级公益性科研院所基本科研业务费专项资金项(CAFYBB2014QB007)、国家自然科学基金项目(31300496)、中国林科院森林生态环境与保护研究所中央级公益性科研院所基本科研业务费专项资金项目(CAFRIFEEP2014)
施 征,女,助理研究员,博士,从事森林生理生态研究. E-mail sz481@126.com
* 致谢:本研究得到祁连山水源林涵养研究院西水生态站的支持和帮助,谨致谢枕。
** 通讯作者:E-mail: xiaowenf@caf.ac.cn
S791.18
A
1001-1498(2017)06-0908-08
崔 贝)

