山鸡椒LcGPPS表达模式及其与LcGGPPS蛋白互作分析
曹 佩,陈益存,高 暝, 郭浩波, 汪阳东*
(1.中国林业科学研究院亚热带林业研究所,浙江 杭州 311400; 2.美国田纳西大学生物化学系,田纳西州 诺克斯维尔TN 37996)
山鸡椒LcGPPS表达模式及其与LcGGPPS蛋白互作分析
曹 佩1,陈益存1,高 暝1, 郭浩波2, 汪阳东1*
(1.中国林业科学研究院亚热带林业研究所,浙江 杭州 311400; 2.美国田纳西大学生物化学系,田纳西州 诺克斯维尔TN 37996)
目的鉴定与山鸡椒精油合成关键酶香叶基二磷酸合酶(LcGPPS)的互作蛋白,为揭示山鸡椒精油主要成分单萜物质的合成机理奠定基础。方法通过本地Blast搜索山鸡椒果实转录组数据库,采用RT-PCR克隆山鸡椒GPPS基因(编码异质GPPS小亚基的LcGPPS.SSU1)和山鸡椒GGPPS基因(LcGGPPS1和LcGGPPS3);利用qRT-PCR分析其组织特异性表达模式,通过蛋白互作预测和酵母双杂实验验证LcGPPS.SSU1分别与LcGGPPS1和LcGGPPS3的互作关系。结果克隆得到LcGPPS.SSU1、LcGGPPS1和LcGGPPS3 3条基因序列,基因表达模式分析表明,LcGPPS.SSU1特异性地在花和果实中高水平表达;蛋白结构互作预测结果显示,LcGPPS.SSU1可以分别与LcGGPPS1和LcGGPPS3互作形成异质二聚体;经过酵母双杂交实验验证发现,仅LcGGPPS3能与LcGPPS.SSU1发生互作。结论LcGPPS.SSU1通过与LcGGPPS3蛋白发生互作从而在山鸡椒萜类合成途径中发挥作用,为深入研究山鸡椒萜类合成机制提供参考。
山鸡椒;萜类合成;GPPS;GGPPS;异质二聚体;蛋白互作;表达模式
香叶基焦磷酸合酶(GPPS)是调控萜类化合物生物合成途径中调控节点行使作用的关键酶,催化底物C5前体异戊烯基二磷酸酯(IPP)及其异构体二甲基烯丙基二磷酸酯(DMAPP)合成单萜前体香叶基焦磷酸GPP,竞争性地将底物流导向单萜合成,为单萜的合成提供了基本的碳骨架,也为后续各种化合物的形成提供了基础[1]。GPPS在单萜合成过程中起着关键作用,参与防御反应、吸引传粉等生理生化过程,在植物生长发育中不可或缺[2]。
GPPS在自然界中以异质二聚体和同质二聚体的形式存在,均以催化合成GPP为唯一产物[3]。同质二聚体GPPS由2个相同亚基,由GPPS基因编码组成,在自然界中广泛存在[4],目前已从裸子植物和被子植物中分离、鉴定出GPPS基因[5-6];而异质二聚体GPPS则由一大一小2个亚基组成,分别由大亚基GPPS.LSU和小亚基GPPS.SSU编码。GPPS.LSU是一类异戊烯基转移酶类似蛋白(prenyltransferase,PTS-like protein),通常与负责催化合成二萜化合物前体香叶基香叶基焦磷酸(GGPP)的香叶基香叶基焦磷酸合酶(GGPPS)有70%的序列相似性[7-8],同时,GGPPS也可以充当大亚基搭档,与小亚基形成异质二聚体GPPS,催化生成GPP,从而调节代谢底物转向单萜物质的合成[9]。目前,GPPS.LSU的研究主要是观察其单独表达是否有活性,能否与GPPS.SSU互作,以及与GPPS.SSU共表达后的催化活性。文献报道仅从少数几种植物中克隆出GPPS.LSU,包括薄荷(MenthapiperitaL.)MpGPPS.LSU、啤酒花(HumuluslupulusL.)HlGPPS.LSU、金鱼草(AntirrhinummajusL.)AmGPPS.LSU和长春花(Catharanthusroseus(L.) G. Don.)CrGPPS.LSU等,其中,MpGPPS.LSU和HlGPPS.LSU单独表达时均没有活性,AmGPPS.LSU单独表达时具有GGPPS催化活性,CrGPPS.LSU单独表达时具有GPPS和GGPPS的双催化活性[6-7,9-10]。
山鸡椒(Litseacubeba(Lour.) Pers.)又名山苍子、木姜子,多年生落叶小乔木,属樟科(Lauraceae)木姜子属(LitseaLam.),广泛分布于我国长江以南,资源丰富。山苍子的根、叶和果实中均含有精油,其中以果实中含量最高,高达85%左右[11-12]。精油中的成分主要是单萜和倍半萜化合物,其主要成分柠檬醛更是合成紫罗兰酮系列名贵香料的主料[13];然而,目前我国的山鸡椒主要以野生资源为主,精油产量和品质受环境影响较大[12],为培育优良品种,提高山鸡椒精油产量,改善精油品质,迫切需要探究山鸡椒体内单萜合成的调控机制。目前,关于山鸡椒体内萜类合成途径的研究甚少,仅有LcDXR、LcTPS1、LcTPS2和LcTPS3被克隆验证[14-15],而GPPS作为单萜合成途径的关键节点,在山鸡椒中尚无文献报道。因此,本研究以山鸡椒的幼果以及各组织为试验材料,分析了LcGPPSs与LcGGPPSs的表达模式,并克隆了LcGPPS.SSU1、LcGGPPS1和LcGGPPS3基因,对蛋白之间的互作进行探索验证,以期为山鸡椒果实中单萜的形成和调控机制研究提供理论参考,为提高精油产量和品质的遗传育种奠定基础。
1 材料与方法
1.1 植物材料
所采用的山鸡椒植株新鲜组织(花、花芽、叶芽、嫩叶、茎、果实和根等),采自浙江杭州市富阳区中国林科院亚热带林业研究所黄公望森林公园内,采后迅速置于液氮中,带回实验室保存在-80℃冰箱,留于后续实验。
1.2 数据来源
由于GPPS.LSU已鉴定的物种较少,且与GGPPS具有较高的相似性,为了获得更全面的序列,作者在山鸡椒的果实转录组数据库(NCBI登录号:SRA080286)中分别利用拟南芥(Arabidopsisthaliana(L.) Heynh.)GGPPS11(NM_113869)和薄荷MpGPPS.LSU(AAF08792)核苷酸序列,以1×10-5为临界值,搜索相似序列,将得到的候选序列经过寻找编码框(ORF Finder, https://www.ncbi.nlm.nih.gov/orffinder/),翻译成氨基酸序列后经BLASTP分析(https://blast.ncbi.nlm.nih.gov/Blast.cgi),保守域分析验证(https://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi),共得到10条目的序列。
1.3 山鸡椒总RNA的提取及cDNA合成
采集山鸡椒的花、花芽、叶芽、嫩叶、茎、果实和根等组织,总RNA提取采用EASYpin Plus植物RNA快速提取试剂盒(北京艾德莱生物科技有限公司)。利用美国Invitrogen公司反转录试剂盒SuperScriptⅢⅠst Strand cDNA合成第一链cDNA,用于后续qRT-PCR分析和基因克隆实验。
1.4 LcGPPSs和LcGGPPSs的表达分析
采用qRT-PCR分析LcGPPSs和LcGGPPSs基因在正常生长的山鸡椒不同组织间和果实发育过程中的表达模式。在4条序列的保守区域至非保守区域设计引物,测序验证,以微管蛋白α基因(TUA)为内参基因,检测山鸡椒不同部位这10个基因的表达水平,具体操作步骤按SYBR Premix Ex TaqTM (TaKaRa, Tokyo, Japan)说明书进行。以灭菌双蒸水为模板作为空白对照,在Applied Biosystems Prism 7300仪器(ABI,美国)上进行,目的基因相对表达水平利用2-△△Ct方法计算,所有反应均为2次生物学重复,4次技术性重复。qRT-PCR程序如下:95℃ 30 s 1个循环,95℃ 5 s、60℃ 31 s, 35个循环。用于这10条基因的qRT-PCR引物见表1。
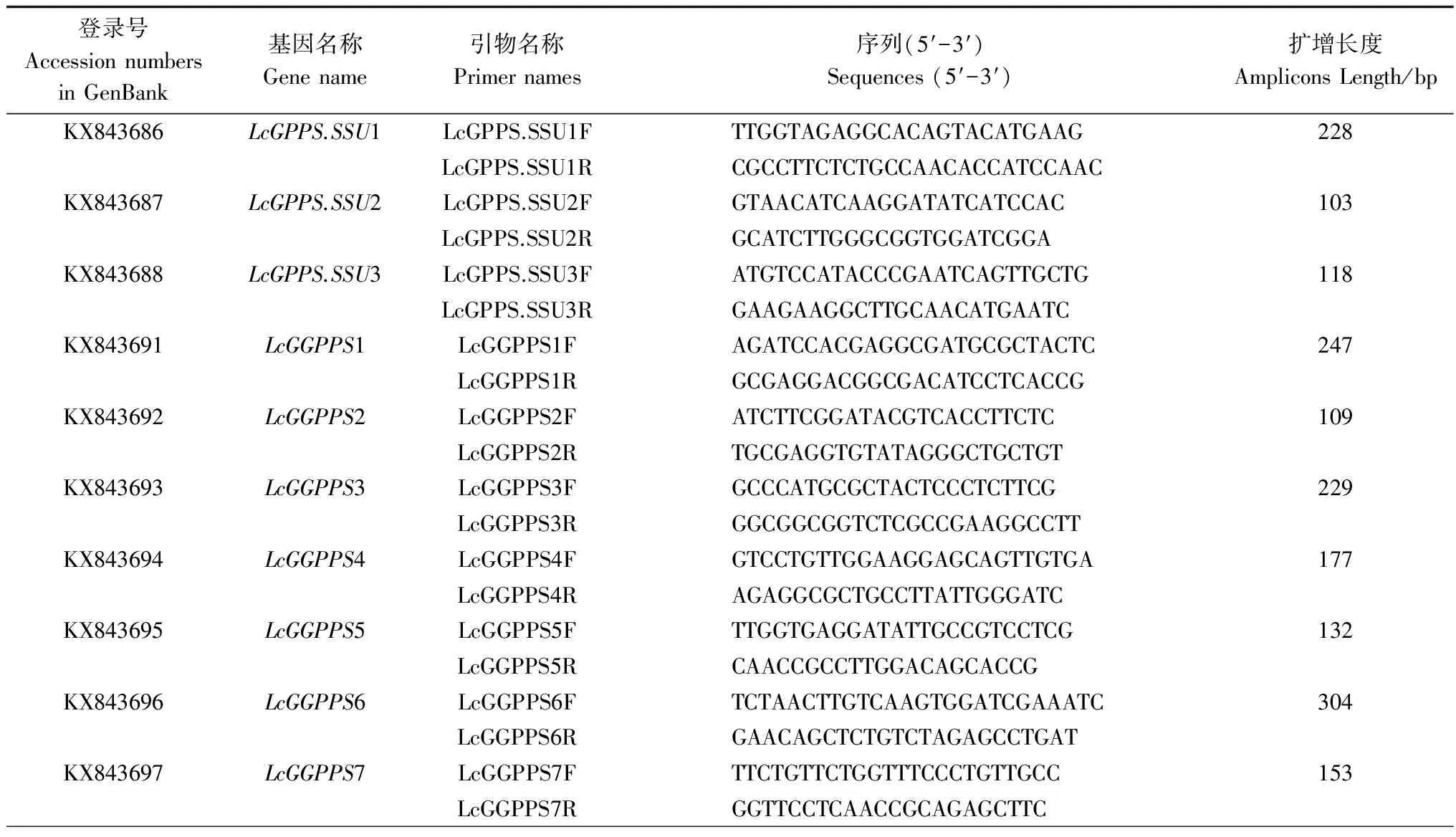
表1 用于表达模式分析的10条基因的qRT-PCR引物及登录号
1.5 LcGPPS和LcGGPPSs基因的克隆
根据LcGPPS.SSU1、LcGGPPS1和LcGGPPS3的序列信息,分别在其开放阅读框上、下游设计特异性引物,采用PrimeSTAR Max DNA Polymerase mix(TakaRa)扩增cDNA序列。将获得的PCR产物连接于pClone007载体上,并送到测序公司(北京擎科新业生物技术有限公司,杭州)进行测序。用于扩增这3条基因的引物见表2。
1.6 LcGPPS和LcGGPPSs的序列分析、进化分析以及结构预测
利用ExPaSy ProtParam(http://web.expasy.org/protparam/)在线计算蛋白质的分子质量和理论等电点等基本信息,运用I-TASSER v4.3对LcGPPS和LcGGPPSs的高级结构进行预测与分析[16],多序列比对使用Clustalx、DNAMAN、Bioedit等软件;采用邻接算法(NJ),使用MEGA 4.0软件构建进化树,bootstrap检测设置重复为1 000次。
1.7 诱饵质粒与捕获质粒的构建
根据LcGPPS.SSU1、LcGGPPS1和LcGGPPS3序列分别设计上、下游带质粒酶切位点引物(表2)PrimeSTAR Max DNA Polymerase酶用于PCR扩增,PCR反应程序:98℃预变性2 min;98℃变性10 s,55℃退火15 s,72℃延伸60 s,33个循环;72℃延伸5 min;4℃保存。产物用1%的琼脂糖凝胶电泳检测,切胶回收目的片段。同时分别用EcoRI/PstI双酶切pGBKT7载体,EcoRI/BamHI、NcoI/BamHI双酶切pGADT7载体,37℃孵育2 h,酶切结束后1%的琼脂糖凝胶电泳,切胶回收,利用无缝克隆,连接酶切后的载体和目的片段,转化大肠杆菌DH5α,分别经卡那霉素抗性和氨苄霉素抗性筛选,挑选阳性转化子,提取质粒,PCR酶切验证后,由公司测序验证。

表2 LcGPPS.SSU1、LcGGPPS1和LcGGPPS3的登录号和引物
1.8 诱饵质粒的毒性和自活性验证以及捕获质粒的假阳性检测

1.9 酵母共转化及阳性克隆的鉴定
以共转化pGBKT7-53质粒和pGADT7-T到Y2HGold菌株作阳性对照实验,共转化pGBKT7-Lam质粒和pGADT7-T到Y2HGold菌株中做阴性对照实验,将pGADT7-L1质粒、pGADT7-L3质粒分别和pGBKT7-SUl质粒共转化到Y2HGold菌株中,分别在DDO/X、DDO/ X /A、QDO/X/A固体培养基上培养,观察菌落的生长情况。
2 结果与分析
2. 1 LcGPPSs和LcGGPPSs家族基因成员的克隆与表达模式分析
在山鸡椒的果实转录组数据库中,共搜索得到10条目标序列,其中,3条LcGPPS.SSU序列,分别命名为LcGPPS.SSU1、LcGPPS.SSU2和LcGPPS.SSU3;7条LcGPPS.LSU序列,由于其与LcGPPS.SSU蛋白的互作关系未知,暂且命名为LcGGPPS1-7。萜类物质是植物重要的次生代谢物,尤其是单萜物质更是植物与环境交流的媒介,为了探寻LcGPPS.SSU及其可能的搭档在山鸡椒体内的作用,利用荧光定量PCR,对LcGPPS.SSUs与LcGGPPSs在山鸡椒果实发育过程和不同组织中的表达模式进行了探究,结果见图1、2。来自LcGPPS.SSUs家族的3个基因展现了2种表达模式,其中,LcGPPS.SSU2和LcGPPS.SSU3具有相似的表达模式,在山鸡椒果实的发育过程中,不仅在前中期呈现了一个表达高峰,而且在果实发育后期表达量又有提升,而且两基因在不同组织中也表现出相似的特征,都在幼果中具有较高的表达,其次是花和花蕾,然后是叶芽和根,在茎中的表达量最少,不同的是LcGPPS.SSU2整体表达量较高,LcGPPS.SSU3在花中的特异性更加明显。LcGPPS.SSU1拥有不同的表达模式,特异性地在花、花蕾和果实中表达,而且在果实发育前中期呈现了一个显著的表达高峰,其最高表达量达到LcGPPS.SSU2的5倍,达到LcGPPS.SSU3最高表达量的40倍;所以,在LcGPPS.SSUs基因家族中,作者挑选表达量最高且特异性表达的LcGPPS.SSU1作为研究对象。
来自LcGGPPSs家族的7条基因表达模式各不相同,在山鸡椒果实发育过程中,LcGGPPS2、LcGGPPS4和LcGGPPS5在前中期出现了表达高峰,LcGGPPS3和LcGGPPS7的表达高峰则出现在果实发育后期,而LcGGPPS1在前中期和后期都出现了表达高峰,LcGGPPS6在过程中无明显规律。在不同组织中的表达显示,LcGGPPS3-7虽然表达量各不相同,但在花和花蕾中的表达量都显著高于其它组织,LcGGPPS1除了在茎中表达量较低外,在其它组织中的表达量相差不大,LcGGPPS2则显示了在果实、根、花和花蕾中的特异性,说明在LcGGPPSs家族中,LcGGPPS1参与较多组织中萜类物质的生成,LcGGPPS2主要在果实、根与花中发挥作用,而LcGGPPS3-7主要在花发育过程中参与萜类物质的合成,在其它部位作用较少。作者挑选分别代表2种表达模式的LcGGPPS1和LcGGPPS3,探究可能与LcGPPS.SSU1的大亚基搭档。
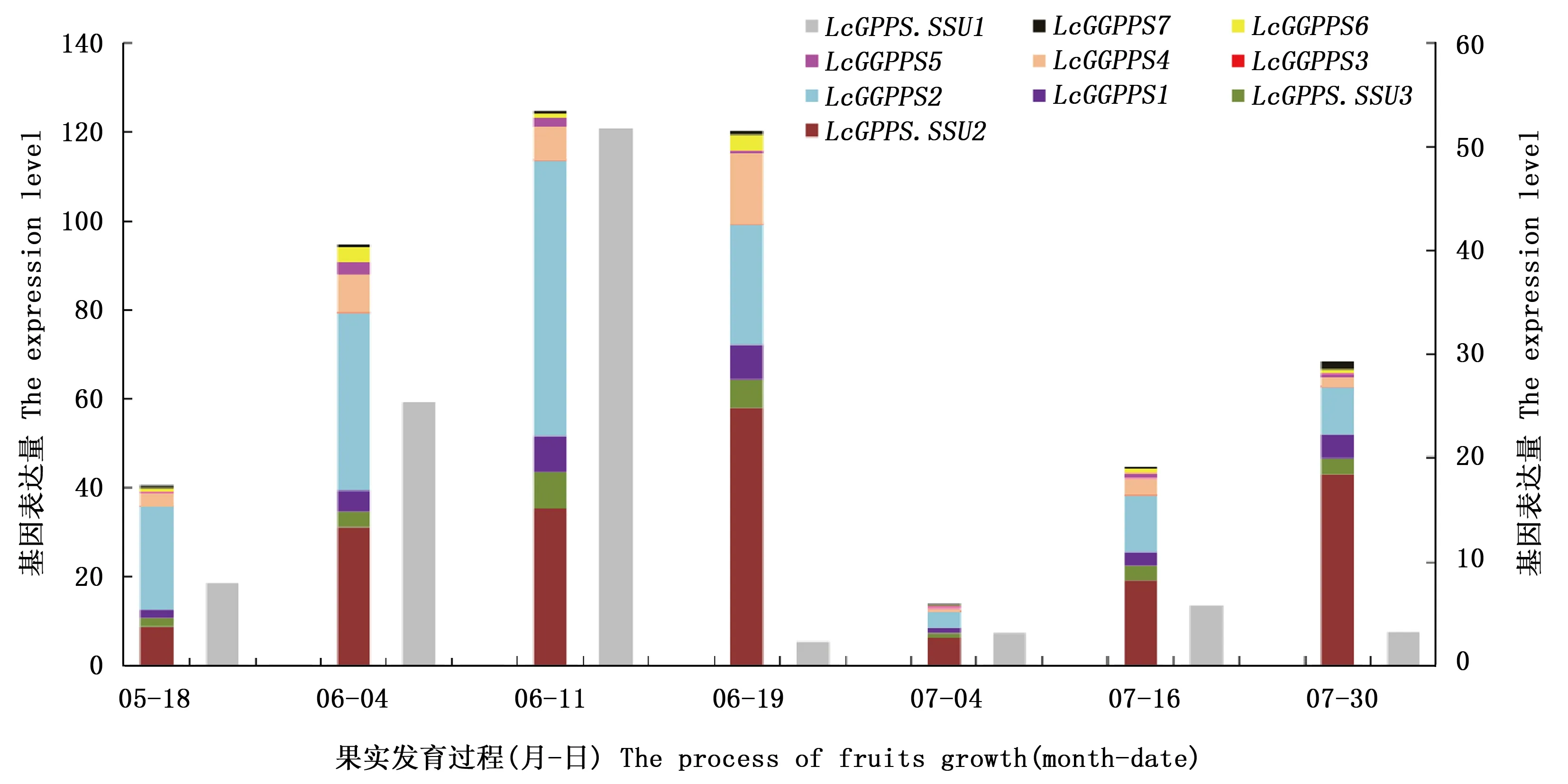
LcGPPS.SSU1的表达量位于左边主坐标轴上,其余9条基因的表达量位于次坐标轴上。 LcGPPS.SSU1 was exhibited in primer axis, and the rest genes were exhibited in second axis.图1 LcGPPS.SSUs和LcGGPPSs在山鸡椒果实发育过程中的表达模式Fig.1 The expression patterns of LcGPPS.SSUs and LcGGPPSs in fruits maturation

图中共包含9条基因,LcGPPS.SSU1由于表达量过高,未在图中显示;FB:花芽;LG:叶芽;F:花;S:茎;R:根;FL:幼果。LcGPPS.SSU1 was absent because of extremely high expression level. The tissues tested includes flower bud (FB), leafbud (LB), flower (F), steam (S), root (R) and fruitlet (FL).图2 LcGPPS.SSUs和LcGGPPSs在山鸡椒不同组织中的表达模式Fig.2 The expression patterns of LcGPPS.SSUs and LcGGPPSs in different tissues in L. cubeba
2.2 LcGPPS.SSU1、LcGGPPS1和LcGGPPS3的克隆
利用PCR对LcGPPS.SSU1、LcGGPPS1和LcGGPPS3进行扩增,PCR产物经过1% 的琼脂糖电泳之后,分别检测到3条不同大小的条带(图3),序列测序结果与转录组电子序列一致。在NCBI中BLASTP结果显示,LcGPPS.SSU1与来自芍药(Paeonialactiflora,AKJ26303)的GPPS.SSU具有50%的相似性,LcGGPPS1和LcGGPPS3分别与来自欧洲榛(Corylusavellana,ABW06960.1)和葡萄(Vitisvinifera,XP_002273789.1)的GGPPS展现73%与60%的相似性。分别将以上3条基因提交至NCBI数据库。登录号与所用引物见表2。
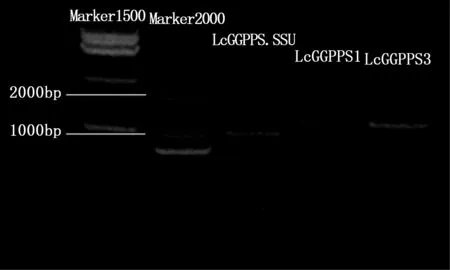
图3 LcGPPS.SSU1、LcGGPPS1和LcGGPPS3家族基因ORF扩增产物Fig. 3 The PCR amplification product of ORF of LcGPPS.SSU1、LcGGPPS1 and LcGGPPS3
2.3 LcGPPS.SSU1分别与LcGGPPS1和LcGGPPS3的互作探究
在单萜的合成过程中,异质二聚体GPPS起着显著的作用,在金鱼草和啤酒花里,GPPS.SSU的表达量与单萜的释放紧密相关[6,10],异质二聚体结构里的大亚基通常由特定的LSU或者一些GGPPS蛋白来扮演,但并不是所有的GGPPS都能充当大亚基[7]。目前,LSU与GGPPS的界定只能通过催化活性的有无及能否与GPPS.SSU互作来鉴别,通过氨基酸序列以及三维结构上关键位点来判别,目前只在少数物种中实现,尚未在大多数物种中得到验证。作者利用三维结构预测和酵母双杂互作验证对山鸡椒LcGGPPS1和LcGGPPS3能否与LcGPPS.SSU1互作进行了探索。
2.3.1 LcGPPS.SSU1和LcGGPPSs蛋白结构及互作预测 以薄荷异质GPPS晶体结构(PDB entry: 3KRO)为参照,作者利用I-TASSER v4.3对LcGPPS.SSU1分别与LcGGPPS1和LcGGPPS3的晶体互作结构进行了互作预测。LcGGPPS1/3与LcGPPS.SSU1的三维模型主要由α-螺旋组成,以无规则卷曲和转角等连接,LcGGPPS1/3与LcGPPS.SSU1能分别覆盖到薄荷异质二聚体大小亚基的三维结构上,也就是说晶体结构预测LcGGPPS1与LcGGPPS3都能与LcGPPS.SSU1互作,构成异质二聚体GPPS,由于LcGGPPS1与LcGGPPS3的结构相似,图4中以LcGGPPS1与LcGPPS.SSU1的互作结构为例。
2.3.2 酵母双杂验证LcGPPS.SSU1的互作蛋白
2.3.2.1 诱饵质粒的毒性和自活性验证以及捕获质粒的假阳性检测 Y2HGold-pGBKT7-SU1在SD/-Trp、SD/-Trp/X、SD/-Trp/X/A固体培养基上的观察结果(图5)显示:该菌株没有自激活,没有毒性,说明pGBKT7-SU1可以作为诱饵蛋白用于互作验证。pGBKT7原型质粒与pGADT7-L1共转化Y2HGold,在DDO/X、DDO/X /A、QDO/X/A上的培养结果显示:pGADT7-L1质粒没有发生自激活,没有产生假阳性。pGBKT7原型质粒与pGADT7-L3的共转化培养结果显示:pGADT7-L3也没有发生自激活和假阳性。

图4 LcGPPS.SSU1(红色)与LcGGPPS1(橙色)的二聚体结构Fig. 4 Dimeric structures of LcGPPS.SSU1(red) and LcGGPPS1(orange)
2.3.2.2 pGBKT7-SU1分别与pGADT7-L1和pGADT7-L3的酵母双杂结果 以共转化pGBKT7-53质粒和pGADT7-T到Y2HGold菌株作阳性对照,共转化pGBKT7-Lam质粒和pGADT7-T到Y2HGold菌株中做阴性对照,将pGBKT7-SU1和pGADT7-L1共转化Y2HGold。培养结果(图6)显示:在DDO/X平板上出现明显蓝色菌落,说明编码a半乳糖苷酶的MEL1报告基因已被激活,其分泌的a半乳糖苷酶能与培养基中的X-a-gal相互作用而使菌落呈现明显的蓝色,但是在DDO/ X /A和QDO/X/A平板上并没有长出菌落,说明二者表达的蛋白之间没有互作,转化菌株没有获得AbA抗性。pGBKT7-SU1与pGADT7-L3共转化Y2HGold,培养结果(图6)显示:在3种平板上都长有菌落,但与阳性克隆在相同平板上的表现相比,长出的菌落较少且着色较浅,说明pGBKT7-SU1与pGADT7-L3质粒表达的蛋白虽然存在互作,但作用强度较弱。

A:Y2HGold-pGBKT7-SU1菌株自激活及毒性检测;B:pGADT7-L1质粒假阳性验证;C:pGADT7-L3质粒假阳性验证。A: Testing Bait Y2HGold-pGBKT7-SU1 for autoactivation and toxicity; B: Eliminating false positive of pGADT7-L1; C: Eliminating false positive of pGADT7-L3.图5 诱饵质粒自激活验证及捕获质粒假阳性验证Fig.5 Verification of Y2HGold-pGBKT7-SU1 for autoactivation and toxicity and false positive for pGADT7-L1 and pGADT7-L3

图6 LcGPPS.SSU1分别和LcGGPPS1与LcGGPPS3的蛋白互作验证以及阴性和阳性对照Fig.6 Verifying of the proteins interactions between LcGPPS.SSU1and LcGGPPS1/3 and negative and positive control
2.4 LcGPPS.SSU1与LcGGPPSs的系统进化分析
编码GPPS和GGPPS关键酶的基因已经从数十种植物中分离出来,利用邻接法(NJ),对山鸡椒LcGPPS.SSU1和LcGGPPSs及一些植物GPPS/GGPPS蛋白进行系统进化分析。图7表明:43条蛋白序列清楚地分成3类(图中所包含的序列及登录号见表3),其中:SSUII与GGPPS聚成一大类,说明SSUII与GGPPS的相似性更高;SSUI单独聚成一小类,LcGPPS.SSU1聚类到SSUI里,同在这一类的多来自芳香植物,其中包含来自丹参(SalviamiltiorrhizaBge.)的SmGPPS.SSUI, LcGPPS.SSU1的表达模式也与SSUI的特征相同,主要表达在单萜的储藏与释放器官[6,9]。在SSUII分类中,包含拟南芥的AtSSU(即AtGGPPS12)和来自丹参的 SmGPPS.SSUII1和SmGPPS.SSUII2,说明一个物种中可能同时含有两类GPPS.SSU,其分类可能与功能的分化有关,而不是之前报道的根据物种分类。在GGPPS这一类中,可以看到主要包括两大类,分别由来自被子植物和裸子植物的GGPPS蛋白组成,其中,裸子植物分类中含有2条来自被子植物的蛋白序列,分别是丹参和麻风树(JatrophacurcasL.);在被子植物分类中,又分出若干小的类别,而已克隆并鉴定活性的4条LSU序列聚成一个小类,说明LSU起源于GGPPS,并且已经进化出了特定的功能,与其它的GGPPS亲缘关系较远,LcGGPPS3不仅没有聚到LSU分类中,还与SmGGPPS3一起聚类到裸子植物与被子植物的GGPPS之外,说明其与大多数的GGPPS蛋白亲缘关系较远,其起源可能要早于裸子植物与被子植物的分化。

图7 山鸡椒与其它物种GPPS/GGPPS系统进化分析Fig.7 Phylogenetic relationship between L. cubeba and other plants GPPS/GGPPS families

序号No.缩写Abbreviationinthetree物种Species登录号Accessionnumber序号No.缩写Abbreviationinthetree物种Species登录号Accessionnumber1EuGGPPSElaeagnusumbellataACO5990521LiSSULavandulaintermediaAGH33891.12TkGGPPSTaraxacumkok⁃saghyzALJ30146.122AtSSUArabidopsisthalianaAAG40013.13PbGGPPSPlectranthusbarbatusALE19959.123GmSSUGlycinemaxNP_001238613.14PmGGPPSPinusmassonianaAGU43761.124MsSSUMedicagosativaAEL29573.15JcGGPPSJatrophacurcasNP_001295715.125VvSSUVitisviniferaXP_0022780236CaGGPPSCorylusavellanaABW06960.126OsSSUOryzasativaEAY87007.17TcGGPPSTaxuscanadensisAAD16018.127HbSSUHeveabrasiliensisBAF983008MtGGPPSMedicagotruncatulaXP_003629488.128AgGPPS2AbiesgrandisAAN01134.19MsGGPPSMedicagosativaADG0184129AgGPPS1AbiesgrandisAAN01133.110GbGGPPSGinkgobilobaAAQ72786.130AgGPPS3AbiesgrandisAAN01135.111NaGGPPSNicotianaattenuataABQ53935.131SmGPPS.SSUISalviamiltiorrhizaJN83110812CrGPPS.LSUCatharanthusroseusAGL91645.132SmGPPS.SSUII.1SalviamiltiorrhizaJN83110913MpGPPS.LSUMenthapiperitaAAF08793.133SmGPPS.SSUII.2SalviamiltiorrhizaJN83111014AmGPPS.LSUAntirrhinummajusAAS82860.134SmGGPPS1SalviamiltiorrhizaFJ64361715SmGPPS.LSUSalviamiltiorrhizaAEZ55681.135SmGGPPS2SalviamiltiorrhizaJN83111216MpSSUMenthaxpiperitaAAF08792.136SmGGPPS3SalviamiltiorrhizaJN83111317HlSSUHumuluslupulusACQ90681.137AtGGPPS2ArabidopsisthalianaNM_127943.218LcSSULeucosceptrumcanumALT07956.138AtGGPPS11ArabidopsisthalianaNM_113869.119CbSSUClarkiabreweriAAS82870.139CsGGPPSCrotonsublyratusBAA86284.120AmSSUAntirrhinummajusAAS82859.140AgGGPPSAbiesgrandisAAL17614.2
3 讨论
根据文献报道,Chang等[7]为验证异质MpGPPS的催化活性,在底物结合与催化区域挑选3个氨基酸残基,构建了[LSU(D83A/D84A/D89A)·SSU]2突变体,发现突变体完全没有活性,证实异质GPPS的催化活性是由MpLSU大亚基行使;而通过晶体结构解析发现,MpSSU通过R loop限制住MpLSU的移动,并通过催化活性腔构象的改变影响底物的结合以及产物的变化,从而改变催化的特异性,说明异质二聚体GPPS中,LSU负责催化,SSU负责调节。在金鱼草和薄荷中,其单萜释放量与GPPS.SSU组织时空表达水平呈相关,与GPPS.LSU表达无相关性,说明SSU在单萜的合成过程中可能起关键的作用[7,10],Orlova等[17]将本身不具有催化活性的金鱼草AmSSU在烟草中超表达,结果也获得了单萜释放量增加,提示外源AmSSU可以与系统进化上较远的烟草GGPPS互作,并改变了其催化特异性,调节底物转向单萜合成方向。此外,早期研究发现,茉莉酸甲酯处理能够通过刺激转录因子进而调控萜类积累相关的酶基因的表达[18]。Avanish等[9]用茉莉酸甲酯处理长春花的叶子,结果发现显著诱导了CrGGPPS.SSU的表达,说明GPPS.SSU能够通过转录因子响应外界刺激,找到能与之互作的GGPPS并改变其催化活性从而改变代谢底物转向单萜合成,生成与防御、化感以及繁殖相关的单萜物质。
系统进化分析结果显示,GPPS.LSU起源于GGPPS,已经与GGPPS蛋白展现出一定的遗传距离,聚成一个单独的类别,说明在与GPPS.SSU的互作过程中,GPPS.LSU出现了选择性进化。结合山鸡椒中3条序列的系统进化分析,LcGGPPS3不仅不属于LSU类别,且与大部分GGPPS和LSU蛋白距离较远,但LcGGPPS3能与LcGPPS.SSU1互作,说明GPPS.SSU不仅能与LSU互作,也能与部分GGPPS互作,但这部分GGPPS作者通过系统进化分析并不能辨别。
Chang等[7]从晶体结构角度对大小亚基之间的互作进行解析,根据薄荷GPPS,(LSU·SSU)2异四聚体的晶体结构,比较来自白芥(SinapisalbaL.)同型二聚体GGPPS与MpGPPS.LSU的序列发现,在大小亚基互作界面A上存在4个氨基酸残基与二聚体形成的性质有关,在SaGGPPS结构里,这4个氨基酸通过与另一个相同亚基氨基酸之间的作用力来稳定结构,但在MpGPPS.LSU结构里,这4个氨基酸被替换,当MpGPPS.LSU形成同型二聚体时,相互之间的作用力消失或者产生相排斥的力,造成同型二聚体结构不够稳定,认为这可能是MpGPPS.LSU更倾向于形成异质二聚体而不是同型二聚体的原因,但通过对比到山鸡椒LcGGPPS3,作者发现这一规律并不完全符合,而来自金鱼草的AmGPPS.LSU不仅能与AmGPPS.SSU互作,而且单独表达时还具有GGPPS催化活性,说明GGPPS与LSU蛋白之间的界定并不是严格的非此即彼,结合Mp异四聚体的晶体结构,作者发现上面讨论的4个关键氨基酸只是位于互作界面的一条螺旋结构上,互作界面还包括另外3条螺旋结构,说明界面上还存在更多的氨基酸残基之间的作用力来维持稳定的结构。
作者的实验结果表明,LcGPPS.SSU1与LcGGPPS3 二者在山鸡椒果实成熟过程中也呈现相似的表达模式,并且LcGPPS.SSU1通过与LcGGPPS3蛋白互作从而在山鸡椒精油单萜合成中发挥作用。另外,LcGGPPS3虽然能与LcGPPS.SSU1互作,但实验显示互作不是很强,提示可能还存在其它的GGPPS或特定的LSU能与LcGPPS.SSU1互作,也就是说LcGPPS.SSU1可能互作的搭档不止一个。在LcGGPPS家族中,每一条基因的表达模式都不相同,但具体分工还需要试验的进一步验证。LcGPPS.SSU1与LcGGPPS3的互作为研究山鸡椒精油中单萜合成的机制提供了基础。
4 结论
本研究中,分离克隆得到了LcGPPS.SSU1、LcGGPPS1和LcGGPPS3基因,其中LcGPPS.SSU1特异性地在山鸡椒花和果实中呈现高表达水平,在山鸡椒果实发育过程中,LcGGPPS3呈现出与LcGPPS.SSU1相似的表达趋势,酵母双杂交实验证实,LcGGPPS3可以与LcGPPS.SSU1互作,从而在山鸡椒精油单萜合成中发挥作用。
[1] Bohlmann J, Meyer-Gauen G, Croteau R. Plant terpenoid synthases: Molecular biology and phylogenetic analysis[J]. Proceedings of the National Academy of Sciences, 1998, 95(8): 4126-4133.
[2] 王凌健, 方 欣, 杨长青, 等. 植物萜类次生代谢及其调控[J]. 中国科学: 生命科学, 2013, 43(12): 1030-1046.
[3] 张长波, 孙红霞, 巩中军, 等. 植物萜类化合物的天然合成途径及其相关合酶[J]. 植物生理学通讯, 2007, 43(4): 779-786.
[4] Bouvier F, Rahier A, Camara B. Biogenesis, molecular regulation and function of plant isoprenoids[J]. Progress in Lipid Research, 2005, 44(6): 357-429.
[5] Schmidt A , Gershenzon J. Cloning and characterization of two different types of geranyl diphosphate synthases from Norway spruce (Piceaabies)[J]. Phytochemistry, 2008, 69(1): 49-57.
[6] Wang G, Dixon R A. Heterodimeric geranyl (geranyl) diphosphate synthase from hop (Humuluslupulus) and the evolution of monoterpene biosynthesis[J]. Proceedings of the National Academy of Sciences, 2009, 106(24): 9914-9919.
[7] Chang T H, Hsieh F L, Ko T P,etal. Structure of a heterotetrameric geranyl pyrophosphate synthase from mint (Menthapiperita) reveals intersubunit regulation[J]. The Plant Cell, 2010, 22(2): 454-467.
[8] Kavanagh K L, Dunford J E, Bunkoczi G,etal. The crystal structure of human geranylgeranyl pyrophosphate synthase reveals a novel hexameric arrangement and inhibitory product binding[J]. Journal of Biological Chemistry, 2006, 281(31): 22004-22012.
[9] Raia A, Smitab S S, Singha A K,etal. Heteromeric and homomeric geranyl diphosphate synthases fromCatharanthusroseusand their role in monoterpene indole alkaloid biosynthesis[J]. Molecular Plant, 2013, 6(5): 1531-1549.
[10] Tholl D, Kish C M, Orlova I,etal. Formation of monoterpenes inAntirrhinummajusandClarkiabreweriflowers involves heterodimeric geranyl diphosphate synthases[J]. The Plant Cell, 2004, 16(4): 977-992.
[11] 方学军. 山苍子油的功能及应用[J]. 湖南林业科技, 2007, 34(3): 82-84.
[12] Si L, Chen Y, Han X,etal. Chemical composition of essential oils ofLitseacubebaharvested from its distribution areas in China[J]. Molecules, 2012, 17(6): 7057-7066.
[13] 杨保刚, 丁晓雯. 山苍籽及其精油研究利用现状分析[J]. 食品与发酵科技, 2004, 40(4): 10-14.
[14] Chang Y T, Chu F H. Molecular cloning and characterization of monoterpene synthases fromLitseacubeba(Lour.) Persoon[J]. Tree Genetics & Genomes, 2011, 7(4): 835-844.
[15] 刘英冠, 吴庆珂, 何关顺, 等. 山鸡椒1-脱氧木酮糖-5-磷酸还原异构酶DXR基因的克隆和SNP分析[J]. 林业科学研究, 2015, 25(1): 93-100.
[16] Roy A, Kucukural A, Zhang Y. I-TASSER: a unified platform for automated protein structure and function prediction[J]. Nature Protocols, 2010, 5(4): 725-738.
[17] Orlova I, Nagegowda D A, Kish C M,etal. The small subunit of snapdragon geranyl diphosphate synthase modifies the chain length specificity of tobacco geranylgeranyl diphosphate synthase in planta[J]. The Plant Cell, 2009, 21(12): 4002-4017.
[18] Hemmerlin A, Harwood J L, Bach T J. A raison d’etre for two distinct pathways in the early steps of plant isoprenoid biosynthesis?[J]. Progress in Lipid Research, 2012, 51(2): 95-148.
GeneExpressionPatternofLcGPPSandItsInteractionwithLcGGPPSsinLitseacubeba
CAOPei1,CHENYi-cun1,GAOMing1,GUOHao-bo2,WANGYang-dong1
(1. Research Institute of Subtropical Forestry, Chinese Academy of Forestry, Hangzhou 311400, Zhejiang, China;2. Department of Biochemistry, University of Tennessee, Knoxville TN 37996, Tennessee, USA)
ObjectiveTo identify the interacted proteins of geranyl diphosphate synthase (GPPS) and provide theoretical bases for illuminating the mechanism of monoterpene biosynthesis inLitseacubeba.MethodThe transcriptome database of fruits ofL.cubebawas searched by basic blast tool. RT-PCR was used to cloneGPPSgenes (LcGPPS.SSU1 encoding the small subunit of heteromeric GPPS) andGGPPSgenes (LcGGPPS1 andLcGGPPS3). qRT-PCR was conducted to analyze the expression patterns. In addition, prediction of three-dimensional structure models and yeast two-hybrid system were used to verify the protein interaction.ResultLcGPPS.SSU1,LcGGPPS1 andLcGGPPS3 were cloned. The expression pattern analysis showedLcGPPS.SSU1 specifically expressed in flower, flower bud and fruit in a significant high level. The prediction of protein interaction showed that both LcGGPPS1 and LcGGPPS3 could interact with LcGPPS.SSU1, while the result of yeast two-hybrid system showed that only LcGGPPS3 can interact with LcGPPS.SSU1.ConclusionLcGPPS.SSU1 can interact with LcGGPPS3 to form heterodimer to function in the terpenoids biosynthesis inL.cubeba, which provides knowledge for addressing the mechanism of terpenoids biosynthesis pathway inL.cubeba.
Litseacubeba; terpenoids biosynthesis; GPPS; GGPPS; heterodimer; protein interaction; expression pattern
10.13275/j.cnki.lykxyj.2017.06.024
2017-02-13
国家自然科学基金项目(31370576)
曹 佩(1992—),女,河南信阳人,硕士研究生,研究方向为林木遗传育种.
* 通讯作者:汪阳东,研究员,博士,研究方向为林木遗传育种与分子生物学.E-mail:Wyd11111@126.com
S718.46
A
1001-1498(2017)06-1050-09
金立新)

