利用慢病毒载体构建稳定干扰AMPKα1的HeLa细胞系
李树朋,陈浩,林晓莹,林广宏,赵斌,钟望涛,李文,冯杜
(1.广东医科大学,广东 湛江 524001;2.广东医科大学附属医院神经病学研究所广东省衰老相关心脑疾病重点实验室,广东 湛江 524001;3.广东医科大学附属医院神经内科,广东 湛江 524001)
·论 著·
利用慢病毒载体构建稳定干扰AMPKα1的HeLa细胞系
李树朋1,陈浩1,林晓莹1,林广宏1,赵斌2,钟望涛3,李文2,冯杜2
(1.广东医科大学,广东 湛江 524001;2.广东医科大学附属医院神经病学研究所广东省衰老相关心脑疾病重点实验室,广东 湛江 524001;3.广东医科大学附属医院神经内科,广东 湛江 524001)
目的建立稳定干扰AMPKα1的HeLa细胞系。方法利用AMPKα1慢病毒干扰质粒PLKO.1-puro-AMPKα1转染293T细胞制备重组慢病毒,然后用重组慢病毒感染HeLa细胞,荧光显微镜观察病毒感染效率,免疫印迹实验检测Sh-AMPKα1病毒感染组的AMPKα1表达。然后采用嘌呤霉素筛选出稳定干扰AMPK α1的HeLa细胞单克隆,免疫印迹实验和免疫荧光实验检测AMPKα1表达情况。最后用AMPK激活剂Metformin实验验证AMPKα1稳定干扰的Hela细胞中AMPKα1蛋白的表达以及AMPKα1的生物功能。结果荧光拍照结果显示慢病毒成功感染Hela细胞;免疫印迹实验显示特异性Sh-AMPKα1病毒感染组的AMPKα1表达[(0.58±0.02)DPI]比WT组[(1.00±0.00)DPI]低,免疫荧光实验结果也显示Sh-AMPKα1病毒感染组中AMPKα1的平均光密度[(0.09±0.01)IOD/area]比WT组[(1.00±0.00)IOD/area]要低,差异均具有显著统计学意义(P<0.01);经AMPK激活剂Metformin处理后,AMPKα1稳定干扰的Hela细胞中仍无AMPKα1蛋白表达,并且Sh-AMPKα1组中LC3-Ⅱ/Ⅰ/Actin[(1.00±0.00I)DPI]也显著低于HA-AMPKα1组[(1.62±0.02)DPI],表明病毒感染组细胞中AMPKα1不能发挥其生物功能,差异具有显著统计学意义(P<0.01)。结论利用ShRNA-AMPKα1慢病毒筛选出了高效干扰AMPKα1表达的HeLa细胞系,为后续深入研究AMPKα1的生物功能奠定了基础。
慢病毒载体;AMPKα1;RNA干扰;Hela细胞;Metformin
AMPK[(Adenosine 5'-monophosphate(AMP)-activa ted protein kinase)]即AMP依赖的蛋白激酶,是真核生物体内保守的丝氨酸和苏氨酸激酶,对于糖、脂肪和蛋白质代谢及能量稳态的维持起着关键代谢调节酶的作用[1]。AMPK由1个α-催化亚基、1个β-调节亚基和1个γ-调节亚基组成[2]。研究表明,在低氧、缺血、热激和营养缺乏的条件下,ATP的浓度水平降低,5'-AMP增多,随后,5'-AMP和AMPK的γ亚基相互作用,通过激活AMPKα1(Thr-172)而发挥生物功能[3]。AMPK调节的细胞能量代谢与线粒体功能关系密切:线粒体功能障碍能激活AMPK和自噬来促进细胞存活[4]。另外AMPK也从多方面对线粒体进行调控[5]:当线粒体受损时,AMPK通过PGC-1α途径增加线粒体DNA的合成,以促进线粒体膜蛋白的生成[6];AMPK还可以磷酸化线粒体分裂因子MFF,从而诱导动力相关蛋白DRP-1介导的线粒体分裂[7-8];此外,AMPK可以直接作用于自噬核心激酶ULK1并促使后者磷酸化,进而诱导受损线粒体的自噬性清除[9]。另有报道称,AMPK可以通过调控线粒体的质量,从而在线粒体功能障碍相关疾病中发挥调节作用[10-11]:例如,Metformin通过活化AMPK进而阻止线粒体膜去极化以及线粒体过度的裂变,从而在亨廷顿病的发病过程中起着保护作用[12];另外,AMPK也可以和家族性帕金森病连接基因PAKIN共同参与维持神经元线粒体稳态,在帕金森病的发病机制中扮演重要角色[13]。总之,线粒体的调控与AMPK关系密切,而AMPK生物活性的发挥主要依赖于其α1催化亚基,因此为了进一步探索AMPKα1与线粒体质量调控之间的关系、分析AMPKα1下游新底物以及AMPKα1作用于该底物后对线粒体形态功能和线粒体相关疾病的影响,笔者拟采用RNA干扰(RNAinterference,RNAi)技术沉默AMPKα1基因的表达[14],利用慢病毒载体和嘌呤霉素筛选构建稳定干扰AMPKα1的HeLa细胞系[15],为后续研究奠定基础。
1 材料与方法
1.1 材料 HeLa、293T细胞为本实验室所有,PLKO.1-puro-AMPKa1、PLKO.1-puro-vector、HA-AM PKα1、HA-AMPK KD 质粒、嘌呤霉素、Metformin、DAPI和LC3抗体购自Sigma公司,Actin抗体、质粒提取试剂盒购自北京全式金公司,AMPKα1抗体购自Thermo公司,p-Ampk抗体购自CST公司,HA、P62抗体购自Abcam公司,Lipofectamine 2000购自Invitrogen公司,0.45 μm过滤器购自上海生工,其他试剂为实验室所有。
1.2 细胞培养 取HeLa、293T细胞用含10%胎牛血清的DMEM培养基于37℃含5%CO2的细胞培养箱培养。待细胞状态最佳且密度大于90%时用胰酶消化传代,每2~3 d传代一次。
1.3 慢病毒颗粒的包装 选择生长状态良好的293T细胞,待细胞密度达90%,用Lipofectamine 2000进行如下4种质粒的共转染:6.0 μg慢病毒重组质粒、3 μg 辅助质粒pGag-PoL、1.2 μg pRev和1.8μg pVSVG。转染48 h时,将培养皿中的培养液收集到无菌的50 mL旋盖离心管中,用封口膜封好后于4℃冰箱保存。再向上述培养皿内补加10 mL完全培养基,培养72 h后再次收集培养液,并与上次收集的慢病毒粗液混合。4℃,1 500 r/min离心5 min,吸取上清,再用0.45 μm滤器过滤,即得病毒原液,将该病毒原液冻于-80℃冰箱备用。
1.4 Sh-AMPKα1单克隆细胞的筛选 用病毒原液感染状态较好的HeLa细胞,实验设AMPKα1干扰组(Sh-AMPKα1-1/Sh-AMPKα1-2/Sh-AMPKα1-3),空载体组(VECTOR)和未感染组(WT)。感染48 h后,用含2 μg/mL嘌呤霉素的新鲜培养基替换病毒感染液。待WT组细胞被嘌呤霉素全部杀死后,将AMPKα 1干扰组存活下来的细胞转移至6孔板,继续用含嘌呤霉素的培养基培养至细胞密度达70%时,收集部分细胞,免疫印迹检测AMPKα1的干扰效率,选取AMPKα1干扰效率高的细胞铺于96孔板进行单克隆培养,单克隆细胞个数为1个/孔,用含嘌呤霉素的培养基持续培养20 d,选取生长状态良好的阳性克隆孔逐级扩大培养,收集部分细胞免疫印迹检测单克隆细胞中AMPKα1的干扰效率。
1.5 免疫荧光 细胞培养皿中放置干净盖玻片,分别将未感染组(WT)、空载体组(VECTOR)和干扰效果最好的Hela细胞组接种于培养皿中,待细胞密度为60%时用4%多聚甲醛37℃固定细胞10 min。固定结束后磷酸盐缓冲液(PBS)洗3次,每次3 min,弃PBS,加1 mL PBS(含0.1%Triton X-100)室温打孔15 min。弃溶液,PBS洗3次后弃PBS,再加1%牛血清白蛋白(BSA)室温封闭30 min。弃封闭液,加一抗室温孵育1 h。弃一抗,PBS洗3次每次3 min后弃PBS,室温避光孵育荧光二抗50 min。PBS洗二抗3次每次3 min后弃PBS,室温染Dapi 5 min后PBS洗三次,于载玻片上加适量抗荧光淬灭剂,将盖玻片倒扣于载玻片上,指甲油封片后于4℃存放。
1.6 蛋白质免疫印迹 细胞刮刮取细胞,离心裂解并配平蛋白浓度后变性。取10~20 μg蛋白进行SDS-聚丙烯酰胺凝胶电泳,转膜。用含5%脱脂奶粉的PBST液室温封闭1 h,4℃摇床孵育一抗过夜。次日将目的条带室温复温1h后,PBST洗3次,每次5 min。室温孵育二抗1 h后,PBST洗3次每次5 min。然后于曝光房行ECL化学发光法显影。
1.7 统计学方法应用SPSS13.0统计软件进行数据分析,对蛋白质免疫印迹结果和荧光图的光密度统计结果先行总体方差分析,总体有差异后,再采用LSD-t检验进行两两比较,以P<0.05为差异有统计学意义,P<0.01为差异有显著统计学意义。
2 结 果
2.1 有效Sh-AMPKα1病毒株的筛选 感染慢病毒并用嘌呤霉素筛选48 h后荧光拍照发现,未感染慢病毒的HeLa细胞(WT组)基本无存活,而感染慢病毒 Sh-VECTOR、Sh-AMPK α 1-1、Sh-AMPK α 1-2 和Sh-AMPKα1-3组的Hela细胞部分存活(图1A);免疫印迹实验发现和WT组相比,Sh-AMPKα1-2感染的Hela细胞中,AMPKα1蛋白的干扰效果最为显著(图1B),差异具有显著统计学意义(P<0.01)(图1C)。
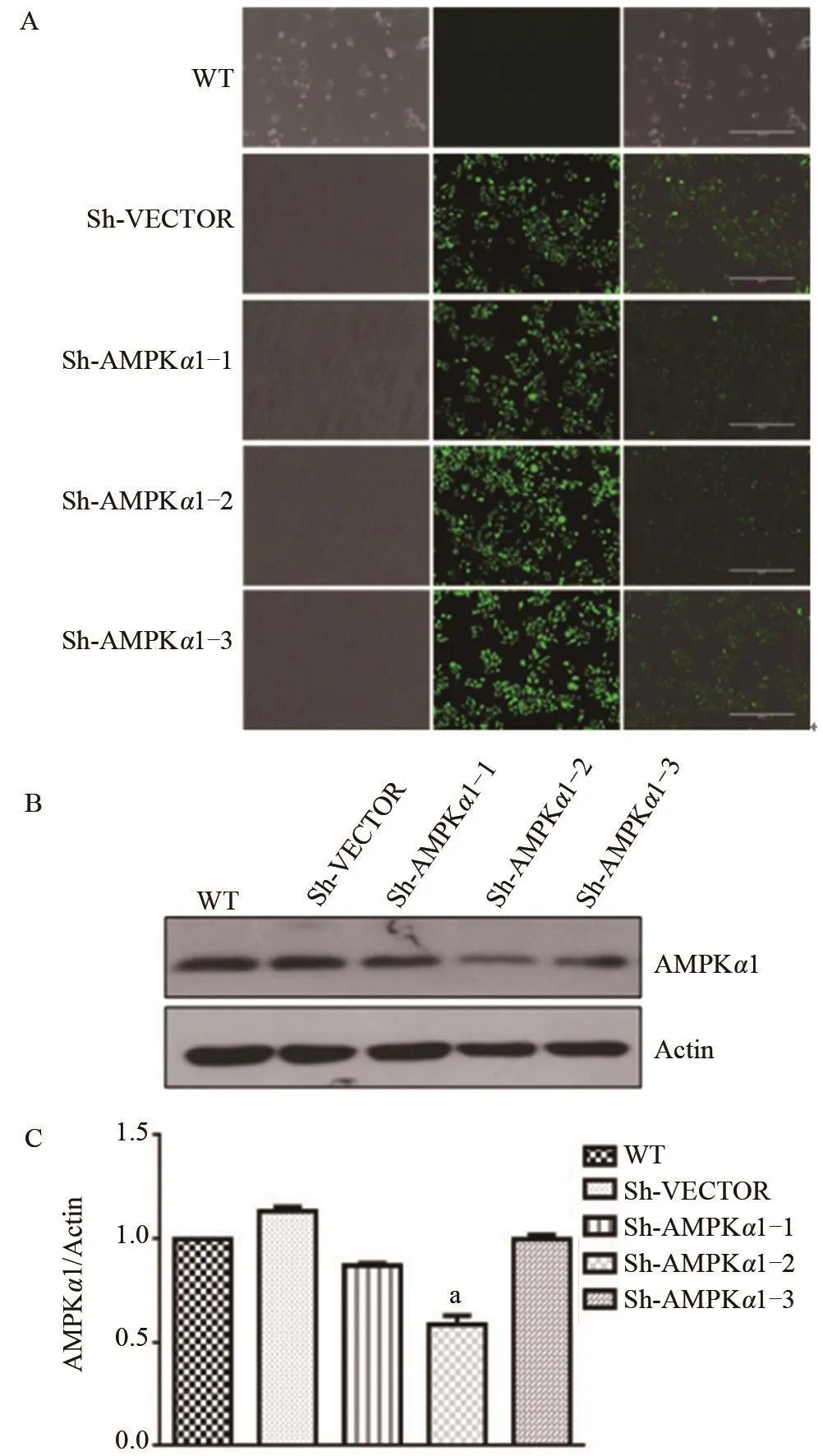
图1 有效Sh-AMPKα1病毒株的筛选
2.2 Sh-AMPKα1单克隆细胞的筛选 免疫印迹结果显示,Sh-AMPKα1-2各组细胞的AMPKα1蛋白表达水平均降低,且以Sh-AMPKα1-2-6组降低最为显著,差异具有显著统计学意义(P<0.01)(图2A、2B)。免疫荧光实验检测WT、Sh-VECTOR和Sh-AMPKα1-2-6组中AMPKα1的表达,经共聚焦显微镜拍照和Image J软件对平均光密度统计分析,发现AMPKα1蛋白在WT组和Sh-VECTOR组细胞胞浆均有强表达,而在Sh-AMPKα1-2-6组细胞内表达明显降低(图2C),与WT组比较,差异有显著统计学意义(P<0.01)(图2D)。

图2 Sh-AMPKα1单克隆细胞的筛选
2.3 外源过表达HA-AMPKα1能挽救Sh-AMPK α1 Hela细胞中被缺失的AMPKα1的生物功能 有报道称AMPK是自噬的上游分子,Metformin使AMPK活化,活化的AMPK通过激活ULK1促进自噬,导致P62表达下降,LC3-Ⅰ向LC3-Ⅱ转化[16]。笔者在Sh-AMPKα1 Hela细胞中分别转染HA-AMPKα1、HA-AMPK KD(Thr-172 kinase dead,该位点的失活将阻碍AMPK发生磷酸化)质粒,免疫印迹结果显示在HA-AMPKα1组中,Metformin(0.5 mmol/L,4 h)促进p-AMPK表达,P62降低和LC3-Ⅱ/LC3-Ⅰ比例增加(图3A),说明细胞自噬增强,且灰度分析结果表明差异具有统计学意义;而Sh-AMPKα1组和过表达HA-AMPK KD组,Metformin对p-AMPK的表达基本无影响,并且P62的降低以及LC3-Ⅰ向LC3-Ⅱ的转换也不如HA-AMPKα1组明显(图3B、3C)。以上结果说明在干扰AMPKα1表达的HeLa细胞中,AMPKα1不能发挥其原有的生物功能,而外源过表达AMPKα1可以挽救AMPKα1的生物功能,间接说明Sh-AMPKα 1 HeLa细胞系构建成功。
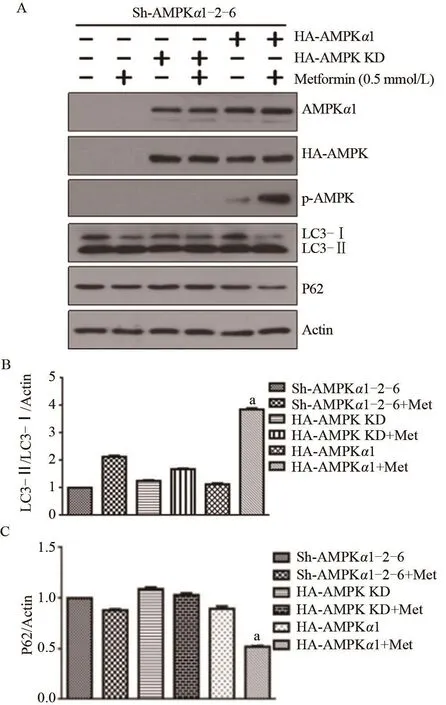
图3 外源过表达HA-AMPKα1能挽救Sh-AMPKα1 Hela细胞中被缺失的AMPKα1的生物功能
3 讨论
AMPK是线粒体稳态的主要调节激酶。研究证实AMPK通过直接磷酸化ULK1和抑制mTORC1来触发线粒体自噬[9]。另外,AMPK参与线粒体形态的维持:如在胰腺B细胞中,AMPK通过磷酸化DRP-1,进而减弱棕榈酸酯诱导的线粒体断裂[17];AMPK还可以通过磷酸化MFF来促进DRP-1介导的线粒体断裂[18]。AMPK生物活性的发挥主要依赖于其α1催化亚基,因此AMPKα1是线粒体质控的关键激酶。线粒体质量控制是线粒体融合、断裂和自噬的一个动态过程[19],并且线粒体自噬又与多种神经变性疾病的发病机制有关,如帕金森病、阿尔兹海默病、亨廷顿病等[20-22]。因此,从深入研究AMPKα1在线粒体质量控制中的重要性、从挖掘AMPKα1新的下游作用底物以及AMPKα1与该底物之间通过相关作用调控自噬的分子机制、从AMPKα1与线粒体相关疾病发病机制的相关性来看,构建AMPKα1稳定干扰的细胞株是必要的。
RNAi技术能够高效、特异地沉默特定基因的表达,该技术已经得到广泛应用[23-24]。本研究利用慢病毒干扰质粒PLKO.1-puro-AMPKα1建立了稳定干扰AMPKα1的HeLa细胞系。通过蛋白质免疫印迹实验和免疫荧光实验验证了AMPKα1的干扰情况,并且功能实验也间接证明了Sh-AMPKα1的干扰效果较好。该Sh-AMPKα1 HeLa细胞模型,为进一步研究AMPKα1在线粒体质量控制中的分子机制奠定了基础。
[1]Hardie DG.AMPK:positive and negative regulation,and its role in whole-body energy homeostasis[J].Curr Opin Cell Biol,2015,33:1-7.
[2]Kurumbail RG,Calabrese MF.Structure and Regulation of AMPK[J].EXS,2016,107:3-22.
[3] Morales-Alamo D,Ponce-Gonzalez JG,Guadalupe-Grau A,et al.Critical role for free radicals on sprint exercise-induced CaMKII and AMPKalpha phosphorylation in human skeletal muscle[J].J Appl Physiol(1985),2013,114(5):566-577.
[4]Zhao B,Qiang L,Joseph J,et al.Mitochondrial dysfunction activates the AMPK signaling and autophagy to promote cell survival[J].Genes Dis,2016,3(1):82-87.
[5]Zhang CS,Lin SC.AMPK promotes autophagy by facilitating mitochondrial fission[J].Cell Metab,2016,23(3):399-401.
[6]Bremer K,Kocha KM,Snider T,et al.Sensing and responding to energetic stress:The role of the AMPK-PGC1alpha-NRF1 axis in control of mitochondrial biogenesis in fish[J].Comp Biochem Physiol B Biochem Mol Biol,2016,199:4-12.
[7]Li J,Wang Y,Wang Y,et al.Pharmacological activation of AMPK prevents Drp1-mediated mitochondrial fission and alleviates endoplasmic reticulum stress-associated endothelial dysfunction[J].J Mol Cell Cardiol,2015,86:62-74.
[8]Toyama EQ,Herzig S,Courchet J,et al.Metabolism.AMP-activated protein kinase mediates mitochondrial fission in response to energy stress[J].Science,2016,351(6270):275-281.
[9]Tian W,Li W,Chen Y,et al.Phosphorylation of ULK1 by AMPK regulates translocation of ULK1 to mitochondria and mitophagy[J].FEBS Lett,2015,589(15):1847-1854.
[10]Cai Z,Yan L J,Li K,et al.Roles of AMP-activated protein kinase in Alzheimer's disease[J].Neuromolecular Med,2012,14(1):1-14.
[11]Vingtdeux V,Chandakkar P,Zhao H,et al.Novel synthetic small-molecule activators ofAMPK as enhancers of autophagy and amyloid-beta peptide degradation[J].FASEB J,2011,25(1):219-231.
[12]Jin J,Gu H,Anders NM,et al.Metformin protects cells from mutant huntingtin toxicity through activation of AMPK and modulation of mitochondrial dynamics[J].Neuromolecular Med,2016,18(4):581-592.
[13]Hang L,Thundyil J,Lim KL.Mitochondrial dysfunction and Parkinson disease:a Parkin-AMPK alliance in neuroprotection[M].Ann N YAcad Sci,2015,1350:37-47.
[14]Mohr SE,Smith JA,Shamu CE,et al.RNAi screening comes of age:improved techniques and complementary approaches[J].Nat Rev Mol Cell Biol,2014,15(9):591-600.
[15]Segura MM,Garnier A,Durocher Y,et al.New protocol for lentiviral vector mass production[J].Methods Mol Biol,2010,614:39-52.
[16]Song YM,Lee YH,Kim JW,et al.Metformin alleviates hepatosteatosisby restoring SIRT1-mediated autophagy induction viaan AMP-activated protein kinase-independent pathway[J].Autophagy,2015,11(1):46-59.
[17]Wikstrom JD,Israeli T,Bachar-Wikstrom E,et al.AMPK regulates ER morphology and function in stressed pancreatic beta-cells via phosphorylation of DRP1[J].Mol Endocrinol,2013,27(10):1706-1723.
[18]Ducommun S,Deak M,Sumpton D,et al.Motif affinity and mass spectrometry proteomic approach for the discovery of cellular AMPK targets:identification of mitochondrial fission factor as a new AMPK substrate[J].Cell Signal,2015,27(5):978-988.
[19]Matic I,Strobbe D,Di Guglielmo F,et al.Molecular biology digest of cell mitophagy[J].Int Rev Cell Mol Biol,2017,332:233-258.
[20]Mouton-Liger F,Jacoupy M,Corvol JC,et al.PINK1/Parkin-dependent mitochondrial surveillance:from pleiotropy to Parkinson's disease[J].Front Mol Neurosci,2017,10:120.
[21]Kerr JS,Adriaanse BA,Greig NH,et al.Mitophagy and Alzheimer's disease:cellular and molecular mechanisms[J].Trends Neurosci,2017,40(3):151-166.
[22]Khalil B,El FN,Aouane A,et al.PINK1-induced mitophagy promotes neuroprotection in Huntington's disease[J].Cell Death Dis,2015,6:e1617.
[23]Subramanya S,Kim SS,Manjunath N,et al.RNA interference-based therapeutics for human immunodeficiency virus HIV-1 treatment:synthetic siRNA or vector-based shRNA?[J].Expert Opin Biol Ther,2010,10(2):201-213.
[24]Charbgoo F,Behmanesh M,Nikkhah M,et al.RNAi mediated gene silencing of ITPA using a targeted nanocarrier:apoptosis induction in SKBR3 cancer cells[J].Clin Exp Pharmacol Physiol,2017,44(8):888-894.
Construction of a AMPKα1 stably interfered Hela cell line by lentiviral vectors.
LI Shu-peng1,CHEN Hao1,LIN Xiao-ying1,LIN Guang-hong1,ZHAO Bin2,ZHONG Wang-tao3,LI Wen2,FENG Du2.1.Guangdong Medical University,Zhanjiang 524001,Guangdong,CHINA;2.Guangdong Key Laboratory of Age-related Cardiac-Cerebral Vascular Disease,Institute of Neurology,the Affiliated Hospital of Guangdong Medical University,Zhanjiang 524001,Guangdong,CHINA;3.Department of Neurology,the Affiliated Hospital of Guangdong Medical University,Zhanjiang 524001,Guangdong,CHINA
ObjectiveTo establish adenosine monophosphate-activated protein kinase α1(AMPKα1)stably interfered Hela cell line.MethodsLentiviral vector PLKO.1-puro-AMPKα1 was transfected into 293T cells to prepare recombinant lentivirus.Then HeLa cells were infected with the recombinant lentivirus,and the efficiency of virus infection was detected by fluorescent photography.The monoclonal Hela cell stably interfered AMPKα1 was screened by puromycin,and Western blot and immunofluorescence were used to detecte the expression of AMPK α 1 in specific Sh-AMPKα1 virus infected group.Finally,the biological function of AMPKα1 in Hela cells stably interfered with AMPKα1 under the treatment of metformin,a AMPK activator,was detected.ResultsThe results of fluorescent photography showed that the virus infection was highly efficient.Immunoblotting results showed that the expression of AMPKα1 was significantly reduced in Hela cells stably interfered with AMPKα1(0.58±0.02)DPI compared with the WT group(1.00±0.00)DPI.Immunofluorescence results also showed that the mean optical density of AMPKα1 was(0.09±0.01)IOD/area in Sh-AMPKα1 virus infected group versus(1.00±0.00)IOD/area in the WT group.All the above differences were statistically significant(P<0.01).After the treatment of metformin,the expression of AMPKα1 in the Sh-AMPKα1 virus infected group was still not expressed.Moreover,the relative ratio of LC3-Ⅱ/Ⅰ/Actinin in the Sh-AMPKα1 group was(1.00±0.00)DPI,which was significantly lower than(1.62±0.02)DPI in the HA-AMPKα1 group,indicating that AMPKα1 could not play its biological function(P<0.01).ConclusionThe above results revealed that AMPKα1 effectively interfered Hela cell line was established by ShRNA-AMPKα1 lentivirus,which laid the foundation for the further research ofAMPKα1 biological function.
Lentiviral vector;Adenosine monophosphate-activated protein kinase α1(AMPKα1);RNA interference;HeLa cells;Metformin
国家自然科学基金(编号:31401182);广东省自然科学基金(编号:2014A030313533);广东省科技发展专项资金(编号:2016A020215152);广东省粤东西北地区引进紧缺拔尖人才“扬帆计划”人才项目(编号:4YF14007G);广东医科大学科研基金(编号:M2014024,M2015001)
冯杜。E-mail:feng_du@foxmail.com
R373
A
1003—6350(2017)23—3785—05
10.3969/j.issn.1003-6350.2017.23.001
2017-07-20)

